香菇多糖对人肺腺癌细胞A549免疫原性死亡相关分子表达的影响
2018-05-24吴小清陈鸿策游思远李婵艺陈宏远
吴小清,陈鸿策,芮 雯,游思远,李婵艺,陈宏远,3,4
(广东药科大学:1基础学院病原生物学与免疫学系,2中心实验室,广东广州510006;3广东省局部精准药物递药制剂工程技术研究中心,4国家中医药管理局中药数字化质量评价技术重点研究室,广东广州510006)
0 引言
肿瘤免疫原性细胞死亡(immunogenic cell death,ICD)是细胞在发生凋亡(如放化疗)的同时由非免疫原性的细胞转变为具有免疫原性的肿瘤细胞,继而诱发免疫系统的抗肿瘤免疫效应[1]。ICD是由细胞表面多种信号分子和细胞因子参与的复杂过程,其细胞定位及表达量水平的改变直接影细胞免疫的命运[2]。现代医药学研究成果表明,香菇[lentinus edodes(Berk.)sing]具有增强免疫力,抗肿瘤,降血脂,抗血栓,健胃保肝,预防佝偻病和防治贫血等功能。香菇多糖(lentinus edodes polysaccharide)分离于香菇子实体,是香菇中的主要活性成分之一[3]。可采用水提或碱提后再醇沉的方法进行提取,其分子量在几千到几十万道尔顿不等。香菇多糖分子主要由甘露糖、葡萄糖、半乳糖、木糖及阿拉伯糖等组成。天然香菇多糖绝大多数具有 β⁃(1→3)⁃D⁃吡喃葡萄糖的基本骨架,空间结构为β⁃三股绳状螺旋立体结构,具有生物活性,但其在抗肿瘤当中的构效关系还未得到阐明[4]。
已有香菇多糖在晚期肺癌治疗中的应用报道[5],但未见其通过影响ICD抗肿瘤的报道。本研究主要采用人肺腺癌细胞A549为模型,考察香菇多糖体外对A549细胞凋亡、细胞周期及ICD相关分子、免疫检测点分子和抗原呈递分子等表达量的影响。
1 材料和方法
1.1 材料 香菇多糖由广东药科大学范华钧教授课题组经水提再醇沉而分离,纯度>95%;人肺腺癌细胞A549购自购自美国 ATCC公司;PBS、DMEM培养基、0.25%胰酶(Trypsin⁃EDTA)、RPMI⁃1640 培养基、胎牛血清(FBS);双抗(Pen Strep)购自 Gibco公司;CCK8购自碧云天生物技术有限公司;米托蒽醌(Mitoxantrone,MTX)购自美国Selleck生物科技有限公司;重组人干扰素⁃γ(IFN⁃γ)购自上海近岸蛋白质科技有限公司;细胞周期与细胞凋亡检测试剂盒购自上海翔圣生物科技有限公司;BV785标记的鼠抗人的HLA⁃DR 抗体(BV785⁃HLA⁃DR)购自 Biolegend 公司;7⁃氨基放菌素 D(7⁃AAD)和 APC标记的膜联素 V(APC⁃Annexin V)购自 Biolegend 公司;溴化乙锭(PI)购自翊圣公司;BV650标记的鼠抗人CD80抗体(BV650⁃CD80)购自 BD 公司;Percp/Cy5.5 标记的鼠抗人 Galectin9 抗体 (Percp/Cy5.5⁃Galectin9) 购自Biolegend公司;BV510标记的鼠抗人 CD39抗体(BV510⁃CD39)购自 Biolegend 公司;BV421 标记的鼠抗人 CD270抗体(BV421⁃CD270)购自 BD 公司;APC 标记的鼠抗人 HSP70抗体购自 Biorbyt公司(APC⁃HSP70);FITC标记的山羊抗兔二抗和CRT一抗购自Abcam公司。
1.2 方法
1.2.1 细胞培养 A549用含10%FBS的1640培养基培养,细胞置于37℃、5%CO2空气和饱和湿度培养箱中按照常规方法培养。
1.2.2 细胞存活检测 采用CCK8法检测细胞存活:取对数生长期的A549细胞接种于96孔板中,细胞密度为 1×105个/mL,每孔接种 100 μL,置于 37℃、5%CO2培养箱中培养。细胞贴壁 24 h后加入0.4~12.8 μg/μL的香菇多糖,并设置不加药的空白对照组。继续培养24 h和48 h后,每孔加入10 μL的CCK8,96孔板于培养箱内避光孵育2 h,然后分别在24 h和48 h采用酶标仪检测各样品在450nm处的吸光度值。
1.2.3 细胞凋亡检测 采用 AnnexinV/7AAD 双染法⁃流式检测与分析细胞凋亡:取对数生长期的A549细胞接种于6孔板中,细胞密度为2.0×105个/mL,每孔接种2 mL,置于37℃、5%CO2培养箱中培养。细胞贴壁 24 h 后加入 0.4~8.0 μg/μL 的香菇多糖,4.52 ng/μL的 MTX 设为阳性对照,继续培养 48 h,0.25%的胰酶消化后收集细胞,重悬细胞使其终浓度为1×105个/mL,取 100 μL 细胞悬液于 5 mL 离心管中,加入 5 μL 100 μg/mL PE⁃Annexin V 和 1 μL 100 μg/mL 7AAD 工作液,室温避光孵育 15 min,染色1 h。流式细胞仪上样检测与分析。
1.2.4 细胞周期检测 采用PI单染法⁃流式检测细胞周期:取对数期的A549细胞接种于直径为60 mm的培养皿中,细胞密度为 2.0×105个/mL,每孔接种3 mL,置于37℃、5%CO2培养箱中培养。细胞贴壁24 h 后加入浓度为 0.5~2.0 μg/μL 的香菇多糖,设3个复孔。继续培养48 h后,0.25%的胰酶消化细胞,离心收集细胞并使用预冷-20℃的70%乙醇4℃固定过夜,离心收集细胞,过滤,重悬细胞使其终浓度为1×105个/mL,取 100 μL 细胞悬液于 5 mL 离心管中,加入 1 μL 50 μg/mL 的 PI、 2 μL 100 μg/mL RNase A在4℃避光孵育30 min。使用流式细胞仪检测与分析各样品中PI的荧光强度。
1.2.5 肿瘤细胞免疫原性死亡相关分子的检测 取对数生长期的A549细胞接种于24孔板中,细胞密度为 2.0×105个/mL,每孔接种 0.5 mL,置于 37℃、5%CO2培养箱中培养。细胞贴壁24 h后加入0.5~4.0 μg/μL的香菇多糖,并设置不加香菇多糖的空白对照组和20 ng/μL IFN⁃γ作为阳性对照,每孔重复3次。继续培养24 h及48 h后,0.25%的胰酶消化收集细胞,过滤、重悬细胞使其终浓度为1×105个/mL。取100 μL细胞悬液于5 mL离心管中,加入 1 μL 50 μg/mL BV786 标记的 HLA⁃DR 抗体在 4℃避光孵育30 min。含1%FBS的PBS洗涤一次后,分别在24 h和48 h采用流式细胞仪检测与分析各样品中的BV786 荧 光 强 度。 CD80、 Galectin9、 CD39、 CD270、HSP70、CRT等分子的表达量检测与分析采用上述类似方法。
1.3 统计学处理 所有实验均重复3次,数据采用SPSS9.0和Graphpad Prim软件分析,结果以x±s表示。组间差异比较采用t检验分析,P<0.01具有显著性统计学差异。
2 结果
2.1 香菇多糖对A549细胞增殖的影响 CCK8法检测各实验组细胞存活率的结果表明:香菇多糖对A549细胞的增殖具有显著抑制作用,香菇多糖在24 h和 48 h,IC50分别为 6.258 μg/μL 和 15.823 μg/μL(图 1)。

图1 不同浓度的香菇多糖处理48 h后对A549细胞存活率的影响
2.2 香菇多糖对A549细胞凋亡及其周期的影响
不同浓度的香菇多糖处理A549细胞48 h后,Annex⁃inV/7AAD双染⁃流式检测细胞凋亡结果表明:香菇多糖明显诱导A549细胞发生凋亡,且细胞发生早期凋亡率提高最为明显(图2)。

图2 不同浓度的香菇多糖对A549细胞凋亡的影响
不同浓度的香菇多糖对A549细胞的周期影响结果表明:香菇多糖作用48 h后,细胞周期各阶段的细胞数目比例都发生明显的改变:随香菇多糖浓度的增加,G0/G1期细胞比例减少,S期细胞比例上升,而G2/M期细胞比例不变,表明香菇多糖对细胞周期S期都具有阻滞作用(图3、4)。
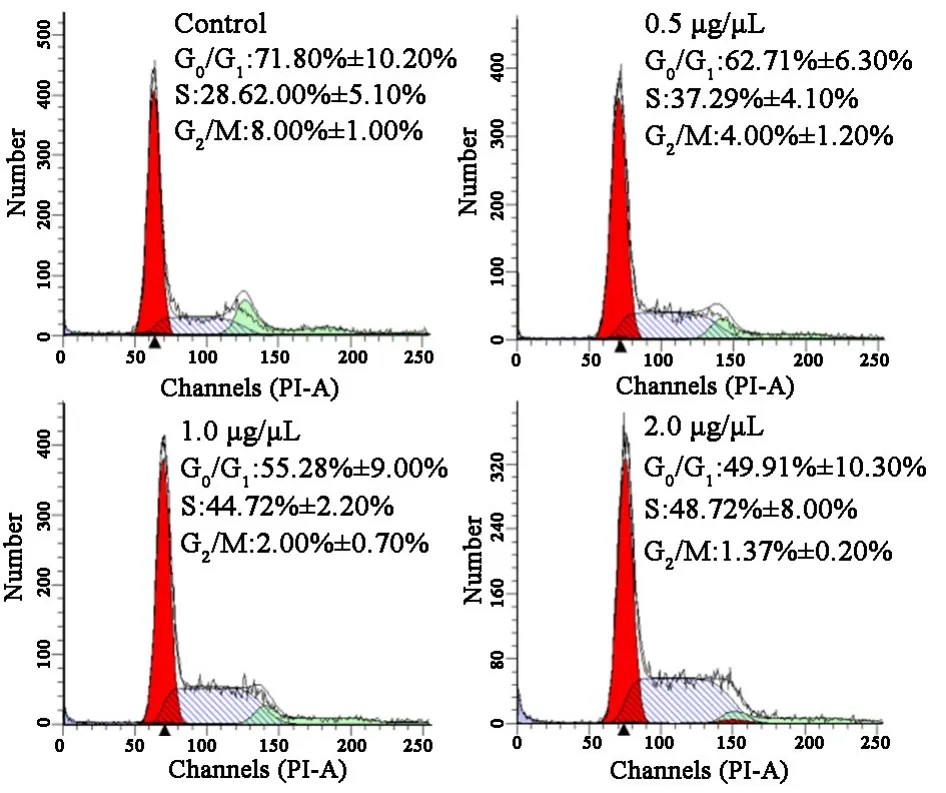
图3 不同浓度的香菇多糖对A549细胞周期的影响

图4 不同浓度的香菇多糖对A549细胞周期的影响
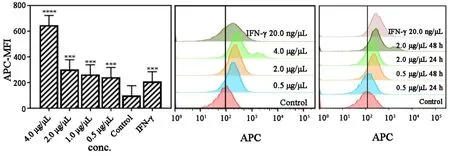
2.3 香菇多糖对细胞ICD相关分子表达的影响为探究香菇多糖对A549细胞死亡信号分子钙网蛋白(calreticulin, CRT)的影响,分别以 0.5~4.0 μg/μL的香菇多糖作用A549细胞48 h后,流式细胞术检测细胞表面CRT的表达。结果显示:香菇多糖都能明显诱导A549细胞CRT表达提高,促进A549细胞在凋亡的同时使CRT从内质网大量转移到细胞膜表面(图5);不同浓度的香菇多糖都能明显诱导A549细胞表达热休克蛋白 70(heat shock proteins 70,HSP70),促进A549细胞在凋亡的同时释放带有特异性抗原肽的HSP70(图6)。

图5 不同浓度的香菇多糖处理48 h后对A549表达CRT的影响
2.4 香菇多糖对免疫检查点相关分子表达的影响流式细胞术检测结果表明:0.5~4.0 μg/μL 的香菇多糖都能明显诱导A549细胞免疫系统功能抑制性蛋白 CD270、CD39及CD80表达量升高 (图7~9)。 但诱导A549表面免疫检测点分子Galectin9蛋白表达量明显下降(图9)。
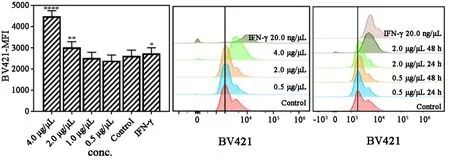
图7 不同浓度的香菇多糖处理48 h后对A549表达CD270的影响

图8 不同浓度的香菇多糖处理48 h后对A549表达CD39的影响
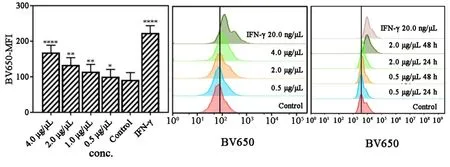
图9 不同浓度的香菇多糖处理48 h后对A549表达CD80的影响
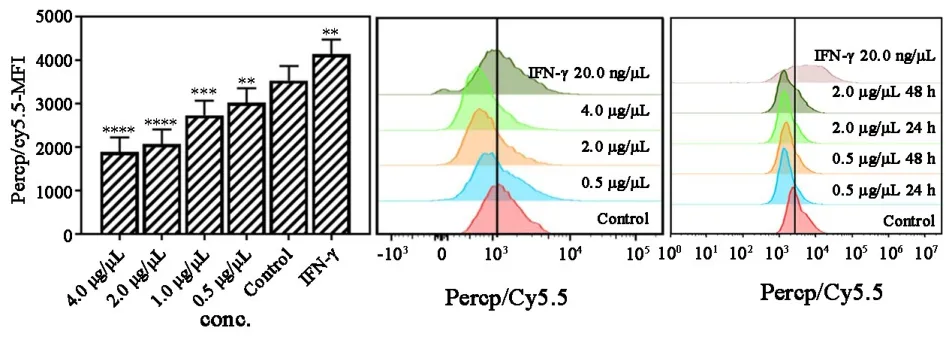
图10 不同浓度的香菇多糖处理48 h后对A549表达Galec⁃tin9的影响
为了进一步探究香菇多糖对A549细胞表面CD4+T细胞识别抗原MHC⁃II表达的影响,香菇多糖处理A549细胞48 h后,流式细胞术检测表达结果显示,香菇多糖可显著促进 A549表面 MHC⁃II表达。实验结果还表明,香菇多糖刺激 A549细胞表达MHC⁃II的最佳浓度约为4 μg/μL ,作用时间为48 h(图 11)。
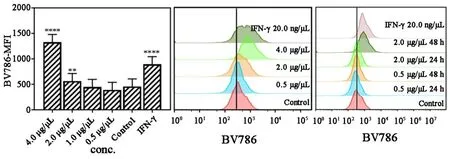
图11 不同浓度的香菇多糖处理48 h后对A549表达MHC⁃II的影响
3 讨论
我们曾考察过香菇多糖分别处理HT1299、PC⁃9、H1975、A549、Huh7及HepG2等多种肿瘤细胞系后对ICD相关分子表达的影响,发现仅对A549细胞的影响最为明显。本研究因而选择A549肺癌细胞株为模型分别考察了香菇多糖的促细胞凋亡作用,对细胞周期的影响。香菇多糖对A549细胞的增殖具有抑制作用且具有时间和浓度依赖性,诱导A549细胞发生早期凋亡且对细胞周期S期都具有阻滞作用。
本研究进一步考察了香菇多糖对A549细胞发生ICD的两大标志物CRT和HSP70的影响。本研究发现香菇多糖在诱导A549凋亡的同时增加细胞膜表面CRT表达的水平,CRT是定位在细胞内质网(ER)的钙结合蛋白,其跨膜转位表达于细胞膜表面可以作为细胞毒性标志而被机体内的抗原提呈细胞(antigen processing cells, APCs)识别,APCs将相关的抗原肽提呈给T淋巴细胞,激活T淋巴细胞介导机体的适应性免疫应答[6]。CRT在介导肿瘤细胞发生免疫原性死亡中具有非常重要的作用[7-8],抑制CRT的表达量在很多肿瘤模型中被证实可以使肿瘤细胞的免疫原性清除[9],而肿瘤细胞的免疫原性在敲除CRT的细胞表面重构后又可恢复[10]。CRT蛋白跨膜转位数量的变化与ICD呈正相关。本研究发现香菇多糖抑制A549细胞增殖的同时提高了细胞膜表面HSP70的表达水平。HSP70是高度保守的热休克蛋白家族的一员,正常情况下HSP70位于胞浆,肿瘤细胞在经过硼替佐米或者蒽醌类药物处理发生凋亡的时候分泌HSP70,分泌到细胞膜表面的HSP70可以促进DC对肿瘤细胞的吞噬,促进抗原呈递,激活CD8+T 细胞[11]。 HSP70 变化与 ICD 呈正相关[12]。细胞膜表面CRT和HSP70的共同表达可以有效激活APCs识别肿瘤细胞继而激发机体抗肿瘤免疫[13]。本研究结果验证了香菇多糖诱导ICD的能力,因而将香菇多糖确定为ICD诱导物,香菇多糖对体内的抗肿瘤作用具有积极的影响。
本研究还考察了香菇多糖对免疫检查点分子CD270、CD39、Galectin9 表达量的影响,结果显示经过香菇多糖处理A549表面CD270、CD39的表达量增加,Galectin9的表达量减少。免疫检测点主要是一类具有免疫抑制性的分子[1],正常情况下能够抑制T淋巴细胞的功能,在肿瘤组织中可能被肿瘤细胞利用而发生免疫逃逸。程序性死亡受体⁃1(programmed death protein⁃1, PD⁃1)抑制剂临床实验证明可应用于晚期黑色素瘤的治疗[14]。Ipilimumab抗体应用于晚期或者不可切除的黑色素瘤患者[15]。下调免疫系统功能抑制性蛋白,可以促进DC对肿瘤细胞的抗原呈递,增强T细胞的杀伤作用。免疫检查点的数量变化与T细胞的杀伤作用呈负相关[16]。免疫检测点分子的高表达为我们后期动物水平联合PD⁃1治疗提供了实验依据[17-18]。上述体外实验结果为香菇多糖抗肺癌免疫提供了实验的依据,后续将构建肺癌荷瘤小鼠动物模型,深入研究香菇多糖诱导荷瘤小鼠肿瘤细胞发生免疫原性细胞死亡的体内免疫机制,为完善香菇多糖通过免疫调节发挥抗癌作用提供实验依据。
[1]Kroemer G, Galluzzi L, Kepp O, et al.Immunogenic cell death in cancer therapy[J].Annu RevImmunol,2013,31:51-72.
[2]Garg AD, Dudek⁃Peric AM, Romano E, et al.Immunogenic cell death[J].Int J Dev Biol,2015,59(1⁃3):131-140.
[3]Blackwell AD, Tamayo MA, Beheim B, et al.Helminth infection,fecundity,and age of first pregnancy in women[J].Science,2015,350(6263):970-972.
[4]Ferreira SS, Passos CP, Madureira P, et al.Structure⁃function relationships of immunostimulatory polysaccharides: A review[J].Carbohydr Polym,2015,132:378-396.
[5]Muth C, Rubner Y, Semrau S, et al.Erratum to: Primary glioblas⁃toma multiforme tumors and recurrence:comparative analysis of the danger signals HMGB1,HSP70,and calreticulin[J].Strahlenther Onkol,2016,192(3):156.
[6]Kepp O, Tesniere A, Schlemmer F, et al.Immunogenic cell death modalities and their impact on cancer treatment[J].Apoptosis,2009,14(4):364-375.
[7]Obeid M, Tesniere A, Panaretakis T, et al.Ecto⁃calreticulin in immunogenic chemotherapy[J].ImmunolRev,2007,220:22-34.
[8]Yerlikaya A, Okur E, Eker S, et al.Combined effects of the protea⁃some inhibitor bortezomib and Hsp70 inhibitors on the B16F10 mela⁃noma cell line[J].Mol Med Rep,2010,3(2):333-339.
[9]Obeid MS.Method for effecting localized, Non⁃systemic and systemic,Immunogenic treatment of cancer using CRT translocation[P].2009.
[10]Obeid M, Tesniere A, Ghiringhelli F, et al.Calreticulin exposure dictates the immunogenicity of cancer cell death[J].Nat Med,2007,13(1):54-61.
[11]Strachan DC, Ruffell B, Oei Y, et al.CSF1R inhibition delays cer⁃vical and mammary tumor growth in murine models by attenuating the turnover of tumor⁃associated macrophages and enhancing infiltration by CD8+Tcells[J].Oncoimmunology,2013,2(12):e26968.
[12]D'Eliseo D, Manzi L, Velotti F.Capsaicin as an inducer of damage⁃associated molecular patterns(DAMPs) of immunogenic cell death(ICD) in human bladder cancer cells[J].Cell Stress Chaperones,2013,18(6):801-808.
[13]Pawaria S, Binder RJ.CD91⁃dependent programming of T⁃helper cell responses following heat shock protein immunization[J].Nat Commun,2011,2:521.
[14]Hamid O, Robert C, Daud A, et al.Safety and Tumor Responses with Lambrolizumab (Anti⁃PD⁃1) in Melanoma[J].New England Journal of Medicine,2013(2):134-144.
[15]Hodi FS, O'Day SJ, McDermott DF, et al.Improved survival with ipilimumab in patients with metastaticmelanoma[J].N Engl J Med,2010,363(8):711-723.
[16]Karyampudi L, Lamichhane P, Scheid AD, et al.Accumulation of memory precursor CD8 T cells in regressing tumors following combi⁃nation therapy with vaccine and anti⁃PD⁃1 antibody [ J].Cancer Res,2014,74(11):2974-2985.
[17]Brown ZJ, Heinrich B, Steinberg SM, et al.Safety in treatment of hepatocellular carcinoma with immune checkpoint inhibitors as com⁃pared to melanoma and non⁃small cell lung cancer[J].J Immunother Cancer,2017,5(1):93.
[18]Nemoto S, Mailloux AW, Kroeger J, et al.OMIP⁃031: Immunologic checkpoint expression on murine effector and memory T⁃cell subsets[J].Cytometry A,2016,89(5):427-429.
