沉默Cdk5对星形胶质细胞活化增殖和细胞周期的影响
2018-05-21龙根苏竹毅谢敏杰王伟徐沙贝刘晨辰
龙根 苏竹毅 谢敏杰 王伟 徐沙贝 刘晨辰
细胞周期是细胞生命活动的重要特征和基本过程,其运行主要通过细胞周期蛋白依赖性激酶(Cyclin-dependent kinases,Cdks)的蛋白激酶家族进行调节[1]。其中,细胞周期蛋白依赖性激酶5(Cdk5)作为Cdks家族的一员,是一种脯氨酸介导的丝氨酸/苏氨酸蛋白激酶,其氨基酸序列与Cdk2和细胞分裂周期激酶2(cdc2)有60%的同源性[2-3]。然而相比于其他细胞周期依赖性激酶,在中枢神经系统高度表达的Cdk5并不直接参与细胞周期,并且需要与非细胞周期调节亚基蛋白 p35和p39以及它们的截短形式p25和p29结合才能产生活性[4]。Cdk5在中枢神经系统正常生长发育调节神经细胞迁移、轴突生长、神经递质释放、突触可塑性及认知功能等方面发挥重要作用[5-7],然而Cdk5在星形胶质细胞增殖过程中的作用尚不明确。本研究采用RNA干扰技术特异性沉默Cdk5,观察其对星形胶质细胞增殖的影响,探讨Cdk5在星形胶质细胞增殖中的作用。
1 材料与方法
1.1 实验材料
新生24 h内的SPF级SD大鼠乳鼠,购于华中科技大学同济医学院实验动物中心。DMEM/F12、胎牛血清(美国Hyclone公司),Opti-MEM(美国Gibco公司),小鼠抗大鼠GFAP抗体(美国Neomarkers公司),兔抗大鼠Cdk5抗体(美国Santa Cruz公司),FITC标记羊抗兔IgG、Cy3标记羊抗兔IgG、HRP标记羊抗小鼠IgG、HRP标记羊抗兔IgG(美国Jackson ImmunoResearch公司),Edu试剂盒(上海锐博公司),Lipofectamine2000(美国Invitrogen公司),RT-PCR试剂盒(日本TaKaRa公司),Cdk5引物及内参(上海生工生物工程股份有限公司)。设计3种作用于星形胶质细胞Cdk5的干扰序列为目的的siRNA分别为Si-r-Cdk5-001、Si-r-Cdk5-002及Si-r-Cdk5-003(表1),由广州锐博生物有限公司合成。
1.2 方法
1.2.1 星形胶质细胞原代培养和纯化鉴定
取新生24 h内的SD大鼠乳鼠脑组织,PBS漂洗3遍,冰上小心去除脑膜及血管,取皮层组织置于无血清的DMEM/F12培养基中,眼科剪剪碎,0.125%胰酶37℃消化2 min,用含15%胎牛血清DMEM/F12培养基中和胰酶,用200目筛网过滤,4℃ 800 r/min离心5 min,弃上清液,用含20%胎牛血清DMEM/F12培养基重悬,种于用多聚赖氨酸包被的培养瓶中,放置于恒温培养箱中,24 h后换液,除去死亡细胞和未贴壁细胞,之后2~3 d换液,传代2次后可用于实验。
将星形胶质细胞爬片,冰甲醇固定15 min,PBS漂洗3次,0.2% Triton X-100破膜15 min,PBS漂洗3次,5% BSA封闭1 h,PBS漂洗3次,小鼠抗大鼠GFAP抗体(1∶200)4℃孵育过夜,PBS漂洗3次,FITC标记羊抗小鼠IgG抗体(1∶200)避光室温下孵育1 h,PBS漂洗3次,DAPI染核8 min,PBS漂洗3次,50%甘油封片,荧光显微镜进行观察。
1.2.2 siRNA转染
将星形胶质细胞用0.25%胰酶消化,含15%胎牛血清DMEM/F12培养基中和胰酶,4℃ 800 r/min离心5 min,不含血清Opti-MEM培养基重悬细胞,置于离心管中备用。用不含血清的Opti-MEM培养基稀释Lipofectamin 2000和siRNA,室温置于EP管中5 min,将稀释后的Lipofectamin 2000和siRNA轻柔混匀,室温静置20 min形成siRNA/Lipo 2000复合物,将复合物加入备好的含有星形胶质细胞的离心管中,轻柔摇匀后静置5 min,将细胞种入细胞培养板中,将细胞培养板置于36℃细胞培养箱中培养6 h后改成含15%胎牛血清DMEM/F12培养基继续培养,利用转染Cy3-siRNA的细胞来观察转染效率。根据实验需要,有3组siRNA序列可筛选,即Si-r-Cdk5-001(SiT1)组、Si-r-Cdk5-002(SiT2)组及Si-r-Cdk5-003(SiT3)组,分别加入SiT1/Lipo 2000复合物、SiT2/Lipo 2000复合物及SiT3/Lipo 2000复合物;同时设置空白对照组和阴性对照组,其中阴性对照组加入阴性对照siRNA,阴性对照siRNA与目的siRNA序列有相同的碱基组分,但排列不同;与Cdk5无同源性的序列用来排除转入siRNA本身对细胞的影响。
1.2.3 RT-PCR
通过访谈和实验,认为语速缓慢,语音较高适合老年人的学习。但是这部分的课程只能是针对老年人开设的。如同上文所说,不能让受众面扩大。
细胞总RNA提取按照Trizol说明书进行,将溶解后的RNA取1 μL用DEPC水稀释200倍后用紫外分光光度计测定OD260、OD280及OD260/OD280比值,计算RNA的纯度及水平。将RNA在65℃条件下预变性5 min,42℃条件下60 min逆转录60 min,70℃条件下终止反应5 min,合成cDNA。PCR扩增引物序列为Cdk5,上游引物:5’-GGCACCTACGGAACTGTGTT-3’,下游引物:5’-CACAATCTCAGGGTCCAGGT-3’;GAPDH,上游引物:5’-GACATGCCGCCTGGAGAAAC-3’,下游引物:5’-AGCCCAGGATGCCCTTTAGT-3’。PCR扩增条件为95℃ 30 s,63℃ 30 s,72℃ 5s,30个循环。最终数据以2-△△Ct法进行分析。

表1 大鼠Cdk5 siRNA序列
1.2.4 Western Blot检测
收集转染72 h后的星形胶质细胞,加裂解液提取各组细胞总蛋白,BCA法测蛋白水平。取20 μg蛋白进行10% SDS-PAGE电泳,250 mA、90 min转至PVDF膜,PVDF膜经5%脱脂牛奶封闭液封闭90 min后小鼠抗大鼠Cdk5抗体(1∶500)4℃孵育过夜,TBST漂洗3次,HRP标记羊抗小鼠IgG抗体(1∶8000)室温孵育1 h,TBST漂洗3次,ECL液显色曝光,采用Gene Genius Bio-Imaging system凝胶成像分析系统对电泳进行采集和拍照,将拍照用软件ImageJ对条带的灰度信号(OD值)加以半定量分析。
1.2.5 Edu检测细胞增殖
取已转染Cdk5 siRNA的星形胶质细胞及对照组细胞分别接种于24孔板,各个检测时间点前2 h加入Edu,2 h后取出细胞,PBS漂洗3次,室温下用冰甲醇固定细胞15 min,然后按照Edu试剂盒说明书进行染色。
1.2.6 流式细胞术分析细胞周期
取已转染Cdk5 siRNA的星形胶质细胞及对照组细胞置于0.1 mL PBS中,加入1 mL 80%的冰乙醇后放入-20℃,检测前用PBS漂洗冰乙醇2次,用终浓度为50 μL/mL的PI染液4℃避光染色过夜,用流式细胞仪检测星形胶质细胞细胞周期变化。
1.2.7 统计学处理
2 结 果
2.1 星形胶质细胞培养及鉴定
SD大鼠乳鼠星形胶质细胞原代培养得到纯化的星形胶质细胞,呈不规则形,边界清晰,胞体丰满扁平,细胞间彼此连接,折光性强,将星形胶质细胞行GFAP免疫荧光染色,证明原代培养的星形胶质细胞98%表达胶质纤维酸性蛋白GFAP(图1)。

图1 大鼠星形胶质细胞的鉴定 其中绿色为GFAP阳性,蓝色为细胞核DAPI染色
2.2 Cdk5-siRNA转染效率及沉默效率
星形胶质细胞转染Cy3-siRNA,培养后荧光染色可见Cy3标记的siRNA包绕在细胞核周围,提示成功转染入星形胶质细胞,转染效率可达85%以上。利用RT-PCR和Western blot分别测定Cdk5 mRNA及蛋白表达水平来筛选最有效沉默星形胶质细胞Cdk5的siRNA。其中RT-PCR显示与空白对照组比较, SiT1组、SiT2组及SiT3组的Cdk5 mRNA表达水平都降低(P<0.01),其中SiT3转染后的Cdk5 mRNA表达水平最低(图2)。Western blot显示与空白对照组比较,SiT1、SiT2及SiT3转染后的Cdk5蛋白水平均降低(P<0.01),其中SiT3组的Cdk5 蛋白表达水平最低(图2),这与RT-PCR一致。因此,后续实验选取SiT3作为Cdk5 siRNA对星形胶质细胞进行干预。

图2 不同Cdk5-siRNA对Cdk5表达水平的影响 其中A为RT-PCR,SiT3组的Cdk5mRNA表达水平最低,与阴性对照组比较,*P<0.01;B为Westernblot,SiT3组的Cdk5蛋白表达水平最低,与阴性对照组比较,*P<0.01
2.3 Edu检测星形胶质细胞增殖
Edu阳性反应位于胞核内,Edu检测显示Cdk5 siRNA干预组3、6、12 h Edu染色阳性率较对照组显著降低(P<0.01),24 h Cdk5 siRNA干预组与对照组的比较无明显差异(P>0.05)(图3)。
2.4 流式细胞术检测星形胶质细胞细胞周期变化
流式细胞术对星形胶质细胞细胞周期分析显示Cdk5 siRNA干预组3、6、12 h处于S期的星形胶质细胞比例较对照组显著降低(P<0.05),24 h 2组S期细胞比例无明显差异(P>0.05)(图4)。
3 讨 论
细胞周期在真核细胞的生长、分化及增殖过程中起到决定性作用。通常细胞在细胞周期相关蛋白的精密调控下可以完美地完成整个细胞周期过程,然而一旦出现任何异常调节的情况均可导致细胞功能的异常,甚至细胞死亡。神经元和胶质细胞作为中枢神经系统中最主要的两类细胞,以往普遍认为成熟的神经元属于终末分化细胞,不具备增殖能力,但最新研究显示神经元受到损伤时可出现细胞周期的重激活,神经元可重新进入细胞周期,但是细胞周期激活后的神经元并不能完成整个细胞周期,最终会走向死亡[8-9]。相反,胶质细胞不同于神经元,它本身即具备增殖的能力,受损的胶质细胞可发生过度激活,从而致使胶质疤痕的形成以及炎性因子大量释放[10]。
星形胶质细胞作为中枢神经系统中最多的细胞,在正常状态下可以维持内环境稳定、清除氧自由基、减轻神经兴奋性毒性、介导血管形成、营养神经再生等。在神经系统受损后(包括缺血、损伤等)星形胶质细胞出现细胞肥大、活化增殖等现象。活化的星形胶质细胞虽然在一定程度上能够保护周围受损的神经元,但过度的活化增殖可直接介导神经元的死亡以及胶质疤痕的形成,从而造成更进一步的损伤[11]。虽然损伤后星形胶质细胞活化增殖的具体机制目前仍不清楚,但前期研究已经发现细胞受损后细胞周期重激活及细胞周期的调控在其中起到关键性作用[12-13]。
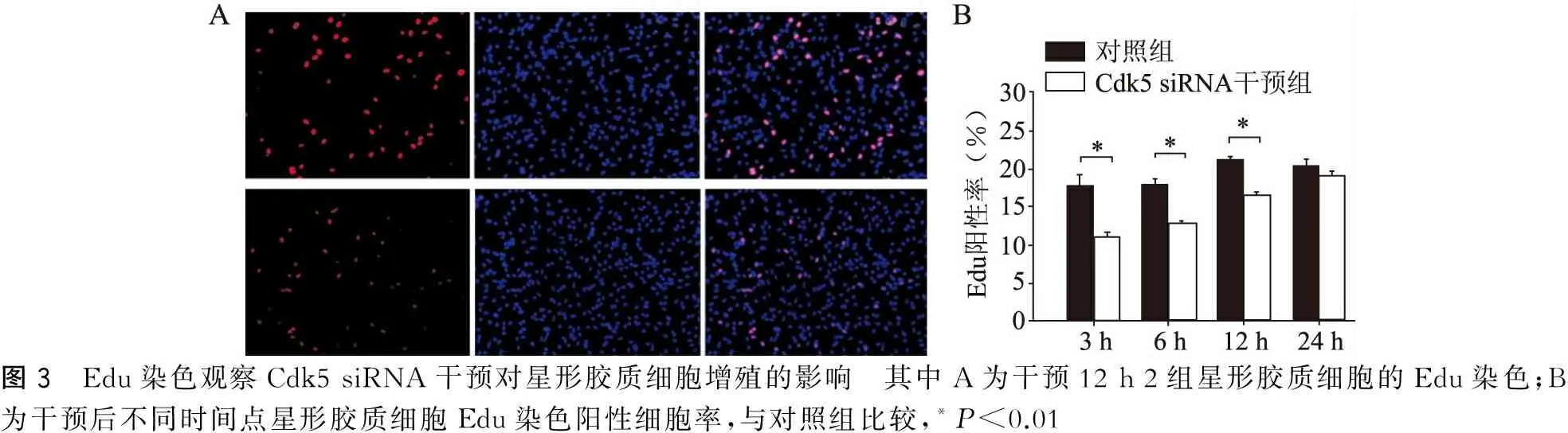
图3 Edu染色观察Cdk5siRNA干预对星形胶质细胞增殖的影响 其中A为干预12h2组星形胶质细胞的Edu染色;B为干预后不同时间点星形胶质细胞Edu染色阳性细胞率,与对照组比较,*P<0.01

图4 流式细胞术分析Cdk5siRNA干预对星形胶质细胞细胞周期的影响 其中A为干预12h2组星形胶质细胞的流式细胞术检测;B为干预后不同时间点星形胶质细胞处于S期细胞比例,与对照组比较,#P<0.05
参与细胞周期调控过程主要包括细胞周期蛋白(Cyclins)、细胞周期蛋白依赖性激酶 (Cyclin dependent kinases,Cdks)和Cdks抑制蛋白(Cyclin dependent kinases inhibitors,CdkIs)[12]。其中Cdks发挥重要作用。细胞周期蛋白依赖性激酶5(Cyclin-dependent kinases 5,Cdk5)是Cdks家族中的一员。Cdk5被认为是“标新立异”的Cdks成员,它并不直接参与细胞周期调控,它可以和CyclinD1和D2结合,但并不产生激酶活性,与调节因子p35或p39结合后产生活性[4]。其中p35主要在大脑皮质中起作用,而p39更多出现在小脑[14]。通常来讲,Cdk5的活性在活体内被有序的调控,包括p35和Cdk5基因的转录控制、p35的降解、p35和Cdk5的磷酸化和结合以及p35到p25的转变等[15]。
早期研究证明CDK5在神经元中存在表达,且在神经元的正常生理功能中起关键作用。有研究显示CDK5/p35复合体稳定可以维持神经元的存活,但同时也证实在多种中枢神经系统疾病中CDK5的过度激活可以介导一系列反应,最终导致神经元的死亡[16-18]。此外,Zhang 等[17,19]发现在神经系统受损后神经元细胞周期重激活导致神经元死亡和CDK5胞浆胞核的表达变化密切相关。由此可见CDK5在神经元各个过程中均起到重要作用。然而在星形胶质细胞中关于Cdk5的研究很少。
目前Cdk5抑制剂(例如roscovitine,olomoucine或者butyrolactone-1)被频繁使用,但最主要的问题是这些抑制剂对其他Cdks也都有抑制作用[20-22]。因此,特异性沉默星形胶质细胞Cdk5显得尤为重要。RNA干扰是近年来发展的新技术,利用小的双链RNA特异性降解与其同源的mRNA来阻断体内特定基因表达[23]。本研究利用RNA干扰技术特异性沉默星形胶质细胞Cdk5后Edu检测结果显示RNA干扰沉默Cdk5组Edu染色阳性率较对照组降低,流式细胞术检测结果与Edu检测结果一致,RNA干扰沉默Cdk5组的S期细胞率较对照组减少。将Edu染色及流式细胞术检测结合起来能更加准确反映DNA合成的S期。本研究结果显示特异性沉默Cdk5可显著降低星形胶质细胞的增殖及细胞周期进展,可以推测Cdk5对星形胶质细胞的增殖可能起正向调控作用,但具体机制仍需进一步研究。
综上所述,本研究结果显示沉默Cdk5可抑制星形胶质细胞的增殖及细胞周期进展,通过对Cdk5的干预可能起到抑制星形胶质细胞过度活化增殖的目的,可为进一步研究中枢神经系统损伤后反应性星形胶质细胞过度活化增殖机制和调控提供实验依据。
[1] Lees E.Cyclin dependent kinase regulation[J].Curr Opin Cell Biol,1995,7(6):773-780.
[2] Hellmich MR,Pant HC,Wada E,et al.Neuronal cdc2-like kinase:a cdc2-related protein kinase with predominantly neuronal expression[J].Proc Natl Acad Sci U S A,1992,89(22):10867-10871.
[3] Lew J,Winkfein RJ,Paudel HK,et al.Brain proline-directed protein-kinase is a neurofilament kinase which displays high sequence homology to P34(CDC2)[J].J Biol Chem,1992,267(36):25922-25926.
[4] Dhavan R,Tsai LH.A decade of CDK5[J].Nat Rev Mol Cell Biol,1994,2(10):51-52.
[5] Shelton SB,Johnson GV.Cyclin-dependent kinase-5 in neurodegeneration[J].J Neurochem,1994,88(6):51-52.
[6] Lagace DC,Benavides DR,Kansy JW,et al.Cdk5 is essential for adult hippocampal neurogenesis[J].Proc Natl Acad Sci U S A,2008,105(47):18567-18571.
[7] Lai KO,Ip NY.Recent advances in understanding the roles of Cdk5 in synaptic plasticity[J].Biochim Biophys Acta,1994,1792(8):51-52.
[8] Di Giovanni S,Knoblach SM,Brandoli C,et al.Gene profiling in spinal cord injury shows role of cell cycle neuronal death[J].Ann Neurol,2003,53(4):454-468.
[9] Liu DX,Greene LA.Regulation of neuronal survival and death by E2F-dependent gene repression and derepression[J].Neuron,1994,32(3):51-52.
[10] Pekny M,Nilsson M.Astrocyte activation and reactive gliosis[J].Glia,2005,50(4,SI):427-434.
[11] Wang W,Bu BT,Xie MJ,et al.Neural cell cycle dysregulation and central nervous system diseases[J].Prog Neurobiol,2009,89(1):1-17.
[12] Wang W,Redecker C,Yu ZY,et al.Rat focal cerebral ischemia induced astrocyte proliferation and delayed neuronal death are attenuated by cyclin-dependent kinase inhibition[J].Journal of Clinical Neuroscience,2008,15(3):278-285.
[13] Zhu Z,Zhang Q,Yu Z,et al.Inhibiting cell cycle progression reduces reactive astrogliosis initiated by scratch injury in vitro and by cerebral ischemia in vivo[J].Glia,2007,55(5):546-558.
[14] Ko J,Humbert S,Bronson RT,et al.p35 and p39 are essential for cyclin-dependent kinase 5 function during neurodevelopment[J].J Neurosci,2001,21(17):6758-6771.
[15] Zhu J.Li W and Mao Z[J].Cdk5:mediator of neuronal development,death and the response to DNA damage.Mech Ageing Dev,2011,132(8/9):389-394.
[16] O'hare MJ,Kushwaha N,Zhang Y,et al.Differential roles of nuclear and cytoplasmic cyclin-dependent kinase 5 in apoptotic and excitotoxic neuronal death[J].J Neurosci,2005,25(39):8954-8966.
[17] Zhang J,Cicero SA,Wang L,et al.Nuclear localization of Cdk5 is a key determinant in the postmitotic state of neurons[J].Proc Natl Acad Sci U S A,2008,105(25):8772-8777.
[18] Cheung ZH.Gong K and Ip NY[J].Cyclin-dependent kinase 5 supports neuronal survival through phosphorylation of Bcl-2.J Neurosci,2008,28(19):4872-4877.
[19] Zhang J.Li H and herrup K[J].Cdk5 nuclear localization is p27-dependent in nerve cells:implications for cell cycle suppression and caspase-3 activation.J Biol Chem,2010,285(18):14052-14061.
[20] Glab N,Labidi B,Qin LX,et al.Olomoucine,an inhibitor of the CDC2/CDK2 kinases activity,blocks plant-cells at the G1 to S and G2 to M cell-cycle transitions[J].FEBS Lett,1994,353(2):207-211.
[21] Meijer L,Borgne A,Mulner O,et al.Biochemical and cellular effects of roscovitine,a potent and selective inhibitor of the cyclin-dependent kinases cdc2,cdk2 and cdk5[J].Eur J Biochem,1997,243(1/2):527-536.
[22] Glicksman MA,Cuny GD,Liu M,et al.New approaches to the discovery of cdk5 inhibitors[J].Curr Alzheimer Res,2007,4(5):547-549.
[23] Paddison PJ,Silva JM,Conklin DS,et al.A resource for large-scale RNA-interference-based screens in mammals[J].Nature,2004,428(6981):427-431.
