BDNF基因重组慢病毒转染MSCs诱导分化神经样细胞的实验研究
2018-05-21卫辉任瑞芳赵君贵永堃闫海清王昊亮闫志新张平
卫辉 任瑞芳 赵君 贵永堃 闫海清 王昊亮 闫志新 张平
骨髓间充质干细胞(mesenchymal stem cells,MSCs)被誉为一种多潜能的种子细胞,具有多向分化及很强的自我增值能力。其低免疫源性为细胞的自体与异体移植提供了极大方便[1-7]。在不同药物、细胞营养因子、细胞共培养等作用下可诱导MSCs分化为多种不同细胞,甚至向神经细胞跨胚层分化[3,5,8-10],研究表明正常神经细胞间的突触联系以及靠突触联系所传递的电生理及神经递质在该神经样细胞上很可能也具备[11-14],而且移植后可代替坏死的神经细胞发挥正常的生理作用,明显修复损毁的组织结构,进一步促进神经功能恢复。突破了脑细胞损伤后不能恢复的常规观念,成为现阶段神经系统疾病治疗的一个焦点[15-20]。
脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)是神经营养因子家族成员之一,1982年由德国神经化学家Barde等[21]首次从猪脑提取液中发现并提纯,其广泛分布于中枢神经系统内,在神经系统发育过程中能延缓神经元的变性和凋亡,对神经元的存活、分化及生长发育起重要作用,还能降低缺血性脑损伤后局部组织的缺血程度,防止神经元受损,改善病理状态,促进和保护神经元的修复和再生,从而增进脑卒中后神经功能的恢复,是中枢及周围神经系统神经元维持生存及正常生理功能所必需的神经营养因子[22-26]。有研究发现BDNF不仅能诱导MSCs分化为神经样细胞,而且能延长其存活时间[10,27]。
本实验旨在通过应用BDNF基因重组慢病毒(1entiviral vectors,LV)转染MSCs,诱导其向神经样细胞分化,并将其移植到脑出血模型体内后应用免疫荧光技术检测诱导后的MSCs脑内迁移及分化神经细胞标志物的情况。
1 材料与方法
1.1 实验材料、试剂及仪器
L-DMEM 培养基(美国,Hyclone公司)、胎牛血清(美国,Hyclone公司)、VII型胶原酶(美国,Sigma Bio Science公司)、胰蛋白酶(美国,Hyclone公司)、SD雄性大鼠60只,随机分为PBS组(n=15)、MSCs组(n=15)、MSCs-EGFP组(n=15)、MSCs-EGFP-BDNF组(n=15)。以7、14、21 d作间隔将大鼠等分到3个亚组,每亚组各5只。大鼠常温饲养,自由摄食、饮水,术前12 h禁饮食、MILLI-Q超纯水纯化系统(美国,Millipore Trading Co.ltd公司)、大鼠脑立体定位仪(中国,深圳瑞沃德)、CO2培养箱(美国,Thermo公司)、激光共聚焦显微镜(德国,Leica公司)。
1.2 MSCs的分离、培养及鉴定
快速断颈6周龄SD雄性大鼠,浸于75%酒精中,消毒10 min后置超净工作台取股骨和胫骨;剪开两端骨髓腔,磷酸盐缓冲液(PBS)冲出骨髓,1000 r/min 离心5 min,弃上清,用含有15%胎牛血清、100 U/mL青霉素、100 U/mL链霉素的L-DMEM完全培养基制成单细胞悬液于培养瓶内,37 ℃、5% CO2培养箱中松口培养;1 d后半换液、2 d后全换液,之后每2~3 d换液1次,细胞80%融合时消化、传代。收集3组生长良好的第3代MSCs,第1组加入大鼠IgG-FITC、IgG-PE各5 uL作为对照;第2组加入大鼠CD29-FITC、CD45-PE各5 uL,第3组加入CD90-PE 5 uL,混匀后室温、避光状态下作用25 min,每管加入PBS液 2 mL,于振荡器上震荡混匀,1000 r/min,离心5 min,弃上清,加入2%多聚甲醛200 uL固定,待上机检测。
1.3 慢病毒载体转染MSCs
用第3代状态较好的MSCs(约1×104)接种于96孔板中;根据慢病毒的不同滴度和细胞数按照50的转染复数(multiplicity of infection,MOI)分别加入BDNF-EGFP-LV和EGFP-LV;同时按病毒转染增强溶液体积加入8 μg/mL的促转染剂(polybrene),混匀后置于37 ℃、5% CO2培养箱中培养;8~12 h观察细胞状态,换完全培养基;3~4 d荧光显微镜下观察MSCs中EGFP的荧光表达情况,分别收集由BDNF-EGFP-LV和EGFP-LV转染的2组MSCs的细胞悬液及1组单纯MSCs作为对照组,每组约5×105个MSCs行流式细胞仪检测转染率。
1.4 大鼠脑出血模型建立及侧脑室MSCs移植
取体重为250~300g SD雄性大鼠,术前禁饮食12 h,10%水合氯醛(300mg/kg)腹腔麻醉,俯卧固定于立体定位仪;消毒并剪开皮肤,暴露颅骨,微量加样器于右侧尾状核(前囟前0.2 mm,右旁开3 mm,进针5.5 mm)注入0.5 uL Ⅶ型胶原酶(1 U/mL),留针10 min,缝合皮肤,局部消毒;3 d后麻醉固定造模成功的大鼠,微量加样器于左侧脑室(前囟后0.8 mm,左旁开1.5 mm,进针4.6 mm)分别移植(1)PBS组:PBS液 20 uL;(2)MSCs组:MSCs悬液20 uL(相当于2×105个细胞);(3)MSCs-EGFP组:空病毒转染MSCs悬液20 uL;(4)MSCs-EGFP-BDNF组:携带BDNF的慢病毒转染MSCs悬液20 uL。每组各15只大鼠。
1.5 脑组织切片免疫荧光单标鉴定MSCs的迁移
各组模型大鼠分别于7、14、21 d用10%水合氯醛麻醉(n=5),断颈处死后迅速选脑出血附近脑组织冰冻,以冠状面10 μm厚度连续切取,隔20张提取1张;室温晾干后用多聚甲醛固定20 min,PBS洗5 min×3次;0.3%的Trition透膜20 min,PBS洗5 min×3次;2 mol/L的HCL 37 ℃作用30 min,PBS洗5 min×3次;分别加一抗(对照组加PBS)后4 ℃冰箱过夜;弃去一抗,PBS洗5 min×3次;分别加荧光二抗(1∶200),室温下避光孵育1 h,PBS洗5 min×3次;抗荧光衰减封片剂封固。
1.6 免疫荧光双标鉴定MSCs脑内分化神经细胞标志物的表达
以上述方法选取脑组织冰冻切片室温晾干,多聚甲醛固定20 min,0.3%辛基苯基聚氧乙烯醚(Trition X-100)透膜20 min,2 mol/L的盐酸37 ℃下作用30 min,加一抗GFAP(1∶100),阴性对照加PBS;4 ℃过夜后加荧光二抗(1∶200),避光状态下室温孵育1 h,洗净后抗荧光衰减封片剂封固镜检。
1.7 统计学处理
2 结 果
2.1 MSCs的培养、鉴定及诱导分化
MSCs由原代传至第3代时可见形态呈均匀一致的长梭状。细胞的增殖速度较原代明显增快。流式细胞术检测显示CD90阳性率98.09%、CD29阳性率95.17%、CD45阳性率6.33%。符合MSCs表型特征;慢病毒转染MSCs后镜下可见大量绿色荧光表达,转染复数为50时流式细胞转染率测定BDNF-EGFP-LV转染率为95.23%、EGFP-LV转染率为96.08%、对照组为2.29%;3 d后MSCs胞体逐渐收缩变小、变亮、遮光性增强,伸出较多长突起;呈现出单极、双极甚至多极的类神经样细胞;MSCs组、MSCs-EGFP组细胞形态无明显变化(图1)。

图1 A为单纯MSCs,呈均匀一致长梭形;B为诱导72h后MSC逐渐出现胞体收缩变亮、遮光性增强,并出现较多的长突起,有单极、双极甚至多极的类神经样细胞(×100倍)
2.2 成功构建的SD大鼠脑出血模型及神经功能缺损评分
各组大鼠造模1 d后参照Longa评分法[28]进行评分:0分为无神经功能缺损;1分为偏瘫侧前爪不能完全伸展;2分为行走时向偏瘫侧转圈;3分为行走时身体向偏瘫侧倾倒;4分为不能自发行走,有意识丧失。本实验中评分为2~3分者为造模成功,剔除造模失败者随机补充(图2)。PBS组神经功能缺损显著,每个时间点缺损评分均高于其他3组,MSCs-EGFP-BDNF组分值最低(P<0.05),MSCs组和MSCs-EGFP组无明显差异(P>0.05)(图3)。

图2 A为成功构建的脑出血模型;B为脑出血模型的脑组织切片
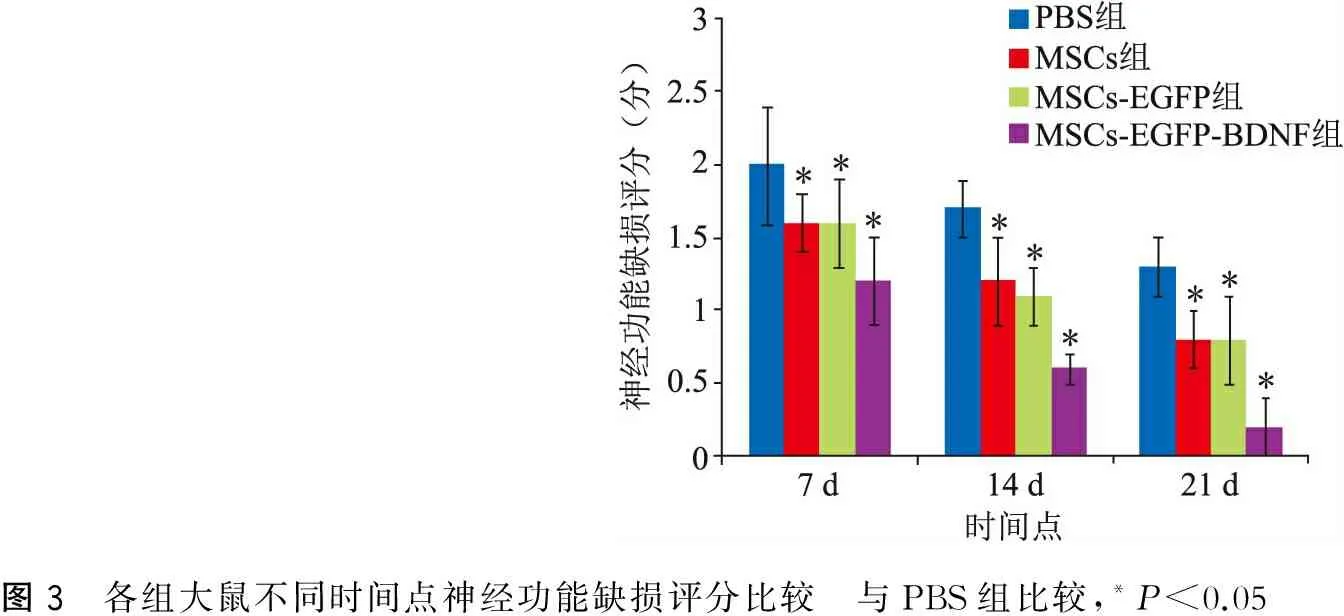
图3 各组大鼠不同时间点神经功能缺损评分比较 与PBS组比较,*P<0.05
2.3 免疫荧光单标鉴定MSCs的脑内迁移
快速脑组织冰冻切片,镜下可见免疫荧光单标的MSCs向脑出血灶周围迁移,而病灶对侧脑组织则未见MSCs的示踪荧光(图4)。观察免疫荧光单标的MSCs,每张切片取5个不同视野进行计数,取其平均值后进行统计显示MSCs-EGFP-BDNF组阳性细胞数明显多于MSCs组及MSCs-EGFP组(P<0.05),而MSCs组与MSCs-EGFP组除7 d外其余比较均无明显差异(P>0.05)(图5)。

图4 A为脑出血灶周围组织,免疫荧光单标显示MSCs迁移至脑出血灶周围;B为出血灶对侧脑组织,未见MSCs(×200倍)
2.4 免疫荧光双标鉴定MSCs脑内分化神经细胞标志物GFAP的表达
荧光双标显示经侧脑室移植的MSCs于7、14、21 d均可见到Brdu或EGFP标记的绿色MSCs。星形胶质细胞特异表达的胶原纤维酸性蛋白(glia fibrilary Acidic protein,GFAP)阳性率均随时间延长而增多(P<0.05)(图6),其中MSCs-EGFP-BDNF组各时间点双标细胞阳性率均高于其它2组(P<0.05),但MSCs-EGFP组与MSCs组无明显差异(P>0.05)(图7)。
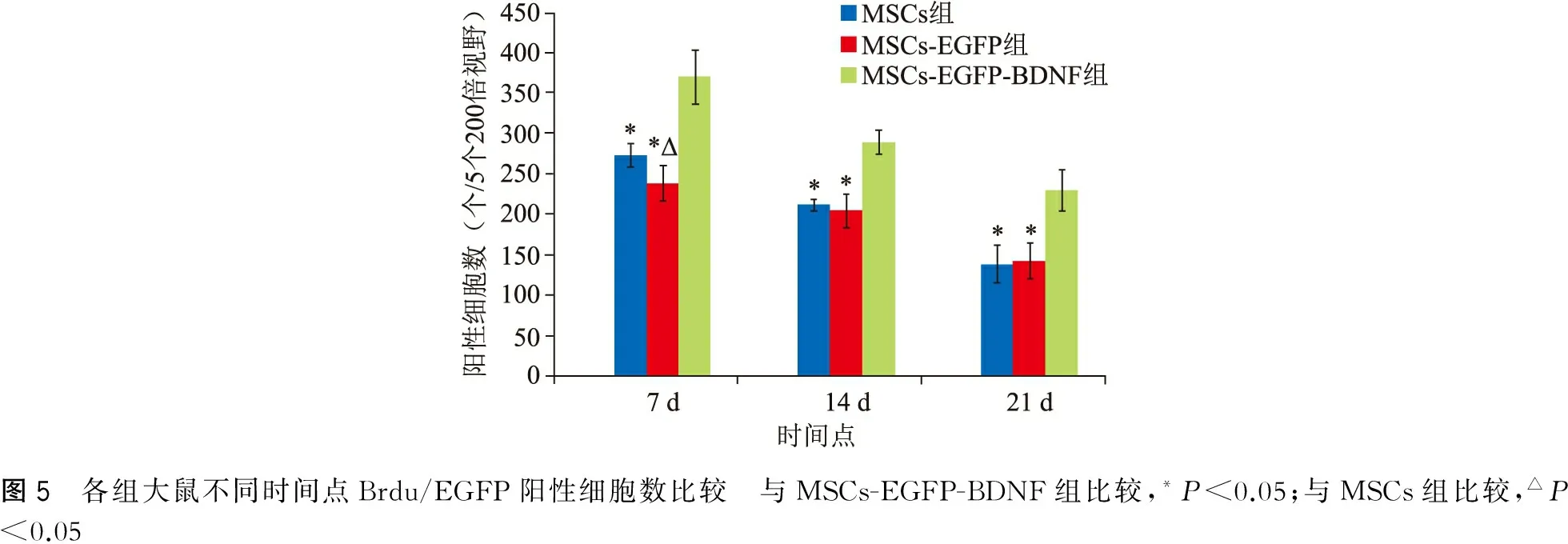
图5 各组大鼠不同时间点Brdu/EGFP阳性细胞数比较 与MSCs-EGFP-BDNF组比较,*P<0.05;与MSCs组比较,△P<0.05

图6 MSCs移植后分化为星形胶质细胞(GFAP)的荧光双标细胞(×400倍) A为移植后迁移至出血灶周围的MSCs(绿色);B为同一部位GFAP蛋白的表达(红色);C为移植后MSCs胞浆内GFAP蛋白的表达(黄色)

图7 各组大鼠不同时间点GFAP阳性细胞数比较 与MSCs-EGFP-BDNF组比较,*P<0.05
3 讨 论
MSCs在不同培养基、细胞共培养、空间结构及营养因子的调节下可向不同种类、甚至不同胚层细胞分化。其分化机制相当复杂,从遗传学角度分析,细胞的定向分化是由相同基因组在不同时间、空间表达不同基因的结果。BDNF可保护神经细胞免受各种损害、促进突触联系,更好地保证突触传递,因而被誉为神经细胞的保护剂和营养剂[12,15-16,25]。有研究显示BDNF可保护移植的细胞从而延长寿命,诱导MSCs分化为神经样细胞[10,29]。但是正常脑组织内神经营养因子的表达很少,且外源的BDNF很难通过血脑屏障,无法在脑损伤后对受损神经细胞起到足够的修复与保护作用[30]。如果在MSCs植入动物模型前用BDNF诱导其分化为神经细胞,移植后是否可以保护其存活、增殖并促进神经修复?进而探讨该神经样细胞是否具备正常神经细胞的生理功能。
本实验选用BDNF与慢病毒DNA基因重组,将携带有BDNF的慢病毒转染MSCs,病毒糖蛋白与MSCs膜上的特异受体结合而进入细胞浆,与MSCs基因同时复制并代代相传。病毒DNA与BDNF基因转录成RNA后再转运至胞浆,在胞浆内BDNF的RNA翻译合成蛋白,使BDNF达到稳定过表达[10,31-34]。本实验前期已通过RT-RCR、Western blotting及细胞爬片免疫荧光三标等方法检测到MSCs-EGFP-BDNF组较其它2组BDNF基因及蛋白表达明显增多,提示转基因MSCs组BDNF在MSCs内转录并能翻译合成蛋白。镜下观察未经诱导的MSCs多为均匀一致的长梭形,而经BDNF诱导3 d后的MSCs逐渐出现胞体回缩变小、变圆,折光性增强,并伸出较多的长突起交织成网,呈现出有单极、双极甚至多极的突触联系样类神经细胞,提供了神经递质传递和电生理产生的基本网络通道。经侧脑室移植后荧光单标检测各组大鼠脑出血灶周围均可见绿色荧光标记的MSCs,提示侧脑室移植的MSCs可迁移至对侧脑出血灶周围[35-36]。有实验表明脑血管病变时毁损的脑细胞会释放一些炎性因子致使MSCs表达不同的粘附分子、趋化因子、受体和配体,趋使被移植入血管或局部的MSCs向病灶周围定向迁移和归巢,并促进神经功能的恢复[37]。另值得注意的是,MSCs在脑卒中后的迁移及神经功能缺损的修复作用可能与脑组织损伤后分泌的BDNF有关[38]。本实验结果显示21 d在对侧脑出血灶周围组织中仍可见EGFP标记的MSCs存活,且BMSCs-EGFP-BDNF组的迁移率及存活率更高,进一步提示BDNF对MSCs具有强大的保护作用。有研究表明,MSCs移植入大鼠体内后缺血缺氧的脑组织分泌大量BDNF而促进MSCs再生突触及新生血管,并趋化MSCs归巢入毁损组织周围与宿主脑细胞之间建立突触联系,从而取代坏死的神经细胞修复损伤组织[12,34]。本实验中虽各组大鼠神经功能评分均有所改善,但明显以MSCs-EGFP-BDNF组神经功能恢复最为突出。其机制可能是MSCs移植后可分化为神经细胞并和宿主细胞建立联系,从而改善神经功能(替代学说)[39],而BDNF起到了神经保护作用,它可以调节机体内环境,为MSCs提供有力的生长条件,对神经细胞的发育、分化、生长、再生和功能特性的表达均起到了至关重要的作用(营养学说)[27,34,40]。
在神经功能修复过程中星形胶质细胞的作用非常重要。GFAP是星形胶质细胞特异表达的中间纤维丝蛋白,构成胶质细胞的骨架,连接细胞核和细胞膜,促进有丝分裂和向成熟星形胶质细胞分化,保证神经元的基本结构和髓鞘形成,使细胞信号转导通路得以完成。本实验研究结果显示荧光双标的细胞除PBS组外其他3组均有GFAP的表达,且随时间延长而增多,其中MSCs-EGFP-BDNF组各时间点双标细胞阳性率均高于其他3组(P<0.01),但MSCs-EGFP组与MSCs组之间差异无统计学意义(P>0.05)。表明MSCs于体外经BDNF诱导分化后不但具有神经细胞的形态,且脑内移植后在特定的微环境下还可以表达神经细胞相关蛋白(GFAP)。有研究显示BDNF对MSCs衍生的神经潜力是通过与MSCs膜上的跨膜蛋白即BDNF受体TrkB的结合后激活磷脂酶C、丝裂原活化蛋白激酶、肌醇三磷酸激酶等通路,从而促进神经元存活、分化及调节外周和中枢神经系统突触传递[41-42]。
本实验研究结果显示被BDNF诱导后的神经样细胞可能具备神经突触并建立突触联系、表达神经细胞相关特异蛋白。虽然MSCs被诱导为神经样细胞的研究取得了一些进展,但仅从其类神经样细胞的形态及表达神经细胞一两个特异蛋白来判定其分化成了有正常生理功能的成熟神经细胞?证据是不足的。这里仍有太多问题值得进一步思考:如何更有效提升MSCs向神经细胞诱导分化的成活率及分化率,移植后是否整合入正常的神经环路、是否有正常神经递质的分泌?再则,本实验是由处死被干预的大鼠模型而取得实验数据,显然这类方法无法用于人体研究,然而不可否认任何实验的最终目的都要归终于临床才有其根本的研究意义和价值。因此,为了能够更好地评价和指导临床治疗效果,必须要找到可以在活体内示综的方法,以便高效、无创的检测到被基因重组MSCs的动态变化。目前看来MSCs虽已在基础研究和动物实验方面崭露头角,但应用于临床还有很长的路要走。
[1] Fernandez V,Romaniuk M,Choi H,et al.Mesenchymal stem cells and their use in therapy: what has been achieved[J].Differentiation,2013,85(1/2):1-10.
[2] Iskandar ME,Cipriano AF,Lock J,et al.Improved bone marrow stromal cell adhesion on micropatterned Titanium surfaces[Z],2012:5666-5669.
[3] Lee J,Baek JH,Choi KS,et al.Cyclin-dependent kinase 4 signaling acts as a molecular Switch between syngenic differentiation and neural transdifferentiation in human mesenchymal stem cells[J].Cell Cycle,2013,12(3):442-451.
[4] Salgado AJ,Sousa JC,Costa BM,et al.Mesenchymal stem cells secretome as a modulator of the neurogenic niche:basic insights and therapeutic opportunities[Z],2015:249.
[5] Himes BT,Neuhuber B,Coleman C,et al.Recovery of function following grafting of human bone marrow-derived stromal cells into the injured spinal cord[J].Neurorehabil Neural Repair,2006,20(2):278-296.
[6] Gregory CA,Prockop DJ,Spees JL.Non-hematopoietic bone marrow stem cells: Molecular control of expansion and differentiation[J].Exp Cell Res,2005,306(2):330-335.
[7] Spencer ND,Gimble JM,Lopez MJ.Mesenchymal stromal cells: past,present,and future[J].Veterinary Surgery,2011,40(2):129-139.
[8] Liu QX,Cheng G,Wang ZW,et al.Bone marrow-derived mesenchymal stem cells differentiate into nerve-like cells in vitro after transfection with brain-derived neurotrophic factor gene[J].In Vitro Cell Dev Biol Anim,2015,51(3):319-327.
[9] Zhao L,Lin YD,Ma J,et al.Culture and neural differentiation of rat bone marrow mesenchymal stem cells in vitro[J].Cell Biol Int,2007,31(9):916-923.
[10] Han ZM,Huang HM,Wang FF.Brain-derived neurotrophic factor gene-modified bone marrow mesenchymal stem cells[J].Exp Ther Med,2015,9(2):519-522.
[11] Liu ZW,Li Y,Zhang XE,et al.Contralesional axonal remodeling of the corticospinal system in adult rats after stroke and bone marrow stromal cell treatment[J].Stroke,2008,39(9):2571-2577.
[12] Sygnecka K,Heider A,Scherf N,et al.Mesenchymal stem cells support neuronal fiber growth in an organotypic brain slice Co-Culture model[J].Stem Cells Dev,2015,24(7):824-835.
[13] Shen LH,Li Y,Chen J,et al.Intracarotid transplantation of bone marrow stromal cells increases axon-myelin remodeling after stroke[J].Neuroscience,2006,137(2):393-399.
[14] Li Y,Chen J,Zhang CL,et al.Gliosis and brain remodeling after treatment of stroke in rats with marrow stromal cells[J].Glia,2005,49(3):407-417.
[15] Jeong CH,Kim SM,Lim JY,et al.Mesenchymal stem cells expressing Brain-Derived neurotrophic factor enhance endogenous neurogenesis in an ischemic stroke model[J].Biomed Res Int,2014,129145.
[16] Sharma AD,Brodskiy PA,Petersen EM,et al.High throughput characterization of adult stem cells engineered for delivery of therapeutic factors for neuroprotective strategies[J].J Vis Exp,2015,95:e52242.
[17] Tanna T,Sachan V.Mesenchymal stem cells: potential in treatment of neurodegenerative diseases[J].Curr Stem Cell Res Ther,2014,9(6):513-521.
[18] Zhou S.From bone to brain:human skeletal stem cell therapy for stroke[J].Cent Nerv Syst Agents Med Chem,2011,11(2):157-163.
[19] Li Y,Chopp M,Chen J,et al.Intrastriatal transplantation of bone marrow nonhematopoietic cells improves functional recovery after stroke in adult mice[J].J Cereb Blood Flow Metab,2000,20(9):1311-1319.
[20] Iihoshi S,Honmou O,Houkin K,et al.A therapeutic window for intravenous administration of autologous bone marrow after cerebral ischemia in adult rats[J].Brain Res,2004,1007(1/2):1-9.
[21] Barde YA,Edgar D,Thoenen H.Purification of a new neurotrophic factor from mammalian brain[J].EMBO J,1982,1(5):549-553.
[22] Chen BY,Wang X,Wang ZY,et al.Brain-derived neurotrophic factor stimulates proliferation and differentiation of neural stem cells,possibly by triggering the Wnt/beta-catenin signaling pathway[J].J Neurosci Res,2013,91(1):30-41.
[23] Markham A,Bains R,Franklin P,et al.Changes in mitochondrial function are pivotal in neurodegenerative and psychiatric disorders:how important is BDNF[J].Br J Pharmacol,2014,171(8):2206-2229.
[24] Song MS,Learman CR,Ahn KC,et al.In vitro validation of effects of BDNF-expressing mesenchymal stem cells on neurodegeneration in primary cultured neurons of APP/PS1 mice[J].Neuroscience,2015,307:37-50.
[25] Gomes C,Smith SC,Youssef MN,et al.RNA polymerase 1-driven transcription as a mediator of BDNF-induced neurite outgrowth[J].J Biol Chem,2011,286(6):4357-4363.
[26] Nomura T,Honmou O,Harada K,et al.I.v.infusion of brain-derived neurotrophic factor gene-modified human mesenchymal stem cells protects against injury in a cerebral ischemia model in adult rat[J].Neuroscience,2005,136(1):161-169.
[27] Shi W,Nie D,Jin G,et al.BDNF blended chitosan scaffolds for human umbilical cord MSC transplants in traumatic brain injury therapy[J].Biomaterials,2012,33(11):3119-3126.
[28] Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[29] Yaghoobi MM,Mahani MT.NGF and BDNF expression drop off in neurally differentiated bone marrow stromal stem cells[J].Brain Res,2008,1203:26-31.
[30] Makar TK,Trisler D,Eglitis M,et al.Brain-derived neurotrophic factor(BDNF)gene delivery into the CNS using bone marrow cells as vehicles in mice[J].Neurosci Lett,2004,356(3):215-219.
[31] Nasri M,Karimi A,Farsani MA.Production,purification and titration of a lentivirus-based vector for gene delivery purposes[J].Cytotechnology,2014,66(6):1031-1038.
[32] Lu FZ,Fujino M,Kitazawa Y,et al.Characterization and gene transfer in mesenchymal stem cells derived from human umbilical-cord blood[J].J Lab Clin Med,2005,146(5):271-278.
[33] Mcmahon JM,Conroy S,Lyons M,et al.Gene transfer into rat mesenchymal stem cells: a comparative study of viral and nonviral vectors[J].Stem Cells Dev,2006,15(1):87-96.
[34] Zhao LX,Zhang J,Cao F,et al.Modification of the brain-derived neurotrophic factor gene: a portal to transform mesenchymal stem cells into advantageous engineering cells for neuroregeneration and neuroprotection[J].Exp Neurol,2004,190(2):396-406.
[35] Mahmood A,Lu D,Yi L,et al.Intracranial bone marrow transplantation after traumatic brain injury improving functional outcome in adult rats[J].J Neurosurg,2001,94(4):589-595.
[36] Li Y,Chen J,Wang L,et al.Treatment of stroke in rat with intracarotid administration of marrow stromal cells[J].Neurology,2001,56(12):1666-1672.
[37] Von LI,Notohamiprodjo M,Wechselberger A,et al.Human adult CD34-progenitor cells functionally Express the chemokine receptors CCR1,CCR4,CCR7,CXCR5,and CCR10 but not CXCR4[J].Stem Cells Dev,2005,14(3):329-336.
[38] Yuan Y,Pan SM,Sun ZM,et al.Brain-derived neurotrophic factor-modified umbilical cord mesenchymal stem cell transplantation improves neurological deficits in rats with traumatic brain injury[J].International Journal of Neuroscience,2014,124(7):524-531.
[39] Titomanlio L,Kavelaars A,Dalous J,et al.Stem cell therapy for neonatal brain injury: perspectives and challenges[J].Ann Neurol,2011,70(5):698-712.
[40] Kurozumi K,Nakamura K,Tamiya T,et al.BDNF gene-modified mesenchymal stem cells promote functional recovery and reduce infarct size in the rat middle cerebral artery occlusion model[J].Molecular Therapy,2004,9(2):189-197.
[41] Lim JY,Park SI,Oh JH,et al.Brain-derived neurotrophic factor stimulates the neural differentiation of human umbilical cord blood-derived mesenchymal stem cells and survival of differentiated cells through MAPK/ERK and PI3K/Akt-dependent signaling pathways[J].J Neurosci Res,2008,86(10):2168-2178.
[42] Lim JY,Park SI,Kim SM,et al.Neural differentiation of Brain-Derived neurotrophic Factor-Expressing human umbilical cord Blood-Derived mesenchymal stem cells in culture via TrkB-Mediated ERK and beta-Catenin phosphorylation and following transplantation into the developing brain[J].Cell Transplant,2011,20(11/12):1855-1866.
