实时荧光定量PCR检测马尔尼菲篮状菌病组织样本中菌载量的研究
2018-05-17郑艳青史娜娜曹存巍
郑艳青 史娜娜 曹存巍
(1.广西医科大学第一附属医院皮肤性病科,南宁 530021;2.南宁市第四人民医院,南宁 530023;3.广西艾滋病防治研究重点实验室,南宁 530021)
马尔尼菲篮状菌病 (talaromycosis marneffei,TSM)在东南亚、我国南方,尤其是广西、广东具有区域性流行[1],TSM好发于免疫受损患者[2],尤其是AIDS患者,据统计广西19%的AIDS患者合并T.marneffei感染,是仅次于结核的第二大机会性感染[3]。值得注意的是,近年来TSM在未合并基础疾病,细胞免疫功能未见异常的人群中发病数逐渐增多[4]。TSM病情隐匿,临床表现错综复杂,缺乏特征性,容易误诊和漏诊,若不早期诊断和及时治疗死亡率高 (超过80%)[5]。本研究组前期应用实时荧光定量PCR (quantitative real-time PCR,qPCR)技术,设计出具有高度特异性的T.marneffei引物和Taqman探针,建立了稳定、高度特异、敏感、快速的检测体系。在初步临床检测中,55例首次采集的血清样本首次qPCR检测呈阳性,与真菌培养结果一致性高达100%,耗时比真菌培养确诊提前5~14 d,此方法有助于快速、特异性诊断TSM[6]。本研究基于前期研究结果,将临床样本扩展到病理切片、活检组织,期望从不同的临床样本中收集T.marneffei感染证据,为TSM的快速确诊提供坚实、可靠的证据。
1 材料与方法
1.1 研究对象
2017年1~6月期间,收集首次就诊于广西医科大学第一附属医院的5名HIV阴性TSM患者样本,包括肩部、臀部、前额、手背病理切片样本共5例,淋巴结活检组织样本1例。患者基本情况见表1。
1.2 方法

表1 TSM患者基本信息和临床表现
注:/.无合并症
1.2 方法
病理组织切片总DNA提取 将石蜡包埋的病理组织,切3~5薄片放入2 mL离心管中。加入1 200 μL二甲苯,涡旋震荡,20 000 g离心5 min,移去上清。往沉淀加1 200 μL无水乙醇,轻柔地震荡。20 000 g离心5 min,移去上清。重复用无水乙醇清洗1次。37℃开盖孵育10~15 min,直到酒精蒸发干净。加入180 μL的ATL缓冲液。按照DNeasy Blood & Tissue Kit (Qiagen, Hilden, Germany)试剂盒说明书提取组织总DNA。
淋巴结组织总DNA提取 取疑似TSM患者病变淋巴结,于生物安全柜中研磨破碎组织,用200 μL Buffer ATL重悬,将匀浆转移至1.5 mL离心管中,按照DNeasy Blood & Tissue Kit (Qiagen, Hilden, Germany)试剂盒说明书提取组织总DNA。
qPCR扩增[6]引物和Taqman探针序列:见表2。
Real-time PCR反应体系:2×Taqman universal PCR master mix 10 μL、5 μmol/L上下游引物和探针各1 μL,模板1~5 μL,无菌三蒸水补足20 μL。扩增体系:50℃ 2 min;95℃ 10 min;95℃ 15 s,60℃ 1 min运行40个循环。设置已知浓度T.marneffeiDNA做阳性对照,白念珠菌DNA为阴性对照,反应终点读取达阈值荧光量的循环数

表2 qPCR 引物和探针序列
(Cq)。
2 结 果
上述实验操作至读取结果所需时间为3~4 h。如表3所示,皮肤病理切片、淋巴结活检组织qPCR检测结果阳性。淋巴结活检组织马尔尼菲篮状菌载量4.68×105copies,病理石蜡切片平均菌载量3.01×104copies (1.07×104~7.26×104copies)。
3 讨 论
T.marneffei主要侵犯人体单核吞噬细胞系统,可引起局限性感染和全身播散性感染,不同器官受累出现不同的临床表现,主要以发热,贫血,浅表及深部淋巴结肿大,肝脏和脾脏肿大,皮肤黏膜损害、溶骨性损害、呼吸道症状等为主,缺乏特异性[7],导致TSM患者难以确诊,耽误早期治疗。邓卓霖等[8]报道TSM的病理改变与患者免疫状态有关,免疫力强的患者病变局限,T.marneffei较少,表现为慢性肉芽肿炎;具有一定免疫力的患者,表现为化脓性炎;而免疫功能低下的患者,病变组织中无或极少淋巴细胞存在,布满大量T.marneffei,表现为无反应性坏死性炎症,TSM患者临床表现个体差异大,尤其是免疫功能未见异常的患者,其临床表现不明显,容易漏诊、误诊。
表3TSM不同组织样本中T.marneffei菌载量
Tab.3Loads ofTalaromycesmarneffeiin different samples of TSM cases
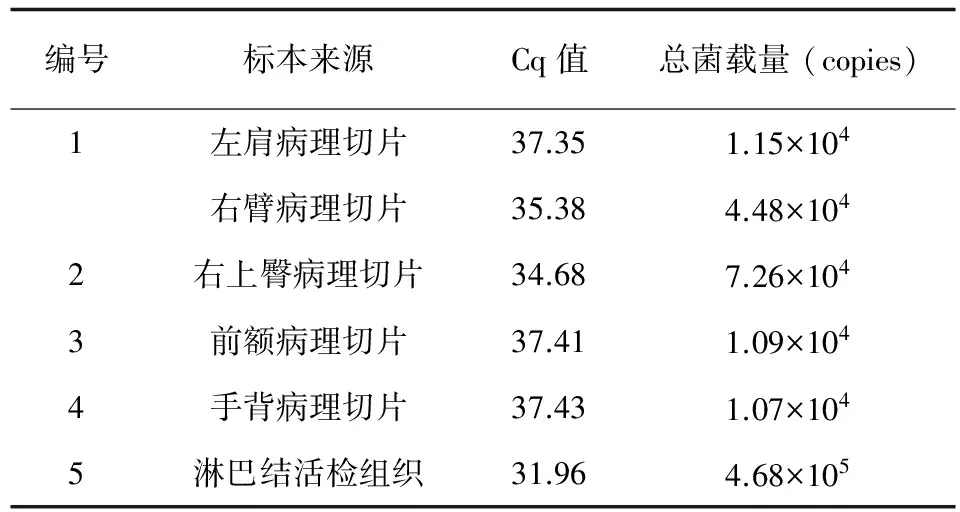
编号标本来源Cq值总菌载量(copies)1左肩病理切片37.351.15×104右臂病理切片35.384.48×1042右上臀病理切片34.687.26×1043前额病理切片37.411.09×1044手背病理切片37.431.07×1045淋巴结活检组织31.964.68×105
目前,临床上诊断TSM以血标本、骨髓、痰液、活检组织等无菌样本的真菌涂片和培养作为金标准,病理学检查、血清学检测作为辅助诊断。TSM临床特点和病理学特征与结核分枝杆菌、荚膜组织胞浆菌感染非常相似,难于辨别[8-9],T.marneffei与荚膜组织胞浆菌在感染组织中的大小、形态相似,染色相同,需要进行真菌培养才能鉴别。但是,真菌培养耗时长 (4~7 d),不能满足临床快速诊断、早期治疗的迫切需求[10]。
血清半乳甘露聚糖 (GM)试验作为TSM病广泛的辅助诊断,具有便捷、快速、无创等优点,GM试验对PSM患者总体敏感度为78.38%,特异度为82.98%,但多种影响因素均可导致GM试验出现假阳性[11]。而T.marneffei未释放入血或释放入血后被迅速清除则会使GM试验出现假阴性,导致漏诊、误诊的情况。本研究旨在运用多种检测手段,从不同临床样本中收集T.marneffei感染证据,为临床诊断提供依据。
实时荧光定量PCR (qPCR)具有快速、灵敏度高、特异性强、重复性好、定量准确、全封闭反应等优点,成为病原分子生物学研究的重要工具,qPCR已经有效地运用在结核分枝杆、HCV、HIV、曲霉菌等病原微生物的诊断[12]。实验组前期首次建立了qPCR诊断TSM的方法体系,该方法特异性为100%,灵敏度高,最低检测限 (LOD)达到5~10拷贝数/反应。并在前期初步运用于临床血清标本的检测,患者首次采集的血清检测结果比真菌培养确诊提前了5~14 d,并且能够同时检测活菌或者死菌,甚至是游离在在血清中T.marneffei的基因组DNA[6]。
Tsunemi等[13]首次在1例患者皮肤活检组织中扩增出T.marneffei。Hanxiang Zeng等[14]运用巢式PCR成功检测出患者皮肤、肺组织石蜡切片中的T.marneffei。本实验收集TSM患者皮损病理切片或病变淋巴结组织,运用实时荧光定量PCR技术,准确地检测出皮损切片和淋巴结活检组织中T.marneffei载量,本实验方法具有快速、精确、定量、操作密闭性好的特点,直接检测样本中原始的菌载量,可直观反应病变组织遭受侵袭的严重程度。
有研究表明,TSM患者组织T.marneffei培养阳性率依次为:骨髓和淋巴结 (100%)、皮疹组织 (90%)、血液 (76%)。并且皮疹组织及皮疹分泌物培养出T.marneffei的时间比血液、骨髓、痰液时间更短[15。由此可见,皮疹在诊断T.marneffei感染方面有阳性率高、用时短的特点。病变组织是病原菌集中的地方,相比血液更容易检测到病原菌,适合用于早期分子诊断,为临床诊断提供强有力的证据。本研究成功运用qPCR检测到皮损切片中的T.marneffei载量,但是制作病理切片耗时长,工序复杂,不能满足临床快速诊断的迫切需求。继而本研究收集1例TSM患者淋巴结,直接提取组织DNA,qPCR检测呈阳性,T.marneffei载量高达4.68×105copies。结合国内外研究,qPCR直接测定活检组织中的菌载量可作为快速诊断TSM的重要方法。课题组将进一步对患者皮肤、淋巴、肺等活检组织进行研究,为临床诊断TSM提供更多、更可靠的证据,为早期治疗TSM争取时间。
[1] Deng Z,Ribas JL,Gibson DW. Infections caused byPenicilliummarneffeiin China and Southeast Asia:review of eighteen published cases and report of four more Chinese cases[J]. Rev Infect Dis,1988,10:640-652.
[2] 叶枫,罗群,周滢,等. 非HIV感染的马尔尼菲青霉病2例报到并文献复习[J]. 中国真菌学杂志,2013,12,8(6):342-347.
[3] 庄晓晟,梁伶,黄绍标,等. 广西壮族自治区马尔尼菲青霉病 93 例临床分析[J]. 临床皮肤科杂志,2009,38(2):342-346.
[4] Kawila R,Chaiwarith R,Supparatpinyo K. Clinical and laboratory characteristics of penicilliosis marneffei among patients with and without HIV infection in Northern Thailand:a retrospective study[J]. BMC Infect Dis,2013,5(13):464.
[5] Chan JF,Lau SK,Yue KY,et al.Talaromyces(Penicillium)marneffeiinfection in non-HIV-infected patients[J]. Emerg Microbes Infect,2016,5:e19.
[6] 莫冬冬. 实时荧光定量PCR诊断马尔尼菲青霉病方法的建立以及其初步评价[D]. 南宁:广西医科大学,2014.
[7] Yanyin OY,Shuangqi C,Cunwei C,et al. Administration of voriconazole in disseminatedTalaromyces(Penicillium)marneffeiinfection:a retrospective study[J]. Mycopathologia,2017,182(5-6):569-575.
[8] 邓卓霖,马韵. 酷似组织胞浆菌病的马尔尼菲青霉病[J]. 中华病理学杂志,1999,28(5):348-349.
[9] 朱伦,何燕,余波,等. 肠道荚膜组织胞浆菌病2例临床病理观察[J].诊断病理学杂志,2013,20(9):549-552.
[10] 陈阳霞,席丽艳. 马尔尼菲青霉病诊断研究进展[J]. 实用皮肤病学杂志,2014,7(1):31-33.
[11] 严汝帆,李鑫垒,曹存巍,等. 血清半乳甘露聚糖试验在诊断马尔尼菲青霉病中的应用[J]. 中国真菌学杂志,2016,2,11(1):16-19.
[12] 刘小荣,张笠,王勇平. 实时荧光定量 PCR 技术的理论研究及其医学应用[J]. 中国组织工程研究与临床康复,2010,14(2):329-332.
[13] Tsunemi Y,Takahashi T,Tamaki T.Penicilliummarneffeiinfection diagnosed by polymerase chain reaction from the skin specimen[J]. J Am Acad Dermatol,2003, 49(2):344-346.
[14] Hanxiang Z,Xiqing L,Liyan X,et al. Identification ofPenicilliummarneffeiin paraffin-embedded tissue using nested PCR[J]. Mycopathologia,2009,168:31-35.
[15] 张建全,杨美玲,钟小宁,等. 人免疫缺陷病毒抗体阴性与阳性者播散性马尔尼菲青霉菌病的临床及实验室特征[J]. 中华结核和呼吸杂志,2008,31(10):740-746.
