白念珠菌酵母相与菌丝相对5种抗真菌药物的敏感性比较
2018-05-16厉荣玉陈京欧成举
厉荣玉 陈京 欧成举
(皖南医学院1.微生物学与免疫学教研室;2.附属弋矶山医院检验科,芜湖 241002)
白念珠菌是最常见的条件致病性真菌,该菌有酵母相和菌丝相两种细胞形态,酵母相几乎没有致病性,而菌丝相的形成在对宿主的黏附和致病过程中起重要作用[1]。随着真菌病治疗学研究的发展,白念珠菌的耐药问题已成为研究的热点[2-3],但以往研究主要针对的是酵母相,若以菌丝相为研究对象,能更确切反映其在体内真实情况。因此,为明确这两相细胞对抗真菌药物的敏感性的差异,指导临床合理使用抗真菌药物治疗白念珠菌引起的感染,本研究对近期临床所分离的220株白念珠菌的酵母相和菌丝相两相细胞对5种常用的抗真菌药物的敏感性作一比较,报告如下。
1 材料与方法
1.1 材料
受试菌株来自于皖南医学院附属第一医院和第二医院住院感染患者的痰液、咽拭子、尿液等标本,其中同一患者同样标本多次分离出相同白念珠菌者,按1株计算。受试菌株共220株。抗真菌药物两性霉素B (AmB)、氟康唑 (FCA)、伊曲康唑 (ITR)、伏立康唑 (VRC)、5-氟胞嘧啶 (5-FC)均来自微量稀释法药敏试剂盒ATB FUNGUS 3,购于法国-生物梅里埃公司。
白念珠菌酵母相采用氯霉素沙堡弱培养基,购于郑州博赛生物工程公司;菌丝相采用含10%小牛血清的RPMI 1640培养基,购于江苏凯基生物技术有限公司;法国科玛嘉念珠菌显色培养基 (CHROM agarCandida)购于博赛生物工程公司;自动微生物鉴定系统VITEK-32、酵母样真菌鉴定卡 (YBC)、微量稀释法药敏试剂盒ATB FUNGUS 3均为法国-生物梅里埃公司产品;质控菌株近平滑念珠ATCC22019、克柔念珠菌ATCC6258购于中国药品生物制品检定所。
1.2 方法
菌株分离鉴定 将各种临床标本先接种于氯霉素沙堡弱培养基,35℃孵育,培养阳性者,菌落经革兰染色确认为酵母样菌后,转种至科玛嘉显色培养基进行初步鉴定,再用VITEK-32的酵母样真菌鉴定卡 (YBC)进行鉴定。
菌丝相的诱导 白念珠菌菌丝相的诱导参照文献进行[4]。将220株白念珠菌分别接种于5 mL含10%小牛血清的RPMI 1640 (pH7.5)培养液中,置于恒温震荡培养箱,36℃传代培养7 d。其中第1~2天每8 h转种1次,第3~5天每12 h转种1次,第6~7天每24 h转种1次,共转种12次。
药敏试验 采用ATB FUNGUS 3试剂盒,严格按照操作按说明进行。挑取单个菌落 (≥1 mm)用无菌生理盐水调整比浊至2麦氏单位,用微量加样器取20 μL菌液加入ATB培养基,用自动加样器混匀后依次加入ATB药敏板,每孔135 μL,盖上塑料盖,35℃孵育24 h上机测定。结果参照美国临床实验室标准化委员会 (NCCLS)抗真菌药敏试验标准,判定敏感 (S)、中介 (I)、耐药 (S)3种结果。FCZ MIC≤8 μg/mL为敏感,16~32 μg/mL为中介,≥64 μg/mL为耐药;ITR MIC≤0.125 μg/mL为敏感,0.25~0.5 μg/mL为中介,≥1.0 μg/mL为耐药;VRC MIC≤1 μg/mL为敏感,MIC=2 μg/mL为中介,≥4 μg/mL为耐药;5-FC MIC≤4 μg/mL为敏感,8~16 μg/mL中介,≥32 μg/mL为耐药。AMB尚未定义,根据说明书,MIC≤1 μg/mL为敏感,≥2 μg/mL为耐药。
统计学分析 利用SAS 8.1统计软件,采用t检验进行差异显著性分析。
2 结 果
2.1 白念珠菌菌丝相培养结果
白念珠菌在含10%小牛血清的RPMI 1640培养液中连续传代7 d后,其菌丝相形成率达99%以上,见图1~2。
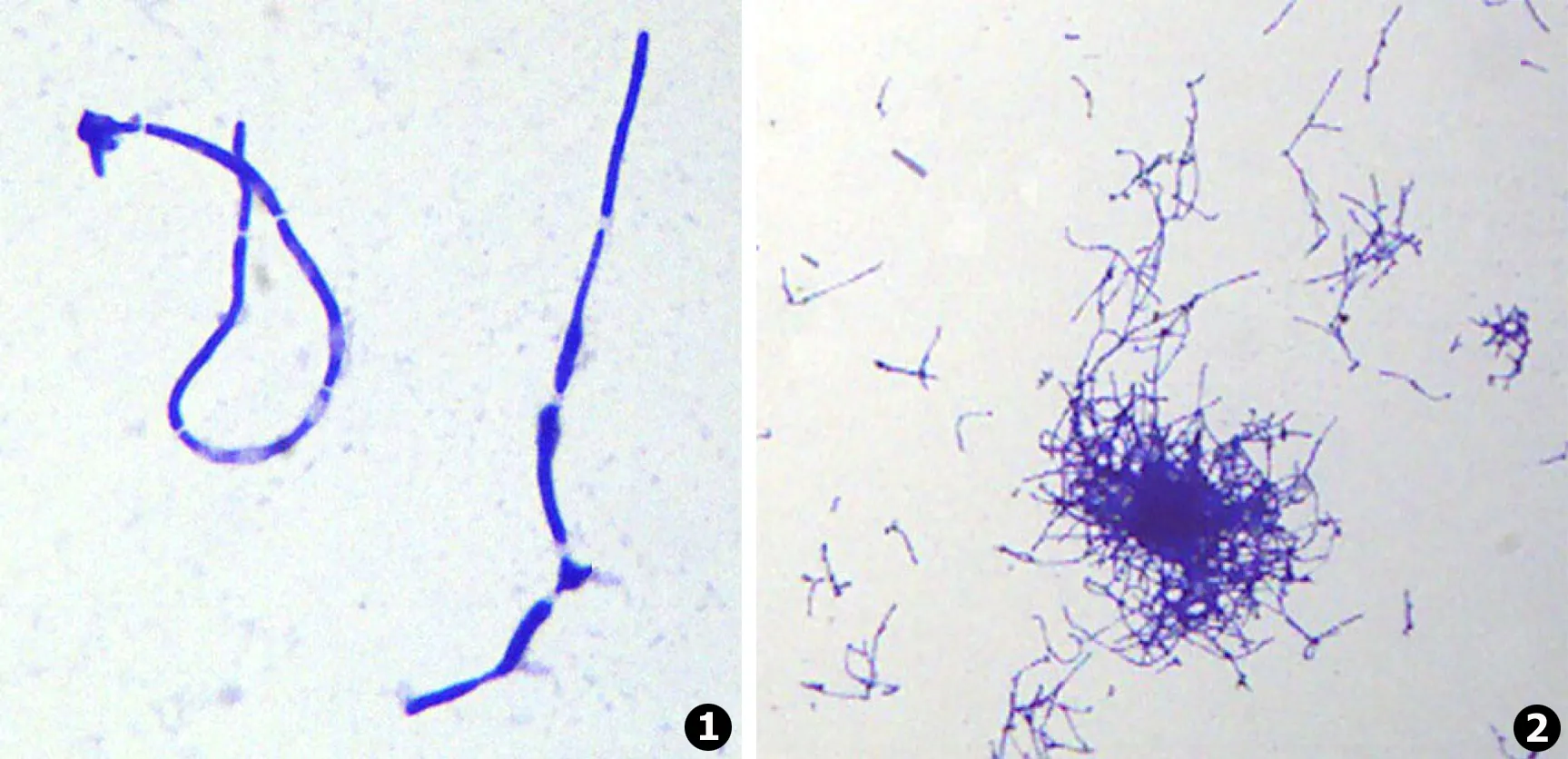
图1白念珠菌菌丝相细胞 (革兰染色,×1 000)图2白念珠菌菌丝相细胞 (革兰染色,×400)
Fig.1Candidaalbicanscells of hyphal form (Graman staining,×1 000)Fig.2Candidaalbicanscells of hyphal form (Graman staining,×400)
2.2 药敏结果
220株白念珠菌酵母相与菌丝相对5种抗真菌药物的敏感率及MIC值 220株受试菌株对两性霉素B和5-氟胞嘧啶较为敏感,酵母相和菌丝相对两性霉素B敏感率分别为97.27%、97.73%,耐药率分别为2.73%、2.27%;对5-氟胞嘧啶敏感率分别为96.82%、97.27%,耐药率均为2.27%。3种唑类药物中,对氟康唑的敏感率最低,敏感率分别为81.82%、85%,耐药率分别为14.54%、11.36%;其次是伊曲康唑,对伊曲康唑的敏感率分别为87.27%、90.46%,耐药率分别为9.09%、6.36%;对伏立康唑的敏感率最高,分别为92.72%、95%,耐药率分别为3.64%、2.27%。
5种抗真菌药物中,氟康唑、伊曲康唑和伏立康唑对白念珠菌酵母相MIC值显著高于菌丝相 (P<0.05),而两性霉素对白念珠菌酵母相和菌丝相MIC值差异不显著 (P>0.05)。
220株白念珠菌酵母相与菌丝相对5种抗真菌药物的敏感率及MIC值见表1。

表1 220株白念珠菌酵母相与菌丝相对5种抗真菌药物的敏感率及MIC值
注:*.α=0.05水平上差异显著
白念珠菌酵母相与菌丝相敏感性的差异 220株白念珠菌两相细胞对5种抗真菌药物的敏感度总体一致性为85.46% (188/220),220株受试菌株中共有32株白念珠菌酵母相与菌丝相对5种抗真菌药物表现出不同的敏感性。
两性霉素B有1株酵母相为耐药株,但菌丝相却为敏感株。氟康唑有4株酵母相为耐药株,但菌丝相却为中介株;有3株酵母相为耐药株,但菌丝相却为敏感株;有4株酵母相为中介株,但菌丝相却为敏感株。伊曲康唑有4株酵母相为耐药株,但菌丝相却为中介株;有2株酵母相为耐药株,但菌丝相却为敏感株;有5株酵母相为中介株,但菌丝相却为敏感株。伏立康唑有3株酵母相为耐药株,但菌丝相却为中介株;有5株酵母相为中介株,但菌丝相却为敏感株。5-氟胞嘧啶有1株酵母相为中介株,但菌丝相却为敏感株。白念珠菌酵母相与菌丝相敏感性的差异见表2。
3 讨 论
本研究中报道的受试菌株无论是酵母相还是菌丝相的敏感率与国内其他学者的报道均有一定差异[5-7],敏感率多低于以往报道,这可能与菌株的来源及各医院抗真菌药物的使用和地区等不同原因有关。
关于白念珠菌酵母相与菌丝相药物敏感性差异的比较,有些学者认为白念珠菌酵母相与菌丝相对抗真菌药物的敏感性不同,某些抗真菌药物对菌丝相的抗菌活性强于酵母相[8-10]。本研究中表1显示,220株受试白念珠菌菌丝相对5种抗真菌药物的敏感率均要高于酵母相,其中酵母相与菌丝相对氟康唑、伊曲康唑和伏立康唑的敏感性存在显著差异 (P<0.05),而对两性霉素差异不显著 (P>0.05)。这表明白念珠菌细胞形态对这3种药物的敏感性具有重要的影响,即氟康唑、伊曲康唑和伏立康唑对白念珠菌菌丝相的作用大干对酵母相。表2显示,同一菌株在酵母相和菌丝相两种不同的形态下对同一种药物的敏感性可能有差异,有些菌株酵母相处于耐药或中介水平,但菌丝相却是中介或敏感,说明酵母相和菌丝相的相位改变会影响其敏感性。以上研究结果表明菌丝相较酵母相对抗真菌药物更加敏感,抗真菌药物对菌丝相作用更强大,这与有关文献报道一致[8-10]。
表232株白念珠菌酵母相与菌丝相对5种抗真菌药物敏感性差异的比较
Tab.2The susceptibilities difference of yeast-form and hyphal-form of 32Candidastrains to 5 antifungal agents
抗真菌药物敏感性差异(酵母相→菌丝相)R→I(株数)R→S(株数)I→S(株数)合计(株数)两性霉素B11氟康唑43411伊曲康唑42511伏立康唑3585⁃氟胞嘧啶11合计1161532
白念珠菌酵母相与菌丝相两相细胞对抗菌药物的敏感性差异产生的原因,可能是由于形成酵母相与菌丝相的结构成分不同,因此对抗菌药物的敏感性也不同。唑类药物的作用机制是通过竞争性抑制真菌羊毛甾醇14α-脱甲基酶,干扰细胞膜麦角固醇的合成,造成固醇前体的积累和麦角固醇的耗尽,导致质膜结构和功能的改变,抑制真菌细胞的生长;两性霉素B是多烯类抗真菌药物,主要作用于真菌细胞膜上的麦角固醇,使麦角固醇不能合成,并产生小孔,细胞因电解质和基质外泄而死亡[11]。白念珠菌酵母相与菌丝相细胞形态不同,两相细胞对麦角固醇的需求量也不同。由此推测,唑类药物及两性霉素B对白念珠菌酵母相与菌丝相抗菌活性的差异,可能是由于酵母相与菌丝相对麦角固醇需求量不同所造成。5-氟胞嘧啶为抑菌剂,属于嘧啶类抗真菌药物,它进入敏感真菌后,在细胞内胞嘧啶脱氨基酶和尿嘧啶磷酸核糖基转移酶作用下转化为5-氟鸟苷酸,干扰或抑制真菌蛋白质或氨基酸的合成,发挥抑菌作用[11]。由此推测,5-氟胞嘧啶对白念珠菌酵母相与菌丝相抗菌活性的差异,可能是由于两相细胞中胞嘧啶脱氨基酶和尿嘧啶磷酸核糖基转移酶含量不同所造成。
综上所述,白念珠菌酵母相与菌丝相对抗菌药物的敏感性存在差异。由于菌丝相是白念珠菌对人体的主要致病形式,因此,在体外对白念珠菌进行病原真菌学研究时,选用其菌丝相更有意义,更能反映体内真实情况。
[1] 朱丹婷, 李景, 俞立英. 白念珠菌致病性研究进展[J]. 中国真菌学杂志, 2015, 10(1): 54-58.
[2] 颜钰, 曹颖瑛, 姜远英. 白念珠菌耐药机制新进展[J]. 中国真菌学杂志, 2013, 8(5): 311-315.
[3] 刘雅, 肖玉玲, 康梅, 等. 侵袭性白念珠菌感染的危险因素及耐药性变迁[J]. 中国抗生素杂志, 2014, 39(10): 780-784.
[4] 厉荣玉, 钱森和, 董群, 等. 白念珠菌菌丝相培养条件及RAPD反应体系优化的研究[J]. 医学分子生物学杂志, 2012, 9(1): 21-26.
[5] 陈芝芳, 王冬. 白念珠菌对五种抗真菌药物敏感性分析[J]. 临床医学, 2011, 31(5): 83-85.
[6] 胡志东, 岳娜, 徐海茹, 钟述猷. 临床标本中分离的白念珠菌对氟康唑的敏感性分析[J]. 中华检验医学杂志, 2004, 27(10):676.
[7] 孙长贵, 王奇军, 张丽君,等. 临床常见念珠菌对四种抗真菌药物体外敏感性研究[J]. 中华检验医学杂志, 2005, 28 (6): 654-655.
[8] 王恩华, 刘朝晖. 不同pH值环境唑类药物对假丝酵母菌双相性药物敏感性研究[J]. 中国实用妇科与产科杂志, 2014, 30(3): 209-213.
[9] 张宏, 石婧, 乔建军. 氟康唑对白念珠菌菌丝相与酵母相体外药物敏感性差异比较[J]. 中国麻风皮肤病杂志, 2006, 22(1): 26-27.
[10] 刘魏, 张旭, 刘朝晖, 等. 时间、二相性、pH环境对白色假丝酵母菌药物敏感性的影响[J]. 现代妇产科进展, 2011,20 (1): 30-34.
[11] 曾昭瑛, 苏建荣. 抗念珠菌药物的耐药特性分析[J]. 首都医科大学学报, 2012, 33(2): 170-176.
