COX- 2和survivin蛋白在非小细胞肺癌中的表达情况及临床意义
2018-05-16王铁延陈修文汤显斌姚莉邱力
王铁延,陈修文#,汤显斌,姚莉,邱力
十堰市太和医院(湖北医药学院附属医院)1病理科,2肿瘤科,湖北 十堰4420000
非小细胞肺癌具有较高的发病率和病死率,早期诊断困难,生长分裂较快,扩散转移相对较晚,患者的5年生存率较低[1-2]。环氧化酶-2(cyclooxygenase-2,COX-2)能够催化花生四烯酸生成前列腺素E2、血栓素A2等多种前列腺素产物[3],在促进肿瘤细胞增殖、抑制肿瘤细胞凋亡以及免疫功能抑制等方面具有重要作用;凋亡抑制蛋白(survivin)在抑制细胞凋亡方面具有重要作用[4]。然而不同病理条件下非小细胞肺癌组织中COX-2和survivin的表达情况及其对患者生存时间的影响仍缺少充足数据。本研究探讨了非小细胞肺癌组织及癌旁组织中COX-2和survivin的表达情况,并分析其与非小细胞肺癌患者临床特征的关系及对生存时间的影响,以期对非小细胞肺癌的早期诊断、临床治疗及发病机制的研究提供帮助,现报道如下。
1 对象与方法
1.1 研究对象
选择2011年1月至2012年1月十堰市太和医院收治的85例非小细胞肺癌患者。纳入标准:①经影像学及组织病理学检查确诊为非小细胞肺癌;②能够积极配合本研究;③符合本研究检测要求。排除标准:①合并免疫系统疾病、心脏疾病、肝肾功能异常、肺结核、内分泌疾病的患者;②不能进行手术的患者;③近期服用对本研究产生影响的化疗药物或接受放疗的患者;④资料不全的患者。85例患者中,男63例,女22例;≥60岁50例,<60岁35例;肿瘤直径<4 cm 41例,≥4 cm 44例;TNM分期:Ⅰ~Ⅱ期40例,Ⅲ~Ⅳ期45例;中高分化39例,低分化46例;有淋巴结转移43例,无淋巴结转移42例;吸烟44例,不吸烟41例。本研究经本院伦理委员会审批通过,所有患者均对本研究知情并签署知情同意书。
1.2 免疫组织化学染色
收集患者的肿瘤组织和癌旁组织(癌旁组织距肿瘤边缘≤2 cm),并进行免疫组织化学染色。肿瘤组织和癌旁组织依次进行甲醛固定、乙醇脱水、透明、石蜡包埋以及石蜡切片,然后进行脱蜡和3%H2O2过氧化物酶灭活,接着微波加热进行抗原修复,滴加一抗(COX-2鼠单克隆抗体,金斯瑞生物科技有限公司,1∶150稀释;survivin鼠单克隆抗体,北京博奥森生物技术有限公司,1∶150稀释)后,4℃孵育过夜,磷酸盐缓冲液(PBS)冲洗。然后进行二抗孵育(羊抗鼠IgG,杭州华安生物技术有限公司,1∶100稀释),随后进行显色和苏木精复染细胞核,最后进行封片。随机选取5个染色区,通过Image-pro-plus软件进行阳性细胞比例和平均光密度检测:阳性细胞比例≤25%或细胞未见着色即为(-);阳性细胞比例在26%~50%即为(+);阳性细胞比例在51%~75%即为(++);阳性细胞比例>75%即为(+++)。(-)和(+)为阴性,(++)和(+++)为阳性。
1.3 随访方法
采用信件随访、电话随访和病历跟踪方式对85例非小细胞肺癌患者进行随访,记录患者转移、复发和死亡的时间。随访截止时间为2017年4月,随访时间为60个月,总生存时间为术后当天到末次随访或患者死亡时间。
1.4 统计学方法
采用SPSS 19.0软件对数据进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以率(%)表示,组间比较采用χ2检验;采用Kaplan-Meier法绘制生存曲线,生存率的比较采用Log-rank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 非小细胞肺癌组织和癌旁组织中COX- 2和survivin的表达情况
免疫组织化学染色结果显示:非小细胞肺癌组织中COX-2的平均光密度为(167.51±12.39),高于癌旁组织的(36.42±4.17),差异有统计学意义(P<0.05);非小细胞肺癌组织中survivin的平均光密度为(77.28±8.45),高于癌旁组织的(17.61±3.34),差异有统计学意义(P<0.05)。(图1)
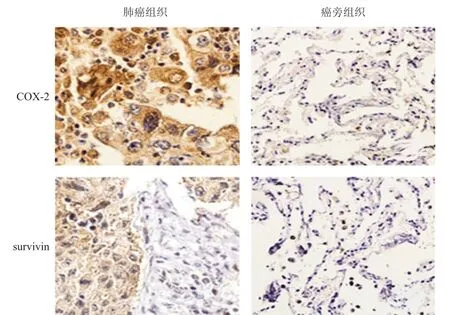
图1 COX- 2和survivin在非小细胞肺癌组织和癌旁组织中的表达情况(免疫组织化学染色,×100)
2.2 COX- 2和survivin的表达情况与非小细胞肺癌患者临床特征的关系
免疫组织化学染色结果显示:COX-2的阳性表达率为64.71%(55/85),survivin的阳性表达率为58.82%(50/85);COX-2和survivin的阳性表达率在不同年龄和性别的非小细胞肺癌患者中比较,差异均无统计学意义(P>0.05);肿瘤直径≥4 cm、低分化、Ⅲ~Ⅳ期、有淋巴结转移和有吸烟史患者的COX-2和survivin阳性表达率明显高于肿瘤直径<4 cm、中高分化、Ⅰ~Ⅱ期、无淋巴结转移和无吸烟史的患者,差异均有统计学意义(P<0.01)。(表1)
2.3 生存曲线的比较
COX-2阳性组非小细胞肺癌患者的中位生存期为28个月(95%CI:23~32),明显短于COX-2阴性组的50个月(95%CI:41~60),差异有统计学意义(χ2=15.033,P<0.01)。survivin阳性组非小细胞肺癌患者的中位生存期为26个月(95%CI:21~30),明显短于survivin阴性组的50个月(95%CI:42~58),差异有统计学意义(χ2=15.196,P<0.01)。(图2、图3)
3 讨论
非小细胞肺癌是肺癌的一种常见类型,占肺癌的70%~80%。近年来,非小细胞肺癌的发病率不断升高,同时具有较高的病死率[5-6]。非小细胞肺癌患者的早期症状不典型,确诊时40%为不可切除的晚期病变[7],严重威胁着患者的生命健康,并增加了治疗难度。非小细胞肺癌的发病机制目前尚未完全阐明,相关研究指出,非小细胞肺癌的形成与原癌基因的活化、抑癌基因的失活以及细胞凋亡的抑制密切相关[8-10]。COX-2和survivin在多种肿瘤组织中高表达,与细胞增殖、侵袭、转移及凋亡抑制密切相关[11-12]。因此,了解COX-2和survivin的表达情况与非小细胞肺癌患者临床特征的关系对疾病诊断、机制探究、临床治疗、预后判断具有重要意义。
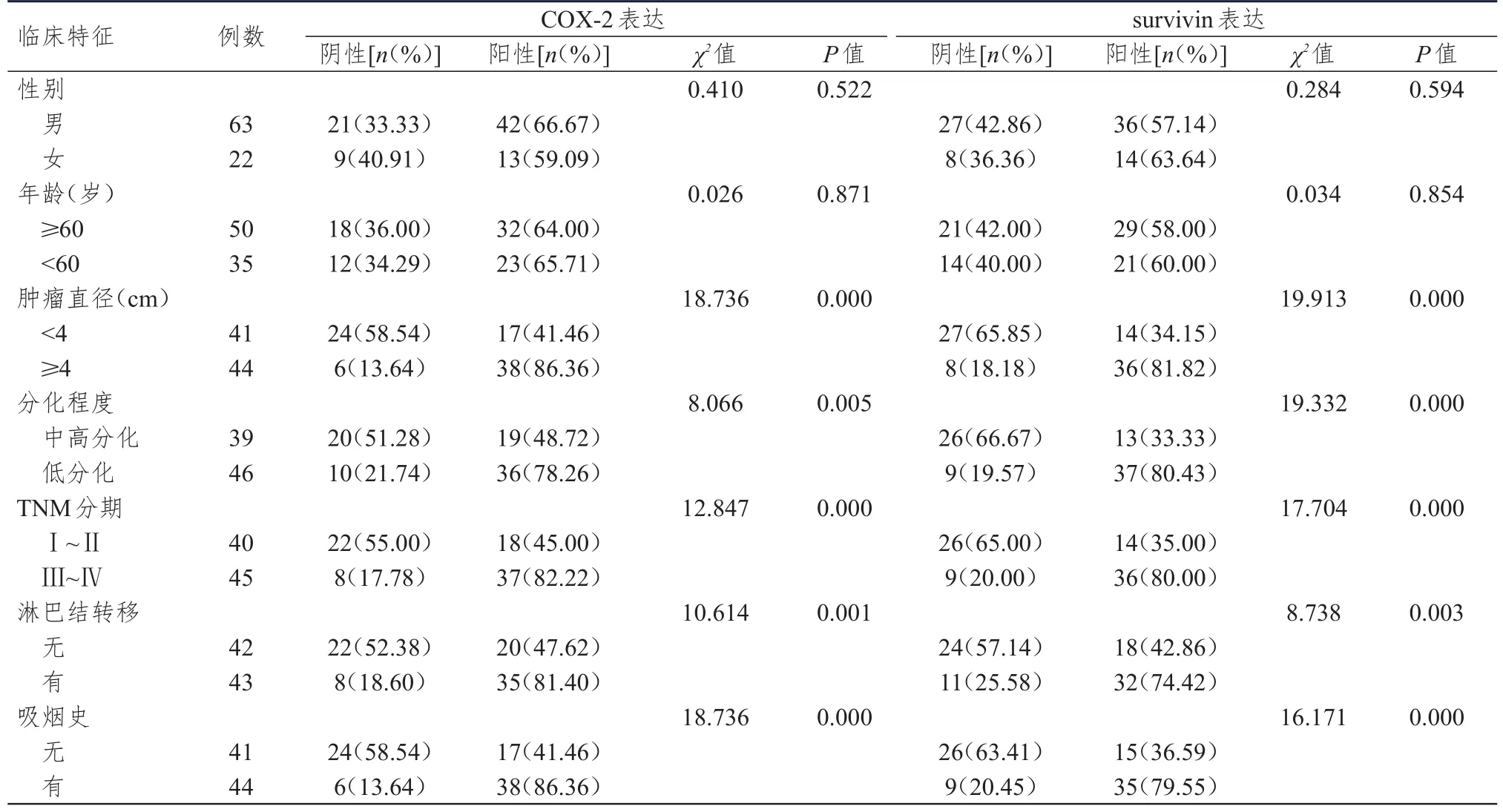
表1 COX- 2和survivin的表达情况与非小细胞肺癌患者临床特征的关系
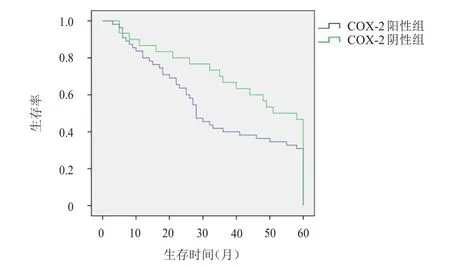
图2 COX- 2阴性组和阳性组非小细胞肺癌患者的生存曲线
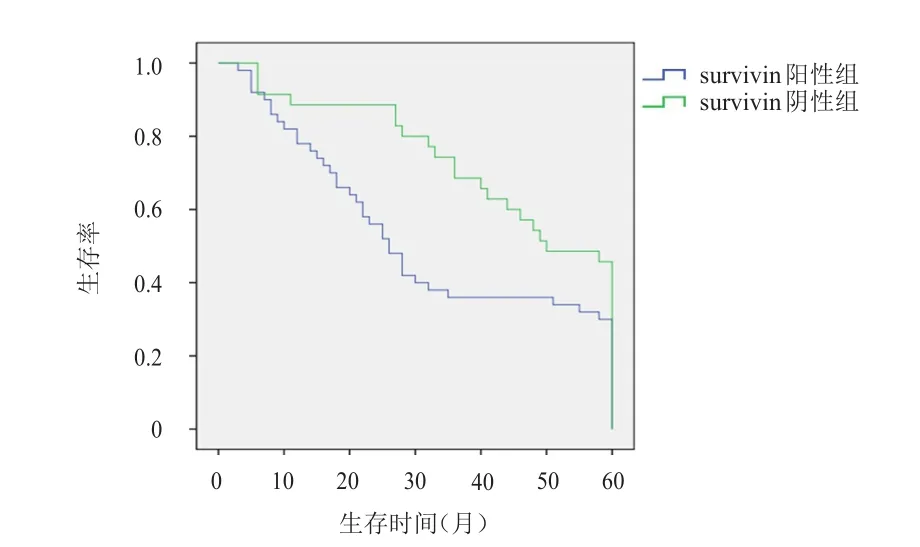
图3 survivin阴性组和阳性组非小细胞肺癌患者的生存曲线
本研究利用免疫组织化学染色技术检测非小细胞肺癌组织和癌旁组织中COX-2和survivin蛋白的表达水平,结果发现,COX-2和survivin在非小细胞肺癌组织中的表达水平较高,而在癌旁组织中的表达水平较低;COX-2和survivin的表达情况与肿瘤直径、临床分期、分化程度、吸烟和淋巴结转移情况有关(P<0.05),而与患者的年龄和性别无关(P>0.05);COX-2和survivin阳性表达患者的中位生存期明显短于阴性表达的患者(P<0.01)。COX是前列腺素合成中的重要限速酶,能够催化花生四烯酸生成前列腺素E2、血栓素A2等多种前列腺素产物[13]。COX具有两种异构体COX-1和COX-2,COX-2在正常组织中的表达水平较低,当细胞受到多种刺激后,COX-2的表达水平升高[14]。COX-2在诱导肿瘤血管生成中发挥重要作用,能够促进前列腺素E2生成,从而诱导血管内皮生长因子的表达水平升高,导致肿瘤组织中的血管密度增加,为肿瘤的发展提供充足营养[15]。研究报道,COX-2高表达能够促使HER2/Neu酪氨酸激酶受体激活,并通过EP-1/SRC/HER2/NEU途径提高肿瘤细胞中血管内皮细胞生长因子C的表达水平,从而促进肿瘤淋巴管生长和淋巴结转移[16]。吸烟、环境污染等刺激可导致机体COX-2的表达水平升高,有学者指出,COX-2及其产物前列腺素E2共同作用诱导Bcl-2表达,Bcl-2能够通过多种途径抑制肿瘤细胞凋亡,从而促进肿瘤的发生和发展[17]。COX-2能够抑制巨噬细胞活化及中性粒细胞浸润,从而有利于肿瘤细胞免疫逃逸,同时前列腺素E2能够抑制T淋巴细胞、B淋巴细胞及NK细胞的毒性作用,并抑制白细胞介素-10的生成,从而发挥抑制免疫功能的作用[18]。COX-2能够影响E-钙黏蛋白的活性,从而有利于细胞侵袭和转移[19]。survivin是凋亡抑制蛋白家族成员,具有肿瘤特异性,本研究发现其在非小细胞肺癌组织中高表达。survivin能够直接抑制凋亡终末效应酶Caspase-7及Caspase-3的活性,从而阻断各种刺激诱导的肿瘤细胞凋亡[20-21];同时survivin能够与周期蛋白激酶CDK2和CDK4相互作用,进一步阻断凋亡信号传导通路[22]。因此,COX-2和survivin表达水平的升高会促进肿瘤发展,增加治疗困难,缩短患者的生存时间。
综上所述,COX-2和survivin蛋白在非小细胞肺癌组织中高表达,可能参与了非小细胞肺癌的发生和发展,其表达情况与肿瘤直径、临床分期、分化程度、吸烟和转移情况有关,而与患者的年龄和性别无关,COX-2和survivin高表达患者的预后较差。
[1]Reck M,Rodríguez-Abreu D,Robinson AG,et al.Pembrolizumab versus chemotherapy for PD-L1-positive nonsmall-cell lung cancer[J].N Engl J Med,2016,375(19):1823-1833.
[2]Davidson SM,Papagiannakopoulos T,Olenchock BA,et al.Environment impacts the metabolic dependencies of Rasdriven non-small cell lung cancer[J].Cell Metab,2016,23(3):517-528.
[3]Giaginis C,Alexandrou P,Tsoukalas N,et al.Hu-antigen receptor(HuR)and cyclooxygenase-2(COX-2)expression in human non-small-cell lung carcinoma:associations with clinicopathological parameters,tumor proliferative capacity and patients'survival[J].Tumor Biol,2015,36(1):315-327.
[4]Singh N,Krishnakumar S,Kanwar RK,et al.Clinical aspects for survivin:a crucial molecule for targeting drug-resistant cancers[J].Drug Discov Today,2015,20(5):578-586.
[5]Barlesi F,Mazieres J,Merlio JP,et al.Routine molecular profiling of patients with advanced non-small-cell lung cancer:results of a 1-year nationwide programme of the French Cooperative Thoracic Intergroup(IFCT)[J].Lancet,2016,387(10026):1415-1426.
[6]Yan H,Li H,Li Q,et al.The efficacy of synchronous combination of chemotherapy and EGFR TKIs for the first-line treatment of NSCLC:a systematic analysis[J].PLoS One,2015,10(8):e0135829.
[7]Checinska A.Role of XIAP in inhibiting cisplatin-induced caspase activation in non-small cell lung cancer cells:a small molecule Smac mimic sensitizes for chemotherapy-induced apoptosis by enhancing caspase-3 activation[J].Exp Cell Res,2016,313(6):1215-1224.
[8]Zhang E,Li W,Yin D,et al.c-Myc-regulated long non-coding RNA H19 indicates a poor prognosis and affects cell proliferation in non-small-cell lung cancer[J].Tumor Biol,2016,37(3):4007-4015.
[9]Schuler M,Yang JC,Park K,et al.Afatinib beyond progression in patients with non-small-cell lung cancer following chemotherapy,erlotinib/gefitinib and afatinib:phase III randomized LUX-Lung 5 trial[J].Ann Oncol,2016,27(3):417-423.
[10]Dai C,Ren Y,Xie D,et al.Does lymph node metastasis have a negative prognostic impact in patients with NSCLC and M1a disease?[J].J Thorac Oncol,2016,11(10):1745-1754.
[11]Hsu CK,Lee IT,Lin CC,et al.Sphingosine-1-phosphate mediates COX-2 expression and PGE2/IL-6 secretion via c-Src-dependent AP-1 activation[J].J Cell Physiol,2015,230(3):702-715.
[12]Chen W,Zhong X,Wei Y,et al.TGF-β regulates survivin to affect cell cycle and the expression of EGFR and MMP9 in glioblastoma[J].Mol Neurobiol,2016,53(3):1648-1653.
[13]Mattsson JS,Bergman B,Grinberg M,et al.Prognostic impact of COX-2 in non-small cell lung cancer:a comprehensive compartment-specific evaluation of tumor and stromal cell expression[J].Cancer Lett,2015,356(2 Pt B):837-845.
[14]Meijerink J,Poland M,Balvers MGJ,et al.Inhibition of COX-2-mediated eicosanoid production plays a major role in the anti-inflammatory effects of the endocannabinoid N-docosahexaenoylethanolamine(DHEA)in macrophages[J].Br J Pharmacol,2015,172(1):24-37.
[15]Wang L,Wang Z,Li J,et al.NFATc1 activation promotes the invasion of U251 human glioblastoma multiforme cells through COX-2[J].Int J Mol Med,2015,35(5):1333-1340.
[16]Zhang H,Liu J,Qu D,et al.Inhibition of miR-200c restores endothelial function in diabetic mice through suppression of COX-2[J].Diabetes,2016,65(5):1196-1207.
[17]Günther M,Plantman S,Davidsson J,et al.COX-2 regulation and TUNEL-positive cell death differ between genders in the secondary inflammatory response following experimental penetrating focal brain injury in rats[J].Acta Neurochir(Wien),2015,157(4):649-659.
[18]Li F,Zhu YT.HGF-activated colonic fibroblasts mediates carcinogenesis of colonic epithelial cancer cells via PKC-cMET-ERK1/2-COX-2 signaling[J].Cell Signal,2015,27(4):860-866.
[19]Prakash G,Umar M,Ajay S,et al.COX-2 gene polymorphisms and risk of chronic periodontitis:a case-control study and meta-analysis[J].Oral Dis,2015,21(1):38-45.
[20]Cheng SM,Chang YC,Liu CY,et al.YM155 down-regulates survivin and XIAP,modulates autophagy and induces autophagy-dependent DNA damage in breast cancer cells[J].Brit J Pharmacol,2015,172(1):214-234.
[21]Tsubaki M,Takeda T,Ogawa N,et al.Overexpression of survivin via activation of ERK1/2,Akt,and NF-κB plays a central role in vincristine resistance in multiple myeloma cells[J].Leukemia Res,2015,39(4):445-452.
[22]Liao A,Shi R,Jiang Y,et al.SDF-1/CXCR4 axis regulates cell cycle progression and epithelial-mesenchymal transition via up-regulation of survivin in glioblastoma[J].Mol Neurobiol,2016,53(1):210-215.
