胃癌切除术后食管蠕动情况及胃肠激素水平变化的临床研究
2018-05-03朱莎葛昊徐妍
朱莎,葛昊,徐妍
无锡市第二人民医院肿瘤科,江苏 无锡 214000
胃癌是临床常见的恶性肿瘤之一,发病率仅次于肺癌,发病部位主要集中于胃窦部、胃小弯以及胃前后壁。手术是治疗胃癌最有效的手段,尤其对于早期胃癌预后较好,随着医疗技术水平的不断提高,胃癌手术的适应证逐渐扩大[1]。研究显示,除手术创伤外,消化功能紊乱是胃癌手术的主要并发症,对患者预后有明显影响[2]。有研究指出,胃癌术后食管动力学指标及胃肠激素水平改变可能与消化功能紊乱有关,但具体机制尚未明确[3]。本研究对24例胃癌患者和25例健康体检者的食管动力学指标及胃肠激素水平的变化情况进行分析,以期为胃癌术后并发症的机制研究和防治提供参考依据,现报道如下。
1 对象与方法
1.1 研究对象
选取2016年1月至2017年1月于无锡市第二人民医院行远端大部切除术的24例胃癌患者为研究组。纳入标准:①经影像学及病理组织学检查确诊为Ⅱ~Ⅲ期;②手术成功且完成6个月以上随访;③术后无并发症,随访期间无复发或转移。排除标准:①合并影响食管功能疾病的患者;②近期接受放化疗或使用影响胃肠功能药物的患者;③依从性较差的患者。另选取同期来本院体检的25例健康体检者为对照组。研究组中,男15例,女9例;年龄26~72岁,平均(58.96±8.68)岁;腺癌 21例,印戒细胞癌1例,其他2例;肿瘤直径为(4.61±1.48)cm;TNM分期:Ⅱ期16例,Ⅲ期8例;2例合并出血梗阻;发病部位:胃窦14例,胃体7例,贲门3例。对照组中,男15例,女10例;年龄25~70岁,平均(58.20±8.33)岁。两组研究对象的年龄、性别等一般资料比较,差异无统计学意义(P﹥0.05),具有可比性。本研究经过本院伦理委员会审批通过,所有研究对象均对本研究知情并签署知情同意书。
1.2 方法
1.2.1 食管动力学检查 检查前受检者常规禁食8 h,在充分了解检查步骤后调整心态和呼吸,使用GAP-36A型36通道HRM高分辨率消化道动力检测系统(宁波迈达医疗仪器有限公司)检测食管动力学指标。受检者取坐位,缓慢将测压导管经鼻腔插入食管,深度达胃内后开始检查。受检者每次吞咽10 ml生理盐水,每次间隔30 s,共10次,根据吞咽过程中食管体部的蠕动情况,通过HRM系统获得食管动力学指标[4]。
1.2.2 胃肠激素检测 检查前受检者禁食禁水8 h,抽取受检者清晨空腹静脉血5 ml装入含EDTA抗凝剂的离心管中,在4℃低温离心机中以3000 r/min离心5 min,获取血浆并置于-80℃低温冰箱中保存待检。分别使用人胃动素检测试剂盒、人胃促生长素检测试剂盒和人瘦素检测试剂盒,采用双抗体夹心法进行检测,检测步骤按照试剂盒说明书进行,试剂盒均购自上海西唐生物科技有限公司。
1.3 观察指标
观察研究组患者术前及术后1个月、术后3个月食管动力学指标(食管体部蠕动远端收缩积分、食管体部蠕动收缩前沿速度、食管下括约肌静息压、食管完整松弛压力)的变化情况以及术前和术后1周、术后3个月胃肠激素(胃动素、胃促生长素、瘦素)水平的变化情况,并与对照组进行比较。
1.4 统计学方法
采用SPSS 19.0软件对数据进行统计分析。计量资料以均数±标准差(±s)表示,两组间比较采用t检验,多组间比较采用随机区组设计方差分析,多组间两两比较采用q检验。计数资料以率(%)表示,组间比较采用χ2检验。以P﹤0.05为差异有统计学意义。
2 结果
2.1 食管动力学指标的比较
研究组患者术前食管下括约肌静息压低于对照组,差异有统计学意义(P﹤0.05)。研究组患者术前、术后1个月、术后3个月各食管动力学指标进行多组间方差分析,结果显示,差异均有统计学意义(P﹤0.05)。多组间进行两两比较,结果显示,研究组患者术后1个月食管下括约肌静息压低于术前及对照组,差异有统计学意义(P﹤0.05);术后3个月食管体部蠕动远端收缩积分、食管体部蠕动收缩前沿速度、食管下括约肌静息压、食管完整松弛压力均低于术后1个月、术前及对照组,差异有统计学意义(P﹤0.05)。(表1)
表1 两组研究对象食管动力学指标的比较(±s)
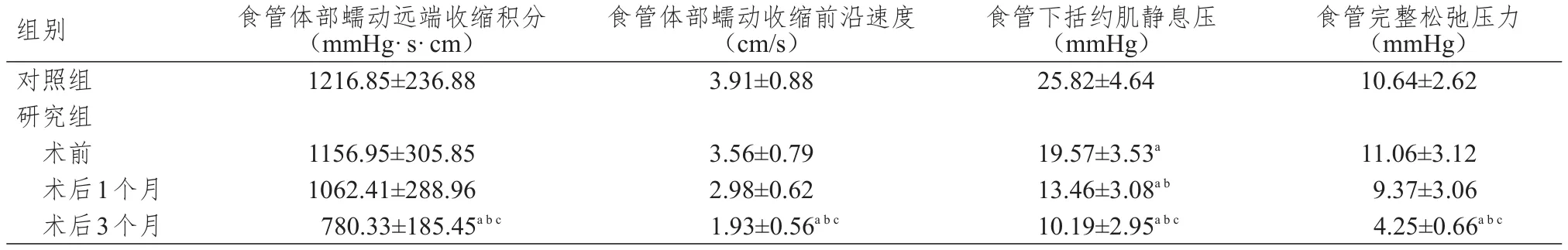
表1 两组研究对象食管动力学指标的比较(±s)
注:a与对照组比较,P<0.05;b与术前比较,P<0.05;c与术后1个月比较,P<0.05;1 mmHg=0.133 kPa
组别对照组研究组术前术后1个月术后3个月食管体部蠕动远端收缩积分(mmHg·s·cm)1216.85±236.88食管体部蠕动收缩前沿速度(cm/s)3.91±0.88食管下括约肌静息压(mmHg)25.82±4.64食管完整松弛压力(mmHg)10.64±2.62 1156.95±305.85 1062.41±288.96 780.33±185.45abc 3.56±0.79 2.98±0.62 1.93±0.56abc 19.57±3.53a 13.46±3.08ab 10.19±2.95abc 11.06±3.12 9.37±3.06 4.25±0.66abc
2.2 胃肠激素水平的比较
研究组患者术前胃动素水平高于对照组,胃促生长素水平低于对照组,差异均有统计学意义(P﹤0.05);术前瘦素水平与对照组比较,差异无统计学意义(P﹥0.05)。研究组患者术前、术后1周、术后3个月胃肠激素水平进行多组间方差分析,结果显示,差异均有统计学意义(P﹤0.05)。多组间进行两两比较,结果显示,研究组患者术后1周和术后3个月胃动素、胃促生长素、瘦素水平均低于术前及对照组,差异有统计学意义(P﹤0.05);术后3个月胃动素水平高于术后1周,胃促生长素水平低于术后1周,差异均有统计学意义(P﹤0.05);术后3个月瘦素水平与术后1周比较,差异无统计学意义(P﹥0.05)。(表2)
3 讨论
手术是治疗胃癌的主要手段,根据病灶位置及肿瘤分期不同,常用的术式为近端胃大部切除术、远端胃大部切除术以及全胃切除术。近几年,临床研究的热点逐渐由优化胃癌治疗手段以改善预后转为关注胃癌术后并发症[5]。消化功能紊乱是胃癌术后常见的并发症,采用不同手术方式的患者术后消化功能紊乱的严重程度不同[6]。有研究指出,胃癌术后消化功能紊乱的主要诱发因素为手术所致的胃肠动力学改变和胃肠激素水平变化,但确切的机制有待于进一步研究[7]。为便于检测食管动力学指标,本研究选择了胃癌远端大部切除术患者作为研究对象,分析患者术后3个月内食管动力学指标及胃肠激素水平的变化情况,以期明确胃肠动力学改变和胃肠激素水平变化对消化功能紊乱的影响。
表2 两组研究对象胃肠激素水平的比较(pg/ml,±s)
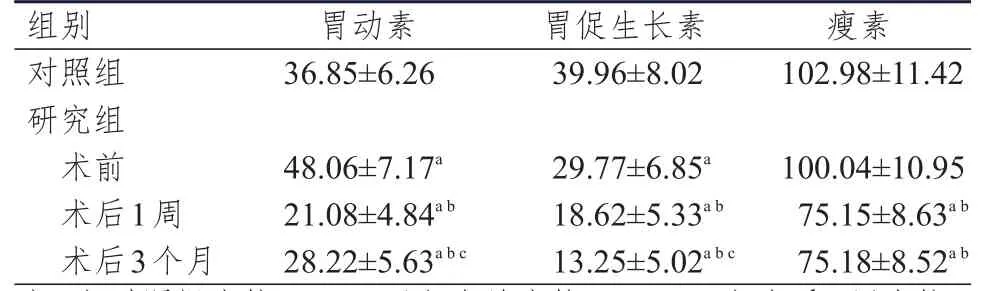
表2 两组研究对象胃肠激素水平的比较(pg/ml,±s)
注:a与对照组比较,P<0.05;b与术前比较,P<0.05;c与术后1周比较,P<0.05
组别 胃动素 胃促生长素瘦素
本研究使用食管体部蠕动远端收缩积分、食管体部蠕动收缩前沿速度、食管下括约肌静息压、食管完整松弛压力4个高分辨率食管测压指标反映食管的蠕动情况,结果显示,研究组患者术前食管下括约肌静息压低于对照组(P﹤0.05),而术前食管体部蠕动远端收缩积分、食管体部蠕动收缩前沿速度、食管完整松弛压力与对照组比较,差异无统计学意义(P﹥0.05),提示胃癌患者与健康者的食管蠕动情况无明显差异,仅存在食管下括约肌静息压下降,这可能与胃癌患者胃肠道自身代偿有关[8]。术后1个月研究组患者的食管下括约肌静息压较术前更低(P﹤0.05),食管体部蠕动远端收缩积分、食管体部蠕动收缩前沿速度、食管完整松弛压力较术前虽有下降趋势但并不明显,差异无统计学意义(P﹥0.05)。术后3个月研究组患者的食管下括约肌静息压、食管体部蠕动远端收缩积分、食管体部蠕动收缩前沿速度、食管完整松弛压力进一步降低,与术后1个月比较,差异均有统计学意义(P﹤0.05)。这主要是因为手术破坏了机体神经和激素调节系统,导致食管蠕动功能随时间延长而逐步下降[9-10]。Alexandre等[11]研究指出,胃癌次全切除术后患者的食管动力学存在蠕动减慢、清空能力下降、食管下括约肌压力下降等情况,且伴有明显的食管运动紊乱,与本研究结果相符。
在胃肠激素检测方面,本研究结果显示,研究组患者术前胃动素水平高于对照组(P﹤0.05),胃促生长素水平低于对照组(P﹤0.05),可能与胃癌发病过程中胃动力受到抑制,减少了胃促生长素分泌,同时肿瘤生长又刺激胃内分泌细胞大量分泌胃动素有关[12-13]。研究组患者术后1周和术后3个月的胃动素、胃促生长素、瘦素水平均低于术前和对照组(P﹤0.05),主要是由于:①肿瘤切除后对胃动力的抑制作用和对胃内分泌细胞的刺激作用消失;②胃部分切除后内分泌细胞大量缺失,机体无法及时代偿,胃肠激素分泌明显降低[14]。
以往的研究报道显示,胃癌患者术后胃肠激素水平对胃肠运动有影响[15]。本研究结果显示,胃癌术后因胃肠结构受到破坏,食管蠕动及胃肠激素水平均受到明显影响,通过观察术后3个月食管动力学指标和胃肠激素水平的变化情况,结果发现,两者存在一定程度的联系,但具体机制尚未明确。由于技术限制,本研究仅选取了接受胃癌远端大部切除术的患者,其余术式的影响有待今后开展进一步研究。
综上所述,胃癌切除术后患者的食管动力学指标和胃肠激素水平均有不同程度的下降,两者具有一定的关联。
[1]桑温昌,李兆德,张军,等.胃癌行全胃切除术76例临床疗效分析[J].中华普外科手术学杂志(电子版),2012,6(4):361-366.
[2]郑朝辉,陆俊,黄昌明,等.胃癌根治术后并发症及其相关因素分析[J].中国实用外科杂志,2013,33(4):317-320.
[3]Barakat O,Cagigas MN,Bozorgui S,et al.Proximal Rouxen-y gastrojejunal anastomosis with pyloric ring resection improves gastric emptying after pancreaticoduodenectomy[J].J Gastrointest Surg,2016,20(5):914-923.
[4]Nicodème F,Pipa-Muniz M,Khanna K,et al.Quantifying esophagogastric junction contractility with a novel HRM topographic metric,the EGJ-Contractile Integral:normative values and preliminary evaluation in PPI non-responders[J].Neurogastroenterol Motil,2014,26(3):353-360.
[5]Wang D,Patel A,Mello M,et al.Esophagogastric junction contractile integral(EGJ-CI)quantifies changes in EGJ barrier function with surgical intervention[J].Neurogastroenterol Motil,2016,28(5):639-646.
[6]赵现光,陈坚.胃癌患者术后胃肠激素与胃肠动力改变的关系[J].上海医药,2014,35(7):36-40.
[7]Tomita R,Sakurai K,Fujisaki S.Significance of the lower esophageal sphincter preservation in preventing alkaline reflux esophagitis in patients after total gastrectomy reconstructed by Roux-en-Y for gastric cancer[J].Int Surg,2014,99(2):174-181.
[8]Gor P,Li Y,Munigala S,et al.Interrogation of esophagogastric junction barrier function using the esophagogastric junction contractile integral:an observational cohort study[J].Dis Esophagus,2016,29(7):820-828.
[9]Tomita R,Sakurai K,Fujisaki S,et al.Manometric study in patients with or without preserved lower esophageal sphincter 2 years or more after total gastrectomy reconstructed by Roux-en-Y for gastric cancer[J].Hepatogastroenterology,2012,59(119):2339-2342.
[10]Salvador R,Savarino E,Pesenti E,et al.The impact of heller myotomy on integrated relaxation pressure in esophageal achalasia[J].J Gastrointest Surg,2016,20(1):125-131.
[11]Alexandre L,Broughton T,Loke Y,et al.Meta-analysis:risk of esophageal adenocarcinoma with medications which relax the lower esophageal sphincter[J].Dis Esophagus,2012,25(6):535-544.
[12]Chen CY,Tsai CY.Ghrelin and motilin in the gastrointestinal system[J].Curr Pharm Des,2012,18(31):4755-4765.
[13]Lin TC,Hsiao M.Ghrelin and cancer progression[J].Biochim Biophys Acta,2017,1868(1):51-57.
[14]Terawaki K,Kashiwase Y,Sawada Y,et al.Development of ghrelin resistance in a cancer cachexia rat model using human gastric cancer-derived 85As2 cells and the palliative effects of the Kampo medicine rikkunshito on the model[J].PLoS One,2017,12(3):e0173113.
[15]Nakajima K,Oiso S,Uto T,et al.Triterpenes suppress octanoylated ghrelin production in ghrelin-expressing human gastric carcinoma cells[J].Biomed Res,2016,37(6):343-349.
