原花青素对食管癌细胞增殖及糖酵解的影响及作用机制研究
2018-05-03王俊钢杨丽田君娜张洁
王俊钢,杨丽,田君娜,张洁
南阳市中心医院胸外科,河南 南阳 473009
食管癌是一种常见的食管肿瘤,约占全部食管肿瘤的90%。食管癌严重威胁着人类的生命健康,据统计世界范围内每年约有超过20万人死于食管癌[1]。癌细胞的能量代谢方式与正常细胞不同,正常细胞在有氧条件下以有氧氧化为主,只有在供氧不足时才会启动糖酵解途径供能,而癌细胞无论是在有氧条件还是在缺氧条件下均优先以糖酵解途径供能,癌细胞的这种能量代谢方式使其在缺氧条件下具有更强的耐受能力[2]。原花青素具有抗氧化、消除氧自由基、消炎、抗过敏、抗心律失常等作用,广泛存在于植物木实部以及果实的皮中[3]。有研究表明,原花青素能够抑制胃癌、胰腺癌、卵巢癌等多种癌细胞的增殖,抑制癌症的发生和发展[4-5]。为了明确原花青素对食管癌细胞增殖和糖酵解的影响,本研究采用MTT、Western blot等多种实验方法对原花青素的作用及机制进行探讨,以期为原花青素治疗食管癌提供理论依据,现报道如下。
1 材料与方法
1.1 细胞
食管癌细胞株OE33、CP-C、Eca109均购自中国科学院细胞库。
1.2 主要试剂
RPMI1640培养基购自美国Gibco公司;胎牛血清购自杭州四季青生物工程材料有限公司;噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT)、二甲基亚砜、胰蛋白酶均购自美国Sigma公司;三磷酸腺苷(adenosine triphosphate,ATP)检测试剂盒购自北京索莱宝科技有限公司;乳酸含量检测试剂盒购自武汉艾美捷科技有限公司;丙酮酸激酶(pyruvate kinase,PK)活性检测试剂盒、己糖激酶(hexokinase,HK)活性检测试剂盒均购自美国Cayman公司;二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度检测试剂盒购自碧云天生物技术研究所;Akt单克隆抗体、p-Akt单克隆抗体、信号转导与转录因子3(signal transducers and activators of transcription 3,STAT3)单克隆抗体、磷酸化的STAT3(p-STAT3)单克隆抗体均购自美国Santacruze公司;牛血清白蛋白购自上海博谷生物科技有限公司;原花青素(提取自葡萄籽中)购自西安天行健生物制品有限公司。
1.3 方法
1.3.1 细胞培养 取出保存在液氮中的人食管癌细胞株OE33、CP-C、Eca109,置于37 ℃环境下,使细胞在1 min内融化,加入RPMI1640培养基混合后,1000 r/min离心10 min,弃上清,用含有10%胎牛血清的RPMI1640细胞培养液重悬细胞,接种到细胞培养瓶中,在37℃,5%CO2培养箱中培养3 d。在显微镜下观察细胞融合度达到80%后,吸除细胞培养液,加入磷酸盐缓冲溶液(phosphate buffered saline,PBS)洗涤 2次,1000 r/min离心 10 min,弃上清液,加入0.25%的胰蛋白酶消化细胞,消化温度为37℃,观察细胞呈单个存在时,转移至离心管中1000 r/min离心10 min,弃酶蛋白酶消化液,用新鲜的细胞培养液悬浮细胞,按照实验要求按不同比例接种到细胞培养瓶中。
1.3.2 MTT法检测细胞增殖情况 取培养至对数生长期的食管癌细胞株OE33、CP-C、Eca109,胰蛋白酶消化后,离心,用细胞培养液悬浮细胞,按照每孔加入3000个细胞接种到96孔细胞培养板中。观察细胞完全贴壁后,将细胞培养液更换成含有0、60、120、180、240、300 μmol/L原花青素的细胞培养液,同时以不加入细胞的组为空白组,每个浓度梯度设置6个复孔。培养48 h后,在每孔中加入20 μl MTT溶液(5 mg/ml),在37 ℃孵育反应4 h后,吸除上清液,每孔加入150 μl的二甲基亚砜溶液,在摇床室温环境下缓慢振荡8 min,观察结晶物充分溶解后,酶标仪检测各组的光密度值(optical density,OD),计算细胞存活率,以0 μmol/L原花青素作用组为对照。细胞存活率=[(原花青素作用组OD值-空白OD值)/(对照OD值-空白OD值)]×100%。
1.3.3 ATP含量检测 用半数抑制浓度的原花青素作用于人食管癌细胞株Eca109 48 h后,弃上清液,加入胰蛋白酶消化细胞后,用生理盐水反复洗涤细胞,加入超纯水悬浮细胞,将细胞制成细胞悬浮液。用匀浆器匀浆后,转移到EP管中,于100℃的水浴锅中孵育10 min。按照ATP检测试剂盒说明书检测细胞中ATP的含量。
1.3.4 乳酸含量检测 用半数抑制浓度的原花青素作用于人食管癌细胞株Eca109 48 h后,吸取细胞培养液上清,根据乳酸含量检测试剂盒说明书检测上清液中的乳酸含量。
1.3.5 丙酮酸激酶和己糖激酶活性检测 用半数抑制浓度的原花青素作用于人食管癌细胞株Eca109 48 h后,用丙酮酸激酶活性检测试剂盒和己糖激酶活性检测试剂盒分别检测并计算细胞中丙酮酸激酶和己糖激酶的活性。
1.3.6 Western blot法检测 Akt、p-Akt、STAT3、p-STAT3水平 采用半数抑制浓度的原花青素作用于Eca109细胞株细胞48 h后,提取细胞总蛋白,采用BCA蛋白浓度检测试剂盒检测提取的蛋白浓度。取出蛋白样品与2×Loading buffer按照1∶1的比例混合均匀,于100℃煮沸5 min使蛋白变性。按照每孔加入40 μl变性蛋白样品加入到聚丙烯酰氨凝胶(8%分离胶,5%浓缩胶)电泳上样孔中。在45 mV恒流条件下电泳。取出蛋白凝胶,在4℃,25 mV恒流条件下转膜90 min。用5%牛血清白蛋白在37℃封闭60 min。800倍稀释一抗,4℃反应过夜;1000倍稀释二抗,37℃反应90 min,滴加显色液,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为 内参,分析目的蛋白表达水平,实验重复3次,取均值。
1.4 统计学分析
采用SPSS 22.0软件对数据进行统计分析。计量资料采用均数±标准差(±s)进行描述,组间比较采用t检验。以P﹤0.05为差异有统计学意义。
2 结果
2.1 细胞增殖检测结果
60、120、180、240、300 μmol/L原花青素作用后,OE33、CP-C、Eca109细胞的细胞存活率均较0 μmol/L组下降,差异有统计学意义(P﹤0.05)。随着原花青素作用浓度的升高,OE33、CP-C、Eca109细胞的细胞存活率均下降(P﹤0.05)。OE33、CP-C、Eca109细胞的原花青素半数抑制浓度分别为(285.48±3.58)μmol/L、(291.00±3.36)μmol/L、(237.95±4.91)μmol/L。原花青素对Eca109细胞的抑制作用最大,后续选用240 μmol/L原花青素作用于Eca109细胞继续研究。(表1)
表1 不同浓度原花青素作用于人食管癌细胞株后的细胞存活率(%,±s)
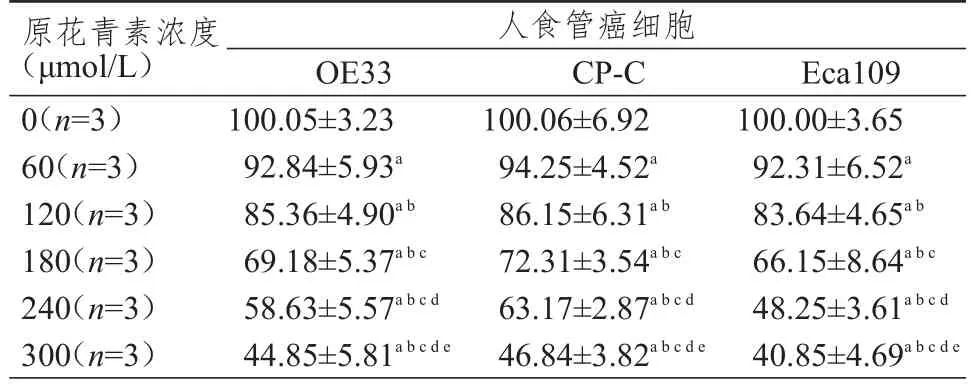
表1 不同浓度原花青素作用于人食管癌细胞株后的细胞存活率(%,±s)
注:a与0 μmol/L组比较,P<0.05;b与60 μmol/L组比较,P<0.05;c与120 μmol/L组比较,P<0.05;d与180 μmol/L组比较,P<0.05;e与240 μmol/L组比较,P<0.05
原花青素浓度(μmol/L)0(n=3)60(n=3)120(n=3)180(n=3)240(n=3)300(n=3)人食管癌细胞OE33 100.05±3.23 92.84±5.93a 85.36±4.90ab 69.18±5.37abc 58.63±5.57abcd 44.85±5.81abcde CP-C 100.06±6.92 94.25±4.52a 86.15±6.31ab 72.31±3.54abc 63.17±2.87abcd 46.84±3.82abcde Eca109 100.00±3.65 92.31±6.52a 83.64±4.65ab 66.15±8.64abc 48.25±3.61abcd 40.85±4.69abcde
2.2 ATP及乳酸含量检测结果
240 μmol/L原花青素作用后,Eca109细胞中的ATP及乳酸含量均较0 μmol/L组降低,差异有统计学意义(P﹤0.05)。(表2)
表2 不同浓度原花青素作用后Eca109细胞中ATP及乳酸含量的比较(mmol/L,±s)
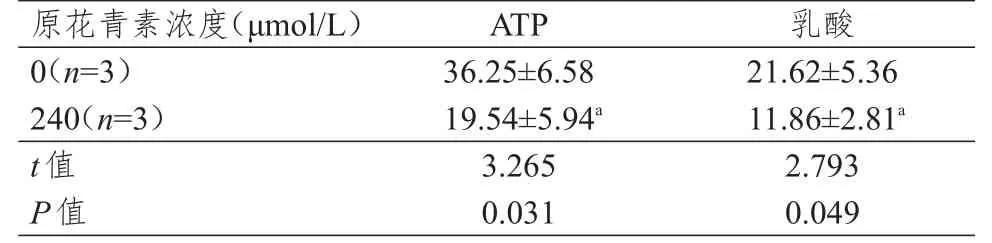
表2 不同浓度原花青素作用后Eca109细胞中ATP及乳酸含量的比较(mmol/L,±s)
注:a与0 μmol/L组比较,P<0.05
?
2.3 丙酮酸激酶及己糖激酶活性检测结果
240 μmol/L原花青素作用后,Eca109细胞的丙酮酸激酶及己糖激酶活性均较与0 μmol/L组降低,差异有统计学意义(P﹤0.05)。(表3)
表3 不同浓度原花青素作用后Eca109细胞中丙酮酸激酶及己糖激酶活性的比较(U/mg,±s)
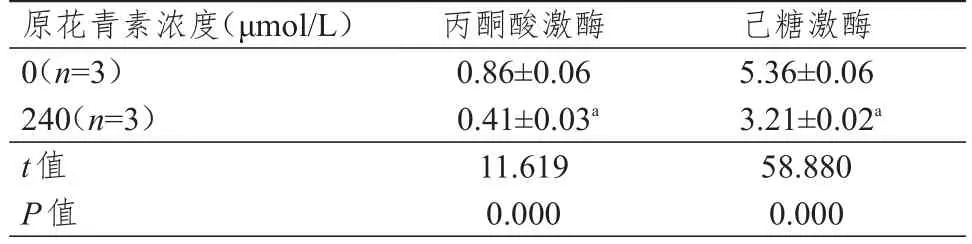
表3 不同浓度原花青素作用后Eca109细胞中丙酮酸激酶及己糖激酶活性的比较(U/mg,±s)
注:a与0 μmol/L组比较,P<0.05
原花青素浓度(μmol/L)0(n=3)240(n=3)t值P值丙酮酸激酶0.86±0.06 0.41±0.03a 11.619 0.000己糖激酶5.36±0.06 3.21±0.02a 58.880 0.000
2.4 Akt、p-Akt、STAT3、p-STAT3表达水平检测结果
240 μmol/L原花青素作用后,Eca109细胞中的 Akt、STAT3水平与 0 μmol/L 组比较,差异无统计学意义(P﹥0.05)。240 μmol/L原花青素作用后,Eca109细胞中的p-Akt、p-STAT3水平均较0 μmol/L组降低,差异有统计学意义(P﹤0.05)。(图1)
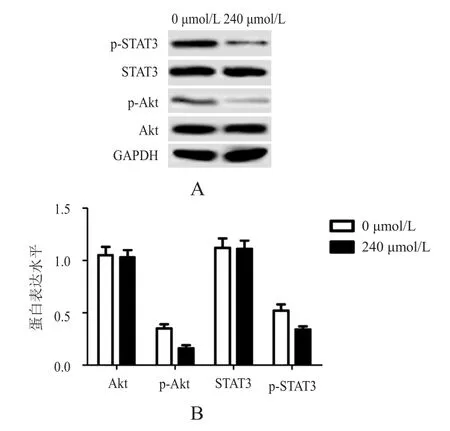
图1 不同浓度原花青素作用后Eca109细胞中Akt、p-Akt、STAT3、p-STAT3蛋白表达水平
3 讨论
原花青素是一类多酚化合物的总称,有二聚体、三聚体等多种形式。最初的研究表明,原花青素可以与多种蛋白质或消化酶结合形成化合物调控食物的吸收过程,随着研究的不断深入发现原花青素还具有抗氧化、抗癌、抗菌、抗炎等多种药理学作用[6-7]。Ma等[8]研究表明,原花青素可以抑制胰腺癌细胞AsPC-1的增殖、迁移和侵袭过程。潘晓婧等[9]研究发现,原花青素可以增加宫颈癌细胞HeLa的重离子辐射敏感性。Kim等[10]研究发现,100~300 μg/ml的原花青素能够呈浓度和时间依赖的抑制前列腺癌细胞PC-3的增殖。以上研究结果均表明,原花青素能够抑制肿瘤细胞的增殖。本研究结果发现,不同浓度的原花青素对三株食管癌细胞均具有增殖抑制作用,并且增殖抑制作用随着原花青素作用浓度的增加而增加,这与之前的研究报道一致,均说明原花青素具有抗肿瘤的作用。
肿瘤细胞的能量代谢途径与正常细胞不同,无论是在缺氧还是氧气充足的情况下均以糖酵解途径供能[11]。在糖酵解过程中有多种限速酶,例如己糖激酶、乳酸脱氢酶、琥珀酸脱氢酶、丙酮酸激酶等,这些酶的活性高低直接影响糖酵解途径[12]。乳酸是糖酵解途径的产物,糖酵解增加时,乳酸含量升高[13]。Zhao等[14]研究表明,miRNA-181b能够促进结肠癌细胞糖酵解,而干扰miRNA-181b表达后结肠癌有氧糖酵解被抑制。王秀等[15]研究表明,通过干扰原癌基因垂体肿瘤转化基因能够降低卵巢癌细胞中的己糖激酶活性,抑制卵巢癌细胞增殖。Di等[16]研究表明,脯氨酸羟化酶 2(PHD2)下调后,结肠癌细胞LS174T乳酸分泌水平和ATP水平明显升高。本研究结果表明,原花青素作用后食管癌细胞中己糖激酶、丙酮酸激酶活性降低,ATP含量降低,细胞分泌的乳酸减少,说明原花青素能够抑制食管癌细胞的糖酵解途径。
癌细胞的生长和能量代谢是一个极为复杂的过程,是细胞内信号转导过程的最终结果。Akt信号通路和STAT3信号通路在肿瘤中异常激活,其磷酸化水平异常升高,参与调控肿瘤细胞的增殖和能量代谢过程[17]。Yu等[18]研究表明,抑制Akt信号通路能够抑制缺氧环境和常氧环境下食管癌细胞中糖酵解酶的活性,降低培养液上清中乳酸含量,抑制食管癌细胞糖酵解途径。潘晓林[19]的研究表明,miRNA-181b可以通过影响STAT3磷酸化水平干扰结肠癌细胞能量代谢。本研究结果显示,原花青素能够降低食管癌细胞中Akt磷酸化水平和STAT3磷酸化水平,提示原花青素可能通过作用于Akt信号通路和STAT3信号通路影响食管癌细胞的增殖和糖酵解。
综上所述,原花青素可能通过抑制Akt信号通路和STAT3信号通路的激活抑制食管癌细胞增殖,干扰食管癌细胞糖酵解。本研究只在体外进行了细胞实验,后续会在体内进一步研究其作用机制。本研究为进一步探讨原花青素的抗肿瘤作用机制奠定了基础,为原花青素治疗肿瘤提供了理论基础。
[1]Mariette C,Dahan L,Mornex F,et al.Surgery alone versus chemoradiotherapy followed by surgery for stage I and II esophageal cancer:final analysis of randomized controlled phase III trial FFCD 9901[J].J Clin Oncol,2014,32(23):2416-2422.
[2]Lee ZW,Teo XY,Tay EY,et al.Utilizing hydrogen sulfide as a novel antiⅢcancer agent by targeting cancer glycolysis and pH imbalance[J].Br J Pharmacol,2014,171(18):4322-4336.
[3]Wu YY,Cao TT,Liu CL.Combined effect of vorinostat and grape seed proanthocyanidins on modulation of thymidine phosphorylase in non-small cell lung cancer[J].Trop J Pharm Res,2015,14(6):953-959.
[4]Vaid M,Singh T,Prasad R,et al.Bioactive proanthocyanidins inhibit growth and induce apoptosis in human melanoma cells by decreasing the accumulation of β-catenin[J].Int J Oncol,2016,48(2):624-634.
[5]Prasad R,Katiyar SK.Grape seed proanthocyanidins inhibit migration potential of pancreatic cancer cells by promoting mesenchymal-to-epithelial transition and targeting NF-κB[J].Cancer Lett,2013,334(1):118-126.
[6]Weh KM,Aiyer HS,Howell AB,et al.Cranberry proanthocyanidins modulate reactive oxygen species in Barrett’s and esophageal adenocarcinoma cell lines[J].J Berry Res,2016,6(2):125-136.
[7]张妍,郭荣年,孙柳青,等.葡萄籽原花青素对肾血管性高血压大鼠动态血压,白细胞介素-18和白细胞介素-10水平的影响[J].中国老年学杂志,2015,35(24):7018-7020.
[8]Ma J,Fang B,Zeng F,et al.Grape seed proanthocyanidins extract inhibits pancreatic cancer cell growth through downregulation of miR-27a expression[J].Zhong Nan Da Xue Xue Bao,2015,40(1):46-52.
[9]潘晓婧,王敏,刘斌,等.葡萄籽原花青素对人宫颈癌细胞的辐射增敏作用[J].中药药理与临床,2012,28(4):40-43.
[10]Kim J,McKeown B,Patel K,et al.Proanthocyanidins from the American cranberry(Vaccinium macrocarpon)induce cell cycle alterations in DU145 human prostate cancer cells in vitro by affecting the expression of cell cycleassociated proteins[J].Functional Foods in Health&Disease,2014,4(4):130-146.
[11]Wahlström T,Henriksson MA.Impact of MYC in regulation of tumor cell metabolism[J].Biochim BiophysActa,2015,1849(5):563-569.
[12]Li XB,Gu JD,Zhou QH.Review of aerobic glycolysis and its key enzymes——new targets for lung cancer therapy[J].Thorac Cancer,2015,6(1):17-24.
[13]Mack N,Mazzio EA,Bauer D,et al.Stable shRNA silencing of lactate dehydrogenase A(LDHA)in human MDAMB-231 breast cancer cells fails to alter lactic acid production,glycolytic activity,ATP or survival[J].Anticancer Res,2017,37(3):1205-1212.
[14]Zhao LD,Zheng WW,Wang GX,et al.Epigenetic silencing of miR-181b contributes to tumorigenicity in colorectal cancer by targeting RASSF1A[J].Int J Oncol,2016,48(5):1977-1984.
[15]王秀,杨爱君,蔡凤梅,等.PTTG沉默通过下调糖酵解相关酶抑制卵巢癌细胞增殖[J].中国妇幼健康研究,2016,27(11):1343-1347.
[16]Di Conza G,Trusso Cafarello S,Loroch S,et al.The mTOR and PP2A pathways regulate PHD2 phosphorylation to fine-tune HIF1α levels and colorectal cancer cell survival under hypoxia[J].Cell Rep,2017,18(7):1699-1712.
[17]Li Z,Li X,Wu S,et al.Long non-coding RNA UCA1 promotes glycolysis by upregulating hexokinase 2 through the mTOR-STAT3/microRNA143 pathway[J].Cancer Sci,2014,105(8):951-955.
[18]Yu VZ,Wong VC,Dai W,et al.Nuclear localization of DNAJB6 is associated with survival of patients with esophageal cancer and reduces AKT signaling and proliferation of cancer cells[J].Gastroenterology,2015,149(7):1825-1836.
[19]潘晓林.miR-181b通过激活STAT3调控结肠癌细胞有氧糖酵解的机制研究[D].南京:南京医科大学,2013.
