TWEAK/Fn14mRNA在大鼠骨性关节炎滑膜中表达的实验研究*
2018-04-19姚作娇沃春新张忠杰
王 雯 姚作娇 陆 巍 沃春新 姚 旌 张忠杰 王 林△
(1贵州医科大学附属医院疼痛科,贵阳550004;2黔西南州人民医院麻醉科,贵州黔西南562400)
骨性关节炎(osteoarthritis, OA)是老年人最常见关节疾病之一,其病理改变主要是关节软骨退变,软骨下骨赘形成,滑膜慢性炎症,关节周围韧带损伤等,该病伴随关节僵硬,关节肿胀,晚期有一定的致残率[1],本病发病多与肥胖、关节过度使用、衰老、遗传因素等多因素相关。发病机制也不完全清楚,该病发病率逐年上升,发病年龄年轻化,成为近年来骨科及相关科室就诊率极高的病种,传统治疗多于晚期出现关节腔严重病变,出现关节腔病变后给予治疗,效果往往不尽如人意。故近年来,探索OA发病机制、早期阻断炎性介质的释放信号通路,寻找OA治疗靶点成为国内外研究的方向。下游表达的炎性细胞因子公认参与了OA的发生发展[2]。TWEAK作为肿瘤坏死因子超体家族的新成员之一倍受关注。而Fnl4是近年来研究较多的特异性受体,它广泛存在于TWEAK高敏感性器官和组织。TWEAK/Fnl4发挥生物学效应可以通过激活激活NF-κB、ERIC、JNK及MARK等信号途径发挥。有研究认为TWEAK及其配体Fn14也参与了骨性关节炎的病理过程[3]。但就TWEAK抗体干预和治疗OA的动物模型的研究现国内外尚未见报道。有研究发现[4],在大鼠OA模型中,TWEAK及其受体Fn14的mRNA和蛋白表达在滑膜及软骨中均有明显增加,但对于阻断TWEAK及其受体Fn14的表达是否影响OA的发生及发展,国内外相关研究较少。本实验拟通过建立OA动物模型,通过建模前对TWEAK通路进行阻断,观察OA与TWEAK/Fn14关系以及其可能激活的下游炎性因子IL-1β、TNF-α改变,探讨TWEAK/Fn14激活是否在OA发生发展中起重要作用。以期进一步阐明OA的发病机制,并为探寻防治OA有效的新靶点提供理论和实验依据。
方 法
1.实验动物及分组
24只健康2~3月龄SD大鼠(雌雄各半)(贵州医科大学动物试验中心提供),体重200~250 g(实验对动物的处理方法符合中华人民共和国科学技术部颁发的《关于善待实验动物的指导性意见》),随机分为3组,即正常组、模型组及TWEAK抗体组,每组8只。
2.主要试剂和仪器
逆转录试剂盒、荧光定量试剂盒(北京天根生化科技有限公司)、引物(英滩基捷(上海)贸易有限公司)、兔抗鼠TWEAK单克隆抗体(美国Abcam公司)、核酸蛋白分析仪 Beckman Coulter DU640型 、PCR 扩增仪 PE 2400型、实时荧光定量PCR仪 PE 5700型、ⅡaB型臭氧发生仪(德国Herrmann Apparatebau GmbH)。
3.动物模型制作
正常组不做任何处理,其余两组分别在1、4、7天于左膝关节腔注射4%木瓜蛋白酶进行骨性关节炎动物模型复制[5]。TWEAK抗体组大鼠在造模前1小时将大鼠固定后,用10%水合氯醛对大鼠腹腔注射(0.06 ml/10 g)进行麻醉,经鼠尾静脉注射TWEAK单克隆抗体(225 μg/kg)[6]。在实验完成后一周,麻醉后用颈椎脱臼法处死大鼠,取膝关节滑膜组织,部分标本立即置于10%中性甲醛液固定24 h分组标记,石蜡包埋。部分组织保存于-80℃冰箱中,作为real-time PCR组织标本。
4.关节滑膜实时荧光定量PCR检测TWEAK和Fnl4的表达
(1)RNA提取:将滑膜组织加入研钵中,加用少量液氮,简单研磨。加入Trizol液1 ml,研磨成液体。加入200 μl氯仿,适度摇匀15秒,室温下放置2~3 min。高速冰冻离心 4 ℃ 12 000转,15 min。取上清约 400 μl,加入异丙醇 400 μl,上下颠倒混匀,室温下静置10 min,高速冰冻离心 4 ℃12 000转,10 min,弃上清。70%乙醇1 ml(DEPC水配制)洗涤1次,高速冰冻离心 4 ℃ 7 500转,5 min。弃上清,干燥10 min。加入30 μlDEPC水充分溶解备用。
(2)逆转录成cDNA:根据逆转录FastQuant RT Kit试剂盒说明书操作,反应体系(20 μl);5×gDNA Buffer 2 μl;10×Fast RT Buffer 2 μl;RT Enzyme Mix1μl;FQ-RT Primer Mix 2 μl;RNase-Free ddH2O根据实际情况补足至20 μl。将上述混匀,放入PCR扩增仪中42 ℃孵育15 min,95 ℃孵育3 min之后放置冰上,得到的cDNA用于后续试验,保存于-20 ℃冰箱。
(3)荧光实时测定PCR:根据 RT-PCR试剂盒进行操作:根据TWEAK及FN14基因序列设计并合成PCR引物:
TWEAK引物 (F)5'-AGGTGTCTGGGCTGTTGC-3' (R)5' -TAGAGGGTGGAGGAGTGGG-3' Fn14引物 (F)5' -AGCAAGCACCAGGCAACG-3' (R)5' -CGCATCCCAGGCAGAAGT-3' GAPDH引物(F)5'-TATCGGACGCCTGGTTAC-3 (R)5'-CTGTGCCGTTGAACTTGC-3'
完全融化cDNA,特异性引物,2×Super-Real PreMix Plus,50×ROX Reference Dye△ ,RNase-free ddH2O,短暂离心后置于冰上。2×Super-Real PreMix Plus 10 μl;50×ROX Reference Dye △2 μl;上、下游特异性引物各 0.6 μl;cDNA 模板 3 μl;RNase-Free ddH2O根据实际情况补足至20 μl。扩增反应条件:95 ℃,5 min;95 ℃预变性15 min;95 ℃变性 10 s,60 ℃退火 30 s,共进行40个循环;数据采用仪器自带软件分析(ABI Prism 7500 SDS Software),用△△Ct法进行各基因表达的相对定量。
5.免疫组化法检测IL-1β,TNF-α在滑膜中的表达
切片用DAB染色的阳性结果为软骨细胞胞浆/胞核呈棕褐色或棕黄色颗粒,淡黄色为弱阳性,黄色为阳性,棕黄色为中度阳性,棕褐色为强阳性。镜下(× 200)随机观察不重叠的五个视野,计数各因子胞浆阳性细胞数,取平均值。
6.统计分析
所有的实验数据均为定量资料,采用excel建立数据库。使用SPSS V 13.0统计软件进行数据处理,计量资料用均数±标准差(±SD)表示,组间比较先确定样本是否符合正态分布,若比较结果有统计学意义,继续采用t检验进行组间比较,P< 0.05为差异有统计学意义。
结 果
1.滑膜组织HE染色光镜观察
①正常组:滑膜上皮细胞为单层、扁平样分布,滑膜组织结构正常(见图1)。②模型组:滑膜上皮细胞表现为明显增生,细胞层次明显增多,排列不均,可见部分滑膜组织结构破坏,出现组织水肿、变性及坏死,部分区域伴有血管扩张充血,部分区域甚至出现炎性肉芽组织及纤维组织增生(见图1)。③TWEAK抗体组:滑膜上皮出现局部增生,细胞层次增多。未见明显纤维增生及血管增生(见图1)。
2.实时荧光定量PCR检测滑膜中TWEAK mRNA表达
TWEAK mRNA表达:模型组、TWEAK抗体组与正常组比较均有明显增高,差异有统计学意义(P< 0.05);TWEAK抗体组和模型组比较表达降低,差异有统计学意义(P< 0.05,见表1)。
3.实时荧光定量PCR检测滑膜中Fnl4 mRNA表达
Fn14 mRNA的表达:模型组、TWEAK抗体组与正常组比较均有明显增高,有统计学差异(P< 0.05);TWEAK抗体组和模型组比较表达降低,有统计学差异(P< 0.05,见表1)。
4.免疫组化检测IL-1β的表达
与正常组相比,模型组细胞阳性率显著增加,差异有统计学意义(P< 0.05,见表2);与模型组相比,TWEAK抗体组细胞阳性率显著降低,差异有统计学意义(P< 0.05,见表2、图2)。
5.免疫组化检测TNF-α的表达
与正常组相比,模型组细胞阳性率显著增加,差异有统计学意义(P< 0.05,见表2);与模型组相比,TWEAK组细胞阳性率显著降低,差异有统计学意义(P< 0.05,见表2、图3)。
讨 论
OA是一种常见的关节慢性病变,是力学和生物学共同作用下造成的老年性疾病[7]。有研究认为滑膜炎性病变在骨关节炎的发生中并不是旁观者,而是关节破坏的直接参与者,促进了骨关节炎的病程进展[8]。
本研究结果显示,模型组滑膜上皮细胞明显增生,细胞层次明显增多,排列不均,可见部分滑膜组织结构破坏、组织水肿、变性及坏死,部分区域伴有血管扩张充血,甚至出现炎性肉芽组织及纤维组织增生。同时滑膜组织IL-1β及TNF-α的表达增高,进一步证实了炎性细胞因子参与了OA的发生发展[9]。滑膜是被覆关节腔内面的纤维结缔组织,可以分为靠近关节腔的滑膜内层(滑膜衬里层或滑膜细胞层)及其滑膜下层 (滑膜衬里下层)。滑膜出现炎症后,滑膜细胞[10~12]不仅会丧失许多生理功能,而且还分泌过多的IL-1,TNF-α、IL-6等炎性细胞因子诱导蛋白溶解酶合成,这些炎性成分又可作用于软骨细胞、滑膜细胞及其周围组织进一步促进致炎因子的产生,加速软骨基质降解,终至出现软骨破坏。此外,因炎症而变形的滑膜皱璧可伸入关节间隙,与关节软骨面相互挤压摩擦,加重对软骨的物理损伤。因此有学者认为滑膜炎症可能为OA病理演变中重要的“启动子”并贯穿整个病理过程[13]。
表1 不同组大鼠滑膜组织中TWEAK / Fnl4 mRNA表达(n = 8,±SD)Table1 The expressions of TWEAK/ Fnl4 mRNA in synovial of rats in different groups (n = 8,±SD)

表1 不同组大鼠滑膜组织中TWEAK / Fnl4 mRNA表达(n = 8,±SD)Table1 The expressions of TWEAK/ Fnl4 mRNA in synovial of rats in different groups (n = 8,±SD)
*P < 0.05,与正常组相比,compared with the normal group; #P < 0.05,与模型组相比,compared with the model group.
TWEAK抗体组TWEAK antibody group TWEAK mRNA 0.21±0.15 0.79±0.21* 0.41±0.17*#Fn14mRNA 0.18±0.17 0.63±0.24* 0.38±0.24*#组别Group正常组Normal group模型组Model group
表2 不同组大鼠滑膜组织中IL-1β、TNF-α表达(n = 8,±SD)Table 2 The expressions of IL-1β and TNF-α in synovial of rats in different groups (n = 8,±SD)

表2 不同组大鼠滑膜组织中IL-1β、TNF-α表达(n = 8,±SD)Table 2 The expressions of IL-1β and TNF-α in synovial of rats in different groups (n = 8,±SD)
*P < 0.05,与正常组相比,compared with the normal group; #P < 0.05,与模型组相比,compared with the model group.
TWEAK抗体组TWEAK antibody group IL-1β 15.24±2.64 52.35±4.23* 32.72±4.57*#TNF-α 12.34±3.21 47.56±3.45* 34.24±3.27*#组别Group正常组Normal group模型组Model group
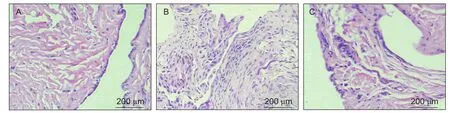
图1 滑膜 HE (A) 正常组(B)模型组(C) TWEAK抗体组 (Scale bar = 200 μm)Fig.1 HE staining of synovial in normal (A) model (B) and TWEAK antibody group (C) (Scale bar = 200 μm)
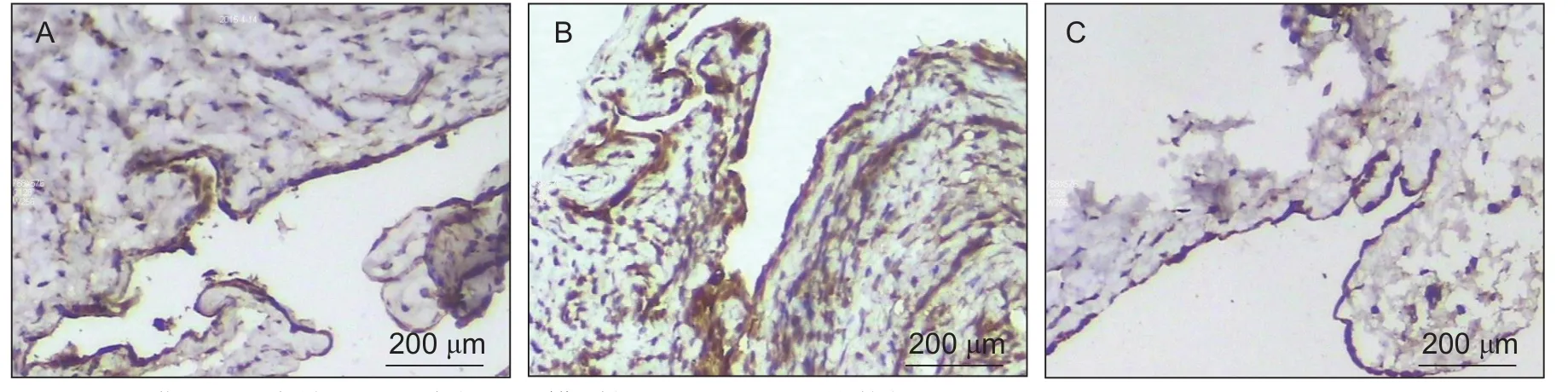
图2 滑膜 IL-1β表达(A)正常组(B)模型组(C) TWEAK抗体组(Scale bar = 200 μm)Fig. 2 The expressions of IL-1β in synovial of rats in normal (A) model (B) and TWEAK antibody group (C) (Scale bar = 200 μm)
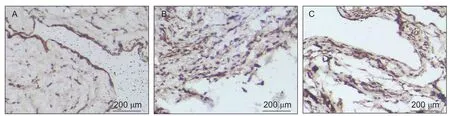
图3 滑膜 TNF-α表达(A)正常组(B) 模型组(C) TWEAK抗体组( Scale bar = 200 μm)Fig.3 The expressions of TNF-α in synovial of rats in normal (A) model (B) and TWEAK antibody group (C) (Scale bar = 200 μm)
肿瘤坏死因子样凋亡微弱诱导剂 (tumor necrosis factor. like weak inducer of apoptosis, TWEAK) 作为肿瘤坏死因子 (tumor necrosis factor, TNF) 超体家族的新成员之一倍受关注[14]。而Fnl4是近年来研究较多的、TWEAK的特异性受体,它广泛存在于TWEAK高敏感性器官和组织。TWEAK/Fnl4发挥生物学作用可以通过激活多条信号通路发挥生物学效应,其中包括激活NF-κB、ERIC、JNK及MARK等信号转导途径,可以引起一系列的相关生物学效应[15],NF-κB信号转导途径被认为有着重要的作用。TWEAK/Fnl4与TRAF分子结合可以激活两条NF-κB相关信号通路:P100程序化和IκBα磷酸化[16]。已有研究证实NF-κB的表达在OA关节液及软骨中明显增高[17]。NF-κB活化后可以进入细胞核,与许多免疫调节因子或促炎因子结合,启动基因转录,生成诱导型酶类 (如诱导型一氧化氮合酶、环氧合酶、磷脂酶A)、急相蛋白、细胞因子、黏附分子等。而这些由NF-κB所激活的细胞因子包括了 MMP-9, MMP-13, IL-1β, TNF-α等,这些细胞因子在骨性关节炎的发病中起到了重要作用。有学者证实[18]TWEAK/Fn14不仅仅参与类风湿性关节炎、系统性红斑狼疮、慢性肾脏损伤、多发性硬化等免疫风湿性疾病,而且高表达于脑卒中、哮喘及心肌梗塞等疾病。动脉粥样硬化、系统性红斑狼疮将TWEAK作为早期的诊断和疗效的生物标记[19]。研究表明在膝关节骨性关节病人血液中NF-κB的表达也有明显增高,TWEAK作为NF-κB的上游激活剂,有研究认为TWEAK及Fn14也参与了骨性关节炎的病理过程[20]。但就TWEAK抗体干预和治疗OA的动物模型的研究现国内外尚未见报道。
本实验结果显示大鼠OA造模成功后,模型组大鼠OA滑膜的TWEAK及Fn14较正常组均出现明显的增高,同时滑膜组织IL-1β及TNF-α的表达也增高,而TWEAK抗体组大鼠OA滑膜的TWEAK及 Fn14表达则降低 (P< 0.05),IL-1β及 TNF-α 的表达也同时降低 (P< 0.05),滑膜组织病理变化程度较模型组改善,提示TWEAK及Fn14参与了OA的发生发展,鉴于于TWEAK具有趋化因子分泌、细胞增生促进炎性细胞因子等生物学效应,因此推测膝关节滑膜组织中TWEAK及Fn14 mRNA表达的增加可能是OA疾病启动因素之一。然而,TWEAK抗体组大鼠OA滑膜的TWEAK及Fn14表达、IL-1β及TNF-α的表达均未降至正常水平,本次研究中所用的为TWEAK多克隆抗体,且给药途径为经鼠尾静脉给药,给药的剂量也为相关实验研究的给药剂量下限,故推测是否与TWEAK抗体剂量、给与的时机以及抗体给药方式有关有待进一步研究探明。
综上所述,大鼠膝关节OA滑膜组织中TWEAK及Fn14 mRNA表达的增加可能是OA疾病启动因素之一,参与了OA的发生发展,为临床上OA的治疗提供新的思路及治疗靶点。
[1]中华医学会骨科学分会.骨关节炎诊治指南 (2007年版).中国临床医生杂志, 2008, 36(1):28 ~ 30.
[2]丁长海,徐建华 .风湿科医生注意骨性关节炎的研究.中华风湿性杂志, 2014, 10(18):651 ~ 654.
[3]Choe JY, Kim SK. Serum, TwEAK as a biomarker for disease activity of systemic lupus erythematosus EJ.In flamm Res, 2016, 65(6):479 ~ 488.
[4]蔡国平,俞永林, 熊敏, 等. TWEAK及其受体Fn14在大鼠骨性关节炎 (OA) 关节软骨级关节滑膜中的表达.复旦大学学报, 2013, 40(3):265 ~ 270.
[5]汪宗保,徐亚林.木瓜蛋白酶诱导大鼠膝早期骨关节炎软骨表面电镜扫描.中国组织工程研究, 2014,18(12):177 ~ 179.
[6]NicolasWisniaci, MD, LakshmiAmaravad; GeraldR.Gallupp,et al. TimothyS.Zheng, RayZhang, Jessica-Kong, andLindaC. Burkly Safety, Tolerability, Pharmacokinetics, and Pharmacodynamics of Anti-TWEAK Monoclonal Antibody in Patients With Rheumatoid Arthritis. Clin Ther, 2013, 8(35):1137 ~ 1140.
[7]邱贵兴, 王澍寰, 卢世璧,等.骨关节炎诊治指南,中华骨科杂志, 2007, 10: 793 ~ 796.
[8]李宁怡, 沃春新, 王林. 关节腔注射臭氧对兔膝骨性关节炎滑膜组织的影响. 中国疼痛医学杂志, 2012,18(7):396 ~ 399.
[9]何飞宇. SD大鼠腰椎小关节胶原酶诱导骨生关节炎模型中TNF-α,IL-1β及NO的表达变化.浙江创伤外科杂志, 2013, 18(5).635 ~ 636.
[10]梁正洋, 王友, 安丙辰.骨关节炎中滑膜炎组织的病理学评估.国际骨科学杂志, 2011, 32; 27 ~ 29.
[11]Li JZ, Li KX, Guo EP,et al. Expression and significance of B-catenin in the synovial of SD rat model of osteoarthritisf. Acta Universitatis Medicinalis Nanjing,2015, 35(2):155 ~ 159.
[12]Shi J, Zhang C, Yi z,et a1. Explore the variation of MMP3, JNK, p38 MAPKs, and autophagy at the early stage of osteoarthritis. IUBMB life, 2016, 68(4): 293 ~ 302.
[13]武豪杰, 王晓, 张明辉, 等.白细胞介素和基质金属蛋白酶在兔膝关节骨性关节炎模型滑膜中的表达及意义.中华实验外科学杂志, 2016, 33:741 ~ 744.
[14]Chicheportiche Y, Bourdon PR, Xu H,et a1. TWEAK a new secreted ligand in the tumor necrosis factor family that weakly induces apoptosis. Biol Chem, 1997,272(51):32401 ~ 32410.
[15]Burkly LC, Michaelson JS, Hahm K,et al. TWEAKing tissue remodeling by a multifunctional cytokine: role of TWEAK/Fn14 pathway in health and diseas. Cytokine,2007, 40(1):1611 ~ 1617.
[16]Bowles RD, Mata BA, Bell RD,et al. In vivo luminescence imaging of NF-κB activity and serum cytokine levels predict pain sensitivities in a rodent model of osteoarthritis. Arthritis Rheumatol, 2014, 66(3):637 ~ 646.
[17]郭静, 张娜, 秦丽娟,等.膝骨关节炎患者中IL-1β、VEGF和NF-κB的表达及意义.实用医学杂志,2013, 29(18):3024 ~ 3025.
[18]Ruiz-Ortega M, Ortiz A, Ramos AM. Tumor necrosis factor-like weak inducer of apoptosis(TWEAK)and kidney disease. Curr Opin Nephrol Hypertens, 2014,23(1):93 ~ 100.
[19]Choe JY, Kim SK. Serum TwEAK as a biomarker for disease activity of systemic lupus erythematosus. Inflamm Res, 2016, 65(6):479 ~ 488.
[20]蔡国平, 俞永林, 熊敏,等. TWEAK及其受体Fn14在大鼠骨性关节炎(OA)关节软骨级关节滑膜中的表达.复旦大学学报, 2013, 40(3):265 ~ 270.
