病原物协同致病性对棉花黄萎病严重度的影响
2018-04-09张帆李晓林张敬泽祝水金
张帆,李晓林,张敬泽,祝水金
(浙江大学农业与生物技术学院,杭州310058)
棉花黄萎病是1种土传病害,由大丽轮枝菌(Verticillium dahliaeKleb.)和黑白轮枝菌(V.albo-atrumReinke et Berth.)引起,在我国主要由大丽轮枝菌引起[1]。该病害的症状包括萎蔫、叶片坏死、茎维管束变色和早衰;其病原菌最终会在寄主中系统定殖,并在侵染的组织中产生休眠结构——微菌核[2]。该病害广泛分布于棉花产区,常造成严重的经济损失,成为棉花产业发展的主要障碍之一。病原菌以微菌核形式在土壤中存活多年,使棉花黄萎病成为生产上最难防治的病害之一[3]。理解棉花黄萎病病原菌与寄主的互作关系,是有效防治该病害的基础。
随着分子生物学的迅速发展,轮枝菌与棉花寄主互作的致病机制已逐渐从分子水平上被阐明。目前,已有许多棉花黄萎病病原菌致病相关基因被克隆,其功能已经被鉴定确认[4]。尤其是大丽轮枝菌基因组测序的完成和大量转录组数据的积累[5],为分析和预测大量相关基因以及从比较基因组水平上阐释相关病原菌基因的演化与其适应性的关系奠定了技术基础。另外,棉花基因组测序和注释的完成[6-7],还为挖掘和利用植物抗病资源奠定了基础。此外,棉花黄萎病发生程度受根围土壤中的线虫影响。一些研究表明,田间土壤中的线虫危害植株,不仅引起棉花线虫病,还能加重黄萎病[8-9]。线虫从棉花根部取食,造成伤口,提供了黄萎病病原菌迅速侵入的途径,增加了发病概率。还有部分研究认为,线虫取食能造成根部伤口,可能改变寄主组织的生理特性,促进病原菌孢子在维管束中的萌发,导致病害严重度增加[10]。
病原真菌和线虫的互作关系,以及其与寄主的互作关系的明确,可对棉花黄萎病防治策略制定和有效防治起指导作用。最新研究发现,1种土壤习居的机会病原菌棉帚霉菌(Scopulariopsis gossypii)也能加重大丽轮枝菌引起的黄萎病[11],而生物学研究显示该真菌具有维管束病原菌的生物学特性。由此可知,在棉花根围系统中存在多种病原物(大丽轮枝菌、线虫和棉帚霉菌)与寄主的互作关系,棉花黄萎病症状和严重度是这些病原物共同作用的结果。
因此,笔者根据目前的研究资料,以及本实验室的研究结果,描述引起维管束病害的病原菌具有的共同特征以及棉帚霉菌作为维管束病原菌的生物学特性,以及大丽轮枝菌与寄主互作的分子机制研究最新进展,评价研究大丽轮枝菌和棉帚霉菌协同致病机制的可行性,并提出从多种病原物与寄主互作体系中研究帚霉菌的致病机制及其协同致病机制的观点,为了解棉花黄萎病发生机制提供新的视野。
1 新病原菌的发现
大丽轮枝菌能生长在营养贫乏的基质上。因而,蒸馏水琼脂培养基(简称“WA”,由20 g琼脂和1 000 mL自来水配制)常用于该病原真菌的分离。在分离过程中,经常分离到帚霉属(Scopulariopsis)的1种真菌。该属不属于已知棉花内生菌的类群[12-14],且新发现的真菌在形态学上与帚霉属的已知种不同[15]。为此,从具有典型黄萎病症状和无病症的棉花植株上进行真菌的系统分离,发现该种仅存在大丽轮枝菌侵染的病株中。通过形态学结合分子系统学(rDNA 28S的D1/D2区、转录延长因子 1-α(TEF1)和 β-微管蛋白(TUB)基因方法)鉴定,发现该种是1个新种,被定名为棉帚霉菌(S.gossypii)[11]。
致病性试验显示,棉帚霉菌和大丽轮枝菌切根混合接种比单独接种大丽轮枝菌的棉株发病早;接种25 d后,混合接种棉株叶片几乎全部脱落,单接大丽轮枝菌棉株中仅个别叶片脱落,而单接棉帚霉菌的棉株仅有叶片褪绿症状。维管束检查显示,混合接种的棉株整个维管束呈黑褐色,比单独接种大丽轮枝菌的棉株症状更严重。据清水对照和无伤接种棉帚霉菌的棉株无黄萎病症状,且维管束无褐变现象,认为棉帚霉菌不能侵染无伤的寄主,是1种机会病原菌[11]。
棉帚霉菌属于帚霉属,在Index Fungorum数据库中该属包含108个种的记录,目前有87个种被接收[15]。棉帚霉属真菌分布广泛,通常作为腐生菌存在土壤、空气、植物残体和粪便中[16],但一些种类被认为是侵染昆虫和动物的病原菌[17-18]。棉帚霉菌是该属中迄今发现唯一能侵染植物的种类。
2 棉帚霉菌具有维管束病原菌的生物学特性
作为维管束病原菌,必须具有适应和定殖维管束栖境的能力。这是因为维管束中营养贫乏,仅有有限的植物病原菌能够生长、产孢和存活[19]。这些病原菌在生活史的大部分时间能驻留在维管束中,这是病原菌与寄主长期互作和协同进化的结果,而它们开拓维管束这个栖境被认为是为了避免与其他微生物竞争[20]。
笔者测定棉帚霉菌在不同固体和液体培养基中产孢能力显示,它能在营养贫乏的培养条件下产孢(表1和表2)。在固体培养基上,棉帚霉菌产孢量(分生孢子和子囊壳)随营养成分增加而增大,但在自来水琼脂培养基 (TWA),甚至在WA中也能产孢(表1)。同样,在相同的液体培养基中,丰富的营养能显著促进棉帚霉分生孢子产生,其中PDB中孢子含量为1 135±19 mL-1,自来水 (TW)+10%挤压棉花组织获得的汁液(juice) 为 8 195±19 mL-1, 蒸馏水 (W)+10%juice为 2 661.7±27.0 mL-1(表 2)。 但在营养贫乏的自来水和蒸馏水中,棉帚霉菌也能产生少量的分生孢子,分别为25±4 mL-1和8.4±2.4 mL-1(表 2),表明该菌能在营养贫乏的基质中产孢。
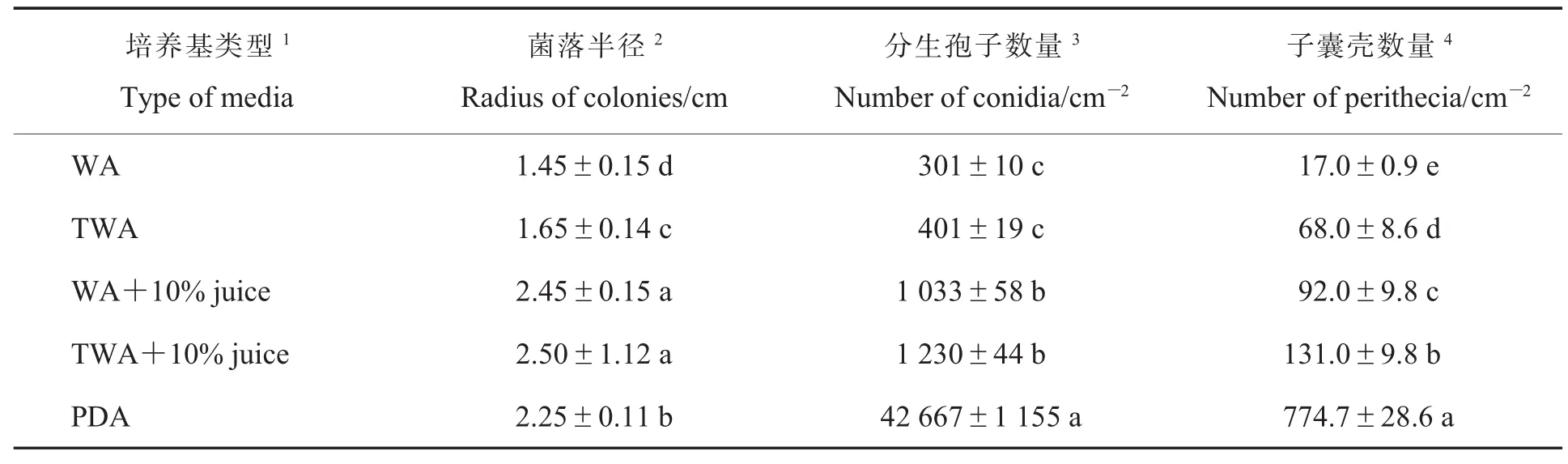
表1 不同固体培养基对棉帚霉菌产孢数量的影响Table 1 Effect of different solid media on sporulation ability ofScopulariopsis gossypii
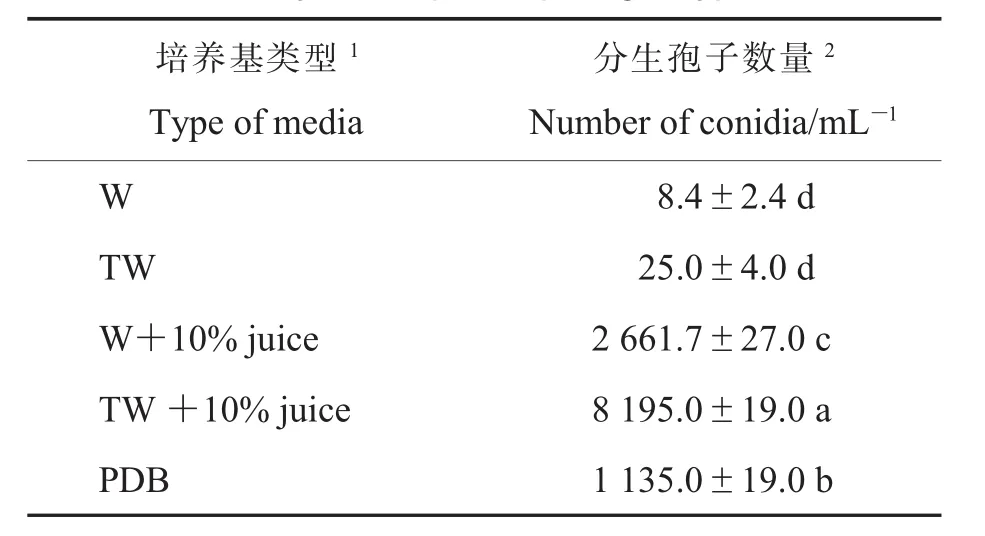
表2 不同液体培养基对棉帚霉菌产孢数量的影响Table 2 Effect of different liquid media on sporulation ability ofScopulariopsis gossypii
据棉帚霉菌能在自来水中产孢推测,它也可能在维管束汁液中产孢。这是因为维管束汁液中也有微量或极少的有机和无机营养,比自来水中营养相对丰富。一些研究显示,维管束中的有机营养包括各种碳水化合物,如葡萄糖、果糖、蔗糖、麦芽糖、棉籽糖、海藻糖、核糖等,各种蛋白、氨基酸和有机酸等;无机营养包括硝酸、硫酸和磷酸等阴离子和钙、钾、镁、锰等阳离子[10,19,21]。另外,一些研究还表明,维管束病原菌不仅能通过棉维管束汁液获得营养,而且能主动分泌细胞壁降解酶降解寄主细胞壁获得营养,或诱导周围组织营养泄露获得营养[5,22-23]。大丽轮枝菌的基因组中含有大量编码降解细胞壁酶的基因,调控降解维管束壁和纹孔膜,释放糖[5,24]。维管束病原菌在定殖期间通过产生植物毒素,干扰膜的完整性,从而利用围绕导管的细胞中泄漏的营养[23]。虽然目前还不清楚棉帚霉菌在维管束中是否能通过产生的细胞壁降解酶和植物毒素获得营养,但维管束的营养足以促进其生长和产孢。
3 棉帚霉菌侵染过程
帚霉属真菌具有极强的腐生能力,可长期存活在土壤中。致病性试验显示,棉帚霉菌不能侵染无伤口植株,但能通过伤口侵入。在田间,棉帚霉菌进入维管束的过程还不完全清楚。一些研究表明,真菌从皮层到达木质部维管束的过程中,内皮层被认为是其侵入的1个障碍[25]。比较侵染油菜的大丽轮枝菌和长孢轮枝孢(V.longisporum),这个障碍对大丽轮枝菌属于非寄主抗性[26-27]。通常仅当内皮层还没有完全发育或其他因素引起皮层损伤时,病原菌才可通过内皮层这个障碍[26,28-30]。但迄今,还不清楚棉花根部内皮层对棉帚霉菌侵入是否具非寄主抗性以及是否为主要障碍。
棉帚霉菌一旦进入维管束后,就可像其他维管束病原菌一样生长繁殖。扫描电镜证据也证实,从田间采集的棉茎维管束薄壁细胞中,存在成链的棉帚霉菌分生孢子[11]。显然,该真菌能在维管束中向上传播。然而,维管束病原菌在寄主内向上传播,需要克服导管末端的障碍[25,31],但在不同病原菌和寄主间存在差异。之前已有大丽轮枝菌在棉花植物导管中传播过程的报道,认为真菌在棉花植物根和茎部的分布是有差异的[1]。在根部维管束组织中,分生孢子和菌丝主要分布在管胞中,分生孢子萌发产生的菌丝可以穿透管胞纹孔到相邻的管胞中,克服导管末端的障碍。穿过管胞纹孔的菌丝一旦到达相邻的导管中,又可产生分生孢子,并向上传播。而在茎部维管束中,真菌主要分布在螺纹导管中。管壁上的菌丝或萌发分生孢子产生的芽管直接穿过导管螺纹间隙,进入相邻导管并产生分生孢子。这些不同于马铃薯植物中大量的分生孢子聚集在导管分子下的穿孔板[32],而且在棉花维管束中没有观察到螺纹导管分子末端的穿孔板[1]。推测,真菌可能主要通过穿透棉花导管壁螺纹向上传播,而不是通过导管末端孔板,正如Beckman等[31]的观察结果。棉帚霉菌是否具有大丽轮枝菌在维管束中的传播机制,还需要进一步证实,但这些研究为进一步揭示棉帚霉菌在植物维管束中传播机制奠定了细胞学和超微结构的基础。
4 棉帚霉菌致病性和协同致病性
棉帚霉菌进入寄主后,除能引起棉花叶片和维管束变色的症状外,还能显著加重大丽轮枝菌引起的棉花黄萎病的程度,导致几乎完全落叶和维管束变色更严重[11]。这表明棉帚霉菌与大丽轮枝菌在棉花寄主体内的互作具有协同致病作用。田间观察也显示,虽然引起棉花黄萎病的田间病原菌都是大丽轮枝菌落叶型株系[1],但分离到棉帚霉菌田块中棉株落叶严重(图1-A),而未分离到棉帚霉菌田块中棉株几乎没有明显落叶症状(图1-B)。目前研究仅证实棉帚霉菌是棉花的1种病原菌,而其致病机制及与其他病原物的协同致病机制还不清楚。

图1 由大丽轮枝菌落叶型株系引起的棉花黄萎病在不同田块中的症状Fig.1 Verticillium wilt symptoms caused by defoliation pathotype ofVerticillium dahliaeisolate in different cotton fields
然而,同属的短帚霉菌(S.brevicaulis)基因组测序和基因注释提供了大量基因和基因组结构演化的信息[33],可为揭示棉帚霉菌致病机制提供参考。短帚霉菌基因组大小仅为32.2 Mb,但含有16 298个基因,而编码细胞壁降解酶相关的碳水化合物活性酶(CAZy)的基因达478个。同时,其基因组中存在代谢产物相关的基因簇[33],可产生多种代谢化合物。
另外,大丽轮枝菌基因组和致病相关基因的深入研究,为揭示棉帚霉菌与大丽轮枝菌协同致病机制提供了基础信息。已完成的大丽轮枝菌基因组测序分析和基因功能注释[5,34],发现基因组重排可导致染色体长度多态性,形成含有很高动态的、富含重复序列的和系谱专化性的区[5],其中富含致病基因或效应子[34]。最新研究表明,大丽轮枝菌的基因组属于双速基因组类型[35],即基因组具有富含基因和很少有重复序列的区,它们含有调节一般生理的核心基因,演化较慢;另有部分含有可塑性的、很少基因的、富含重复序列的区,它们富含效应基因,在与寄主植物互作中调节毒力,演化相对快[36]。近年来,已发现大量致病相关基因,包括VdSSP1(编码大丽轮枝菌专化性分泌蛋白)[37]、Vdsc1(编码异分支酸酶)[38]、VdSge1(编码转录调节因子1)[39]、Vta2(编码1个锌指纹调节因子2)[40],VdSNF1(编码蔗糖非发酵蛋白激酶1)[41],VGB(编码 G 蛋白 β 亚基)[42],VdNUC-2(编码1个粗糙脉孢菌nuc-2同源蛋白)[43]、VDH1(编码疏水素类蛋白1)[44]和VdCYP1(编码细胞色素P450单氧化酶蛋白1)[4]等。这些研究为揭示大丽轮枝菌与棉帚霉菌的协同致病机制奠定了分子基础。
5 线虫对棉花黄萎病严重度的影响和作用
线虫危害棉花通常引起棉花线虫病。线虫取食植物根部,能造成根部伤口,不仅会引起病害症状,还能加重黄萎病等的危害程度[8-9]。关于线虫加重黄萎病严重度的机制研究认为,线虫的危害可能改变寄主组织的生理特性,促进大丽轮枝菌孢子在维管束中的萌发[10]。
危害棉花线虫的种类和分布在不同国家有所不同。在美国,危害棉花的线虫有南方根结线虫(Meloidogyne incognita)、 肾形线虫(Rotylenchulus reniformis)、哥伦比亚矛线虫 (Hoplolaimus columbus)和刺线 虫(Belonolaimus longicaudatus)[45]。但在南美,主要有3个种,即肾形线虫、南方根结线虫和哥伦比亚兰斯线虫[46-47]。在我国,虽然已报道在棉田中发现多种线虫[48-51],但危害棉花的线虫的种类可能是有限的。
在我国新疆棉区,棉田寄生线虫有11属11个种,其中真滑刃线虫(Aphelenchusavenae bastian)、茎 线 虫 (Ditylenehus dipsaci)和 螺 旋线 虫(Helicotylenchus multicinclus)是优势种群[48];四川棉田有7属5个种,肾形线虫和穿刺根腐线虫(Pratylenchus penetrans)是优势种群[49];陕西棉田线虫有6属8个种,其中加洲螺旋线虫(Helicotylenchus californicus)是危害棉花的主要线虫[50]。在我国南方,一些研究证实危害棉花的线虫主要是南方根结线虫[52-54]。
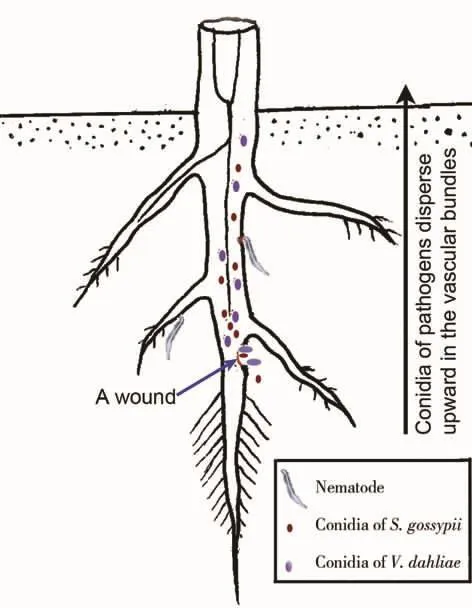
图2 棉田根围系统中多病原菌与寄主互作关系示意图Fig.2 Schematic diagram of multipathogen-host interaction in a cotton rhizosphere soil system
最新发现的机会病原菌棉帚霉菌仅通过伤口侵入,而取食线虫造成的伤口提供了病原菌侵入寄主的途径。因此,棉田土壤系统中存在多病原物与寄主的互作关系,如图2所示。在这个系统中,根围的大丽轮枝菌和棉帚霉菌通过线虫造成的伤口侵入寄主,而2个病原真菌在寄主体内协助致病,最后导致棉花黄萎病严重度增加。从多病原菌与寄主互作体系理解棉花黄萎病发生及其病原物协同致病性机制,是今后研究的重要内容,将为病害防治策略的制定提供新的理论依据。
6 展望
大丽轮枝菌作为棉花黄萎病的病原菌,存在致病力分化。Schnathorst等[55]首次报道了大丽轮枝菌株系间存在毒力水平的差异,依据病原菌株系引起植株发病和落叶情况,把大丽轮枝菌株系分为落叶(Defoliating,D)和非落叶(Nondefoliating,ND)致病型。D致病型株系引起的黄萎病症状出现较早,病害发生更迅速,产量损失比ND株系引起的更大。虽然这2种株系在我国棉区普遍存在,但不同地区的优势种群有差异[1]。然而,随着棉花育种的进展,不同抗性品种在生产中的广泛应用,用于定义病原菌株系间致病性分化的落叶型和非落叶型概念已变得模糊。这是因为虽然落叶型株系侵染感病品种后显示落叶现象,但在另一些品种上不能观察到典型的落叶症状。同时,在不同棉花品种之间,叶片显示多样性病害症状,除典型的症状外 (叶缘部分褪绿和坏死)(图3-A),在一些品种上产生“西瓜皮”症状或掌状斑(图3-B)或(褪绿的)散斑症状(图3-C)。病害症状变化是病原菌与寄主互作的结果,涉及病原菌致病性和寄主对病原菌的反应,尤其表现在不同抗性品种上。另外,其他因素也影响依据落叶型和非落叶型标准对病原菌致病性株系的划分,例如大丽轮枝菌与棉帚霉菌互作也能促进落叶[11],使病原菌致病力分化的定义复杂化。因此,阐明病原菌致病力分化与病害症状变化关系,需要在多病原物与寄主互作体系中澄清。

图3 棉花(新陆中37)黄萎病不同类型的叶片症状Fig.3 Verticillium wilt symptoms of different type on cotton(Xinluzhong 37)leaves
病原菌与寄主互作机制的研究在理论和技术上已取得了很大进展,尤其生物信息学的发展和应用提供了分析病原菌协同作用及其与寄主互作机制研究的技术手段。目前,棉花基因组测序和注释的完成[6-7]以及大量转录组数据的积累,为分析病原菌致病相关基因功能及其信号途径提供了重要信息。这也将推动大丽轮枝菌与棉帚霉菌协同致病机制研究及其致病机制理论的发展,对棉花抗病育种和病害防治具有重要理论和实践意义。
参考文献:
[1]孙晓婷,鹿秀云,张敬泽,等.浙江棉花黄萎病菌致病型菌株的鉴定及高温抑制病害的表征分析[J].浙江大学学报(农业与生命科学版),2016,42(6):671-678.Sun Xiaoting,Lu Xiuyun,Zhang Jingze,et al.Identification ofVerticillium dahliaeisolates on cotton in Zhejiang province and phenotypic analysis on inhibitory effect by high temperature[J].Journal of Zhejiang University(Agriculture&Life Sciences),2016,42(6):671-678.
[2]Elzik K M.Integrated control of Verticillium wilt of cotton[J].Plant Disease,1986,69(12):1025-1032.
[3]Cai Y F,He X H,Mo J C,et al.Molecular research and genetic engineering of resistance to Verticillium wilt in cotton:A review[J].African Journal of Biotechnology,2009,8(25):7363-7372.
[4]Zhang D D,Wang X Y,Chen J Y,et al.Identification and characterization of a pathogenicity-related geneVdCYP1 fromVerticillium dahliae[J/OL].Scientific Reports,2016,6:27979(2016-06-22)[2017-09-20].http://www.nature.com/articles/srep27979.DOI:10.1038/srep27979.
[5]Klosterman S J,Subbarao K V,Kang S,et al.Comparative genomics yields insights into niche adaptation of plant vascular wilt pathogens[J/OL].PLoS Pathology,2011,7:e1002137(2011-07-28)[2017-09-20].https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3145793/pdf/ppat.1002137.DOI:10.1371/journal.ppat.1002137.
[6]Zhang T Z,Hu Y,Jiang W K,et al.Sequencing of allotetraploid cotton(Gossypium hirsutumL.acc.TM-1)provides a resource for fiber improvement[J].Nature Biotechnology,2015,33(5):531-537.
[7]Liu X,Zhao B,Zheng H J,et al.Gossypium barbadensegenome sequence provides insight into the evolution of extra-long staple fiber and specialized metabolites[J/OL].Scientific Reports,2015,5:14139(2015-09-30)[2017-09-20].www.nature.com/articles/srep14139.DOI:10.1038/srep14139.
[8]Katsantonis D,Hillocks R J,Gowen S.Comparative effect of root-knot nematode on severity of Verticillium and Fusarium wilt in cotton[J].Phytoparasitica,2003,31(2):154-162.
[9]Saeed I A M,Macguidwin A E,Rouse D I.Effect of initial nematode population density on the interaction ofPratylenchus penetransandVerticillium dahliaeon'Russet burbank'potato[J].Journal of Nematology,1998,30(1):100-107.
[10]Katsantonis D,Hillocksr J,Gowen S.Enhancement of germination of spores ofVerticillium dahliaeandFusarium oxysporumf.sp.vasinfectumin vascular fluid from cotton plants infected with the root-knot nematode[J].Phytoparasitica,2005,33(3):215-224.
[11]Li X L,Ojaghian M R,Zhang J Z,et al.A new species ofScopulariopsisand its synergistic effect on pathogenicity ofVerticillium dahliaeon cotton plants[J/OL].Microbiological Research,2017,201:12-20(2017-04-10)[2017-09-20].http://dx.doi.org/10.1016/j.micres.2017.04.006.
[12]Li Z F,Wang L F,Feng Z L,et al.Diversity of endophytic fungi from different Verticillium-wilt-resistantGossypium hirsutumand evaluation of antifungal activity againstVerticillium dahliae in vitro[J].Journal of Microbiology and Biotechnology,2014,24(9):1149-1161.
[13]Sword G A,Kerns D L,Morgan G D,et al.Spatial and temporal variation in fungal endophyte communities isolated from cultivated cotton(Gossypium hirsutum)[J/OL].PLoS ONE,2013,8(6):e66049(2013-06-11)[2017-09-20].https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3679028/pdf/pone.0066049.DOI:10.1371/journal.pone.0066049.
[14]Wang B,Priest M J,Davidson A,et al.Fungal endophytes of nativeGossypiumspeciesinAustralia[J].MycologicalResearch,2007,111(3):347-354.
[15]Guarro J,Wiederhold N P,Decock C A,et al.RedefiningMicroascus,Scopulariopsisand allied genera[J/OL].Persoonia,2016,36:1-36(2015-04-15)[2017-09-20].https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4988368/pdf/per-36-1.DOI:10.3767/003158516X688027.
[16]Domsch K H,Gams W,Anderson T H.Compendium of soil fungi[M].Eching,Germany:IHW-Verlag,1993:859.
[17]Iwen P,Schutte S D,Florescu D F,et al.InvasiveScopulariopsis brevicaulisinfection in an immunocompromised patient and review of prior cases caused byScopulariopsisandMicroascusspecies[J].Medical Mycology,2012,50(6):561-569.
[18]Sandoval-Denis M,Sutton D A,Fothergill A W,et al.Scopulariopsis,a poorly known opportunistic fungus:Spectrum of species in clinical samples andin vitroresponses to antifungal drugs[J].Journal of Clinical Microbiology,2013,51(12):3937-3943.
[19]Yadeta K A,Thomma B P H J.The xylem as battleground for plant hosts and vascular wilt pathogens[J/OL].Frontiers in Plant Science,2013,4:97(2013-04-23)[2017-09-20].https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3632776/pdf/fpls-04-00097.DOI:10.3389/fpls.2013.00097.
[20]Mccully M E.Niches for bacterial endophytes in crop plants:A plant biologist’s view[J].Functional Plant Biology,2001,28(9):983-990.
[21]Divon H H,Fluhr R.Nutrition acquisition strategies during fungal infection of plants[J].FEMS Microbiology Letters,2007,266(1):65-74.
[22]Divon H H,Rothan-Denoyes B,Davydov O,et al.Nitrogen-responsive genes are differentially regulated in planta duringFusarium oxysporumf.sp.lycopersiciinfection[J].Molecular Plant Pathology,2005,6(4):459-470.
[23]M bius N,Hertweck C.Fungal phytotoxins as mediators of virulence[J].CurrentOpinioninPlantBiology,2009,12(4):390-398.
[24]Ma L J,Van Der Does H C,Borkovich K A,et al.Comparative genomics reveals mobile pathogenicity chromosomes inFusarium[J].Nature,2010,464(7287):367-373.
[25]H ffner E,Diederichsen E.Belowground defence strategies againstVerticilliumpathogens[M]//Vos C,Kazan K.Belowground defence strategies in plants.Cham Z G,Switzerland:SpringerInternationalPublishing,2016:118-150.DOI:10.1007/978-3-319-42319-7_6.
[26]Eynck C,Koopmann B,Grunewaldt-Stoecker G,et al.Differential interactions ofVerticillium longisporumandV.dahliaewithBrassica napusdetected with molecular and histological techniques[J].European Journal of Plant Pathology,2007,118(3):259-274.
[27]Eynck C,Koopmann B,Karlovsky E,et al.Internal resistance in winter oilseed rape inhibits systemic spread of the vascular pathogenVerticillium longisporum[J].Phytopathology,2009,99(7):802-811.
[28]Bowers J H,Nameth S T,Riedel R M,et al.Infection and colonization of potato roots byVerticillium dahliaeas affected byPratylenchus penetransandP.crenatus[J].Phytopathology,1996,86(6):614-621.
[29]Huisman O.Interrelations of root growth dynamics to epidemiology of root-invading fungi[J].Annual Review of Phytopathology,1982,20(20):303-327.
[30]Reusche M,Truskina J,Thole K,et al.Infections with the vascular pathogensVerticillium longisporumandVerticillium dahliaeinduce distinct disease symptoms and differentially affect drought stress tolerance ofArabidopsis thaliana[J].Environmental and Experimental Botany,2014,108:23-37.
[31]Beckman C H,Vander Molen G E,Mueller W C,et al.Vascular structure and distribution of vascular pathogens in cotton[J].Physiological Plant Pathology,1976,9(1):87-94.
[32]Perry J W,Evert R F.Structure of microsclerotia ofVerticillium dahliaein roots of'Russett Burbank'potatoes[J].Canadian Journal of Botany,1984,62(2):396-401.
[33]Abhishek K,Bernard H,Mikko A,et al.De novo assembly and genome analyses of the marine-derivedScopulariopsis brevicaulisstrain LF580 unravels life-style traits and anticancerous scopularide biosynthetic gene cluster[J/OL].PLoS ONE,2015,10(10):e0140398(2015-10-27)[2017-09-20].https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4624724/pdf/pone.0140398.pdf.DOI:10.1371/journal.pone.0140398.
[34]De Jonge R,Van Esse H P,Maruthachalam K,et al.Tomato immune receptorVe1 recognizes effector of multiple fungal pathogens uncovered by genome and RNA sequencing[J].Proceedings of the National Academy of Science of the United States of America,2012,109(13):5110-5115.
[35]Faino L,Seidl M F,Shi-Kunne X Q,et al.Transposons passively and actively contribute to evolution of the two-speed genome of a fungal pathogen[J].Genome Research,2016,26(8):1091-1100.
[36]Raffaele S,Kamoun S.Genome evolution in filamentous plant pathogens:Why bigger can be better[J].Nature Reviews Microbiology,2012,10(6):417-430.
[37]Liu S Y,Chen J Y,Wang J L,et al.Molecular characterization and functional analysis of a specific secreted protein from highly virulent defoliatingVerticillium dahliae[J].Gene,2013,529(2):307-316.
[38]Liu T L,Song T Q,Zhang X,et al.Unconventionally secreted effectors of two filamentous pathogens target plant salicylatebiosynthesis[J/OL].Nature Communications,2014,5:249-569(2014-08-26)[2017-09-20].https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4348438/pdf/ncomms5686.DOI:10.1038/ncomms5686.
[39]Santhanam P,Thomma B P.Verticillium dahliae Sge1 differentially regulates expression of candidate effector genes[J].Molecular Plant Microbe Interactions,2013,26(2):249-569.
[40]Tran V T,Braus-Stromeyer S A,Kusch H,et al.Verticillium transcription activator of adhesionVta2 suppresses microsclerotia formation and is required for systemic infection of plant roots[J].New Phytology,2014,202(2):565-581.
[41]Tzima A K,Paplomatas E J,Rauyaree P,et al.VdSNF1,the sucrose nonfermenting protein kinase gene ofVerticillium dahliae,is required for virulence and expression of genes involved in cell-wall degradation[J].Molecular Plant Microbe Interactions,2011,24(1):129-142.
[42]Tzima A K,Paplomatas E J,Tsitsigiannis D I,et al.The G protein β subunit controls virulence and multiple growth-and development-related traits inVerticillium dahliae[J].Fungal Genetics and Biology,2012,49(4):271-283.
[43]Deng S,Wang C Y,Zhang X,et al.VdNUC-2,the key regulator of phosphate responsive signaling pathway,is required forVerticillium dahliaeinfection[J/OL].PLoS ONE,2015,10(12):e0145190(2015-09-15)[2017-09-20].https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4682923/pdf/pone.0145190.pdf.DOI:10.1371/journal.pone.0145190.
[44]Klimes,A,Dobinson K F.A hydrophobin gene,VDH1,is involved in microsclerotial development and spore viability in the plant pathogenVerticillium dahliae[J].Fungal Genetics and Biology,2006,43(4):283-294.
[45]Starr J L,Koenning S R,Kirkpatrick T L,et al.The future of nematode management in cotton[J].Journal of Nematology,2007,39(4):283-294.
[46]Koenning S R,Kirkpatrick T L,Starr J L,et al.Plant-parasitic nematodes attacking cotton in the U.S.[J].Plant Disease,2004,88(2):100-113.
[47]Overstreet C,Mcgawley E C,Khalilian A,et al.Site specific nematode management-development and success in cotton production in the United States[J].Journal of Nematology,2014,46(4):309-320.
[48]李克梅,梁智,徐万里,等.新疆棉田寄生线虫的种类[J].西北农业学报,2009,18(2):273-275.Li Kemei,Liang Zhi,Xu Wanli,et al.The species of parasitic nematodes in cotton field of Xinjiang[J].Acta Agriculturae Boreali-Occidentalis Sinica,2009,18(2):273-275.
[49]邓先明,杨永柱,刘光珍.四川省棉田寄生线虫种类及肾形线虫与棉花枯萎病发生关系的研究[J].植物病理学报,1993,23(2):163-167.Deng Xianming,Yang Yongzhu,Liu Gguangzhen.Studies on species of parasitic nematodes in cotton fields and the relationship between reniform nematodes and the incidence of Fusarium wilt in Sichuan[J].Acta Phytopathologica Sinica,1993,23(2):163-167.
[50]王汝贤,杨之为,庞惠玲,等.陕西省棉田主要线虫类群对棉花枯萎病发生影响的研究[J].植物病理学报,1989,19(4):205-209.Wang Ruxian,Yang Zhiwei,Pang Huiling,et al.Studies on the effect of major groups of nematode in the cotton fields of Shaanxi province on Fusarium wilt of cotton[J].Acta Phytopathologica Sinica,1989,19(4):205-209.
[51]风春,李刚,修伟明,等.复合性状转基因棉花对土壤线虫多样性的影响[J].棉花学报,2015,27(3):268-274.Feng Chun,Li Gang,Xiu Weiming,et al.Effects of genetically modified stacked cottons on diversity of soil nematodes[J].Cotton Science,2015,27(3):268-274.
[52]符美英,芮凯,符尚娇,等.海南岛南繁区棉花根结线虫病发生情况调查及综合防治[J].热带农业科学,2015,35(8):69-73.Fu Meiying,Rui Kai,Fu Shangjiao,et al.Survey and comprehensive prevention of root knot nematode disease on cotton in south area of Hainan island[J].Chinese Journal of Tropical A-griculture,2015,35(8):69-73.
[53]还进,戎文治,申屠广仁.棉花根结线虫病病原生物学研究[J].浙江大学学报(农业与生命科学版),1986,12(4):385-391.Huan Jin,Rong Wenzhi,Shentu Guangren.Biological study of cotton disease caused by root-knot nematodes(Meloidogyne incognita)[J].Acta Agriculturae Universitatis Zhejiangensis,1986,12(4):385-391.
[54]马承铸,陈品三.南方根结线虫(Meloidogyne incognita)小种2,3号对棉花的寄生力[J].上海农业学报,1986,2(3):81-88.Ma Chengzhu,Chen Pinsan.The parasitic ability of southern root knot nematodes(Meloidogyne incognita)race 2 and 3 on cotton[J].Acta Agriculture Shanghai,1986,2(3):81-88.
[55]Schnathorst W C,Mathre D E.Host range and differentiation of a severe form ofVerticillium albo-atrumin cotton[J].Phytopathology,1966,56(10):1155-1161.
