花铃期土壤干旱对棉花叶片抗氧化及光合作用的影响
2018-04-09邵德意罗海华陈功刘云涛高欣汤飞宇
邵德意,罗海华,陈功,刘云涛,高欣,汤飞宇
(江西农业大学农学院/作物生理生态与遗传育种教育部重点实验室,南昌330045)
近年来,随着中国棉花生产区域布局的调整,棉花生产中的光温资源配置得到进一步优化[1],但是由于各棉区年内与年际降水分布不均衡,棉花花铃期季节性干旱在我国各大棉区时有发生,严重影响棉花生长发育,导致产量和纤维品质降低[2-3]。光合作用是作物产量形成的基础,棉铃发育的主要养分来自其对位果枝叶光合同化产物。抗氧化代谢及光合作用是表征干旱逆境的重要指标。因此,开展花铃期土壤干旱对棉铃对位果枝叶抗氧化代谢及光合作用的影响具有重要意义。在干旱胁迫条件下,活性氧代谢平衡被打破,导致大量活性氧和自由基积累,进而造成生物膜膜脂过氧化产物丙二醛(malonaldehyde,MDA)的产生,严重影响了植物细胞正常的生理代谢活动[4]。超氧化物歧化酶(Super oxide dismatase,SOD)、过氧化物酶(Peroxidase,POD)、过氧化氢酶(Catalase,CAT)、抗坏血酸过氧化物酶(Ascorbate peroxidase,AP)和谷胱甘肽还原酶(Glutathione reductase,GR)等协同作用共同构成酶促防御系统,能够清除在干旱胁迫下产生的活性氧和自由基,从而维持在较低水平,避免膜伤害[5]。此外,非酶促防御系统的类胡萝卜素、多胺、类黄酮等可为抗自由基伤害提供保护[6-7]。这些抗氧化系统的表达水平因植物种类、干旱程度及持续时间等而表现出上升、下降或无响应[8]。在干旱胁迫下棉花叶片 SOD、POD、GR、AP活力上升[9-12],CAT活力显著降低[9],丙二醛含量增加[9-10]。也有报道认为干旱胁迫对棉花谷胱甘肽代谢仅产生有限的影响,且未使丙二醛含量显著变化,但AP活力增加,因而作者推测在细胞膜损伤前棉花体内抗氧化系统就已经缓解了氧化胁迫[13]。植物亦可以通过渗透调节作用积极积累有机和无机可溶性溶质降低渗透势,提高细胞吸水或保水能力,维持膨压适应干旱胁迫[14]。渗透调节物质主要有可溶性糖、脯氨酸、甜菜碱及无机离子等[15];除了维持渗透势和膨压外,还具有一些次生功能,如在叶片低水势下稳定细胞膜,维持正确的蛋白构象[16],清除活性氧[17],参与调控遭受胁迫的光合组织的代谢[18]。干旱胁迫下棉花叶片脯氨酸含量升高,复水后则下降,且耐旱基因型上升幅度高于敏感基因型[19-20]。干旱胁迫下叶片脯氨酸的含量与棉花生物产量正相关[21]。可溶性蛋白具有调节植物生理代谢和促进植物生长发育的功能,其含量的变化是植物合成和生理代谢能力的重要参考指标。当遭遇干旱等逆境胁迫时,植物体内总蛋白质的合成代谢受到阻碍,蛋白质的合成速率明显下降;与此同时合成一些新蛋白质(即逆境诱导蛋白)[22-23],借以调节细胞渗透势,维持细胞膨压,进而维持细胞生长、气孔开放和光合作用等生理代谢过程的正常进行[24]。
光合作用是作物进行同化物合成的生理代谢过程,对于作物产量和品质的形成具有重要的影响。土壤含水量的高低影响植株叶片光合速率[25]。随着干旱程度的加剧,棉花主茎叶片光合速率明显下降[26]。在干旱胁迫期间,净光合速率(Pn)、蒸腾速率(E)和气孔导度(Gs)等光合特性指标均明显下降,胁迫程度越深其降幅越大[27]。在同一干旱处理下,Pn、E、Gs对干旱胁迫的敏感性存在差异,这些指标受抑制的程度为E>Pn>Gs[27]。综上所述,关于花铃期土壤干旱对棉花的抗氧化系统及光合作用的影响已有报道,但由于干旱处理方法、强度、持续时间及试验材料等不同,研究结果尚存在差异。A001和A705是2个对水分亏缺耐性不同的陆地棉品系,土壤干旱通过抑制敏感基因型A001棉纤维伸长期间液泡转化酶(VIN)和蔗糖合成酶(SuSy)的活性,降低纤维内可溶性糖特别是己糖的含量,导致渗透势上升,膨压下降,最终抑制纤维伸长;但干旱对钝感基因型A705纤维长度的影响不显著[28]。本试验设计为在1个较长的干旱处理持续时间内(开花当天至花后25 d),研究A001和A705在正常供水与土壤干旱胁迫下棉铃对位果枝叶抗氧化系统(POD、脯氨酸、MDA、可溶性蛋白质)和光合特性参数(Pn、E、Gs)的动态变化与基因型差异,旨在为棉花抗(耐)旱品种的选育提供参考。
1 材料与方法
1.1 材料与设计
试验材料系自育的陆地棉品系 A705和A001,其中A001对干旱胁迫反应较敏感,A705对干旱胁迫反应较钝感。试验于2016年在江西省南昌市江西农业大学农业科技园防雨棚中进行,盆栽种植,供试土壤类型为红壤。试验所用盆钵直径50 cm、高45 cm,每盆装土35 kg;所用土壤经自然风干、过筛去杂后装盆,用水沉实。4月中下旬播种,每盆留生长一致的壮苗1株。参照张亚黎等[29]的方法,设2个土壤水分处理:一是常规灌溉 (对照),土壤相对含水量始终保持在70%~75%;二是干旱处理——花铃期重度干旱,在棉花盛花期开花当天至花后25 d,将土壤相对含水量控制在40%~45%,此后将土壤含水量恢复到对照水平直至棉花吐絮成熟。采用烘干称量法[30]监控土壤相对含水量。采用完全随机设计,每个处理种植30盆,重复3次,日常管理按大田高产栽培要求进行。
于棉花花铃期干旱处理开始后挂牌标记中部果枝(第8、第9果枝)当日白花,花后10 d开始取棉铃及其对位果枝叶,以后每隔5 d取样1次,直至花后25 d,共取4次。取下的棉铃对位果枝叶经液氮速冻后保存于-70℃的冰箱中,以备POD活力和MDA、脯氨酸、可溶性蛋白质含量的测定。
1.2 测定内容与方法
POD的提取和酶活力的测定。按鲜物质质量(冷冻)计,1 g对位果枝叶在3 mL的提取液(预冷)中用高速匀浆器匀浆 [50 mmol·L-1Hepes-NaOH, pH 7.5,2 mmol·L-1Na2-EDTA,2.5 mmol·L-1二硫苏糖醇(DL-Dithiothreitol,DDT),10 mmol·L-1MgCl2,0.05% ( 体 积 分 数 )Triton X-100,1%(质量分数)难溶性聚乙烯吡咯烷酮(Polyvinyl pyrrolidone,PVP),冰浴条件下提取 30 min,间隔5 min涡旋混匀1次以保证抽提完全;再转入 15 mL的离心管于低温 4℃、8 000 r·min-1下离心30 min,转移上清液定容至5 mL,即为酶/蛋白提取液。POD酶活力采用愈创木酚比色法[31]进行测定。可溶性蛋白含量采用考马斯亮蓝比色法[23]进行测定。脯氨酸含量的提取和测定。称取0.1 g对位果枝叶(按干物质质量计),加入3%(质量分数)磺基水杨酸5 mL进行研磨,将获得的匀浆液移至离心管并沸水浴提取10 min,冷却后于 4 200 r·min-1离心 10 min,上清液即为脯氨酸提取液。采用酸性茚三酮比色法[31]测定。
MDA的提取和含量测定。称取对位果枝叶0.3 g鲜样剪碎置于研钵中,加入5 mL 10%(质量分数)三氯乙酸和少量石英砂进行研磨,转入离心管中于 4 200 r·min-1离心 10 min, 上清液即为MDA提取液。采用硫代巴比妥酸比色法[31]测定。
光合作用参数的测定。于干旱处理后5 d、14 d、23 d,采用Yaxin-1102便携式光合蒸腾仪在上午9:00―11:00测定主茎倒4叶光合作用参数(Pn、E、Gs),仪器采用开路自动测量方式,每个处理随机选择3株,每株重复测3次。
1.3 数据处理与分析方法
采用SPSS 18.0统计分析软件包的一般线性模型对数据进行方差分析,最小显著差数法分析均值。采用Sigmaplot 10.0作图。
2 结果与分析
2.1 土壤干旱对 A001和A705棉铃对位果枝叶POD酶活力的影响
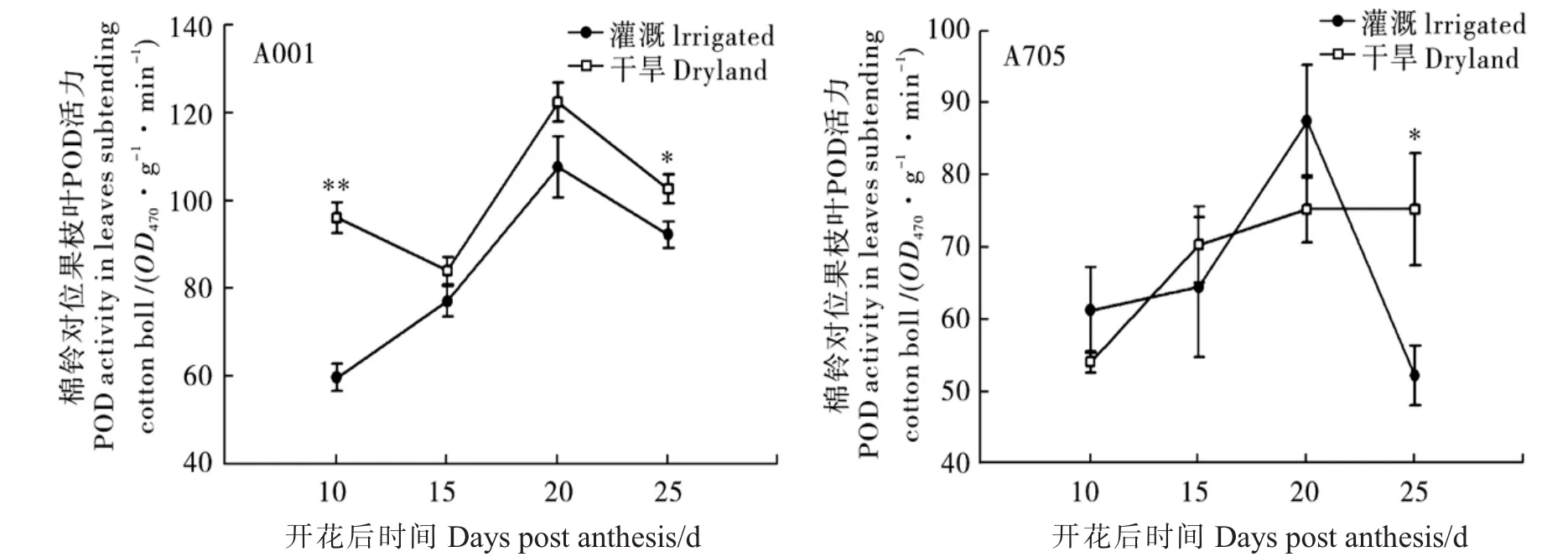
图1 土壤干旱对A001和A705棉铃对位果枝叶(鲜物质质量)POD酶活力的影响Fig.1 Effect of soil drought on peroxidase(POD)activity in leaves subtending cotton bolls of A001 and A705 on a fresh leaf mass basis
由图1可知,A001花后10~25 d棉铃对位果枝叶POD酶活力在干旱处理下均高于对照。其中:开花后10 d达差异极显著水平,增幅为61%;花后25 d达差异显著水平,增幅为11%。A705的POD棉铃对位果枝叶酶活力在干旱处理下呈上升趋势,但在正常灌溉条件下起伏较大;开花后10 d和20 d,正常灌溉的高于干旱处理,但两者差异不显著;花后15 d和25 d,正常灌溉低于干旱处理,其中花后25 d干旱处理POD酶活力显著高于对照,增幅为44%。综上所述,干旱胁迫导致棉铃对位果枝叶POD酶活力升高,A001棉铃对位果枝叶POD酶活力对干旱胁迫的响应在不同铃龄表现一致,而A705不尽一致,即:A001在2个抽样时间点 (花后10 d和25 d)干旱与正常灌溉表现出显著或极显著差异,而A705只在1个抽样时间点(花后25 d)表现出极显著差异。这说明A705对干旱的敏感性较A001弱。在正常灌溉条件下,A705不同铃龄(如正常灌溉花后20 d与25 d)棉铃对位果枝叶POD活力差异大,说明土壤水分不是影响A705棉铃对位果枝叶POD活力的主要因子,而其他的环境因子(温度、光照等)或棉株本身的生理状态可能是主要的影响因素。
2.2 土壤干旱对 A001和A705棉铃对位果枝叶MDA含量的影响
由图2可知,开花后10~25 d A001棉铃对位果枝叶MDA含量在干旱处理下均高于对照,其中花后25 d时达差异极显著水平,增幅为67%。但A705棉铃对位果枝叶MDA对干旱处理的响应在不同取样时期不一致,除花后15 d,其余时期正常灌溉均高于干旱处理,但差异不显著,表明A705应对干旱胁迫抗膜脂过氧化的能力强于A001。此外,A705在正常灌溉下不同取样时期棉铃对位果枝叶MDA含量差异较大 (如花后10 d与15 d),说明其他环境因素,如温度可能是导致其MDA含量变化的主要原因。
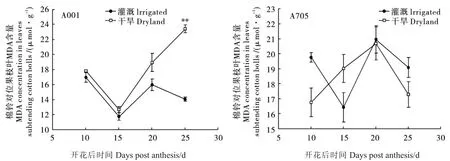
图2 土壤干旱对A001和A705棉铃对位果枝叶(鲜物质质量)MDA含量的影响Fig.2 Effect of soil drought on malondialdehyde(MDA)concentration in leaves subtending cotton bolls of A001 and A705 on a fresh leaf mass basis
2.3 土壤干旱对A001和A705棉铃对位果枝叶可溶性蛋白质含量的影响
由图3可知,花后10~25 d A001棉铃对位果枝叶可溶性蛋白质含量在干旱处理下均低于对照,其中15 d、20 d时达差异显著水平,降幅分别为47%、55%。A705棉铃对位果枝叶可溶性蛋白质含量对干旱胁迫的响应在不同取样时期不一致,花后15 d和20 d棉铃对位果枝叶可溶性蛋白质含量在干旱处理下低于对照,花后10 d、25 d干旱处理高于对照,但各个铃龄干旱处理与对照间的差异均未达显著水平。表明干旱处理对A001棉铃对位果枝叶可溶性蛋白含量的影响程度高于A705。
2.4 土壤干旱对 A001和A705棉铃对位果枝叶脯氨酸含量的影响
由表1可知,花后15 d,A001棉铃对位果枝叶在干旱处理下脯氨酸含量显著高于对照,而在花后20 d则显著低于对照,其余时期无显著差异。干旱处理下,A705棉铃对位果枝叶脯氨酸含量在花后15 d、25 d显著高于对照,而在花后20 d则显著低于对照。表明棉铃对位果枝叶脯氨酸含量对干旱胁迫的响应缺乏规律。
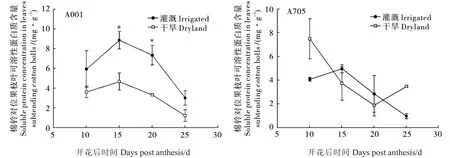
图3 土壤干旱对A001和A705棉铃对位果枝叶(鲜物质质量)可溶性蛋白质含量的影响Fig.3 Effect of soil drought on soluble protein concentration in leaves subtending cotton bolls of A001 and A705 on a fresh leaf mass basis

表1 土壤干旱对不同铃龄棉铃对位果枝叶脯氨酸含量的影响Table 1 Proline concentrations in leaves subtending cotton bolls at different boll stages under two soil moisture regimes mg·g-1
2.5 土壤干旱对 A001和 A705主茎叶光合特性的影响
由图4可知,干旱处理的A001和A705主茎叶净光合速率均较对照大幅下降,其中:A001在花后5 d、14 d、23 d差异达极显著,下降幅度分别为 81%、83%、80%;A705在花后 14 d和 23 d差异达极显著,下降幅度分别为80%、77%。干旱处理下,A001和A705主茎叶蒸腾速率均较对照大幅下降。其中:A001在花后5 d、14 d和23 d差异均达极显著,下降幅度分别为77%、72%、67%;A705在花后5 d、14 d和23 d差异分别达到极显著或显著,下降幅度分别为57%、77%、51%。干旱处理下A001和A705主茎叶气孔导度均较对照大幅下降。其中:A001在花后5 d、14 d和23 d差异均达极显著,下降幅度分别为85%、83%、81%;A705在花后5 d、14 d和23 d差异均达到极显著,下降幅度分别为69%、87%、74%。表明干旱胁迫显著抑制A001和A705的光合作用。
3 讨论
3.1 介导干旱胁迫的生化调节物质对花铃期土壤干旱的响应因基因型而异
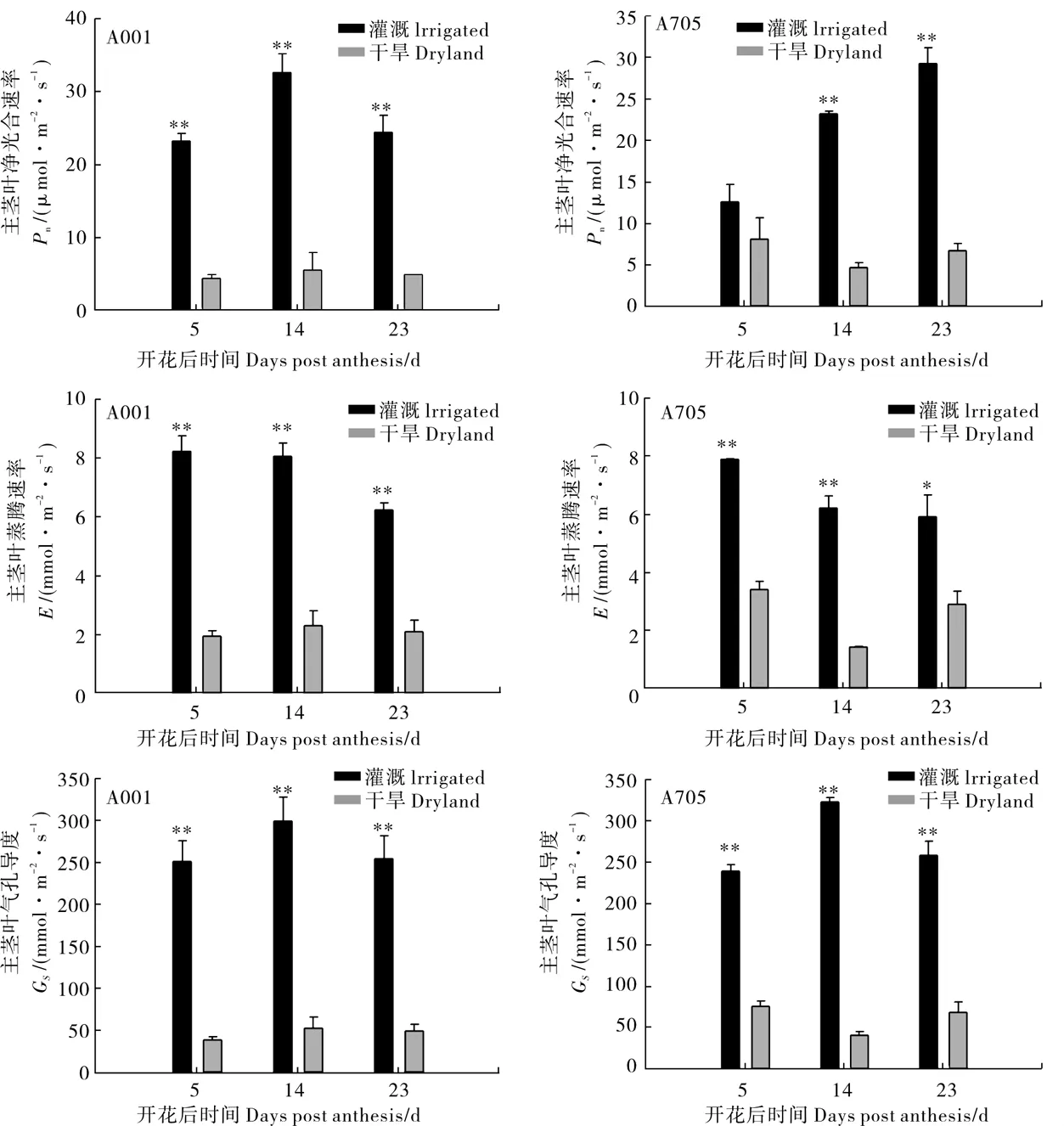
图4 土壤干旱对A001和A705主茎叶净光合速率、蒸腾速率、气孔导度的影响Fig.4 Effect of soil drought on net photosynthetic rate (Pn),transpiration rate (E),stomatal conductance (Gs) in leaves subtending cotton bolls of A001 and A705
干旱胁迫对棉铃对位果枝叶脯氨酸含量的影响因基因型和铃龄而异。通常认为干旱胁迫会诱导叶片脯氨酸含量升高[19-20]。但在本研究中铃龄20 d时2个基因型品种的棉铃对位果枝叶的脯氨酸水平在干旱胁迫下均下降,可能的原因有环境误差、取样误差或叶片类型不同,也可能是脯氨酸对干旱胁迫的响应比较复杂,这有待于进一步深入研究。干旱胁迫下棉铃对位果枝叶可溶性蛋白质含量的变化在不同基因型之间差异较大,干旱敏感基因型A001棉铃对位果枝叶可溶性蛋白质含量持续低于对照,其中铃龄15 d和20 d处理差异显著;干旱钝感基因型A705棉铃对位果枝叶可溶性蛋白质含量对干旱胁迫的响应在不同铃龄均不显著。关于干旱胁迫对棉花叶片可溶性蛋白含量的影响尚存在分歧。Parida等[19]报道干旱胁迫导致棉花叶片可溶性蛋白含量下降,且干旱敏感基因型(Ca/H 631)下降的幅度大于中度耐旱基因型(GM 090304)。Li等[32]报道干旱胁迫导致棉花主茎叶和中部果枝叶可溶性蛋白含量升高,其中铃龄40 d达到显著差异,下部果枝叶可溶性蛋白含量干旱胁迫下低于对照,但未达到显著差异。约一半的叶片可溶性蛋白为核酮糖-1,5-二磷酸羧化酶(RuBP)是同化CO2的关键酶,可溶性蛋白水平的下降主要是因为该酶的损失[33]。Gimenez等[34]认为在水分亏缺胁迫下RuBP的再生能力是光合作用的1个主要因素。本研究中2个基因型在干旱胁迫下光合作用均受到严重抑制,这可能是光合作用的主要限速酶(RuBP)发生了降解所致。但另一方面,干旱胁迫也可能诱导合成一些新的蛋白质,如热休克蛋白(Heat shock protein,HSP)和晚期胚胎丰富蛋白(Late embryogenesis abundant protein,LEA),这 2种蛋白在应对逆境胁迫、维持细胞功能中发挥关键作用[35-36]。土壤干旱对棉铃对位果枝叶生化调节物质(POD酶活力和MDA、可溶性蛋白含量)的影响因基因型而异。A001在不同取样时期对干旱胁迫的响应一致,通常表现为干旱提高了棉铃对位果枝叶POD酶活力和MDA含量,降低了可溶性蛋白含量;而干旱对A705的影响在不同取样时期不一致,且大多数时期与正常灌溉差异不显著,表明A001对土壤干旱敏感,而A705相对不敏感。
3.2 光合作用参数相对其他生化调节物质对花铃期土壤干旱的影响更敏感
在干旱胁迫下,气孔限制和非气孔限制是导致作物光合性能下降的2个主要因素[37]。在干旱胁迫下,叶片萎蔫、气孔导度下降,光合作用的原料CO2供应受阻,从而导致光合速率下降,这属于气孔限制引起;而植物光合磷酸化下降、叶绿体活力降低等因素导致的光合作用能力下降则属非气孔限制[38]。目前,关于干旱胁迫下导致作物光合速率下降的最主要因素是气孔限制还是非气孔限制尚无定论。Chaves等[39]、Flexas等[40]趋向于认为CO2扩散至羧化作用位点的浓度下降是干旱导致光合速率降低的主要因素,即气孔限制占主要地位。通常认为在干旱胁迫初期光合速率的降低主要是因为气孔关闭,导致胞间CO2浓度降低,CO2供应受阻引起光合作用受阻,此时气孔因素是导致光合速率降低的主因。而随着干旱胁迫程度的进一步加剧,造成叶绿体解体、叶绿素含量下降、光合酶活力降低,与光合作用相关的结构性物质受到破坏,光合作用减弱,此时非气孔因素是导致光合速率下降的主因[41-42]。本试验结果表明,在干旱胁迫下,不论是干旱敏感基因型还是钝感基因型,光合作用均受到严重限制,与常规灌溉对照的差异达显著或极显著水平。棉花不同生理生化指标对干旱胁迫的敏感性不同,本研究中干旱对光合作用参数的影响没有表现出基因型的差异,但对POD酶活力、MDA和可溶性蛋白含量的影响因不同基因型而异,表明光合作用参数可能是较好的监测棉花受旱程度的生理指标。
4 结论
花铃期土壤干旱对不同基因型棉铃对位果枝叶抗氧化酶 (POD)活力、膜脂过氧化产物(MDA)等的影响不一致,干旱胁迫导致A001棉铃对位果枝叶POD酶活力、MDA含量上升和可溶性蛋白质含量下降,而在多数取样时期A705棉铃对位果枝叶上述指标在干旱胁迫与常规灌溉之间没有表现出显著差异;但干旱胁迫均显著抑制了2个基因型的光合作用。表明POD、可溶性蛋白和MDA参与了A001和A705棉铃对位果枝叶对土壤干旱胁迫的响应,A705相对于A001对土壤干旱不敏感。上述研究结果可为棉花抗/耐旱品种选育提供参考。
参考文献:
[1]韩会玲,康风君.水分胁迫对棉花生产影响的试验研究[J].农业工程学报,2001,17(3):37-40.Han Huiling,Kang Fengjun.Experiment and study on effect of moisture coerce on cotton producing[J].Transactions of the Chinese Society of Agricultural Engineering,2001,17(3):37-40.
[2]马富裕,李蒙春,杨建荣,等.花铃期不同时段水分亏缺对棉花群体光合速率及水分利用效率影响的研究[J].中国农业科学,2002,35(12):1467-1477.Ma Fuyu,Li Mengchun,Yang Jianrong,et al.A study of effect of water deficit of three period during cotton anthesis on canopy apparent photosynthesis and WUE[J].Scientia Agricultura Sinica,2002,35(12):1467-1477.
[3]Ball R A,Osterhuis D K,Mauromoustakos A.Growth dynamics of the cotton plant during water-deficit stress[J].Agronomy Journal,1994,86:788-795.
[4]王宝山.生物自由基与植物膜伤害[J].植物生理学通讯,1988(2):12-16.Wang Baoshan.Biological free radicals and membrane damage of plants[J].Plant Physiology Communications,1988(2):12-16.
[5]鲍健寅,杨特武,冯蕊华,等.高温和干旱对白三叶生长发育及生理特性的影响[J].草业学报,1995,4(4):9-16.Bao Jianyin,Yang Tewu,Feng Ruihua,et al.The effects of high temperature and drought on the growth and development and physiological characteristics ofTrifolium repens[J].Acta Prata-culturae Sinica,1995,4(4):9-16.
[6]Bouchereau A,Aziz A,Larher F,et al.Polyamines and environmental challenges:Recent development[J].Plant Science,1999,140:103-125.
[7]Gaspar T,Franck T,Bisbis B,et al.Concepts in plant stress physiology:Application to plant tissue cultures[J].Plant Growth Regulation,2002,37:263-285.
[8]Reddy A R,Chaitanya K V,Vivekanandan M.Drought-induced responses of photosynthesis and antioxidant metabolism in higher plants[J].Journal of Plant Physiology,2004,161:1189-1202.
[9]刘瑞显,郭文琦,陈兵林,等.氮素对花铃期干旱及复水后棉花叶片保护酶活性和内源激素含量的影响[J].作物学报,2008,34(9):1598-1607.Liu Ruixian,GuoWenqi,Chen Binglin,et al.Effects of nitrogen on the antioxidant enzyme activities and endogenous hormone contents of cotton leaf under drought stress and after soil re-watering during the flowering and boll-forming stage[J].Acta Agronomica Sinica,2008,34(9):1598-1607.
[10]刘灵娣,李存东,孙红春,等.干旱对不同铃重基因型棉花叶片细胞膜伤害、保护酶活性及产量的影响[J].棉花学报,2009,21(4):296-301.Liu Lingdi,Li Cundong,Sun Hongchun,et al.Effects of drought on cell membrane damage,activities of protective enzymes and yield of different boll-weight genotypes in cotton[J].Cotton Science,2009,21(4):296-301.
[11]Deeba F,Pandey A K,Ranjan S,et al.Physiological and proteomic responses of cotton(Gossypium herbaceumL.)to drought stress[J].Plant Physiology and Biochemistry,2012,53:6-18.
[12]Ratnayaka H H,Molin W T,Sterling T M.Physiological and antioxidant responses of cotton and spurred anoda under interference and mild drought[J].Journal of Experimental Botany,2003,54:2293-2305.
[13]Mahan J R,Wanjura D F.Seasonal patterns of glutathione and ascorbate metabolism in field-grown cotton under water stress[J].Crop Science,2005,45:193-201.
[14]张士功,刘国栋,刘更另.植物营养与作物抗旱性[J].植物学通报,2001,18(1):64-69.Zhang Shigong,Liu Guodong,Liu Gengling.Plant nutrition and drought resistance of crops[J].Chinese Bulletin of Botany,2001,18(1):64-69.
[15]张福锁.环境胁迫与植物营养[M].北京:中国农业大学出版社,1993.Zhang Fusuo.Environmental stress and plant nutrition[M].Beijing:China Agricultural University Press,1993.
[16]Papageorgiou G G,Murata N.The unusually strong stabilizing effects on glycine betaine on the structure and function in the oxygen evolving photosystem II complex[J].Photosynthesis Research,1995,44:243-252.
[17]Pinheiro C,Chaves M M,Ricardo C P.Alterations in carbon and nitrogen metabolism induced by water deficit in the stem and leaves ofLupinus albusL.[J].Journal of Experimental Botany,2001,52:1063-1070.
[18]Lawlor M M,Cornic G.Photosynthetic carbon assimilation and associated metabolism in relation to water deficits in higher plants[J].Plant Cell Environment,2001,25:275-294.
[19]Parida A K,Dagaonkar V S,Phalak M S,et al.Alterations in photosynthetic pigments,protein and osmotic components in cotton genotypes subjected to short-term drought stress followed by recovery[J].Plant Biotechnology Report,2007,1:37-48.
[20]Parida A K,Dagaonkar V S,Phalak M S,et al.Differential responses of the enzymes involved in proline biosynthesis and degradation in drought tolerant and sensitive cotton genotypes during drought stress and recovery[J].Acta Physiologia Plantarum,2008,30:619-627.
[21]Singh D,Sahay R K.Proline accumulation in relation to yield reduction and biomass recovery under stress conditions in cotton[J].Indian Journal of Agricultural Science,1990,60(11):739-741.
[22]朱维琴,吴良欢,陶勤南.干旱逆境对不同品种水稻生长、渗透调节物质含量及保护酶活性的影响[J].科技通报,2006,22(2):176-181.Zhu Weiqin,Wu Lianghuan,Tao Qinnan.Growth and physiological adaption of different rice(Oryza sativaL.)varieties in response to drought stress[J].Bulletin of Science and Technology,2006,22(2):176-181.
[23]肖强,高建明,罗立廷,等.干旱胁迫对空心莲子草抗氧化酶活性和组织学的影响[J].生物技术通讯,2006,17(4):556-559.Xiao Qiang,Gao Jianming,Luo Liting,et al.Effects of drought stress on the activities of anti-oxidant enzymes and histology inAlternanthera philoxeroides[J].Letters in Biotechnology,2006,17(4):556-559.
[24]张中华,杨建平,陈圣栋,等.低温胁迫对韭菜膜透性及保护酶活性的影响[J].西北农业学报,2006,15(2):124-127.Zhang Zhonghua,Yang Jianping,Chen Shengdong,et al.Effect of low temperature stress on protective enzyme activity and membrane permeability in Chinese chives[J].Acta Agriculturae Boreali-Occidentalis Sinica,2006,15(2):124-127.
[25]Blum A,Mayer J,Golan G.Agronomic and physiological assessments of genotypic variation for drought resistance in sorghum[J].Agriculture Research,1989,40:49-61.
[26]艾克拜尔·伊垃洪,周抑强,华天懋.土壤水分对不同品种棉花叶绿素含量及光合速率的影响[J].中国棉花,2000,27(2):21-22.Akbar Yinahong,Zhou Yiqiang,Hua Tianmao.Effects of soil water content on chlorophyll content and photosynthetic rate of different varieties of cotton[J].China Cotton,2000,27(2):21-22.
[27]张寄阳,刘祖贵,段爱旺,等.棉花对水分胁迫及复水的生理生态响应[J].棉花学报,2006,18(6):398-399.Zhang Jiyang,Liu Zugui,Duan Aiwang,et al.Ecophysiological responses of cotton to water stress and recovery[J].Cotton Science,2006,18(6):398-399.
[28]Tang F Y,Zhu J M,Wang T,et al.Water deficit effects on carbon metabolism in cotton fibers during fiber elongation phase[J].Acta Physiologiae Plantarum,2017,39(3):1-9.
[29]张亚黎,罗宏海,张旺锋,等.土壤水分亏缺对陆地棉花铃期叶片光化学活性和激发能耗散的影响[J].植物生态学报,2008,32(3):681-689.Zhang Yali,Luo Honghai,Zhang Wangfeng,et al.Effects of water deficit on photochemical activity and excitation energy dissipation of photosynthetic apparatus in cotton leaves during flowering and boll-setting stages[J].Journal of Plant Ecology,2008,32(3):681-689.
[30]赵增煜.常用农业科学试验法[M].北京:农业出版社,1986.Zhao Zengyu.Commonly used agricultural scientific experimental methods[M].Beijing:Agricultural Press,1986.
[31]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,1999.Li Hesheng.Principles and techniques of plant physiology and biochemistry experiments[M].Beijing:Higher Education Press,1999.
[32]Li Dongxiao,Li Cundong,Sun Hongchun,et al.Effects of drought on soluble protein content and protective enzyme system in cotton leaves[J].Frontiers of Agriculture in China,2010,4(1):56-62.
[33]Pettigrew W T,McCarty J C,Vaughn K C.Leaf senescence-like characteristics contribute to cotton’s premature photosynthetic decline[J].Photosynthesis Research,2000,65:187-195.
[34]Gimenez C,Mitchell V J,Lawlor D W.Regulation of photosynthetic rate of two sunflower hybrids under water stress[J].Plant Physiology,1992,98:516-524.
[35]Ingram J,Bartels D.The molecular basis of dehydration tolerance in plants[J].Annual Review of Plant Physiology and Plant Molecular Biology,1996,47:377-403.
[36]Zhu J,Hasegawa P M,Bressan R A.Molecular aspects of osmotic stress in plants[J].Critical Reviews in Plant Sciences,1997,16:253-277.
[37]Schreiber U,Schliwa U,Bilger W,et al.Continuous recording of photochemical and non-photochemical chlorophyll fluorescence quenching with a new type of modulation fluorometer[J].Photosynthesis Research,1986,10:51-62.
[38]Ramanjulu S,Sreenivasalu N,Kumar G.Photosynthetic characteristics in mulberry during water stress and rewatering[J].Photosynthetica,1998,35(2):259-263.
[39]Chaves M M,Oliveira M M.Mechanisms underlying plant resilience to water deficits:Prospects for water-saving agriculture[J].Journal of Experimental Botany,2004,55:365-384.
[40]Flexas J,Bota J,Loreto F,et al.Diffusive and metabolic limitations to photosynthesis under drought and salinity in C3plants[J].Plant Biology,2004,6:269-279.
[41]Ennahli S,Earl H J.Physiological limitations to photosynthetic carbon assimilation in cotton under water stress[J].Crop Science,2005,45:2374-2380.
[42]Loka D A,Oosterhuis D M,Ritchie G L.Water deficit stress in cotton[M]//Oosterhuis D M.Stress physiology in cotton.Cordova,Tennessee:The Cotton Foundation,2011.
