黄萎病胁迫影响棉花幼苗光合及叶绿素荧光特性的机理
2018-04-09张希鹤李岩郁凯霍钰阳王友华陈兵林
张希鹤 ,李岩 ,郁凯 ,霍钰阳 ,王友华 ,2,陈兵林 ,2*
(1.南京农业大学/农业部作物生理生态与生产管理重点实验室,南京210095;2.江苏省现代作物生产协同创新中心,南京210095)
黄萎病是1种植物土传维管束病害,具有分布广、危害重、存活时间长、传染性强等特点,是我国乃至世界棉花生产上最主要的病害之一。近年来黄萎病有逐年扩增趋势,严重影响了棉花的产量、品质,对我国棉花生产构成了严重威胁,到目前为止尚无根治黄萎病的方法[1]。叶片是黄萎病症状的主要表现部位,快速准确地监测黄萎病胁迫下棉花叶片光合特性的变化,对棉花黄萎病抗性鉴定和防治工作具有重要的指导意义。
目前棉花黄萎病的研究已经深入到分子和基因水平,并已取得了长足进步[2],但对光合荧光等基础生理的研究却相对不足且不成体系。黄萎病菌侵染棉株易造成导管堵塞[3],病菌分泌的毒素造成叶绿素合成受阻、光合系统受损、细胞膜损伤,导致棉花叶面积减小,叶绿素含量、净光合速率、气孔导度、蒸腾速率降低[4-5]。随着黄萎病逐渐加重,叶绿素荧光参数初始荧光(F0)逐渐增大,可变荧光(Fv)、最大荧光(Fm)、潜在最大光化学效率(Fv/Fm)等逐渐降低,光合电子传递受到抑制,光合结构受损[6]。叶绿素荧光与光合作用过程紧密相关,任何逆境对光合作用的影响都可以通过叶绿素荧光参数的变化反映出来[7]。系统分析光合气体交换参数和叶绿素荧光参数,有利于准确认知黄萎病对棉花光合作用的抑制机理。
目前多是基于大田环境研究黄萎病对棉花气体交换参数[5]、叶绿素荧光参数[6]等单一指标的影响,并没有对光合荧光特性的综合分析。对室内苗期接种黄萎病菌条件下棉叶光合特性的研究与黄萎病胁迫对棉花光响应曲线和CO2响应曲线特征参数的影响更是鲜有报道。棉花苗期对黄萎病的抗性与大田鉴定结果具有较好的一致性[8-9],在室内接种黄萎病菌条件下研究黄萎病对棉花幼苗光合及荧光特性的影响,有助于揭示黄萎病影响棉花光合作用的生理机制。因此,本研究拟通过在室内培养接种黄萎病菌后的棉花幼苗,测定棉叶光合和荧光参数的变化,结合叶绿素荧光成像技术,揭示黄萎病菌的致病机理和棉花的抗病机制,为棉花黄萎病抗性鉴定及制定黄萎病防治技术提供理论依据。
1 材料与方法
1.1 棉花幼苗培养及黄萎病菌接种
1.1.1试验条件与材料。试验在人工气候箱(RDN-1000D-4,宁波东南仪器有限公司生产)中进行,全程相对湿度为80%。光照阶段:温度为25℃,光照时间为14 h,光照度为20 000 lx;黑暗阶段:温度为18℃,黑暗时间为10 h。供试品种为中植棉2号(ZZM-2,抗黄萎病品种)和冀棉11号(JM-11,感黄萎病品种)[10]。黄萎病菌菌种为大丽轮枝菌强致病力菌种V08DF1(由江苏省农业科学院植物保护研究所提供)。
1.1.2棉花幼苗培养。挑选无破损饱满的光子,用70%(体积分数)的酒精浸泡5 min,5%(体积分数)的 H2O2浸泡2 h,无菌水冲洗 2~3次,再用无菌水浸种10 h后,平铺在湿润的纱布上。棉种露白后,挑选根长、种子大小基本一致的种子,播种在育苗杯 (长×宽×高=8 cm×8 cm×15 cm)中,每杯4粒,每品种40杯。育苗基质为已高压灭菌的蛭石。子叶平展时定苗,每杯留1棵长势基本一致的幼苗。培养液为Hoagland’s营养液,每周更换1次。
1.1.3黄萎病菌接种。棉苗2叶1心时,用医用注射器吸取孢子浓度为1×107mL-1的黄萎病菌液20 mL注入棉苗根际蛭石基质中,共接种20杯。以注射20 mL无菌水作为对照(20杯)。黄萎病菌孢子悬浮液的制备参考王省芬等[11]的方法。
1.2 测定内容与方法
1.2.1光合特性的测定。接种后第2天,JM-11叶片开始出现病斑,第6天,发病率达60%。因此,接种后第6天,采用Li-6400XT型便携式光合仪(美国LI-COR公司生产)测量棉花主茎倒1叶的光合特性,测定前先进行20 min光适应,每处理重复3次,取其平均值。
常规光合参数测定:使用LED 2×3型红蓝光源叶室,闭合式气路,叶室温度设为24℃,CO2浓度设为 400 μmol·mol-1, 光照度设为 1 400 μmol·m-2·s-1。
光响应曲线参数测定:光照度梯度为1 600、1 400、1 200、1 000、800、600、400、200、150、100、75、50、25、0 μmol·m-2·s-1。
CO2响应曲线参数测定:CO2浓度梯度为400、300、200、100、50、400、400、600、800、1 000、1 200、1 500 μmol·mol-1(参照 Li-6400XT 型便携式光合仪的说明书设定)。
1.2.2叶绿素荧光参数的测定。采用叶绿素荧光快速成像系统Chlorophyll fluorescence imager(英国Technologica公司生产)进行叶绿素荧光参数的测定。
1.2.3其他测定内容和方法。用3005型植物水势压力室 (美国Soilmoisture Equipment公司生产),于12:00―13:00测定棉花倒1叶的水势。用LI-3100C型叶面积仪 (美国LI-COR公司生产)测定单株叶面积。参照李合生[12]的方法,测定棉花倒1叶的光合色素含量。
1.3 数据处理
气孔限制值 (Ls)=1-Ci/C0. 其中:Ci为胞间CO2浓度,C0为空气CO2浓度,闭合气路下取C0=400 μmol·mol-1。
应用Microsoft Excel 2010进行数据处理,采用SPSS 20.0软件的最小显著差数法 (Least significant difference,LSD法)进行统计分析;光、CO2响应曲线应用Photosynthesis work bench程序进行拟合[13]。
2 结果与分析
2.1 黄萎病胁迫对棉花幼苗叶面积和叶水势的影响
未接黄萎病菌的棉株(简称“健株”)和接黄萎病菌的棉株(简称“病株”),其叶面积在品种间差异较大 (图1)。ZZM-2病株单株叶面积为161.1 cm2,比健株低0.93%,差异不显著。JM-11病株单株叶面积为126.9 cm2,比健株低20.74%,差异显著(P<0.05),说明黄萎病对JM-11叶面积的影响较大。
黄萎病胁迫下,2个品种棉花叶水势皆有所下降,降幅因品种抗病性而异(图2):ZZM-2抗病性较强,叶水势下降26.84%,病株与健株间差异不显著;而JM-11抗病性较差,叶水势下降50.01%,病株与健株间差异达显著水平(P<0.05)。

图1 黄萎病胁迫对不同抗性棉花品种单株叶面积的影响Fig.1 Effect of Verticillium wilt stress on leaf area per plant in two cotton cultivars with different resistance
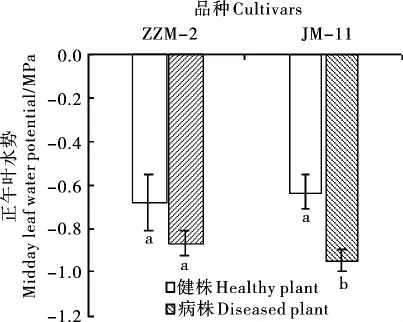
图2 黄萎病胁迫对不同抗性棉花品种正午叶水势的影响Fig.2 Effect of Verticillium wilt stress on midday leaf water potential in two different cotton cultivars with different resistance
2.2 黄萎病胁迫对棉花光合特性的影响
2.2.1黄萎病胁迫对棉花光合色素含量的影响。黄萎病胁迫下,棉花光合色素含量皆有所下降(表1)。ZZM-2病株类胡萝卜素含量下降9.09%,与健株差异达到显著水平(P<0.05);而叶绿素a、叶绿素b、光合色素总量,病株与健株差异均不显著。感病品种JM-11病株叶绿素a、叶绿素b、类胡萝卜素、光合色素总量均显著低于健株(P<0.05)。
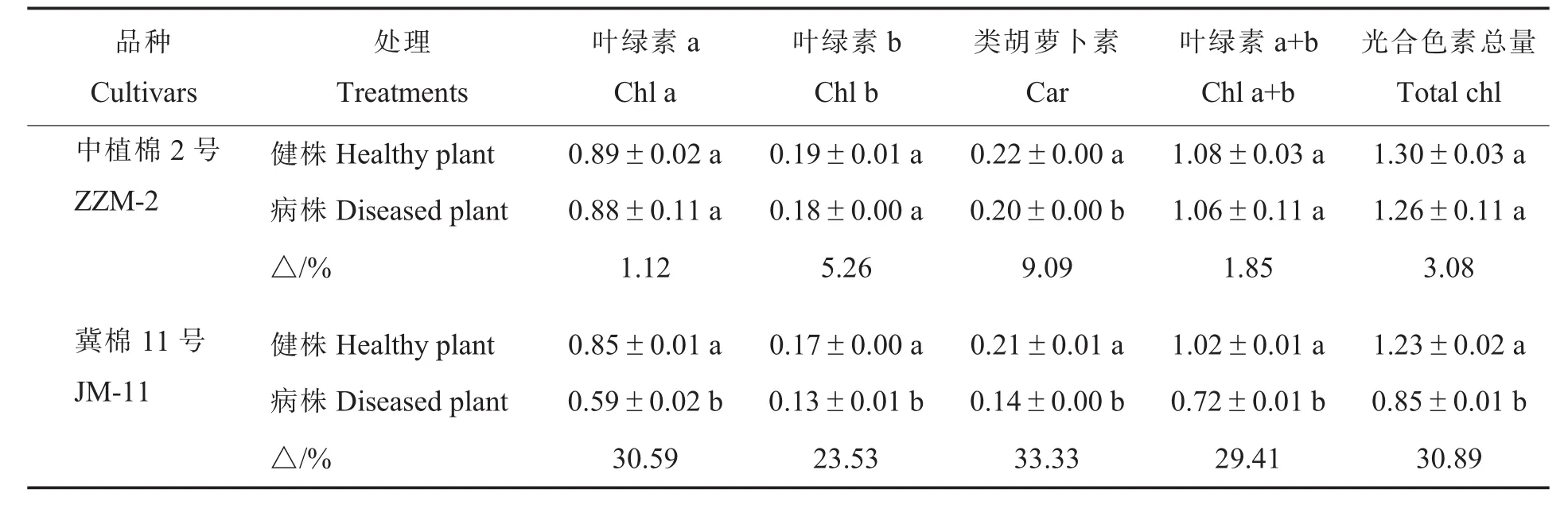
表1 黄萎病胁迫对不同抗性棉花品种光合色素含量的影响Table 1 Effect of Verticillium wilt stress on photosynthetic pigment contents in two cotton cultivars with different resistance mg·g-1
2.2.2黄萎病胁迫对棉叶气体交换参数的影响。黄萎病胁迫下,棉叶净光合速率(Pn)、气孔导度(Gs)、胞间 CO2浓度(Ci)均降低,气孔限制值(Ls)均上升,下降或上升幅度因品种抗病性而异(表2)。抗病品种ZZM-2病株的Pn下降8.55%,与健株差异达显著水平(P<0.05);病株Gs、Ci分别下降 19.23%和 5.31%,Ls上升 12.9%,与健株差异皆未达显著水平。对感病品种JM-11来说,黄萎 病 胁 迫 下 ,Pn、Gs、Ci下 降 53.65% 、62.50% 和17.88%,Ls上升28.21%,与健株差异皆达显著水平(P<0.05)。从各参数变化来看,JM-11的受胁迫程度要明显大于ZZM-2。
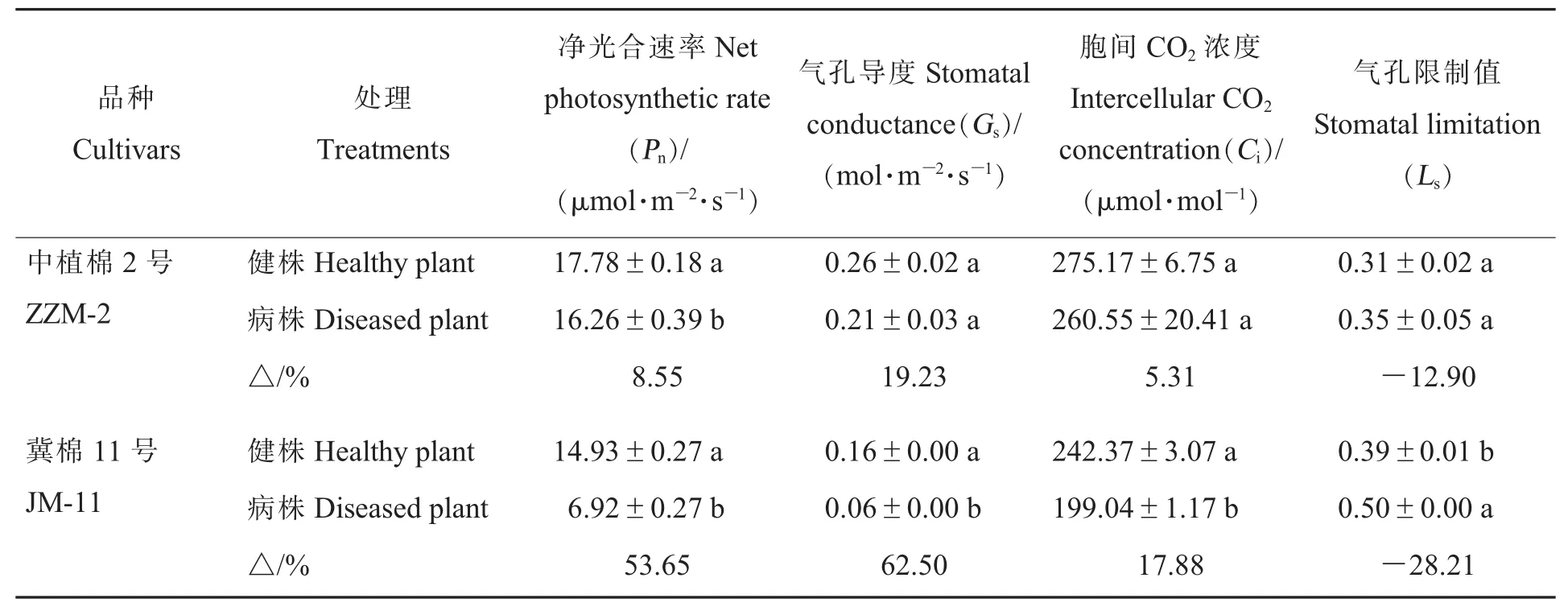
表2 黄萎病胁迫对不同抗性棉花品种气体交换参数的影响Table 2 Effect of Verticillium wilt stress on gas exchange parameters in two cotton cultivars with different resistance
2.2.3黄萎病胁迫对棉花光响应曲线特征参数的影响。黄萎病胁迫下,ZZM-2的光饱和点(Light saturation point,LSP)、 表观量子效率(Ap parent quantum yield,AQY)和最大净光合速率(Pn(max))均呈增加趋势,光补偿点(Light compensation point,LCP)和暗呼吸速率 (Dark respiration speed,RD)呈降低趋势(表 3)。与健株相比,ZZM-2病株 LSP和Pn(max)分别增大 1.24%和9.44%,LCP降低49.95%,差异均达到显著水平(P<0.05);病株 AQY 增加 20%,RD降低 41.84%,差异均不显著。与健株相比,JM-11病株的LCP增加98.39%,RD增加 41.10%,LSP、AQY和Pn(max)分别降低41.13%、40.00%和55.75%,病株和健株间各参数差异均达显著水平(P<0.05)。JM-11的健株光响应曲线特征参数中仅AQY与ZZM-2相当,其他参数均低于ZZM-2。
2.2.4黄萎病胁迫对棉花CO2响应曲线特征参数的影响。黄萎病胁迫下,2个品种CO2响应曲线的特征参数均下降,且病株与健株间差异皆达显著水平(表4)。与健株相比,ZZM-2病株的光呼吸速率(RP)降低2.59%,Rubisco限制下的最大羧化速率(Vc(max))降低 13.40%,最大电子传递速率(Jmax)降低 6.28%,磷酸丙糖利用速率(VTPU)降低15.30%。ZZM-2病株各特征参数降幅均小于JM-11,而其健株的各特征参数均大于JM-11。
2.3 黄萎病胁迫对棉花叶绿素荧光参数的影响
光合作用的强弱可以通过叶绿素荧光参数反映出来。单叶叶绿素荧光成像参数表明,与健株相比,ZZM-2病株的潜在最大光化学效率(Fv/Fm)、调节性能量耗散的量子产量(YNPQ)、非调节性能量耗散的量子产量 (YNO)分别增加1.25%、4.17%和10.53%,实际光化学效率(YⅡ)降低12.12%,但差异均不显著,可变荧光(Fv)下降3.69%,差异达到显著水平(表5)。JM-11病株与健株相比,除YNO增加120.83%外,其他参数均降低,且病株和健株间各参数的差异均达到显著水平。ZZM-2各荧光参数的降幅均小于JM-11。
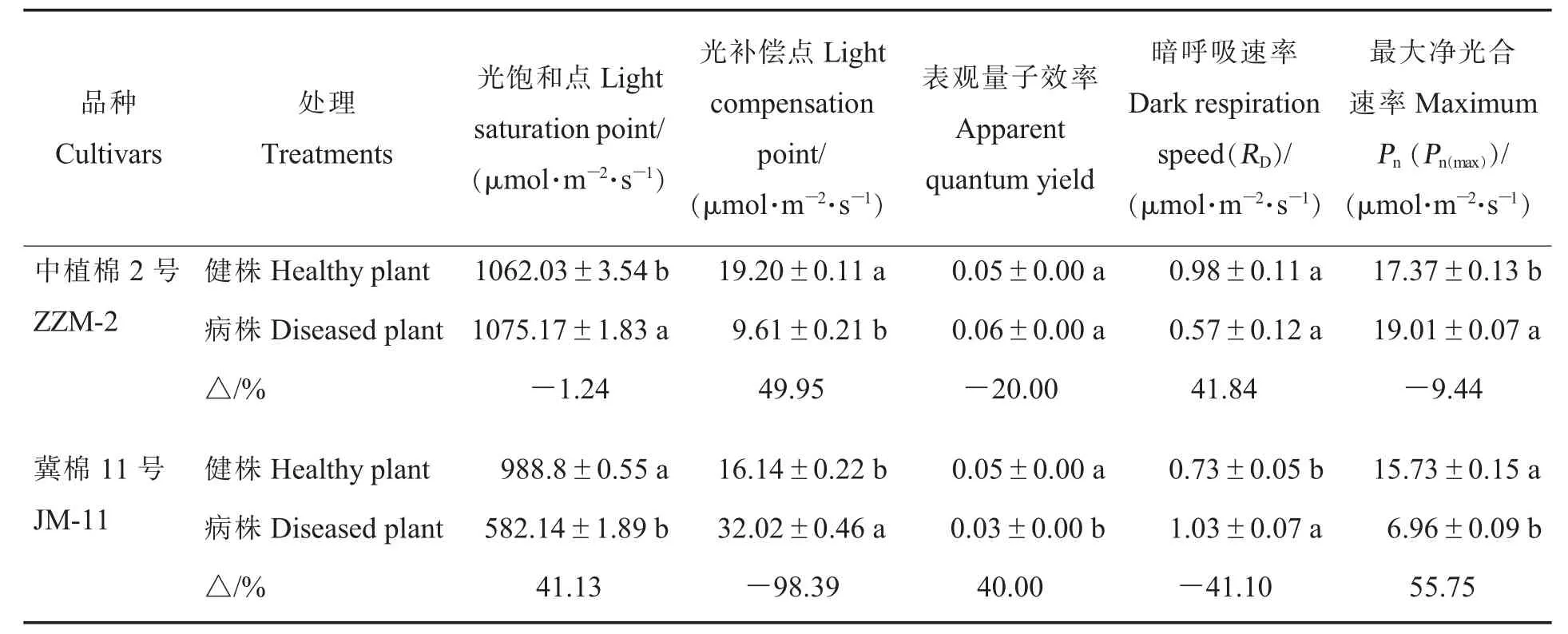
表3 黄萎病胁迫条件下净光合速率对光合有效辐射响应的特征参数Table 3 Characteristic parameters of response of net photosynthetic rate to photosynthetic active radiation under Verticillium wilt stress condition
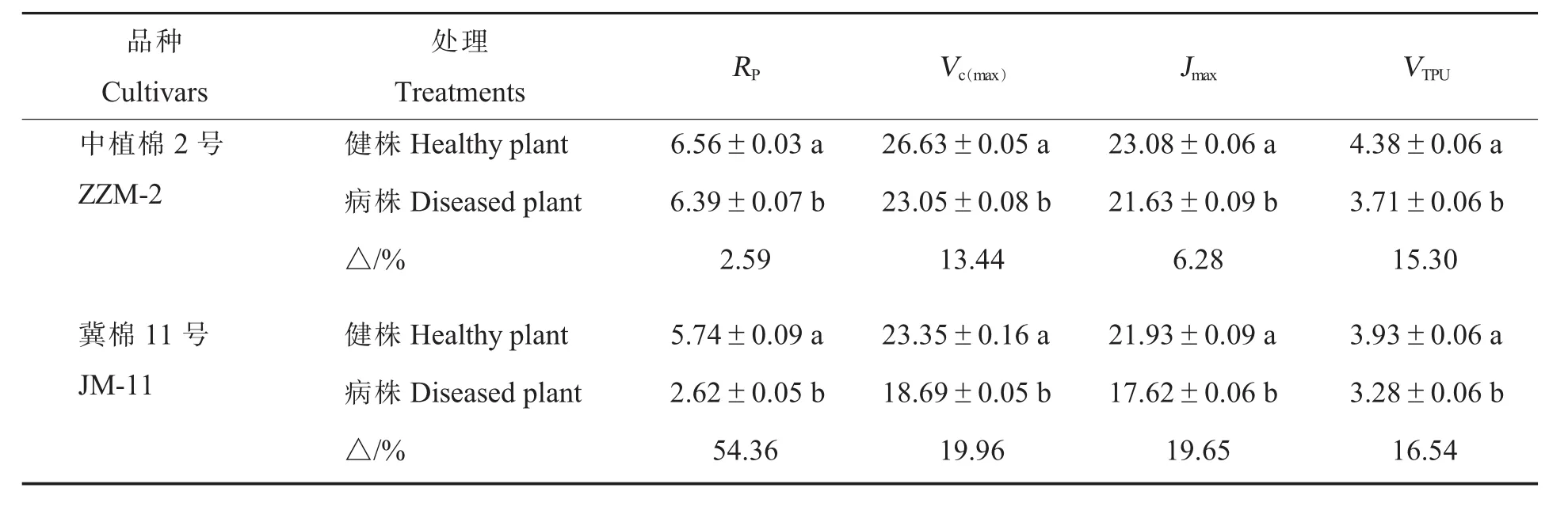
表4 黄萎病胁迫条件下净光合速率对胞间CO2浓度响应的特征参数Table 4 Characteristic parameters of response of net photosynthetic rate to intercellular CO2concentration under Verticillium wilt stress condition μmol·m-2·s-1

表5 黄萎病胁迫对不同抗性棉花品种叶绿素荧光参数的影响Table 5 Effect of Verticillium wilt stress on chlorophyll fluorescence parameters in two cotton cultivars with different resistance
棉花叶绿素荧光成像表明,ZZM-2健株叶片不同部位色差较大(图3),说明叶片不同部位的Fv/Fm存在差异。ZZM-2的病株叶片与健株叶片相比,没有明显的病斑,Fv/Fm变化不大。JM-11病叶具有明显的病斑,病斑部位Fv/Fm显著降低,而非病斑部位Fv/Fm并没有降低。
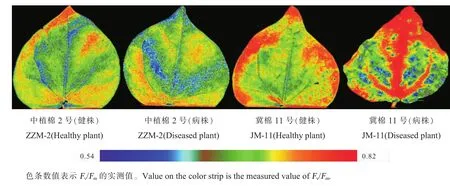
图3 棉花单叶叶绿素荧光成像Fv/Fm值图像对比Fig.3 Picture contrast of value ofFv/Fmbetween healthy plants and diseased plants of cotton
3 讨论
3.1 黄萎病胁迫对棉花叶水势、叶面积及光合色素含量的影响
黄萎病易造成导管堵塞[3-4],棉花叶水势的降低可能与导管堵塞有关。黄萎病胁迫下,ZZM-2叶水势下降26.84%,JM-11下降50.01%,ZZM-2的降幅小于JM-11,说明ZZM-2导管堵塞的程度小于JM-11。前人研究发现,棉花感黄萎病后叶面积减小,叶绿素含量下降,且叶绿素a的降幅大于叶绿素b的降幅[14]。本研究结果表明,黄萎病胁迫下,2个品种单株叶面积、叶绿素a、叶绿素b和类胡萝卜素含量均下降,ZZM-2的降幅小于JM-11;感病品种JM-11叶绿素a的降幅为30.59%,大于叶绿素b的降幅23.53%,但抗病品种ZZM-2叶绿素a的降幅为1.12%,小于叶绿素b的降幅5.26%。这可能与测定时期和品种的抗病性不同有关。类胡萝卜素的降幅要大于叶绿素a和叶绿素b。
3.2 黄萎病胁迫对棉花光合特性的影响
黄萎病胁迫导致棉花Pn、Gs、蒸腾速率同步降低[15],本研究也有相似的结论。刘昭伟等[16]对棉花花铃期土壤持续干旱研究表明,干旱前期Pn下降的主要原因是气孔限制,随着干旱时间的延长,非气孔限制逐渐成为主要原因。综合许大全[17]和 Farquhart等[18]研究结果,判断叶片Pn降低的主要原因是气孔因素还是非气孔因素的2个可靠依据是Ci和Ls的变化方向,Ci降低和Ls升高表明气孔导度降低是主要原因;而Ci增高和Ls降低,则表明主要原因是非气孔因素。本研究表明,2个品种在黄萎病胁迫下均表现为Ci降低和Ls升高,说明气孔限制是导致2个品种Pn降低的主要原因。
前人研究发现,在干旱胁迫下,玉米Pn(max)、AQY、LSP显著降低,LCP明显升高[19]。本研究结果表明,黄萎病胁迫下,ZZM-2 的Pn(max)、AQY 和LSP分别增大 9.44%、20.00%和 1.24%,LCP和RD分别减小49.95%和41.84%,与前人的研究结果不同,说明ZZM-2通过增大利用光能的有效范围和利用效率来减轻病原菌的危害,整体光合能力增强。 而 JM-11 的Pn(max)、AQY 和 LSP 分别下降55.75%、40.00%和41.13%,LCP和RD分别增加98.39%和41.10%,变化趋势与前人的研究结果类似,说明JM-11利用的光能有效范围缩小,光同化能力下降,整体光合能力减弱。植物光合作用的碳同化过程主要受Vc(max)、Jmax和VTPU的限制[20]。前人对黄瓜的研究表明,随着基质水势的降低,Vc(max)、Jmax、VTPU逐渐降低[21]。本研究发现,黄萎病胁迫下,ZZM-2 的Vc(max)、Jmax和VTPU分别降低13.44%、6.28%和 15.30%,JM-11分别降低19.96%、19.65%和16.54%,ZZM-2的降幅均小于JM-11,说明2个品种碳同化过程均受到黄萎病的限制,且ZZM-2受影响的程度小于JM-11。
3.3 黄萎病胁迫对棉花叶绿素荧光特性的影响
叶绿素荧光被称为“光合作用的探针”,相较于反映光合作用“表观性”的气体交换参数更能反映其内在机理[22]。陈兵等[6]研究发现,随黄萎病级的增大,棉花病叶的Fv、Fv/Fm、YⅡ均降低。本研究结果表明,感病品种JM-11病株的Fv、Fv/Fm、YⅡ分别降低78.39%、8.75%和21.43%,与健株差异均达到显著水平(P<0.05),变化趋势与前人研究结果[6]一致,说明JM-11病株的光合器官受到了不可恢复的损伤[23-24];而抗病品种ZZM-2病株除Fv下降显著(P<0.05)外,Fv/Fm、YⅡ变化皆不显著。
光抑制是植物光合作用中非气孔限制的主要形式[25]。ZZM-2病株的YⅡ降低 12.12%,YNPQ和YNO分别增大4.17%和10.53%,与健株差异不显著,JM-11病株的YⅡ和YNPQ降低 21.43%和48.99%,YNO增加120.83%,与健株差异均达到显著水平(P<0.05),说明2个品种病株PSⅡ吸收的光能用于光化学反应的比例均减少,过剩激发能增加[26]。在黄萎病胁迫下,ZZM-2通过调节性和非调节性的光保护机制同时耗能,且各参数变化幅度较小,光合器官并没有受损;JM-11通过调节性光保护机制耗能的比例降低,非调节性光保护机制耗能的比例大幅增加,光合器官受到了极严重的光损伤[16]。前人研究发现,随着黄萎病加重,棉花叶片的Fv/Fm等指标逐渐降低,但由于使用的是普通光纤式叶绿素荧光仪,无法区分病斑部位和非病斑部位的荧光参数[6],因此很难表征整张叶片的荧光特性。本研究采用叶绿素荧光成像系统对整张棉叶的荧光参数分析发现,叶片病斑部位的Fv/Fm值显著降低,而非病斑部位的Fv/Fm值没有降低甚至略有增大的趋势,说明叶片非病斑部位的光合器官并没有受损,甚至其光合能力有增强的趋势,以降低病斑对光合的影响。因此,在黄萎病胁迫下,具有较强的光保护能力和较高的光能利用率,是抗病品种抗性较强的原因之一。
本研究仅测定了棉花幼苗期光合和荧光特性的一些表观参数,下一步将结合棉花碳氮代谢过程,探析黄萎病影响棉花光合和荧光特性的机理。
4 结论
黄萎病胁迫下,棉花叶水势、单株叶面积、光合色素含量以及Pn等皆呈下降趋势,ZZM-2的降幅均小于JM-11;ZZM-2叶绿素a的降幅小于叶绿素b,JM-11则相反;棉苗Pn降低,这主要是由气孔限制引起;ZZM-2的光和CO2响应曲线特征参数分别呈增强、减弱的趋势,JM-11光和CO2响应曲线特征参数均呈减弱趋势;ZZM-2的Fv/Fm、YNPQ和YNO稍增大,YⅡ稍降低,但与健株差异皆不显著,但Fv下降显著,JM-11的Fv、Fv/Fm、YⅡ及YNPQ显著下降,YNO大幅上升。因此,选择光同化能力和碳同化能力较高、抗黄萎病性强的棉花品种,可以减小黄萎病对棉叶光合特性的影响,降低棉花产量和品质的损失。
参考文献:
[1]徐理,朱龙付,张献龙.棉花抗黄萎病机制研究进展[J].作物学报,2012,38(9):1553-1560.Xu Li,Zhu Longfu,Zhang Xianlong.Research on resistance mechanism of cotton to Verticillium wilt[J].Acta Agronomica Sinica,2012,38(9):1553-1560.
[2]陈方圆,杨洋,李波,等.棉花抗黄萎病分子机制研究进展[J].分子植物育种,2016,14(10):2859-2868.Chen Fangyuan,Yang Yang,Li Bo,et al.Research advance on molecular regulation mechanism of Verticillium wilt resistance in cotton[J].Molecular Plant Breeding,2016,14(10):2859-2868.
[3]李正理,李荣敖.棉花黄萎病病叶解剖[J].植物学报(英文版),1980(1):13-18.Li Zhengli,Li Rong’ao.Anatomy of cotton leaf infected withVerticillium[J].Acta Botanica Sinca,1980(1):13-18.
[4]侯丽娟,李卫,刘燕霞,等.棉花黄萎病菌毒素对棉花生化代谢的影响[J].西北农业学报,2010,19(12):63-67.Hou Lijuan,Li Wei,Liu Yanxia,et al.Effect ofV.dahliaetoxin on biochemical metabolism of cotton seedlings[J].Acta Agriculturae Boreali-Occidentalis Sinica,2010,19(12):63-67.
[5]郭海军,董志强,林永增,等.黄萎病对棉花叶片SOD、POD酶活性和光合特性的影响[J].中国农业科学,1995,28(6):40-45.Guo Haijun,Dong Zhiqiang,Lin Yongzeng,et al.Effect of infection of Verticillium wilt on the SOD,POD activities and photosynthetic character in cotton leaves[J].Scientia Agricultura Sinica,1995,28(6):40-45.
[6]陈兵,王克如,李少昆,等.病害胁迫对棉叶光谱反射率和叶绿素荧光特性的影响[J].农业工程学报,2011,27(9):86-93.Chen Bing,Wang Keru,Li Shaokun,et al.The effects of disease stress on spectra reflectance and chlorophyll fluorescence characteristics of cotton leaves[J].Transactions of the Chinese Society of Agricultural Engineering,2011,27(9):86-93.
[7]陈建明,俞晓平,程家安.叶绿素荧光动力学及其在植物抗逆生理研究中的应用[J].浙江农业学报,2006,18(1):51-55.Chen Jianming,Yu Xiaoping,Cheng Jia’an.The application of chlorophyll fluorescence kinetics in the study of physiological responses of plants to environmental stresses[J].Acta Agriculturae Zhejiangensis,2006,18(1):51-55.
[8]马存,简桂良,郑传临.中国棉花抗枯、黄萎病育种50年[J].中国农业科学,2002,35(5):508-513.Ma Cun,Jian Guiliang,Zheng Chuanlin.The advances in cotton breeding resistance to Fusarium and Verticillium wilts in China during past fifty years[J].Scientia Agricultura Sinica,2002,35(5):508-513.
[9]吴家和,张献龙,罗晓丽,等.转几丁质酶和葡聚糖酶基因棉花的获得及其对黄萎病的抗性[J].遗传学报,2004,31(2):183-188.Wu Jiahe,Zhang Xianlong,Luo Xiaoli,et al.Transgenic cotton plants of chitinase and glucanase genes and their performance of resistance toVerticillium dahliea[J].Acta Genetica Sinica,2004,31(2):183-188.
[10]赵丽红,冯自力,李志芳,等.棉花抗黄萎病鉴定与评价标准的商榷[J].棉花学报,2017,29(1):50-58.Zhao Lihong,Feng Zili,Li Zhifang,et al.Development of an improved standard for identifying and evaluating Verticillium wilt resistance in cotton[J].Cotton Science,2017,29(1):50-58.
[11]王省芬,马峙英.一种新的棉花黄萎病抗性鉴定方法[J].棉花学报,2002,14(4):231-233.Wang Xingfen,Ma Zhiying.A new method for identification of cotton Verticillium wilt resistance[J].Cotton Science,2002,14(4):231-233.
[12]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:131-137.Li Hesheng.Principles and techniques of plant physiology and biochemistry experiments[M].Beijing:High Education Press,2000:131-137.
[13]张昌胜,刘国彬,薛萐,等.干旱胁迫和CO2浓度升高条件下白羊草的光合特征[J].应用生态学报,2012,23(11):3009-3015.Zhang Changsheng,Liu Guobin,Xue Sha,et al.Photosynthetic characteristics ofBothriochloa ischaemumunder drought stress and elevated CO2concentration[J].Chinese Journal of Applied Ecology,2012,23(11):3009-3015.
[14]潘学标,邓绍华,崔秀稳.黄萎病对棉花叶片光合效率和棉株生长的影响[J].棉花学报,1994,6(S1):64-68.Pan Xuebiao,Deng Shaohua,Cui Xiuwen.Effects of Verticillium wilt of cotton on leaf photosynthesis efficiency and cotton plant growth[J].Acta Gossypii Sinica,1994,6(S1):64-68.
[15]潘学标,宋晓轩.黄萎病对棉叶二氧化碳与水汽交换的影响[J].中国棉花,1991(3):45-46.Pan Xuebiao,Song Xiaoxuan.Effect of Verticillium wilt on CO2and water vapor exchange in cotton leaves[J].China Cotton,1991(3):45-46.
[16]刘昭伟,张盼,王瑞,等.花铃期土壤持续干旱对棉铃对位叶气体交换参数和叶绿素荧光特性的影响[J].应用生态学报,2014,25(12):3533-3539.Liu Zhaowei,Zhang Pan,Wang Rui,et al.Effects of soil progressive drought during the flowering and boll-forming stage on gas exchange parameters and chlorophyll fluorescence characteristics of the subtending leaf to cotton boll[J].Chinese Journal of Applied Ecology,2014,25(12):3533-3539.
[17]许大全.光合作用气孔限制分析中的一些问题[J].植物生理学报,1997,33(4):241-244.Xu Daquan.Some problems in stomatal limitation analysis of photosynthesis[J].Plant Physiology Communications,1997,33(4):241-244.
[18]Farquhar G D,Sharkey T D.Stomatal conductance and photosynthesis[J].Annual Review of Plant Physiology,1982,33(1):317-345.
[19]吴玮,景元书,马玉平,等.干旱环境下夏玉米各生育时期光响应特征[J].应用气象学报,2013(6):723-730.Wu Wei,Jing Yuanshu,Ma Yuping,et al.Light response characteristics of summer maize at different growth stages under drought[J].Journal of Applied Meteorological Science,2013(6):723-730.
[20]Watling J R,Press M C,Quick W P.Elevated CO2induces biochemical and ultrastructural changes in leaves of the C4cereal sorghum[J].Plant Physiology,2000,123(3):1143-1152.
[21]林琭,汤昀,张纪涛,等.不同水势对黄瓜花后叶片气体交换及叶绿素荧光参数的影响[J].应用生态学报,2015,26(7):2030-2040.Lin Lu,Tang Yun,Zhang Jitao,et al.Effects of different water potentials on leaf gas exchange and chlorophyll fluorescence parameters of cucumber during post-flowering growth stage[J].Chinese Journal of Applied Ecology,2015,26(7):2030-2040.
[22]Krause G H,Weis E.Chlorophyll fluorescence and photosynthesis:Thebasics[J].AnnualReviewofPlantPhysiology,1991,42:313-349.
[23]Sharma P K,Hall D O.Interaction of salt stress and photoinhibition on photosynthesis in barley and sorghum[J].Journal of Plant Physiology,1991,138(5):614-619.
[24]Xu Changcheng,Li Dequan,Zou Qi,et al.Effect of drought on chlorophyll fluorescence and xanthophyll cycle components in winter wheat leaves with different ages[J].Acta Photophysiologica Sinica,1999,25(1):29-37.
[25]Murata N,Takahashi S,Nishiyama Y,et al.Photoinhibition of photosystem II under environmental stress[J].Biochimica et Biophysica Acta,2007,1767(6):414-421.
[26]刘建新,王金成,王鑫,等.外源NO对NaHCO3胁迫下黑麦草幼苗光合生理响应的调节[J].生态学报,2012,32(11):3460-3466.Liu Jianxin,Wang Jincheng,Wang Xin,et al.Regulation of exogenous nitric oxide on photosynthetic physiological response ofLolium perenneseedlings under NaHCO3stress[J].Acta Ecologica Sinica,2012,32(11):3460-3466.
