ClC-3、BK型离子通道与胶质瘤的侵袭性生长关系
2018-04-04卢培刚董元李博王奎重郝振强仇冠中曹敬正
卢培刚 董元 李博 王奎重 郝振强 仇冠中 曹敬正
近年来,离子通道在胶质瘤基础生物学中的作用日益受到关注[1]。ClC-3属于电压门控氯通道家族(votage-gated chloride channels,ClCs),是容积敏感性外向整流性氯通道的主要成员,参与介导细胞氯离子外流,在胶质瘤细胞侵袭性生长过程中发挥重要作用[2-3]。BK通道又称大电导钙激活钾通道或KCa1.1通道,受细胞内Ca2+浓度以及细胞去极化的双重调控,对细胞内Ca2+浓度变化尤为敏感,参与包括胶质瘤细胞在内的多种细胞的行为学改变[4]。本研究旨在进一步验证ClC-3以及BK通道在胶质瘤动物模型中的表达情况,并探讨其在胶质瘤细胞侵袭性生长过程中的重要作用,以期获得直接的动物实验证据。
材料与方法
一、实验动物
健康雄性成年Wistar大鼠(6周,体质量约180 g)70只,购于山东大学实验动物中心,动物合格证编号 SCXK(鲁)2013-0009。
二、主要试剂及用品
C6大鼠胶质瘤细胞株(中国科学院上海细胞库);HPIAS-1000高清晰病理图文分析系统(OLYMPUS公司,日本);动物立体定向仪(上海江湾Ⅱ型);ClC-3特异性阻断剂 Chlorotoxin(CLTX,AnaSpec公司,美国),BK特异性阻断剂Iberiotoxin(IBTX,Alomone Labs公司, 以色列);10%胎牛血清(Gibco公司,美国);一抗:ClC-3兔多克隆抗体1∶300,BK 兔单克隆抗体 1∶100。
三、实验方法
1.实验动物及分组:将70只Wistar大鼠随机分为5组。A组:实验组20只,常规制备荷瘤动物模型,5只用于肿瘤大体病理变化观察,另外15只用于免疫组织化学观察ClC-3以及BK通道在C6胶质瘤细胞系中的表达情况,并计算成瘤体积作为阳性对照;B组:荷瘤模型组15只,在移植肿瘤细胞同时加入ClC-3特异性阻断剂CLTX;C组:荷瘤模型组15只,在移植肿瘤细胞同时加入BK特异性阻断剂IBTX;D组:假手术组15只,手术时使用DMEM替代肿瘤细胞液注入成瘤区作为阴性对照;E组:空白对照组5只,常规饲养,不做任何处理,用于正常脑组织的免疫组织化学检测。
2.荷瘤动物模型制备:C6大鼠胶质瘤细胞株培养后,消化收集生长状态良好的细胞,离心(78 g,5 min)弃上清,PBS缓冲液重悬;计数板计算细胞密度,调整细胞密度为5×107/mL;10%水合氯醛(4 mL/kg)腹腔注射麻醉Wistar大鼠,将实验动物固定于大鼠脑立体定向仪,根据大鼠头部立体定向解剖图谱确定对应于右侧尾状核的钻孔位置:向右旁开3.0mm,冠状缝前0.5 mm。切开头皮,钻头打磨颅骨,微量注射器刺穿硬脑膜。微量注射器抽取C6细胞悬液10 μL(5×105细胞),深6 mm回退1 mm处注射,注射完毕后针头静置10 min后缓慢拔出,骨蜡封闭骨孔,缝合头皮,术毕清洁级常规饲养。B和C组在注射的C6细胞悬液中分别加入50 pmol ClC-3特异性阻断剂ClTX及BK特异性阻断剂IBTX。
3.标本处理:A、B、C 组于接种后 7、14、21 d 随机选取5只实验动物断头处死,取出全脑,分别观察各组动物胶质瘤细胞的病理形态结构特点及侵袭性生长的变化情况,同时检测ClC-3、BK型离子通道在各组模型动物中的表达分布情况;假手术D组亦于术后7、14、21 d随机选取5只动物处死。
4.观察与检测:(1)接种后动物处理及一般情况观察:大鼠接种后置笼自然苏醒,常规饲养,连续7 d皮下注射青霉素;每天观察动物的进食、饮水、运动及精神等状态,测量体质量1次/2 d,记录死亡时间;(2)组织病理学检查:大鼠用10%水合氯醛麻醉后,经左心室快速灌注0.9%NaCl,再灌注4℃的4%多聚甲醛。取出全脑后,按大鼠脑表面的接种穿刺点为中心做冠状切口,观察肿瘤生长情况。取出后置于4%多聚甲醛在4℃状态下后固定3~4 d。组织标本经脱水、包埋后取 3 μm 切片,HE 染色;(3)免疫组织化学检查:肿瘤石蜡切片经脱蜡后,进行免疫组织化学染色,ClC-3兔多克隆抗体1∶100,BK兔单克隆抗体1∶100。观察建模14 d后ClC-3通道、BK通道在大鼠C6脑胶质瘤中的表达情况;(4)普通光学显微镜下观察肿瘤的体积,以400×光镜随机选择视野进行检测:A、B、C组每个时间点选取5只实验动物标本,每个标本选取肿瘤最大截面,病例切片使用Visual Basic 6.0软件测量肿瘤的长度与宽度[5-6]。肿瘤体积计算公式V=长×宽×宽/2[7-8]。
四、统计学分析
采用SPSS13.0软件进行数据处理,各组荷瘤动物不同时间点成瘤体积采用均数±标准差(Mean±SD)表示组间差异,两两比较应用成组t检验,P<0.05为差异具有统计学意义。
结 果
一、一般情况观察
Wistar大鼠接种C6脑胶质瘤细胞的成功率均为100%。A组动物于接种细胞后第2天自行觅食,饮水较E组动物减少,体质量及警觉性有所下降;约14 d出现毛发紊乱、行动迟缓、体质量下降、活动减少、接触反应减弱,偶有抽搐、肢体偏瘫,运动时身体向一侧偏斜、双眼突起等,体质量增长缓慢。B组接种细胞后10 d内,大鼠活动进食均无明显异常,体质量均有所增加,反应较A组好;C组接种细胞后与A组无明显差别;D组未见肿瘤形成。
二、组织病理学检查
如图1所示,大鼠建模成功后14 d,A组大鼠肿瘤标本无包膜,边界轮廓稍模糊,显微镜下观察肿瘤细胞呈圆形,梭形或多角形,肿瘤细胞排列紊乱,可见生长活跃的胶质瘤细胞密集成群,并向正常脑组织浸润生长,脑组织与肿瘤交界处可见肿瘤细胞侵入脑实质,边界较模糊,细胞核呈圆形或不规则形,染色质深染,核分裂相较多,中心部位由于肿瘤生长过快可见坏死。B组大鼠成瘤体积小,瘤细胞密度低,脑组织有肿瘤细胞浸润,仍可见一个较明显的界限,血供一般,瘤中心坏死细胞较少。C组大鼠成瘤体积同A组无明显变化,肿瘤细胞生长活跃的胶质瘤细胞密集成群,并向正常脑组织浸润生长,脑组织与肿瘤交界处可见肿瘤细胞侵入脑实质,边界较模糊。D组动物注射区周围未见肿瘤细胞生长。E组为正常脑组织形态。
三、免疫组织化学检查
ClC-3以及BK通道在正常脑组织中均有表达。ClC-3离子通道蛋白在C6胶质瘤细胞系呈高度表达;而BK离子通道蛋白表达相对较低,如图2所示。
四、各组荷瘤动物成瘤体积的比较
B组应用Chlorotoxin后,荷瘤动物的成瘤体积在各个观察期与A组比较均显著降低,差异均具有统计学意义(P<0.05),而 C组应用 Iberiotoxin后,荷瘤动物的成瘤体积在各个观察期与A组比较差异无统计学意义(P>0.05)。具体内容见表1。
讨 论
恶性胶质瘤是一种致死性极高且最为常见的原发性颅内肿瘤,约占33.3%~58.6%[9]。近年来,虽然恶性脑胶质瘤的治疗效果有一定的提高,但是中位生存期仍仅为9~12个月,5年的生存期仍不能超过10%[10]。影响患者生存期的主要原因是胶质瘤在中枢神经系统呈侵袭性生长,肿瘤界限不清,使手术切除程度受限。因此,脑胶质瘤治疗的进展在很大程度上仍有赖于针对其侵袭性生长的临床治疗研究。

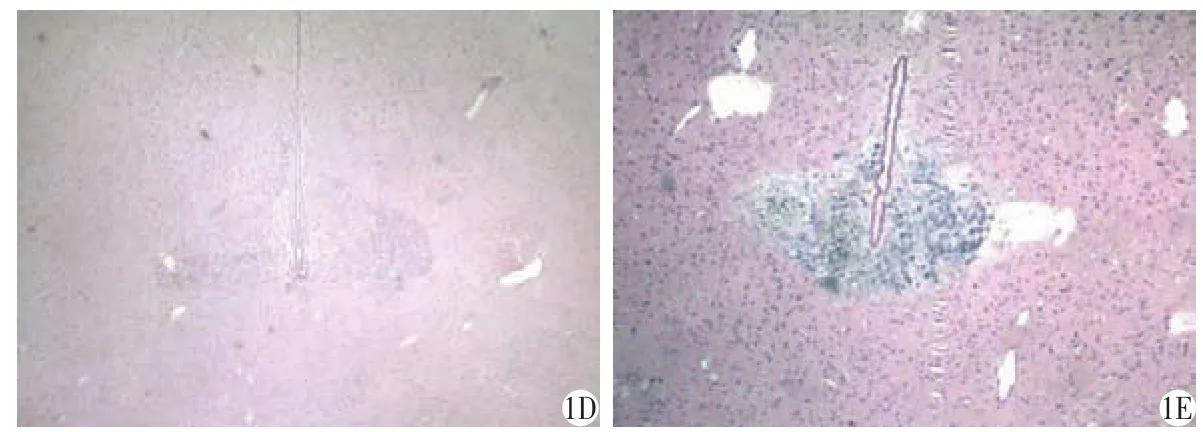
图1 假手术组及各载瘤模型动物脑C6胶质瘤细胞团的病理学特点(HE染色,×40)
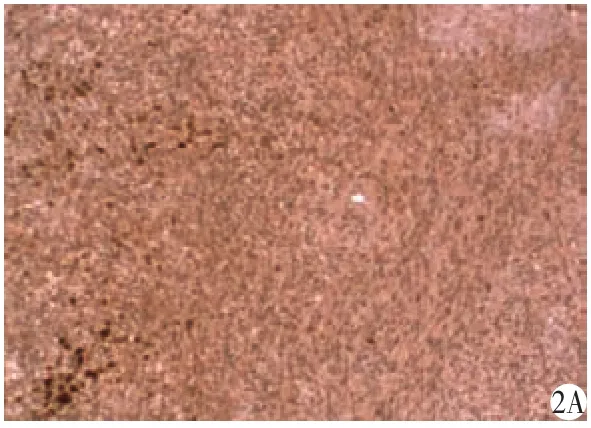

图2 ClC-3和BK通道在正常脑组织以及脑C6胶质瘤细胞团中的表达分布情况(免疫组织化学染色,×400)
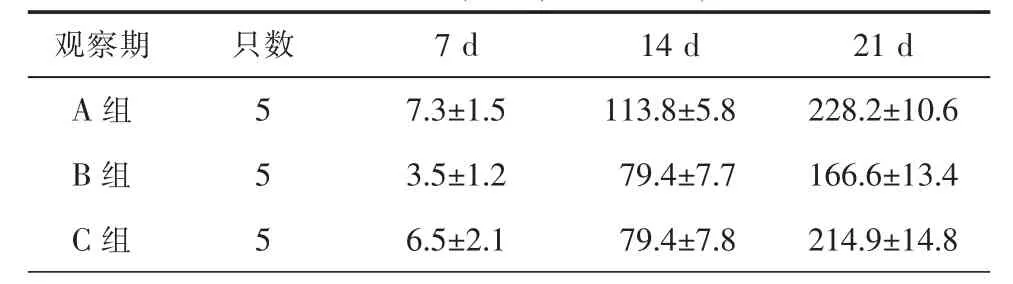
表1 各组荷瘤动物不同时间点成瘤体积比较(mm3,Mean±SD)
建立可靠的动物模型是进行各种实验研究的基础,大鼠C6脑胶质瘤同种移植瘤动物模型是脑胶质瘤实验研究中应用最为广泛的模型之一[11]。大鼠脑内接种后肿瘤形成较快,种植肿瘤成活率较高,而且生长特点与人较为接近,所以广泛应用于脑胶质瘤治疗的实验研究[12-13]。Wistar大鼠是人类试验的代替品,该大鼠性情较为温和,生活习性繁殖规律容易受到外界的气温、气压、湿度及噪声等方面的影响。Wistar大鼠具有优良的抵制传染病能力和低自发性肿瘤发生率,是动物实验大鼠类最为常用的品种。
目前已知一些重要的离子通道(如gBK、ClC-2、ClC-3等)在恶性胶质瘤细胞中呈特征性分布,直接参与胶质瘤细胞在侵袭性生长过程中的细胞形变。传统的治疗策略主要针对于胶质瘤细胞侵袭微环境的变化,以瘤细胞侵袭相关性离子通道为治疗靶点,从直接改变胶质瘤细胞本身侵袭能力的角度出发,很可能大大提高恶性胶质瘤治疗的时效性。针对胶质瘤细胞侵袭相关性离子通道筛选或者开发出的各种高结合力特异型试剂,能够有效地降低其对周围正常脑细胞和组织的损害。在体外实验中应用ClC-3型通道的特异性阻断肽ClTX,其和胶质瘤细胞结合后能够显著地延缓和缩短瘤细胞的迁移速度和距离[14]。笔者前期体外Transwell细胞实验已经证实,应用ClTX后透过小孔的U251胶质瘤细胞数目减少[15]。本实验在前期体外实验的基础上,观察BK及ClC-3离子通道在正常脑组织细胞系及C6胶质瘤组织中的表达及分布情况,分别运用ClC-3特异性阻滞剂ClTX以及BK通道特异性阻滞剂IBTX观察荷瘤动物成瘤体积的变化情况。研究结果显示,C6胶质瘤细胞系均高度表达ClC-3离子通道蛋白,BK离子通道蛋则表达相对较低。成瘤体积的比较进一步证实运用ClC-3通道特异性阻滞剂ClTX后,胶质瘤细胞侵袭性生长特性显著降低。上述结果表明,相对BK通道,ClC-3通道在胶质瘤侵袭性生长过程中发挥更重要的作用,抑制ClC-3通道可有效降低胶质瘤侵袭性。就BK通道而言,本实验结果表明其在胶质瘤细胞侵袭性生长中的作用有限,这与某些研究报道结果并不完全相符。原因可能是在不同的胶质瘤细胞系中,BK通道表达及功能可能存在差异;ClC-3通道特异性阻滞剂,可能直接影响肿瘤细胞的活性,其有待进一步研究。
综上所述,紧紧围绕上述侵袭相关性离子通道,探寻以其为靶标的新型治疗策略将在恶性胶质瘤侵袭性治疗中具有重要意义。
