两种术前活检方案用于早期胃癌患者行内镜黏膜下剥离术的临床价值比较
2018-03-28王岩孙成刚黄丽
王岩,孙成刚,黄丽
(1.山东省济南市济钢医院 消化内科,山东 济南 250101;2.山东省立医院 消化内科,山东 济南 250021;3.山东省淄博市中心医院 消化内科,山东 淄博 255000)
目前胃癌早发现早诊断主要依赖内镜活检术病理检查,其中以多点多块活检和靶向活检术最为常用[1]。以往对于胃癌患者筛查常规行白光成像内镜引导下多点多块活检术,并被广泛用于胃癌癌前病变内镜随访[2]。近年来放大窄带成像内镜技术逐渐发展成熟,可清晰显示胃黏膜腺管和异型血管形态,避免传统取材盲目性和有效提高诊断准确度,亦减轻患者检查痛苦,提高治疗依从性[3];但对于该活检方案能否较多点多块活检方案增加患者临床收益,国内尚缺乏相关比较研究证实。本文以本院2013年6月-2016年6月行ESD术治疗早期胃癌患者共60例作为研究对象,分别在术前行多次多点活检术和靶向活检术,探讨术前活检方案差异对行内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)早期胃癌患者取材量及手术用时的影响。现报道如下:
1 资料与方法
1.1 一般资料
研究对象选取本院2013年6月-2016年6月行内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)治疗早期胃癌患者共60例,根据活检方案不同分为A组和B组,每组各30例。A组患者中男17例,女13例,年龄35~82岁,平均(57.40±6.82)岁,病变直径3.0~6.5 cm,平均(4.72±1.63)cm;B组患者中男19例,女11例,年龄34~84岁,平均(57.61±6.87)岁,病变直径3.2~6.7cm,平均(4.81±1.66)cm。两组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。见表1。
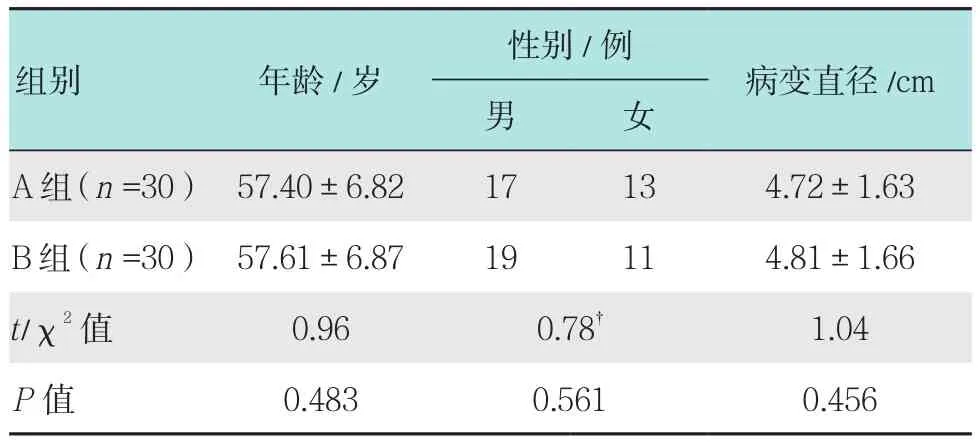
表1 两组基本资料比较Table 1 Comparison of general information between the two groups
1.1.1 纳入标准①符合日本《胃癌治疗指南》(2014年)ESD手术指证[4];②年龄18~70岁;③病理活检确诊胃窦部早期胃癌或上皮内瘤变;④方案经医院伦理委员会批准,且患者及家属签署知情同意书。
1.1.2 排除标准①病变累及黏膜下层;②感染性或家族性肠道疾病;③合并淋巴结或远处转移;④既往ESD手术史;⑤长期服用非甾体抗炎药;⑥其他系统恶性肿瘤;⑦凝血功能障碍;⑧精神系统疾病;⑨心脑肝肾功能障碍;⑩临床资料不全。
1.2 方法
1.2.1 取材方法A组患者术前行多次多点活检术,白光成像内镜引导下进行取材;常规钳取2块,溃疡者围绕周边4个方位各取1块,息肉于顶部及基底部多点取材;可疑癌变者则取材≥5块;B组患者术前行靶向活检术,放大窄带成像内镜引导下进行取材,即在白光成像内镜发现病变位置后改为放大窄带成像模式,靠近病灶处行黏膜浅层、黏膜下血管、胃黏膜腺管微结构识别,于异型微血管处定向取材。
1.2.2 ESD手术方法于距病灶边缘5 mm处行氩离子凝固术(argon plasma coagulation,APC)凝固标记,标记点外5 mm处进行多点注射,顺序为远侧、两侧及近侧;注射液成分为5 ml生理盐水+10%甘油+5%果糖+亚甲蓝+去甲肾上腺素,保证病灶充分抬举;采用Dual刀沿标记外缘切开黏膜层及黏膜下层,在病变部位全周切开后自基底部逐步剥离黏膜下层;电凝止血,对于可疑穿孔处采用金属钛夹夹闭,观察创面无出血后退镜。
1.3 观察指标
①记录患者活检次数和取材总标本数,计算平均值;②记录患者术后病理活检诊断结果,包括早期胃癌、高级别瘤变及低级别瘤变例数,计算符合率;符合例数=早期胃癌例数+高级别瘤变例数;③记录患者确定切除范围时间、标记时间、黏膜下注射时间、黏膜剥离时间、止血时间、创面处理时间及切除标本处理时间,计算平均值。
1.4 统计学方法
采用SPSS 20.0软件进行数据分析,其中计量资料以均数±标准差(±s)表示,采用t检验;计数资料以百分比(%)表示,采用χ2检验;检验水准为α=0.05。
2 结果
2.1 两组患者活检次数和取材总标本数比较
B组患者活检次数和取材总标本数均明显少于A组,差异有统计学意义(P<0.05)。见表2。
2.2 两组患者术后病理符合率比较
B组患者术后病理符合率明显高于A组,差异有统计学意义(P<0.05)。见表3。
2.3 两组患者ESD手术过程用时比较
两组患者确定切除范围时间、标记时间、黏膜下注射时间及切除标本处理时间比较差异无统计学意义(P>0.05);B组患者黏膜剥离时间、止血时间及创面处理时间均明显短于A组,差异有统计学意义(P<0.05)。见表4。
表2 两组患者活检次数和取材总标本数比较 (±s)Table 2 Comparison of number of biopsy and the total number of specimens between the two groups (±s)
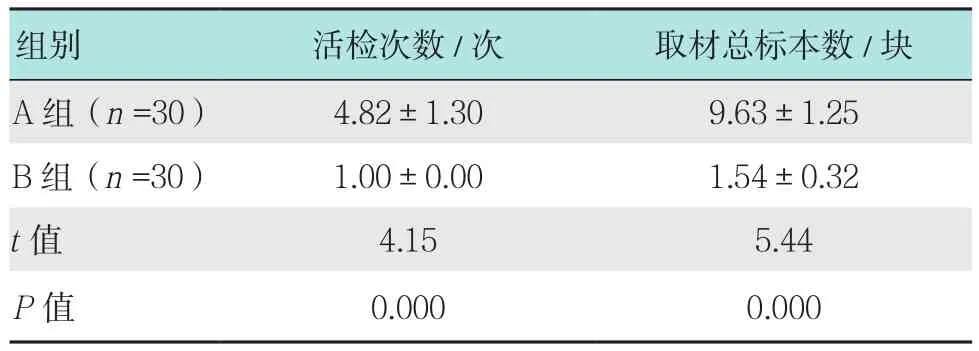
表2 两组患者活检次数和取材总标本数比较 (±s)Table 2 Comparison of number of biopsy and the total number of specimens between the two groups (±s)
组别 活检次数/次 取材总标本数/块A组(n =30) 4.82±1.30 9.63±1.25 B 组(n =30) 1.00±0.00 1.54±0.32 t值 4.15 5.44 P值 0.000 0.000
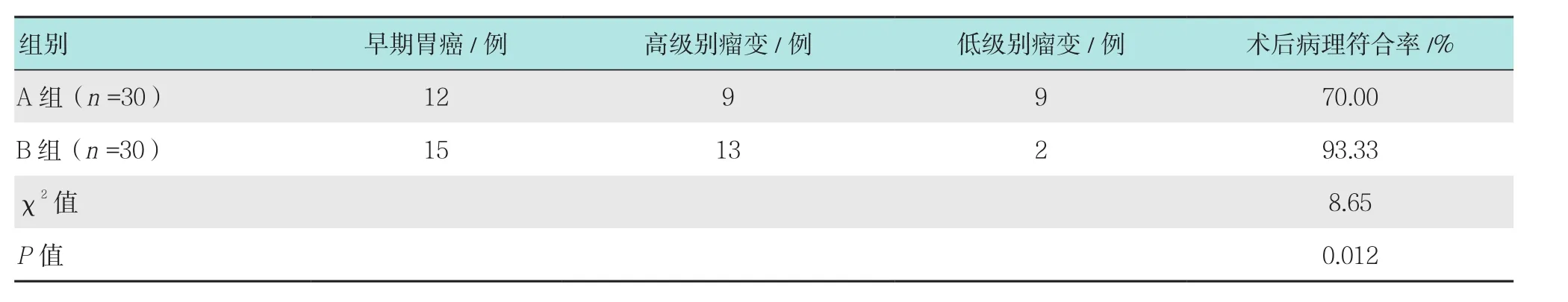
表3 两组患者术后病理符合率比较Table 3 Comparison of postoperative pathological coincidence rate between the two groups
表4 两组患者ESD手术过程用时比较 (min,±s)Table 4 Comparison of ESD operation time between the two group (min,±s)
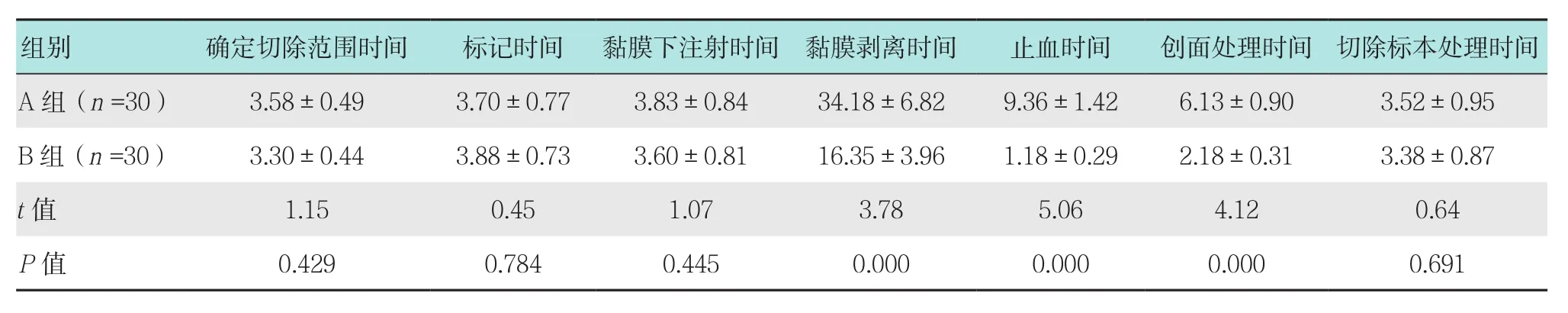
表4 两组患者ESD手术过程用时比较 (min,±s)Table 4 Comparison of ESD operation time between the two group (min,±s)
?
3 讨论
白光成像内镜引导下多块多次活检术钳取胃黏膜要求具有代表性,在保证病变部位准确基础上,应尽量钳取达黏膜肌层大块组织,以对胃黏膜全层进行清晰观察[5];但已有研究显示,尽管该活检术采用专用钳取材多量黏膜组织,但病理诊断特异度较低,造成较多假阴性病例出现[6]。国外多中心回顾性报道证实,行多点多块活检术患者术后病理结果较术前病变程度加重比例可达33.80%,而减轻比例亦接近10.00%[7];同时白光内镜诊断过程因钳取组织过多,在多次内镜随访活检后,可出现胃黏膜纤维粘连甚至瘢痕,对诊疗效果产生不利影响,严重者甚至出现穿孔,威胁生命安全[8]。
放大窄带成像是一种新型内镜成像技术,相较于白光成像,其能够观察胃黏膜腺管和间质内微血管增生程度,鉴别分化型与非分化型恶性肿瘤[9];其中分化型肿瘤细胞自腺管内形成、间质内可见微血管增生,且密度较正常黏膜微血管增加,部分可见不规则微血管;而未分化型肿瘤细胞则自黏膜肌层内形成,无正常微血管和黏膜结构,部分可见皱襞样改变[10]。由放大窄带成像内镜引导下进行活检取材能够更精确判断病变位置和范围,提高良恶性凹陷性病变检出效能,在较小取材量下即可进行准确诊断[11];同时借助放大窄带成像技术在观察胃黏膜细微结构方面的优势,临床医师还能够将病变特点和病理活检结果进行评价,更早确定治疗方案;此外该方案对于病变位置和范围更为精确定位亦有助于避免过度治疗发生[12-13]。
本次研究结果中,B组患者活检次数和取材总标本数均明显少于A组(P<0.05);B组患者术后病理符合率明显高于A组(P<0.05),证实术前靶向活检术应用有助于提高早期胃癌患者诊断准确性,减少有创取材所致胃黏膜损伤,而活检次数减少亦能够降低检查费用,提高患者依从性;同时两组患者确定切除范围时间、标记时间、黏膜下注射时间及切除标本处理时间比较差异无统计学意义(P>0.05);B组患者黏膜剥离时间、止血时间及创面处理时间均明显短于A组(P<0.05),则表明行ESD术早期胃癌患者术前采用靶向活检术进行取材在缩短手术操作用时和提高检查效率方面具有优势;常规多块多次活检术取材组织深度可达黏膜肌层,故ESD术中黏膜下注射后难以充分隆起;而溃疡瘢痕、取材部位瘢痕粘连及黏膜下丰富血管丛导致手术操作需更加谨慎,且需要花费大量时间进行瘢痕剥离松解,进一步增加手术难度和风险[14];而放大窄带成像引导下靶向活检术取材后,患者病变黏膜下注射抬举征(+)比例可达96.0%以上,且液体垫持续时间易显著延长,这对于降低操作难度、减少术中出血及缩短手术用时具有重要意义[15]。
对于ESD术后切缘病理诊断阳性问题,笔者认为主要与病变位置染色和白光成像下边界判断不足有关,推荐采用联合色素染色或改为放大窄带成像模式下判断;本次研究中,A组患者中1例术后病理活检提示为进展期胃癌,并行胃癌根治切除+淋巴结清扫术治疗;这可能与该患者之前多次活检造成胃黏膜粘连、无法均匀剥离基底部有关;同时提醒临床医师对于基底切缘阳性者再行ESD术治疗时因黏膜下层往往形成大量瘢痕和纤维化组织,注射后难以有效抬举,故剥离深度应以紧贴并暴露固有肌层为宜,范围包括残留病变组织和外扩1.0 cm正常黏膜组织[16]。
综上所述,术前靶向活检术用于行ESD手术患者可有效减少取材创伤,提高活检准确率,并有助于缩短手术用时,价值优于多次多点活检术。
[1]ABE S, ODA I, NAKAJIMA T, et al.A case of local recurrence and distant metastasis following curative endoscopic submucosal dissection of early gastric cancer[J].Gastric Cancer, 2015, 18(1):188-192.
[2]ONO H, YAO K, FUJISHIRO M, et al.Guidelines for endoscopic submucosal dissection and endoscopic mucosal resection for early gastric cancer[J].Dig Endosc, 2016, 28(1): 3-15.
[3]REN G, CAI R, ZHANG W J, et al.Prediction of risk factors for lymph node metastasis in early gastric cancer[J].World J Gastroenterol, 2013, 19(20): 3096-3107.
[4]胡祥.2014年第4版日本《胃癌治疗指南》更新要旨[J].中国实用外科杂志, 2015, 35(1): 16-19.
[4]HU X.The fourth edition Japan’s 《Guidebook for the treatment of gastric cancer》update keystone in 2014[J].Chin J Prac Surg,2015, 35(1): 16-19.Chinese
[5]KANG S H, LEE K, LEE H W.Delayed perforation occurring after endoscopic submucosal dissection for early gastric cancer[J].Clin Endosc, 2015, 48(3): 251-255.
[6]TANABE S, ISHIDO K, HIGUCHI K, et al.Long-term outcomes of endoscopic submucosal dissection for early gastric cancer: a retrospective comparison with conventional endoscopic resection in a single center[J].Gastric Cancer, 2014, 17(1): 130-136.
[7]KIM Y D, LEE J, CHO J Y, et al.Efficacy and safety of 0.4 percent sodium hyaluronate for endoscopic submucosal dissection of gastric neoplasms[J].World J Gastroenterol, 2013, 19(20): 3069-3076.
[8]SCHMIDT A, FUCHS KH, CACA K, et al.The endoscopic treatment of iatrogenic gastrointestinal perforation[J].Deuts Arztebl Int, 2016, 113(8): 121-128.
[9]TAHARA T, YAMAZAKI J, TAHARA S, et al.Magnifying narrowband imaging of gastric mucosal morphology predicts the H.pylori-related epigenetic fi eld defect[J].Sci Rep, 2017, 7(1): 3090-3097.
[10]VESPER I, SCHMIEGEL W, BRECHMANN T.Equal detection rate of cervical heterotopic gastric mucosa in standard white light, high de fi nition and narrow band imaging endoscopy[J].Z Gastroenterol, 2015, 53(11): 1247-1254.
[11]NOZAKI I, HATO S, KOBATAKE T, et al.Incidence of metachronous gastric cancer in the remnant stomach after synchronous multiple cancer surgery[J].Gastric Cancer, 2014,17(1): 61-66.
[12]NODA H, OGASAWARA N, IZAWA S, et al.Risk factors for bleeding evaluated using the Forrest classification in Japanese patients after endoscopic submucosal dissection for early gastric neoplasm[J].Eur Gastroenterol Hepatol, 2015, 27(9): 1022-1029.
[13]DINC S, CAYDERE M, AKGUL G, et al.Methylene Blue inhibits the in fl ammatory process of the acetic acid-induced colitis in the rat colonic mucosa[J].Int Surg, 2015, 5(10): 57-65.
[14]BANG C S, BAIK G H, SHIN I S, et al.Endoscopic submucosal dissection for early gastric cancer with undifferentiated-type histology: a meta-analysis[J].World J Gastroenterol, 2015,21(19): 6032-6043.
[15]MILHOMEM L M, CARDOSO D M, MOTA E D, et al.Frequency and predictive factors related to lymphatic metastasis in early gastric cancer[J].Arq Bras Cir Dig, 2012, 25(4): 235-239.
[16]AKINTOYE E, OBAITAN I, MUTHUSAMY A, et al.Endoscopic submucosal dissection of gastric tumors: A systematic review and meta-analysis[J].World J Gastrointest Endosc, 2016, 8(15): 517-532.
