糙米、米糠和精米在体外模拟消化过程中抗氧化活性的变化规律
2018-03-27万红霞孙海燕王慧清
万红霞, 孙海燕, 赵 旭, 刘 冬*, 王慧清
(1.深圳职业技术学院,广东 深圳 518055;2.深圳市腾泰米业有限公司,广东 深圳 518040)
自由基是人体新陈代谢过程中产生的中间代谢产物,在正常生理情况下,人体内自由基的产生系统和清除系统处于动态平衡中,保护机体细胞和组织受自由基的伤害性攻击。实验研究表明,谷物中含有大量抗氧化活性物质,摄入足量的谷物食品可有效降低糖尿病、心血管病等慢性退行性疾病和肿瘤的发病风险[1-3]。
目前研究表明稻米中的天然酚类物质主要包括酚酸类和黄酮类化合物,且多以酯键、糖苷键、醚苷键等与其他物质(包括蛋白质、单糖、有机酸等)以结合形式存在,不能被上消化道酶分解,但可以在体外被酸或碱水解或在体内结肠中被微生物分泌的酶(如糖苷酶)酶解才能释放而发挥抗氧化作用[4-6]。目前,对谷物抗氧化活性的评价采用体外化学法[4,7]。Baublis等研究发现谷物在胃酸和胃肠消化酶作用下总抗氧化活性有显著提高,认为在评价谷物食品抗氧化活性时应考虑胃肠道环境[8-10]。为此,作者在前期建立的体外模拟胃肠道消化法评价食物抗氧化活性方法的基础上,以广西稻米(桂小粘品种)为原料,通过体外模拟消化实验研究稻米(糙米、米糠和精米)在模拟消化过程中多酚、黄酮及其抗氧化活性的变化规律,以期对谷物类食品的抗氧化活性进行更全面科学的评价,也为消费者提供更合理的膳食指导。
1 材料与方法
1.1 材料、试剂与仪器
广西桂小粘(早稻,籼米)的糙米、米糠和精米:购于深圳南海粮食工业有限公司;猪胃蛋白酶、猪胰酶、猪胆汁提取物、没食子酸、(+)-儿茶素、Trolox、Folin-ciocalteu 试剂、2,2'-azobis (2-methylpropionamidine) dihydrochloride(AAPH)、荧光素钠盐:购自美国Sigma-Aldrich公司;其它试剂均为国产分析纯;高带中药粉碎机:中国大海药材器械厂产品;T25 digital ULTRA-TURRAX高速匀浆机:德国IKA设备公司产品;5180 R型冷冻离心机:德国Eppendorf公司产品;SY-2230恒温水浴摇床:美国Crystal Technology&Industries公司产品;Spectra Max M5e多功能酶标仪:美国Molecular Devices公司产品。
1.2 方法
1.2.1 样品及试剂的准备 将糙米、米糠和精米分别研磨成粉,贮存于-80℃备用。模拟胃液:0.2 g胃蛋白酶溶于 5 mL 0.01 mol/L HCl;模拟肠液:0.04 g胰酶和0.25 g胆汁溶于10 mL 0.1 mol/L NaHCO3-Na2CO3缓冲溶液,均使用前配制。总酚、总黄酮和氧自由基吸收能力(ORAC)测定所用样品为-80℃贮存的稻米游离酚、结合酚提取样品和胃、肠模拟消化的样品经37℃水浴融解、4℃离心(12 000 r/min,15 min)处理。
1.2.2 稻米游离多酚和结合多酚的提取 参照Okarter等[4]的方法对糙米、米糠和精米游离多酚和结合多酚分别进行提取,并略作改进。
1)游离多酚提取 准确称取1 g(绝干质量)样品,加10 mL正己烷除脂,重复操作3次;加入50 mL预冷的体积分数80%丙酮,冰浴高速匀浆(14000r/min,5 min),4 ℃离心(12 000 r/min,10 min),收集上清液,重复此操作5次。合并上清液,45℃旋转蒸干,去离子水定容至10mL,得游离多酚,-80℃贮存备用。
2)结合多酚提取 在提取游离多酚后的残渣中加入20 mL 2 mol/L NaOH溶液,充氮气2 min,避光室温振荡消化1 h;用浓盐酸调pH至2.0,加入20 mL正己烷混匀,弃上层正己烷油脂层,重复此操作2次;加20 mL乙酸乙酯混匀,4℃离心(12 000 r/min,10 min),收集上清液,重复此操作5次。合并上清液,45℃旋转蒸干,去离子水定容至10 mL,得结合多酚,-80℃贮存备用。
1.2.3 体外模拟胃肠消化 体外模拟消化实验参照赵旭[11]实验方法对稻米(糙米、米糠和精米)进行消化。体外模拟消化包含体外模拟胃消化和体外模拟肠消化两部分。体外模拟肠消化是在胃消化的基础上,根据胃消化的最佳消化时间点,即在该时间点多酚释放量达到最大且再无显著性变化后再进行肠消化。
1)模拟胃消化 模拟胃液组:取20 g(绝干质量)样品,加入200 g生理盐水,沸水浴糊化并持续搅拌15 min后冷却,用去离子水恒重至220 g,用1 mol/L HCl调pH至2.0,加入 2.5 mL模拟胃液;胃空白对照组:用等体积生理盐水(pH7.0)代替模拟胃液;胃酸对照组:用等体积的0.01 mol/L HCl代替胃蛋白酶消化液。用锡纸将烧杯顶部和四周包好避光,充分充入氮气后在37℃恒温水浴摇床消化4 h(持续充入氮气)。 分别在消化 0、0.5、1、2和 3 h时取定量悬浊液,4 ℃离心 (12 000 r/min,15 min),取上清液,分装,-80℃贮存备用。
2)模拟肠消化 模拟肠液组:向达到最佳胃消化时间 (2 h)的消化液中加入1 mol/L NaHCO3调pH至7.0,加入 5 mL模拟肠液,胰酶-胆汁消化液,继续置于37℃恒温水浴摇床中,持续充入氮气消化4 h。肠空白对照组:用等体积的0.1 mol/L NaHCO3-Na2CO3缓冲溶液代替模拟肠液。分别在肠消化 0、0.5、1、2、3和 4 h时取定量悬浊液,4 ℃离心(12 000 r/min,15 min),取上清液,分装,-80 ℃贮存备用。
1.2.4 多酚的测定 多酚的测定按Folin-ciocalteu法[12]进行。
1.2.5 黄酮的测定 黄酮含量测定采用氯化铝-亚硝酸钠比色法[13]。
1.2.6 氧自由基吸收能力(ORAC)的测定 ORAC的测定参照文献[14-15]方法进行。
1.2.7 数据统计分析 实验结果用Mean±SD表示,重复3次。用SYSTAT.Sigmaplot V10.0软件进行作图,用SPSS V18.0统计软件进行实验数据分析,平均值的差异显著性用one-way ANOVA的LSD检验,P<0.05视为有显著性差异,P<0.01视为有极显著性差异。
2 结果与讨论
2.1 稻米多酚、黄酮含量及抗氧化活性
目前对谷物食品抗氧化能力评价主要采用传统方法有机溶剂提取结合碱消化法分别提取游离多酚和结合多酚,再通过测定谷物的多酚含量和抗氧化活性来评价谷物的抗氧化能力[7]。因米糠中含大量的抗氧化多酚物质,大米的加工精度越精越易导致抗氧化物质的大量丢失。
2.2 体外模拟消化过程中稻米多酚的变化规律
体外模拟胃消化过程中糙米、米糠和精米多酚释放量的变化情况如图1(a、b和c)所示。与模拟胃消化0 h相比,糙米、米糠和精米的多酚释放量在0.5 h内显著升高(P<0.05),糙米和米糠的多酚释放量在分别在 2 h和 1 h后趋于稳定(P>0.05),精米的多酚释放量在3 h时仍有显著性升高 (P<0.05)。三者的胃空白对照组和糙米及米糠胃酸对照组的多酚释放量在模拟消化前后无显著变化 (P>0.05),而精米胃酸对照组的多酚释放量在0.5 h内显著升高(P<0.05),0.5 h 后趋于稳定(P>0.05),表明胃蛋白酶对促进稻米抗氧化物质的释放占主导作用,胃酸(盐酸)对糙米和米糠抗氧化物质的释放无显著影响,而胃酸对精米抗氧化物质的释放有显著影响。模拟胃消化3 h过程中糙米、米糠和精米多酚的最大释放量 (10.29±0.45、24.54±1.98、9.615±0.440 μmol/g)分别为胃消化 0 h (2.940±0.145、14.00±0.54、1.458±0.117 μmol/g)的 3.499、1.753、6.595 倍。
体外模拟肠消化4 h过程中稻米多酚释放量的变化情况如图1(d、e和f)所示。与模拟肠消化0 h(也即模拟胃消化2 h)相比,糙米、米糠和精米的多酚释放量在0.5 h内显著升高 (P<0.05),0.5 h后趋于稳定(P>0.05),三者的肠空白对照组多酚释放量在模拟肠消化前后均无显著变化(P>0.05)。体外模拟胃肠消化过程中糙米、米糠和精米多酚的最大释放量(15.01±0.13、25.03±0.20、14.49±0.25 μmol/g)分别为肠消化0 h的1.521、1.081、1.697倍和胃消化0 h 的 4.704、1.828、9.113 倍。由图1(A2、B2和 C2)可看出模拟肠消化过程中抗氧化物质释放增加的主要贡献来自胰酶对稻米胚乳(精米)的水解。
谷物中具有抗氧化活性的物质除多酚(包括黄酮)等植物化学物质外,活性多糖和蛋白质酶解后的多肽都可能有抗氧化活性,作者采用Folinciocalteu法测定模拟消化后上清液的多酚含量,由于Folin-ciocalteu法对多酚类物质的测定并不具有特异性 (测定的是所有具有还原性的化合物),因此,模拟消化过程中多酚的释放量变化规律本质上是所有抗氧化物质释放量的变化规律。Nagah等人[9]研究也表明,糙米、全麦和玉米在体外模拟胃肠消化过程中抗氧化活性物质有显著释放,但迄今未见有关释放机制或原因的研究报道。作者认为,抗氧化物质在模拟胃肠消化过程中大量释放的主要原因包括:(1)胃肠蛋白酶水解谷物蛋白质,产生了大量具有抗氧化活性的多肽;(2)胃肠蛋白酶水解了与多酚氢键或疏水结合的蛋白质,释放出了结合多酚;(3)胰酶(胰蛋白酶、胰凝乳蛋白酶、胰脂肪酶等)水解了多酚与细胞壁纤维素、半纤维素和木质素等结合的酯键,释放出结合多酚。
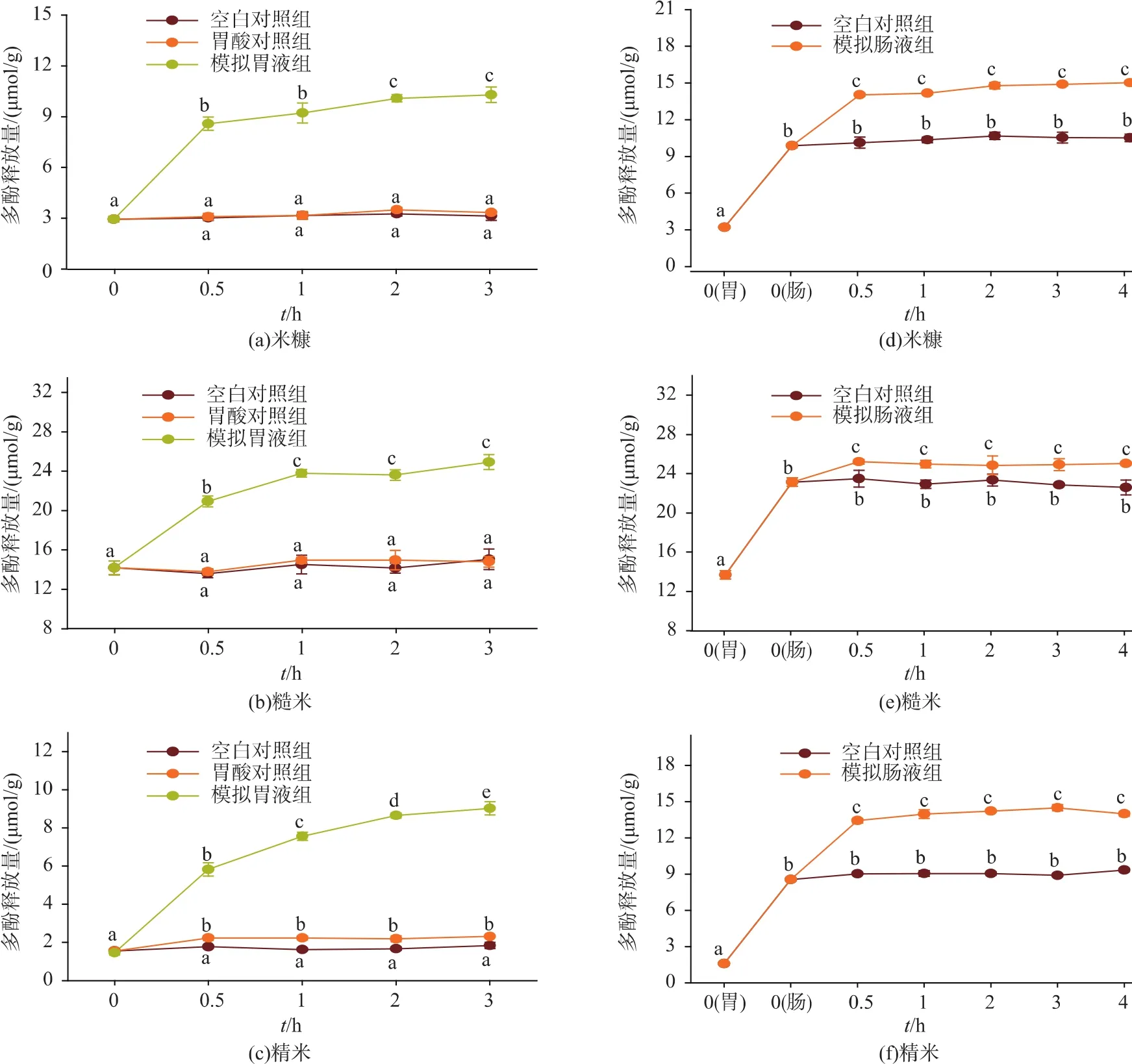
图1 体外模拟胃和肠消化对稻米(米糠、糙米和精米)多酚释放量的影响Fig.1 Effect of in vitro simulated gastric and intestinal digestion on phenolics released from digested rice (rice bran,brown rice and polished rice)
2.3 体外模拟胃肠消化过程中稻米黄酮的变化规律与Folin-ciocalteu法测定多酚的不特异不同,
氯化铝-亚硝酸钠比色法则能较准确的反映谷物中黄酮类物质的含量。体外模拟胃消化过程中稻米黄酮释放量的变化情况如图2(a、b和c)所示。与模拟胃消化0 h相比,糙米、米糠和精米的黄酮释放量在0.5 h 内显著升高(P<0.05),分别在 1 h,1 h 和 0.5 h后趋于稳定(P>0.05),三者的胃空白对照组及精米胃酸对照组的黄酮释放量在模拟胃消化前后无显著变化(P>0.05)。糙米和米糠胃酸对照组的黄酮释放量在0.5 h内显著升高(P<0.05),1 h后黄酮释放量趋于稳定(P>0.05),这表明胃酸对米糠黄酮的释放起主导作用,糙米黄酮的释放则是胃蛋白酶和胃酸协同作用的结果。而精米的胃酸对照组黄酮释放量在模拟胃消化前后变化不显著,这表明胃蛋白酶对精米黄酮的释放占主导作用,而胃酸对黄酮的释放无影响。模拟胃消化3 h过程中糙米、米糠和精米黄酮的最大释放量 (0.725 1±0.010 1、5.202±0.030 5、0.182 0±0.010 9 μmol/g)分别为胃消化 0 h(0.476 5±0.025 3、0.872 6±0.016 0、0.110 1±0.005 0 μmol/g)的 1.522、5.961、1.653 倍。

图2 体外模拟胃肠消化对稻米(米糠、糙米和精米)黄酮释放量的影响Fig.2 Effect of in vitro simulated gastric and intestinal digestion on flavonoids released from digested rice (rice bran,brown rice and polished rice)
体外模拟胃消化2 h和模拟肠消化4 h过程中稻米黄酮释放量的变化情况如图2(d、e和f)所示。与模拟肠消化0 h相比,糙米和精米的黄酮释放量在0.5 h内显著升高 (P<0.05),0.5 h后黄酮释放量趋于稳定(P<0.05),米糠的黄酮释放量在模拟肠消化前后差异不显著(P>0.05),三者的肠空白对照组黄酮释放量在模拟肠消化前后均无显著差异 (P>0.05)。表明在模拟肠消化过程中,黄酮类植物化学物释放增加的主要贡献来自胰酶对稻米胚乳 (精米)的水解。体外模拟胃肠消化过程中糙米、米糠和精米黄酮的最大释放量(1.524±0.071、5.107±0.200、0.326 1±0.013 1 μmol/g) 分别为肠消化 0 h 的2.265、1.075、1.901 倍和胃消化 0 h 的 3.359、5.958、3.242倍。
Andreasen等[6]认为,谷物结合多酚不能被胃和小肠消化吸收,但能被结肠中的微生物酶(酯酶、糖苷酶)降解释放出游离多酚,因而结肠是谷物结合多酚消化、吸收的专一场所。但这一观点并未得到有力证实。作者研究则表明,谷物结合多酚(如黄酮)在胃肠消化过程中,由于胃酸(盐酸)水解和胃肠蛋白酶酶解等消化作用使多酚由结合态转变成游离态,因而,谷物结合多酚可以在胃和小肠消化吸收。
2.4 体外模拟消化过程中稻米抗氧化活性的变化规律
体外模拟胃消化过程中稻米抗氧化活性的变化情况如图3(a、b和c)所示。与模拟胃消化0 h相比,糙米、米糠和精米的ORAC值在0.5 h内显著升高 (P<0.05),糙米和米糠分别在 2 h和0.5 h后ORAC值趋于稳定(P>0.05),精米的ORAC值在3 h时仍有显著性升高(P<0.05)。三者的胃空白对照组和胃酸对照组ORAC值在模拟胃消化前后均无显著差异(P>0.05)。在模拟胃消化3 h过程中糙米、米糠和精米的最大 ORAC 值(27.10±1.37、56.10±1.67、24.46±0.70 μmol/g)分别为胃消化 0 h(7.835±0.650、11.57±0.92、1.892±0.191 μmol/g) 的 3.459、4.849、12.93倍。
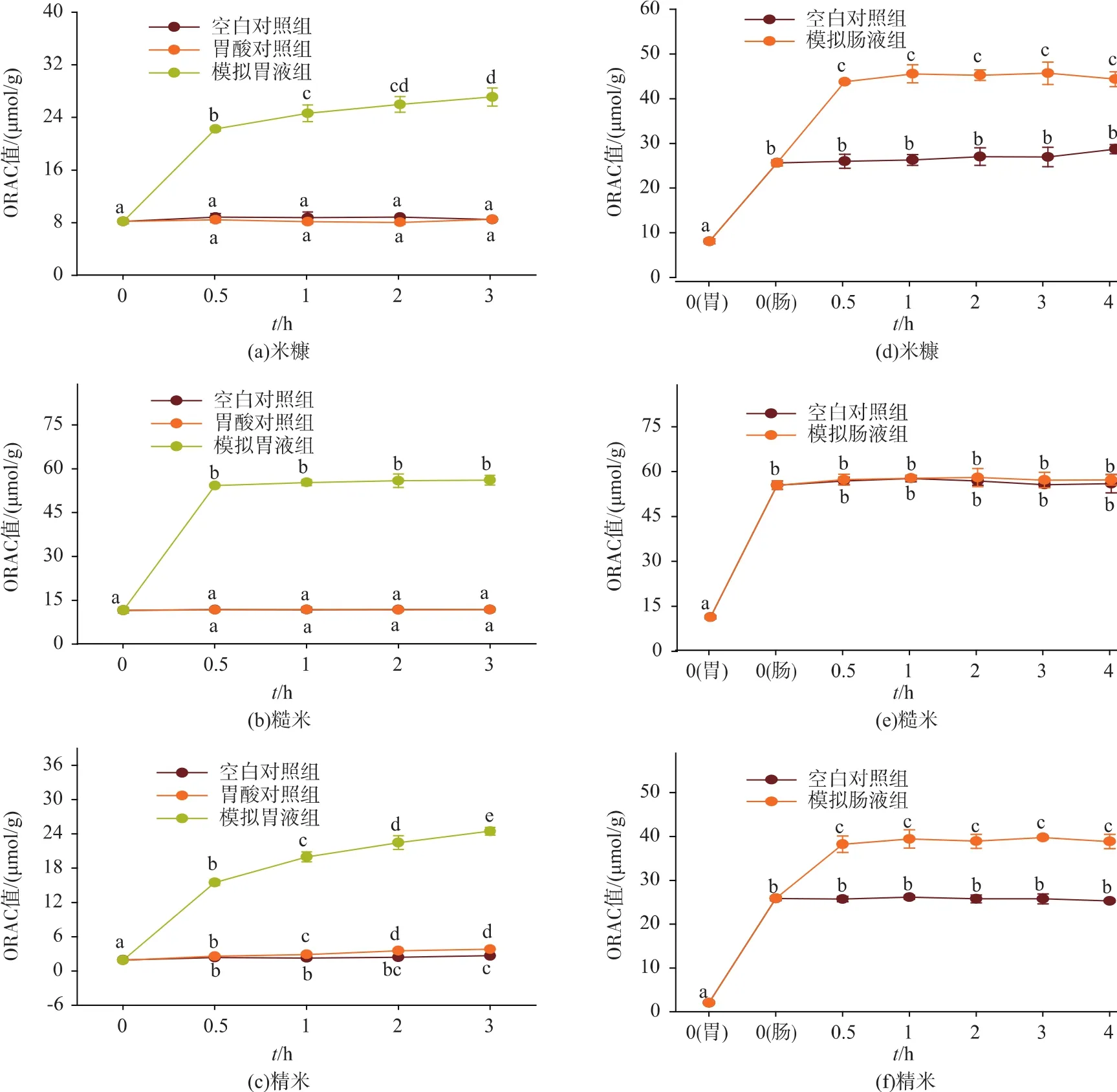
图3 体外模拟胃肠消化对稻米(米糠、糙米和精米)ORAC值的影响Fig.3 Effect of in vitro simulated gastric and intestinal digestion on ORAC values of digested rice ( rice bran,brown rice and polished rice)
体外模拟胃消化2 h和模拟肠消化4 h过程中稻米抗氧化活性(ORAC值)的变化情况如图3(d、e和f)所示。与模拟肠消化0 h相比,糙米和精米的ORAC 值在 0.5 h 内显著升高 (P<0.05),0.5 h 后ORAC 值趋于稳定(P<0.05),米糠的 ORAC 值在模拟肠消化前后差异不显著(P>0.05),三者的肠空白对照组ORAC值在模拟肠消化前后均无显著差异(P>0.05)。体外模拟胃肠消化过程中糙米、米糠和精米的最大 ORAC 值(45.71±2.48、58.02±0.79、39.74±0.34 μmol/g) 分别为肠消化 0 h 的 1.782、1.046、1.690倍和胃消化0 h的5.659、5.112、19.65倍。
3 结语
1)稻米在模拟消化过程中抗氧化能力(ORAC值)的变化规律与多酚(抗氧化活性物质)的释放规律基本一致。
2)模拟消化前精米与糙米的多酚和总抗氧化活性差异均非常显著(P<0.01),精米分别是糙米的49.59%和24.15%;经过模拟胃肠消化后,精米的多酚含量是糙米的96.54%,两者的多酚释放量无显著差异 (P>0.05),精米的总抗氧化活性是糙米的86.94%,精米的总抗氧化活性提高幅度比糙米更大。
3)按照模拟胃肠道消化法评价谷物食品的抗氧化活性与传统的有机溶剂提取结合碱消化法得出的结论可能大相径庭。由于体外模拟胃肠道消化方法是模拟食物在人体内胃肠道的消化过程,评价的结果应该更准确。
参考文献:
[1]李莉蓉.3种黑色粮油作物种皮花色苷的抗氧化作用及其理化特性比较[D].杨凌:西北农林科技大学,2013.
[2]WILLCOX J K,ASH S L,CATIGNANI G L.Antioxidants and prevention of chronic disease[J].Critical Reviews in Food Science and Nutrition,2004,44:275-295.
[3]NEAL O,LIU R H.Health benefits of whole grain phytochemicals[J].Critical Reviews in Food Science and Nutrition,2010,50:193-208.
[4]OKARTER N,LIU C S,SORRELLS M E,et al.Phytochemical content and antioxidant activity of six diverse varieties of whole wheat[J].Food Chemistry,2010,119(1):249-257.
[5]DYKES L,ROONEY L W.Phenolic compounds in cereal grains and their benefits[J].Cereal Foods World,2007,52(3):105-111.
[6]ANDREASEN M F,KROO P A,WILLIAMSON G,et al.Intestinal release and uptake of phenolic antioxidant diferulic acids[J].Free Radical Biology and Medicine,2001,31:304-314.
[7]KAFUI K A,LIU R H.Antioxidant activity of grains[J].Journal of Agricultural and Food Chemistry,2002,50:6182-6187.
[8]BAUBLIS A J,LU C,CLYDESDALE F M,et al.Potential of wheat-based breakfast cereals as a source of dietary antioxidants[J].Journal of the American College of Nutrition,2000(3):308S-311S.
[9]NAGAH A M,SEAL C J.In vitro procedure to predict apparent antioxidant release from wholegrain foods measured using three different analytical methods[J].Journal of the Science of Food and Agriculture,2005,85:1177-1185.
[10]SERRANO J,GONIL I,SAURA C F.Food antioxidant capacity determined by chemical methods may underestimate the physiological capacity[J].Food Research International,2007,40:15-21.
[11]赵旭.体外模拟消化对小麦和大米抗氧化活性和抗细胞增殖作用影响的研究[D].广州:华南理工大学,2013.
[12]VAN H P,MORITA N.Distribution of phenolic compounds in the graded flours milled from whole buckwheat grains and their antioxidant capacities[J].Food Chemistry,2008,109(2):325-331.
[13]ADOM K K,SORRELLS M E,LIU R H.Phytochemical profiles and antioxidant activity of wheat varieties[J].Journal of Agricultural and Food Chemistry,2003,51(26):7825-7834.
[14]WOLFE K L,KANG X M,HE X.Cellular antioxidant activity of common fruits[J].Journal of Agricultural and Food Chemistry,2008,56(18):8418-8426.
[15]FALLER A L K,FIALHO E,LIU R H.Cellular antioxidant activity of feijoada whole meal coupled with an in Vitro digestion[J].Journal of Agricultural and Food Chemistry,2012,60(19):4826-4832.
