鲢鱼肝脏中高分子CPIs提取方法的建立及其鉴定
2018-03-27蒋然然钟海霞陈治光蒋光阳李美良李树红
蒋然然,钟海霞,但 静,陈治光, 李 冉,蒋光阳, 杨 娟,李美良, 李树红
(四川农业大学 食品学院,四川 雅安 625014)
半胱氨酸蛋白酶抑制剂 (cysteine proteinase inhibitors,CPIs), 最初被发现于 20世纪 60年代[1],而后其又被陆续发现广泛分布于生物体各组织中[2]。根据其氨基酸长度、相对分子质量大小、二硫键的数目以及有无糖基化位点等分子结构特性,可将半胱氨酸蛋白酶抑制剂划分为3个家族,其中的家族III是CPIs超家族中蛋白相对分子质量最高的抑制剂,即Kininogens(相对分子质量约6×104~1.2×105)[3]。目前,仅对哺乳动物和鸟类CPIs的研究相对透彻,其中对哺乳动物kininogen的研究发现其不仅是一种半胱氨酸蛋白酶抑制因子,还是一种多功能蛋白[4]。kininogen作为缓激肽的前体在凝血和抗凝血方面发挥作用[5-6],同时还参与肿瘤抑制[7],免疫调节[8],细胞凋亡[9-10],抑菌[11-12]等多种生理和病理过程。目前关于鱼类kininogen的研究仅有从大西洋鲑鱼Atlantic salmon(Salmo salar L.)皮[13],大西洋鳕鱼Atlantic cod(Gadus morhua L.)皮和花狼鳚 Spotted wolffish(Anarhichas minor)皮[14]中得到了纯化。
研究发现,哺乳动物kininogen主要在肝脏合成,再进而分泌到血液等各组织,而鱼类kininogen的表达模式与此相似,其在七星鳗lampreys(Lampetra japonica)[15]肝脏中的mRNA表达水平最高,并且从鱼类肝脏中也检测到了CPIs活性[16-17],但目前尚未见从鱼类肝脏中具体纯化kininogen方法的相关报道。鲢鱼(Hypophthalmichthys molitrix)作为中国四大家鱼之一,其资源丰富[18],且在加工过程中产生大量废弃物,如鱼皮、内脏等,鉴于对鱼类多功能蛋白kininogen的研究十分有限,作者选择kininogen含量丰富的鲢鱼肝脏为材料来源,通过对其中高分子CPIs初步提取条件的系统筛选,建立了最佳的粗提方法,并通过分子筛层析和反相酶谱进一步验证,以便为后续鲢鱼肝脏中kininogen的精细分离纯化和深入研究奠定基础。
1 材料与方法
1.1 试剂与材料
取鲢鱼的新鲜肝脏组织,用4℃蒸馏水清洗除去表面血污,-80℃冻存,用前4℃解冻。
蓝色葡聚糖-2000(2×105)、r-球蛋白(1.5×105)、牛血清白蛋白(6.6×105)、胃蛋白酶原(4.3×104)、胰蛋白酶(2.33×104)、细胞色素 C(1.3×104)、乳链菌肽(3.35×103)、TYR-GLY-GLY-PHE-MET (1.046×103)、ASP-ARG-VAL-TYR-ILE-HIS-PRO-PHE(573)、宽相对分子质量蛋白标品 (6.5×103~200×103):日本Takara公司产品;蛋白质浓度测试试剂盒:南京建成生物工程研究所产品;木瓜蛋白酶(Papain)、荧光合成肽(Z-Phe-Arg-MCA)、苯甲基磺酰氟(PMSF) 、明胶、过硫酸铵(Aps)、十二烷基硫酸钠(SDS)、甲叉双丙烯酰胺(Bis)、丙烯酰胺(Acr)牛血清白蛋白(BSA):美国Sigma公司产品;分子筛Sephacryl S-200:美国GE公司产品。
1.2 仪器和设备
大容量高速冷冻离心机、全波长荧光/比色扫描读数仪:美国Thermo Electron公司产品;Scientz-IID超声波细胞粉碎机:苏州江东精密仪器有限公司产品;TSK G2000 SWXL凝胶过滤高效液相柱:日本TOSOH公司产品;LC-2010C HT高效液相色谱仪:日本SHIMADZU产品;PowerPac 3000电泳电源、Mini Protein电泳槽、Biologic DouFlow全自动中高压层析系统:美国Bio-Rad公司产品;Ultra-8050超滤杯:美国Millipore公司产品。
1.3 实验方法
1.3.1 鲢鱼肝脏中高分子CPIs的粗提取条件筛选
1)CPIs粗提取缓冲液中丝氨酸蛋白酶抑制剂PMSF浓度筛选 4等份鲢鱼肝脏4℃解冻后于冰上用剪刀充分剪碎,分别加入4倍体积的含0 mmol/L (对照组)、1、3、5 mmol/L PMSF 的提取缓冲液 (100 mmol/L的 Tris,3 mmol/L的 EDTA的提取液,pH 7.5)超声破碎(功率 30%,4℃,按工作 1 s停1 s的时间程序超声至肝脏破碎均匀),4℃离心(10 000 g,20 min),取上清液,经 30×103超滤膜浓缩10倍,用于TSK凝胶过滤高效液相分析并回收高分子部分(保留时间RT≤17 min)用于CPIs抑制活性测定。
2)CPIs粗提取过程中热处理温度的筛选 3等份鲢鱼肝脏,按筛选的适宜PMSF浓度的提取缓冲液进行提取,所得上清液用4层纱布过滤,分为3组, 滤液分别经 70 ℃(15 min)、80 ℃(10 min)、90℃(5 min)水浴加热处理后4℃离心 (10 000 g,20 min)取上清液,经3.0×104超滤膜浓缩10倍,用于TSK凝胶过滤高效液相分析,并回收高分子部分(保留时间RT≤17 min)用于CPIs抑制活性测定。
3)CPIs粗提取过程中酸碱处理条件的筛选鲢鱼肝脏,先按筛选的含适宜PMSF浓度的缓冲液
提取的鲢鱼肝脏CPIs粗提液,再经1 mol/L的NaOH调节pH至8.7,然后经确定的适宜条件进行热处理,最后用1 mol/L的 HCl回调pH至7.0,经4℃离心(10 000 g,20 min)后取上清液,经 3.0×104超滤膜浓缩10倍,用于TSK凝胶过滤高效液相分析,并回收高分子部分 (保留时间RT≤17 min)用于CPIs抑制活性的测定。
1.3.2 蛋白质浓度的测定 由Bradford[19]方法,按照南京建成生物工程研究所的蛋白质浓度试剂盒相关说明方法来测定提取液的蛋白质浓度。
1.3.3 CPIs抑制活性的测定 以 Anastasi[20]和Barrett[21]的方法作为参考,利用荧光合成肽底物法监测各条件下高分子CPIs收集液对木瓜蛋白酶的抑制活性,激发和发射波长分别为360 nm和440 nm。把40℃、pH 6.8的反应条件下,底物在1 min内被水解并释放1 nmol的AMC产物的酶活性量(1 nmol AMC/min)定义为1个酶活单位,相应的能够抑制1个酶活单位的活性被定义为一个抑制活性单位。
1.3.4 CPIs粗提液的凝胶高效液相鉴定分析 先用缓冲液A(含质量分数0.05%NaN3和0.1 mol/L Na2SO4的0.1 mol/L的磷酸盐缓冲液,pH 6.7)平衡TSK 凝胶过滤高效液相柱 (7.8 mm×30 cm,5 μm)。将各条件下鲢鱼肝脏CPIs的粗提液用截留相对分子质量为3×103的透析袋在超纯水中透析除盐、经0.22 μm的微滤膜微滤后上样100 μL,之后以0.5 mL/min的流速进行洗脱并回收保留时间RT≤17 min的部分。先用蓝葡聚糖-2000测定得到空体积V0,再分别测得标准蛋白γ-球蛋白、牛血清白蛋白、胃蛋白酶原、胰蛋白酶、细胞色素C、乳链菌肽、TYR-GLY-GLY-PHE-MET和ASP-ARG-VALTYR-ILE-HIS-PRO-PHE在相同条件下的洗脱体积Ve。根据标准蛋白分子质量对数和Ve与V0的比值求得标准曲线,最后由该标准曲线分析鲢鱼肝脏中CPIs相对分子质量的分布情况。
1.3.5 Sephacryl S-200分子筛层析 根据1.3.1最终筛选确定的适宜方法,大量制备的鲢鱼肝脏CPIs粗提取液,经过浓缩(截留相对分子质量3.0×104)、微滤(0.22 μm)后,由制备型 Sephacryl S-200 分子筛(2.5 cm×90 cm)经行分离。以0.44 mL/min的流速,用含磷酸盐缓冲液 (含0.2 mol/L的 NaCl,pH 6.0)洗脱,收集液6.0 mL每管。根据测定的每管收集液中CPIs的抑制活性,得到其活性部分,经浓缩(截留相对分子质量3.0×104的超滤膜)后用于后续鉴定分析。
1.3.6 高分子CPIs的SDS-PAGE及明胶底物-SDS-反相酶谱鉴定 根据电泳试剂盒中电泳分离胶和浓缩胶的配制方法制备12 g/dL的分离胶,之后根据样品浓度上适宜量的样品,使之不超过每个孔道的最大上样量20 μL,电泳结束后经考马斯亮蓝R-250染色过夜,之后用脱色液脱色至背景颜色消失,条带清晰。之后根据适当改进的Li等[22]的方法做明胶底物-SDS-反相酶谱鉴定,并以比样品浓度稍高的BSA做其明胶底物-SDS-反相酶谱鉴定的对照,也是在相同条件下先经行普通SDS-PAGE电泳,电泳结束后将凝胶复兴,复性后的凝胶用50 mmol/L的磷酸盐缓冲液(含0.4 mg/mL的木瓜蛋白酶,pH 7.0)在4℃的条件下反应1 h,随后用50 mmol/L的磷酸盐缓冲液 (含质量分数1%明胶,pH 7.0)在37℃的条件下反应12 h,之后进行染色、脱色。
2 结果与分析
2.1 鲢鱼肝脏中CPIs的粗提取条件筛选结果
2.1.1 提取液中 PMSF浓度筛选结果 CPIs作为半胱氨酸蛋白酶的可逆抑制因子,不具有抑制丝氨酸蛋白酶的活性,同时考虑到鲢鱼肝脏腺中含有丰富的丝氨酸蛋白酶活性[23-24],因此,有必要在提取缓冲液中加入丝氨酸蛋白酶的不可逆抑制剂PMSF。当以含不同浓度PMSF提取缓冲液获得的鲢鱼肝脏CPIs粗提物进行TSK液相分析时,发现提取液中不添加PMSF的对照组(如图1所示)中的蛋白发生了明显的降解,随着提取液中PMSF浓度提高,水解现象被逐步抑制(如图2、图3所示),特别是可能含有kininogen的高相对分子质量部分(TSK上保留时间RT≤17 min,对应相对分子质量≥5.0×104,如横杆所示)的蛋白峰响应值,含不同浓度PMSF的实验组均明显高于对照组,且尤以加5 mmol/L PMSF组最高(加1 mmol/L PMSF组的TSK液相分析图省略)。同时由各PMSF浓度下CPIs粗提取液的TSK高分子(RT≤17 min)回收部分的抑制活性测定结果(表1)可知,5 mmol/L PMSF组抑制活性的总活和比活均最高。结合TSK液相分析和CPIs抑制活性分析结果,说明提取液中添加5 mmol/L PMSF能抑制部分鲢鱼肝脏中丝氨酸蛋白酶对CPIs的降解,这对于尽可能最大限度地回收鲢鱼肝脏中高分子CPIs而言非常重要,因此选取提取过程中加入5 mmol/L的PMSF作为优化条件。
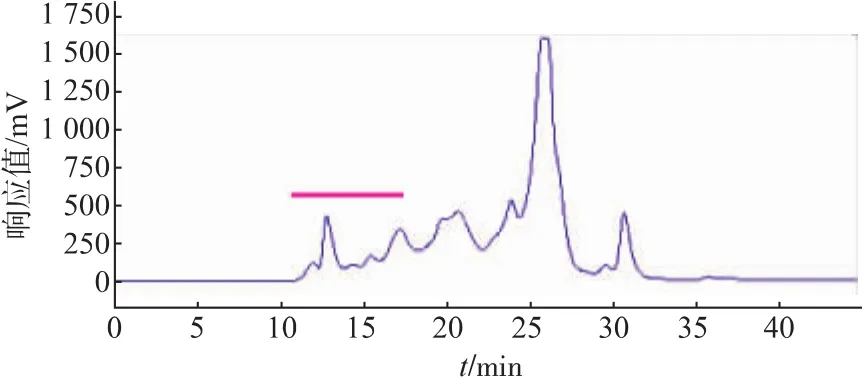
图1 未加PMSF的鲢鱼肝脏CPIs的凝胶高效液相色谱分离Fig.1 Separation of Silver carpliver CPIs by HPLC of TSK-GEL G2000SW without PMSF
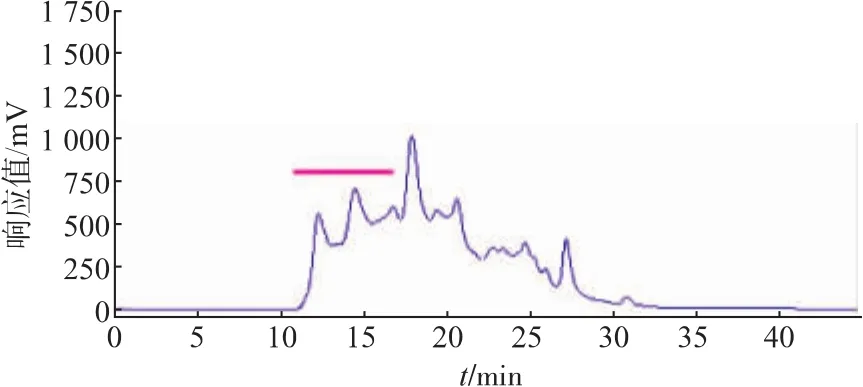
图2 加入3 mmol/L PMSF的鲢鱼肝脏CPIs的凝胶高效液相色谱分离Fig.2 Separation of Silver carpliver CPIs by HPLC of TSK-GEL G2000SW with 3 mmol/L PMSF
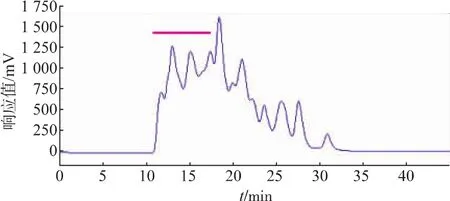
图3 加入5 mmol/L PMSF的鲢鱼肝脏CPIs的凝胶高效液相色谱分离Fig.3 Separation of Silver carpliver CPIs by HPLC of TSK-GEL G2000SW with 5 mmol/L PMSF
2.1.2 CPIs粗提取过程中热处理温度的筛选 由于CPIs具有良好的热稳定性[3],同时一些热稳定的丝氨酸蛋白酶(胰蛋白酶)在50℃加热的情况下仍然保持活性[24],因此在提取过程中设计对样品进行热处理。以含5 mmol/L PMSF的缓冲液提取得到的鲢鱼肝脏中CPIs粗提液上清,分别经过70℃加热15 min、80℃加热10 min和90℃加热5 min后,再进行TSK凝胶高效液相分析(图4、图5、图6),由图可知,加热除去了鲢鱼肝脏粗提液中大量的热不稳定蛋白成分,特别是低相对分子质量部分(TSK上保留时间RT>17 min,对应相对分子质量<5.0×104)的杂蛋白,其中90℃处理5 min组降低的最为明显,这十分有利于目的蛋白的纯化。同时70℃加热15 min和80℃加热10 min所得CPIs粗提液的高分子部分(TSK上保留时间RT≤17 min,对应相对分子质量≥5.0×104,如横杆所示)的蛋白峰响应值略高于90℃处理5 min组,但从该部分的抑制活性测定结果(表2)可知,90℃处理 5 min组抑制活性的蛋白浓度最低,抑制比活性最高,对于目的蛋白纯化而言,是非常有利的。结合TSK液相分析和CPIs抑制活性分析结果,最终选取90℃,5 min为提取过程中适宜的热处理条件。
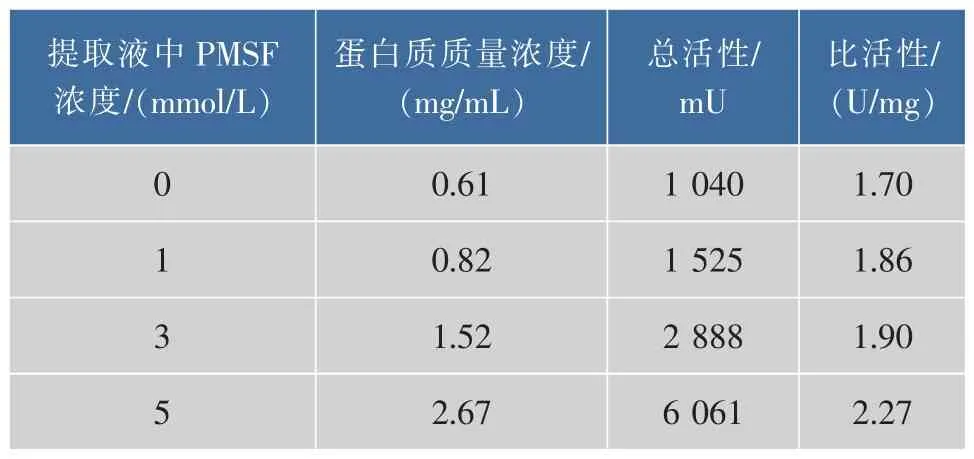
表1 不同PMSF浓度条件下鲢鱼肝脏高分子CPIs粗提液的抑制活性分析Table 1 Inhibitory activities of CPIs of the crude extracts from Silver carpliver with Z-Phe-Arg-MCA Under the condition of different PMSF concentration
3组总活性相对于第一步骤含5 mmol/L PMSF粗提液的总活(表1)都有所下降,说明加热过程在除去鲢鱼肝脏粗提液中杂蛋白的同时,一定程度上也会损失高分子的CPIs,但是三者相较而言,90℃加热条件下鲢鱼肝脏的高分子部分总活性损失量相对较小,比活最高,这可能主要与高分子kininogen比其他杂蛋白耐热性更强有关,该步骤迅速提高了高分子CPIs的抑制比活,可作为提取鲢鱼肝脏高分子CPIs的关键步骤。作者所在实验室早期对纯化的鲢鱼卵中kininogen的热稳定性研究发现,其在70~80℃范围内均十分稳定[25]。
另一方面,低分子杂蛋白部分,90℃加热组下降最快,可能与鲢鱼肝脏中低分子杂蛋白对热的敏感性较强有关。
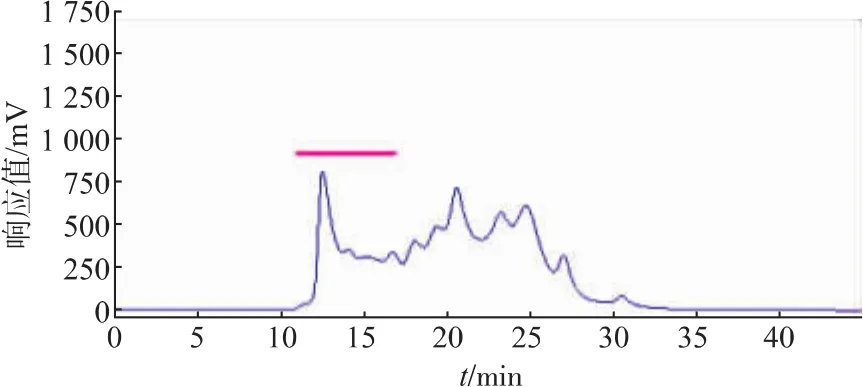
图4 经70℃加热的鲢鱼肝脏CPIs的凝胶高效液相色谱分离Fig.4 Separation of Silver carpliver CPIs by HPLC of TSK-GEL G2000SW after heating treatment at 70℃
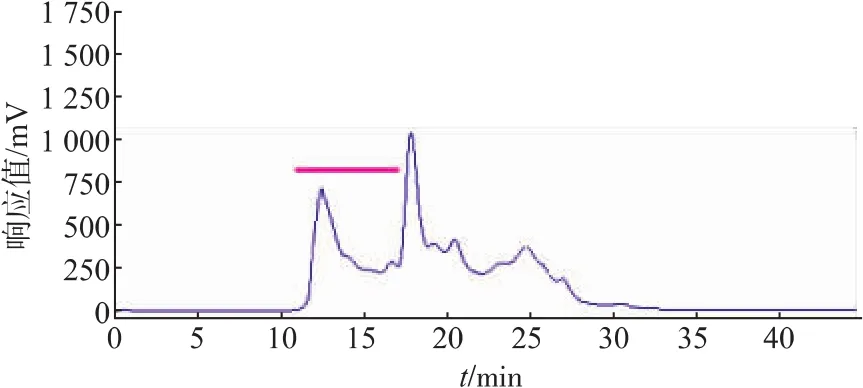
图5 经80℃加热的鲢鱼肝脏CPIs的高效液相色谱分离Fig.5 Separation of Silver carpliver CPIs by HPLC of TSK-GEL G2000SW after heating treatment at 80℃
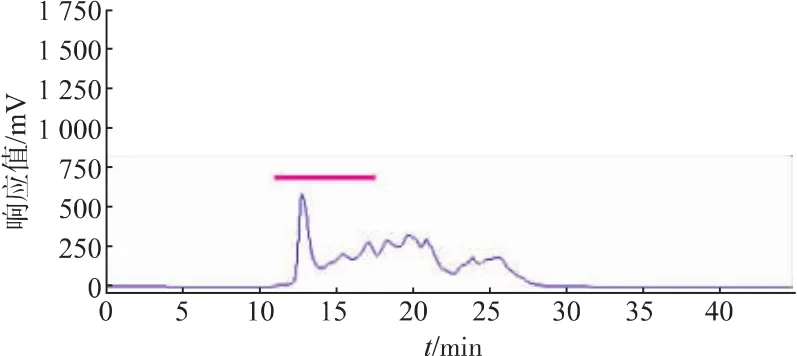
图6 经90℃加热的鲢鱼肝脏CPIs的高效液相色谱分离Fig.6 Separation of Silver carpliver CPIs by HPLC of TSK-GELG2000SWafterheatingtreatmentat90℃
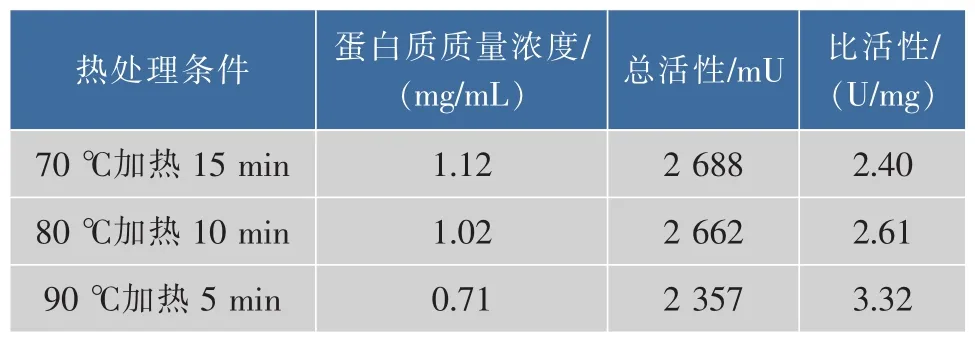
表2 不同温度条件下鲢鱼肝脏CPIs粗提液的抑制活性分析Table 2 Inhibitory activities of CPIs of the crude extracts from Silver carpliver with Z-Phe-Arg-MCA Under the condition of different temperatures
2.1.3 CPIs粗提取过程中碱酸处理条件的筛选由于CPIs具有良好的pH稳定性[3],且根据Matilde[27]对CPI的提取方法,在其基础上做适当改进,因此在提取过程中设计对样品进行适当的碱酸处理。即经pH 8.7碱处理后,90℃加热5 min后,再酸回调到pH 7.0,所得粗提液进行TSK凝胶高效液相分析(图7),由图可知,CPIs粗提液中高相对分子质量部分(TSK上保留时间RT≤17 min,对应相对分子质量≥5.0×104,如横杆所示)的蛋白峰响应值,低于90℃加热组(图6),而RT>17 min的小分子杂蛋白部分则与90℃加热组(图6)相似,同时发现RT≤17 min部分的抑制活性比活明显上升(表3),这可能是由于90℃高温和碱酸调节的协同作用下,去除了高分子部分的杂蛋白,而耐酸碱、且热稳定的高分子CPIs几乎没有受到影响。由此可以初步判断在90℃加热过程结合碱酸调节是可取的处理方式。
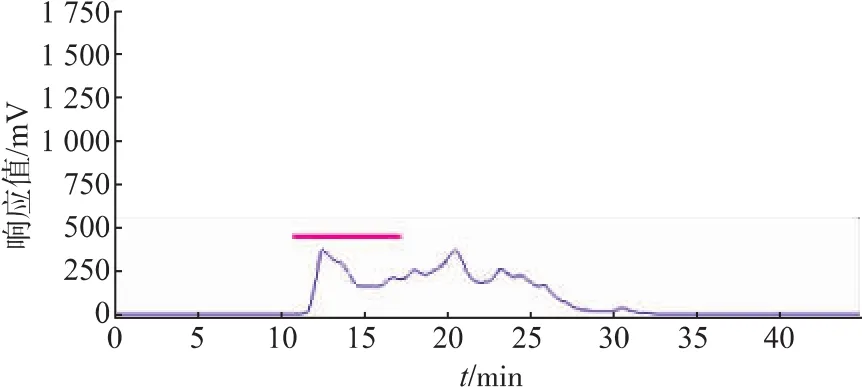
图7 经酸碱处理后的鲢鱼肝脏CPIs的凝胶高效液相色谱分离Fig.7 Separation of Silver carpliver CPIs by HPLC of TSK-GEL G2000SW after alkali-acid treatment
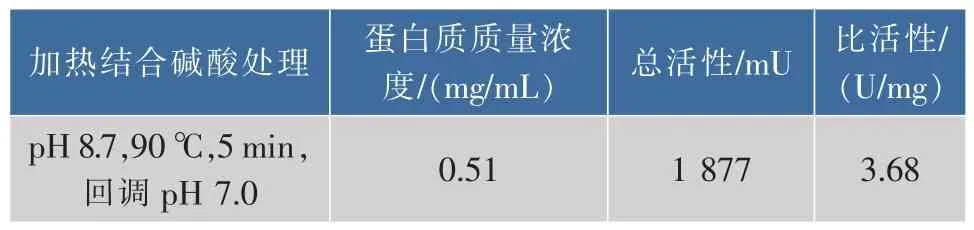
表3 加热结合碱酸处理后鲢鱼肝脏CPIs粗提液的抑制活性分析Table 3 Inhibitory activities of CPIs of the crude extracts from Silver carpliver with Z-Phe-Arg-MCA after alkali-acid treatment
2.2 鲢鱼肝脏粗提CPIs的Sephacryl S-200分子筛层析
采用确定的最佳提取方案大量制备鲢鱼肝脏中的CPIs粗提液,经3.0×103超滤膜浓缩并透析后,上制备型Sephacryl S-200分子筛层析(图8)。如图所示,在制备型的分子筛层析上,抑制活性峰主要体现在高相对分子质量部分(横杆所示),并且能够与低相对分子质量杂蛋白部分得到较好的区分。低相对分子质量部分的抑制活性峰很低,与作者采用的热处理方式和超滤截留有一定关系。
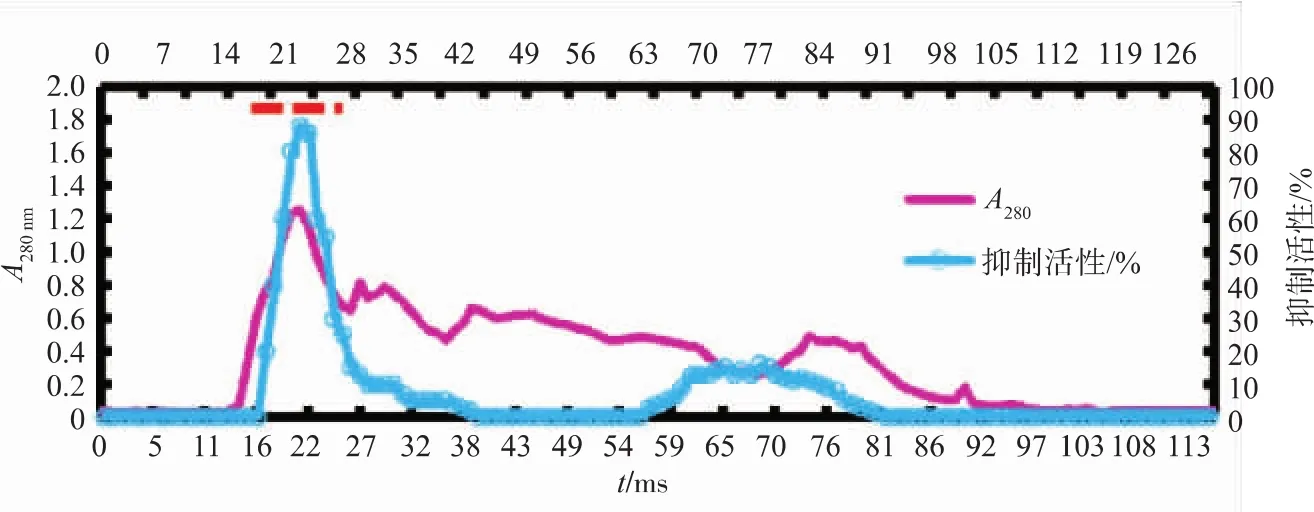
图8 鲢鱼肝脏CPIs的Sephacryl S-200分子筛层析Fig.8 Sephacryl S-200 chromatography of CPIs from Silver carpliver
2.3 鲢鱼肝脏中高分子CPIs的反相酶谱分析
将经过Sephacryl S-200分子筛层析后收集到的高分子活性峰的峰尖浓缩后,用反相酶谱法鉴定其抑制条带,图9为其鉴定结果,可见经木瓜蛋白酶水解作用,对照蛋白BSA(泳道2)和活性峰中的杂蛋白 (泳道3)被完全水解 (泳道4和泳道5所示),而对木瓜蛋白酶具有抑制作用的蛋白质,在电泳上体现为抑制剂条带(泳道5,箭头所示),经计算该蛋白质相对分子质量约为1.94×105,因此推测鲢鱼肝脏中存在一种1.94×105的高相对分子质量形式的活性CPI。但是由于属于家族III的高分子CPIs的相对分子质量约 6.0×104~1.2×105, 又有研究表明从鲤鱼卵膜中提取的半胱氨酸蛋白酶抑制剂以共轭键结合的方式与两种卵膜中的蛋白质形成了大于6.0×104且小于2.0×105的高分子的复合物。
3 结语
由于鲢鱼肝脏中丝氨酸蛋白酶活性高,而其中含量丰富的高分子CPIs在提取和纯化过程中可能被降解,因此作者对鲢鱼肝脏中CPIs粗提条件进行了筛选,从提取缓冲液中PMSF浓度、加热处理条件和酸碱处理3个方面来进行优化,最终确定以含5 mmol/L PMSF的提取液进行提取,而后经过pH 8.7碱处理,90℃加热5 min后再回调pH 7.0,为适宜的粗提取方法。经活性测定和反相酶谱鉴定表明,所得到的CPIs粗提液中保留了明显的高分子CPIs抑制活性。
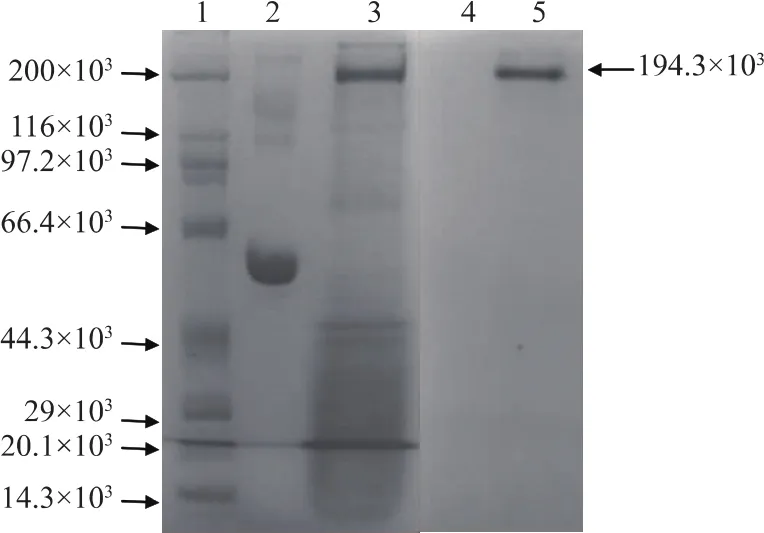
1: 宽相对分子质量蛋白质标准品 (14.3×103~200×103);2:BSA;3:鲢鱼肝脏高分子CPIs收集液;4:反相酶谱处理后的BSA;5:反相酶谱处理后的鲢鱼肝脏高分子CPIs收集液
参考文献:
[1]FOSSUM K,WHITAKER J R.Ficin and papain inhibitor from chicken egg white[J].Archives of Biochemistry&Biophysics,1968,125(1):367-375.
[2]DUBIN G.Proteinaceous cysteine protease inhibitors[J].CMLS Cellular and Molecular Life Sciences,2005,62:653-669.
[3]OCHIENG J,CHAUDHURI G.Cystatin superfamily[J].J Health Care Poor Underserved,2010,21:51-70.
[4]LALMANACH G,NNUDIN C,LECAILLE F,et al.Kininogens:More than cysteine protease inhibitors and kinin precursors[J].Biochimie,2010,92(11):1568-1579.
[5]ZHOU Liwei,MA Fei,LI Qingwei.Progress in the study on alternative splicing and functionsof kininogen genes[J].Hereditas,2006,28(12):1649-1655.(in Chinese)
[6]BAGLIA F A,BADELINO K O,LI C Q,et al.Factor XI binding to the platelet glycoprotein Ib-IX-V complex promotes factor XI activation by thrombin[J].The Journal of Biological Chemistry,2007,282(39):29067.
[7]LIU Y,PIXLEY R,FUSARO M,et al.Cleaved high-molecular-weight kininogen and its domain 5 inhibit migration and invasion of human prostate cancer cells through the epidermal growth factor receptor pathway[J].Oncogene,2009,28(30):2756-2765.
[8]SCHARFSTEIN J,SCHMITZ V,SVENSJO E,et al.Kininogens coordinate adaptive immunity through the proteolytic release of bradykinin,an endogenous danger signal driving dendritic cell maturation[J].Sandinavian Journal of Immunology,2007,66(2-3):128-136.
[9]SUN D,MCCRAE K.Endothelial-cell apoptosis induced by cleaved high-molecular-weight kininogen(HKa) is matrix dependent and requires the generation of reactive oxygen species[J].Blood,2006,107:4714-4720.
[10]XU Xiuyue,YANG Wei,WU Bin,et al.Effect of synthetic peptides derived from HKa D5 on proliferation and apoptosis of MDA-MB-231 cells[J].Journal ofChina Medical University,2008,37(4):494-499.(in Chinese)
[11]NORDAHL E A,RYDENGARD V,MORGELIN M,et al.Domain 5 of high molecular weight kininogen is antibacterial[J].The Journal of Biological Chemistry,2005,280(10):34832-34839.
[12]SONESSON A,NORDAHL E A,MALMSTEN M,et al.Antifungal activities of peptides derived from domain 5 of highmolecular-weight kininogen[J].International Journal of Peptides,2011.
[13]YLONEN A,RINNE A,HERTTUAINEN J,et al.Atlantic salmon (Salmo salar L.) skin contains a novel kininogen and another cysteine proteinase inhibitor[J].European Journal of Biochemistry/FEBS,1999,266(3):1066-1072.
[14]YLONEN A,HELIN J,BOQWALD J,et al.Purification and characterization of novel kininogens from spotted wolffish and Atlantic cod[J].European Journal of Biochemistry/FEBS,2002,269(11):2639-2646.
[15]ZHOU L,LIU X,JIN P,et al.Cloning of the kininogen gene from Lampetra japonica provides insights into its phylogeny in vertebrates[J].Journal of Genetics and Genomics,2009,36(2):109-115.
[16]MICHIAKI Y,SHIRO K.A comparison of cystatin activity in the various tissues of chum salmon Oncorhynchus keta between feeding and spawning migrations[J].Comparative Biochemistry and Physiology Part A:Physiology,1991,100(3):749-751.
[17]LI Shuhong,REN Yangyang,LI Yanfang,et al.Comparative study on three electrophoresis methods for identifying silver carp CPIs[J].Science and Technology of Food Industry,2013,34(21):56-64.(in Chinese)
[18]ZHANG Min,ZHANG Jun.A research review of low value freshwater fishes processingand their discards utilization[J].Journal of Food Science and Biotechnology,2006(5):115-120.(in Chinese)
[19]BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1-2):248-254.
[20]ANASTASI A,BROWN M A,KEMBHAVI A A,et al.Cystatin,a protein inhibitor of cysteine proteinases.Improved purification from egg white,characterization,and detection in chicken serum[J].Biochemical Jourmal,1983,211(1):129-138.
[21]BARRETT A J,KIRSCHKE H.Cathepsin B,Cathepsin H and Cathepsin L[J].Methods in Enzymology,1981,80(41):535-561.
[22]LI D K,LIN H,KIM S M.Purification and characterization of a cysteine protease inhibitor from chum salmon(Oncorhynchus keta) plasma[J].Journal of Agricultural and Food Chemistry,2008,56(1):106-111.
[23]CAO Minjie,LI Yan,WENG Ling,et al.Study on myofibril-bound serine proteinase in silver carp[J].Food Science,2005(1):91-94.(in Chinese)
[24]UAN Shan,TANG Chengzheng,et al.Advances in researches of main endogenous proteases in surimi[J].Academic Periodical of Farm Products Processing,2014(3):52-61.(in Chinese)
[25]刘玲.鲢鱼卵中高分子CPIs的纯化鉴定及其对Ishikawa细胞影响的初探研究[D].雅安:四川农业大学,2014.
