利用环糊精糖基转移酶转化合成AA-2G的研究
2018-03-27单丽媛李江华堵国成
单丽媛 , 刘 龙 , 李江华 , 堵国成 *, 陈 坚
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡214122)
维生素 C(VC),又名 L-抗坏血酸(L-AA),是人体无法合成但却必需的营养元素[1]。在制药、食品、化妆品等行业有重要应用前景。由于VC很容易受到光照、热、金属离子等环境因素的影响而发生氧化反应,导致其本身化学结构极不稳定[2]。因此,寻找一种VC代替品能够行使VC功能的同时提高其稳定性具有重要意义。而2-O-α-D-吡喃葡萄糖基-L-抗坏血酸(AA-2G)作为VC的衍生物具有以下优点:稳定性强:AA-2G在水溶液中特别稳定,能抵抗各种氧化条件。具有较高的耐热性和抗氧化性[3-4]。安全性高:在各种VC糖基衍生物中,AA-2G没有细胞毒性,安全性最佳,并且没有直接还原性[5-7]。能保持VC的生物功能:在α-糖苷酶等酶的作用下AA-2G水解,逐步释放维生素C和葡萄糖,有效保护维生素C的生物活性[8]。生物合成容易:AA-2G可以通过生物酶法转化得到,操作过程简单、易于控制、污染少[9]。
环糊精糖基转移酶(CGTase,EC 2.4.1.19)属于糖基水解酶家族,被认为是催化合成AA-2G的最佳酶[10]。CGTase能够催化4种反应:水解反应,环化反应,耦合反应以及歧化反应[11]。CGTase通过歧化作用可以催化低聚糖和VC反应生成葡萄糖基维生素C[12]。
目前,α-环糊精和β-环糊精在CGTase催化合成AA-2G的过程中凭借它们较高的转化率,常被用作糖基供体[13]。张子臣[14]等利用β-环糊精作为糖基供体得到AA-2G的产量为9.76 g/L。日本林原生化和冈山大学[15]曾首次以α-环糊精作为糖基供体通过生物转化法合成AA-2G,AA-2G的纯度可达97%。Hong[13]等以环糊精为糖基供体利用从泡菜中获得的CGT酶转化合成AA-2G,最终得到AA-2G产量最高为2.98 g/L。但是,α-环糊精和β-环糊精这两种糖基供体同时也存在如下缺陷:α-环糊精价格比较昂贵,以此作为糖基供体时,生产成本比较高;β-环糊精虽然价格比α-环糊精低一些,但是β-环糊精在水溶液中的溶解度较低,经常以固体颗粒形式存在。所以,α-和β-环糊精均不具有大规模生产AA-2G的潜力[16]。因此,选择一种价格低廉又易溶的底物,代替α-和β-环糊精作为CGTase催化生产AA-2G的糖基供体,将会大大降低生产成本。
韩瑞枝[16]等通过对CGT与淀粉酶碳水化合物结合区域进行融合表达,以可溶性淀粉为底物最终得到AA-2G的最高产量为3.03 g/L。作者通过几种糖基供体的比较,选择具有较大优势的可溶性淀粉作为糖基供体。可溶性淀粉具有溶解度高、价格低廉等优势,在转化率、成本等各方面也都优于其它糖基供体。
1 材料与方法
1.1 材料
1.1.1 酶液来源 环糊精糖基转移酶(CGT-SL),酶活(α-环化活力)为476 U/mL:日本天野公司提供。1.1.2 主要试剂 VC:中国医药集团上海化学试剂公司产品;麦芽糊精:山东西王食品有限公司产品;β-环糊精:Sigma-Aldrich(上海)公司产品;AA-2G标准品:和光纯药工业株式会社(日本)产品;其它各种试剂均为国产分析纯。
1.2 实验方法
1.2.1 α-环化活力的测定 采用甲基橙法测定α-环化活力[17]。具体步骤为:0.9 mL 3 g/dL的可溶性淀粉溶液在40℃下预先保温10 min。将适当稀释的酶液 (对照用pH 6.0的磷酸缓冲液代替)0.1 mL加入到0.9 mL 3 g/dL的可溶性淀粉溶液中,在40℃下反应10 min,之后加入1.0 mL 1.0 mol/L盐酸停止反应。然后再加入1.0 mL 0.1 mmol/L甲基橙溶液显色,20℃条件下保温20 min,最后在505 nm下测定样品吸光度。一个酶活单位(U)定义为在上述条件下每分钟生成1 μmol/L α-环糊精所需的酶量[18]。作者所述酶活均为α-环化活力。
1.2.2 AA-2G合成反应的初始条件 反应体系:CGT-SL酶液2 mL(酶液适当稀释,终浓度为47.6 U/mL),糖基供体 0.5 mL(终质量浓度 10 g/L),维生素C 0.5 mL(终质量浓度10 g/L)。反应条件:初始pH 4.2,28℃,转速220 r/min,避光避氧条件下反应24 h[19]。
1.2.3 反应液样品处理方法 将反应结束后的反应液样品12 000 r/min离心10 min,然后用0.22 mm微孔过滤膜过滤。
1.2.4 AA-2G检测方法 高效液相色谱法[20]。色谱柱:Amethyst C18-H;检测器:Variable Wavelength Detector(UV);检测波长:240 nm;柱温:25 ℃;进样量:10 μL;流动相:V(KH2PO4)∶V(甲醇)=99.5∶0.5,用磷酸调pH至2.0。
2 结 果
2.1 转化产物的确定
为了对转化产物进行确定,对在初始反应条件下得到的转化反应液进行LC-MS鉴定。HPLC结果显示,转化反应液样品中在1.12 min出现峰 (图1B)和AA-2G标准样品出峰时间1.11 min(图1A)基本一致,初步判断为AA-2G。为了进行进一步确认,对AA-2G标准样品和转化液样品进行MS鉴定。AA-2G的相对分子质量为338.27。如图1D,转化反应样品 m/z=339.2(M+1)和 m/z=337.2(M-1),推断其相对分子质量为338.2,与标准样品MS(图1C)结果一致,可确定转化液样品中含有AA-2G。
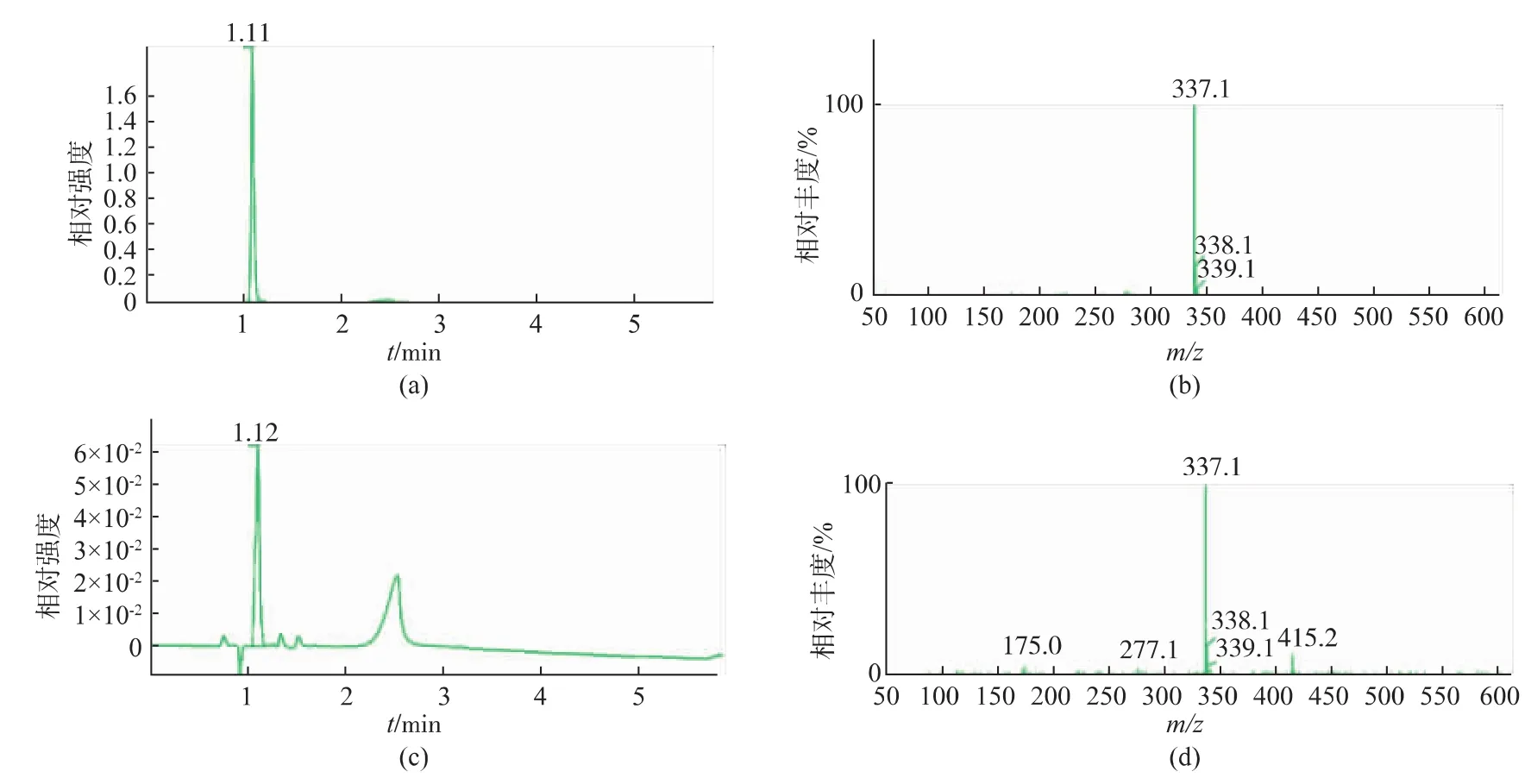
图1 AA-2G标准样品及转化反应液LC-MS图Fig.1 LC/MS result of the biotransformation product and standard sample of AA-2G
2.2 糖基供体种类对CGT-SL转化合成AA-2G的影响
CGT酶可以利用多种寡聚糖合成AA-2G。为了找到合适的糖基供体作为CGT-SL转化合成AA-2G的底物,作者选取了6种不同的糖基供体来源:β-环糊精、麦芽糖、可溶性淀粉、玉米糊精、蔗糖及葡萄糖。如图2,该酶不能利用蔗糖和葡萄糖合成AA-2G。在初始反应条件下,β-环糊精和可溶性淀粉作为糖基供体时AA-2G的产量分别为1.24 g/L和1.23 g/L,明显优于其他糖基供体。考虑到可溶性淀粉与β-环糊精相比具有可溶性强、便宜易得等优点,作者选用可溶性淀粉作为糖基供体进行后续优化研究。
2.3 酶浓度对CGT-SL转化合成AA-2G的影响
酶浓度对AA-2G的产量有重要的影响。在初始反应条件下,以可溶性淀粉为糖基供体,考察不同的酶浓度对AA-2G产量的影响。如图3,随着酶浓度的增加,AA-2G的产量随之增加。当酶浓度达到79 U/mL时,AA-2G的产量最高,达到3.53 g/L。当酶浓度高于79 U/mL时,AA-2G的产量逐渐降低。所以,选择酶浓度为79 U/mL作为后续研究。
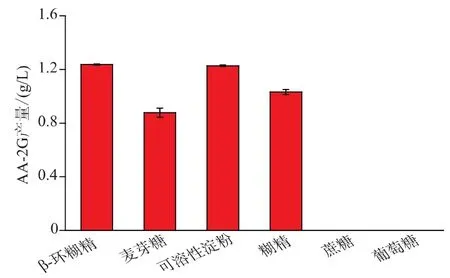
图2 糖基供体对CGT-SL转化合成AA-2G的影响Fig.2 Effect of different glycosyl donors on AA-2G production
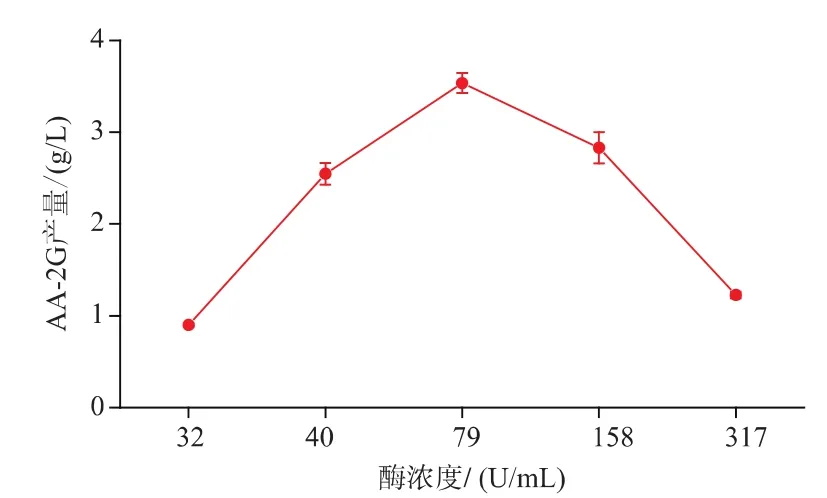
图3 不同的加酶量对AA-2G产量的影响Fig.3 Influence of different enzyme concentrations on AA-2G production
2.4 底物质量浓度对CGT-SL转化合成AA-2G的影响
底物质量浓度对CGT-SL转化合成AA-2G有重要影响。在酶浓度为79 U/mL,其它条件和初始反应条件一致的情况下,考察不同的底物质量浓度对CGT-SL转化合成AA-2G的影响。如图4,随着底物质量浓度的不断增加,AA-2G的产量也随之增加。当底物质量浓度达到16 g/L时,AA-2G的产量达到最高4.36 g/L。当底物质量浓度超过16 g/L时,AA-2G的产量反而有下降趋势。所以选择底物质量浓度16 g/L进行后续条件优化研究。
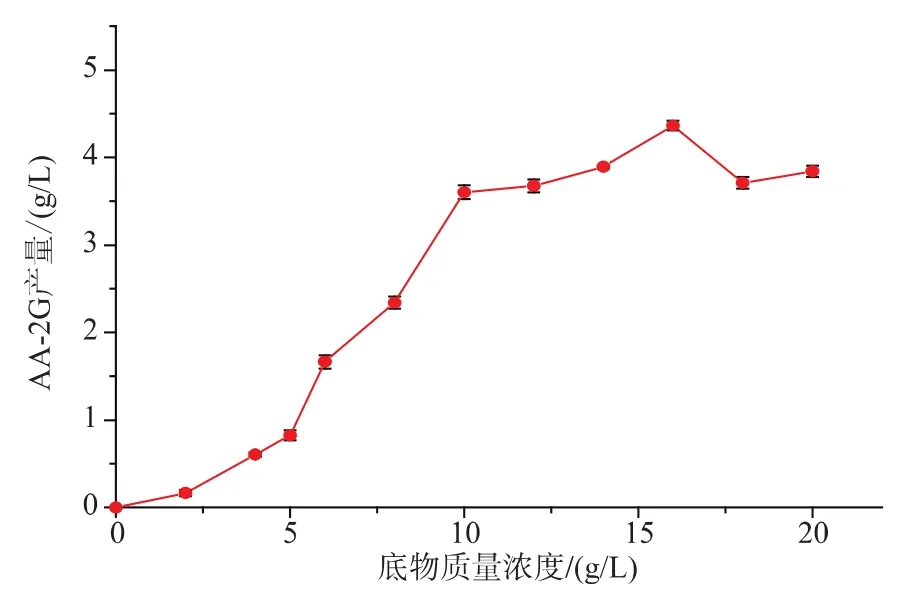
图4 底物浓度对CGT-SL转化合成AA-2G的影响Fig.4 Effect of substrate concentration on synthesis of AA-2G
2.5 底物VC与可溶性淀粉的比例对CGT-SL转化合成AA-2G的影响
VC与可溶性淀粉的比例不同对AA-2G的产量有不同的影响。采用酶浓度为79 U/mL,其它条件和初始反应条件一致,考察VC与可溶性淀粉的质量比对CGT-SL转化合成AA-2G的影响。如图5,当VC与可溶性淀粉的比例为2∶4时,AA-2G的产量最高达到0.826 g/L,VC转化率为21.06%。当VC与可溶性淀粉的质量比为1∶5时,VC转化率为25.08%,高于VC与可溶性淀粉的比例为2∶4时VC的转化率。但AA-2G的产量只有0.48 g/L,较VC与可溶性淀粉的比例为2∶4低。所以,作者选择VC与淀粉的质量比为2∶4进行后续优化研究。
2.6 转化反应时间对CGT-SL转化合成AA-2G的影响
为了考察CGT-SL转化合成AA-2G的最适反应时间,选择酶浓度为79 U/mL,VC质量浓度为16 g/L,VC和淀粉的质量比为2∶4,转化温度为25℃进行转化时间优化。反应过程中分别在不同的时间取样检测AA-2G的含量。如图6,随着转化时间的延长,AA-2G的产量随之增加。当转化反应时间为32 h时,AA-2G的产量达到最高,为4.66 g/L。对应VC转化率为14.90%。当反应时间超过32 h时,AA-2G的产量反而略有下降。所以,作者选择转化时间为32 h进行后续研究。
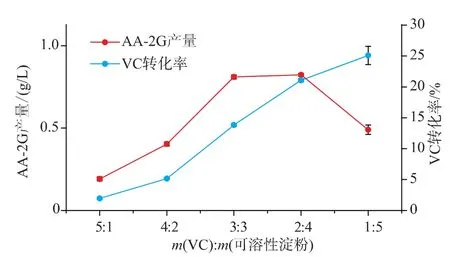
图5 VC与可溶性淀粉的比例对CGT-SL转化合成AA-2G的影响Fig.5 Effect of substrate proportion on the synthesis of AA-2G
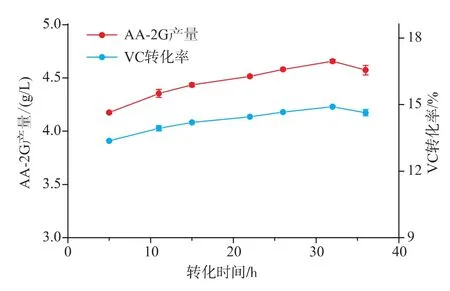
图6 转化反应时间对CGT-SL合成AA-2G的影响Fig.6 Effect of time on AA-2G synthesis
2.7 温度对CGT-SL转化合成AA-2G的影响
反应温度对CGT-SL转化合成AA-2G具有重要影响。选择酶浓度为79 U/mL,VC质量浓度为16 g/L,VC和淀粉的质量比为2∶4,反应时间为32 h进行转化温度优化。作者选取8个不同的温度,考察温度对CGT-SL转化合成AA-2G的影响。如图7,当反应温度为15℃时,AA-2G的产量为5.953 g/L,明显高于其它温度下的产量,VC转化率为19.05%。当温度低于或高于15℃时,AA-2G的产量明显下降。所以,作者选择转化反应温度为15℃。
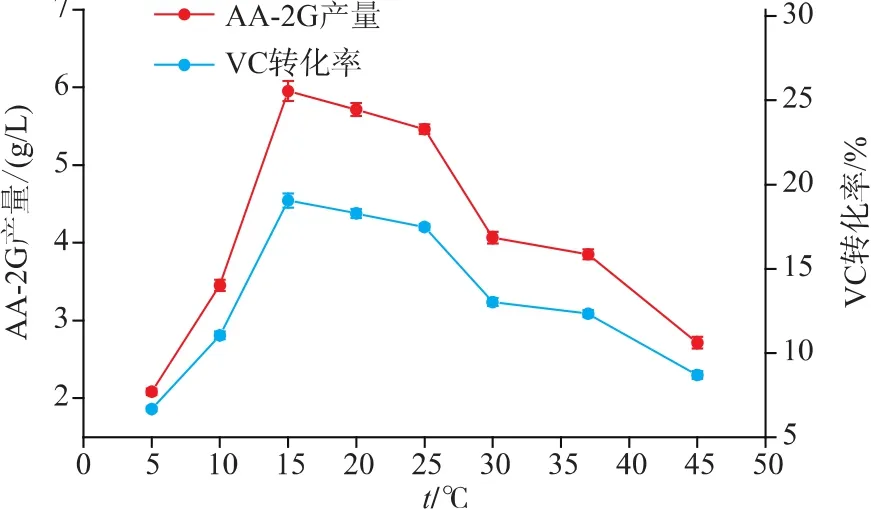
图7 温度对CGT-SL转化合成AA-2G的影响Fig.7 Effect of temperature on AA-2G synthesis
2.8 反应初始pH对CGT-SL转化合成AA-2G的影响
不同的反应初始pH对CGT-SL转化合成AA-2G具有不同的影响,pH过高或过低都可能会造成CGT-SL酶活力损失甚至丧失,进而在转化反应中导致AA-2G的产量下降甚至完全没有。选择酶浓度为79 U/mL,VC质量浓度为16 g/L,VC和淀粉的质量比为2∶4,温度为15℃,反应时间为32 h,改变初始 pH (2.0、3.0、4.0、5.0、6.0), 考察不同 pH 对CGT-SL转化合成AA-2G产量的影响。由图8可以看出,初始pH为4.0时,AA-2G的产量最高,达到6.23 g/L,VC转化率为19.93%。当初始pH低于或高于4.0时,AA-2G的产量有所下降。当初始pH超过6.0时,不再有AA-2G生成,可能是CGT-SL在超过pH 6.0的条件下已经完全失去活力。所以,选择最佳pH 4.0进行转化反应。
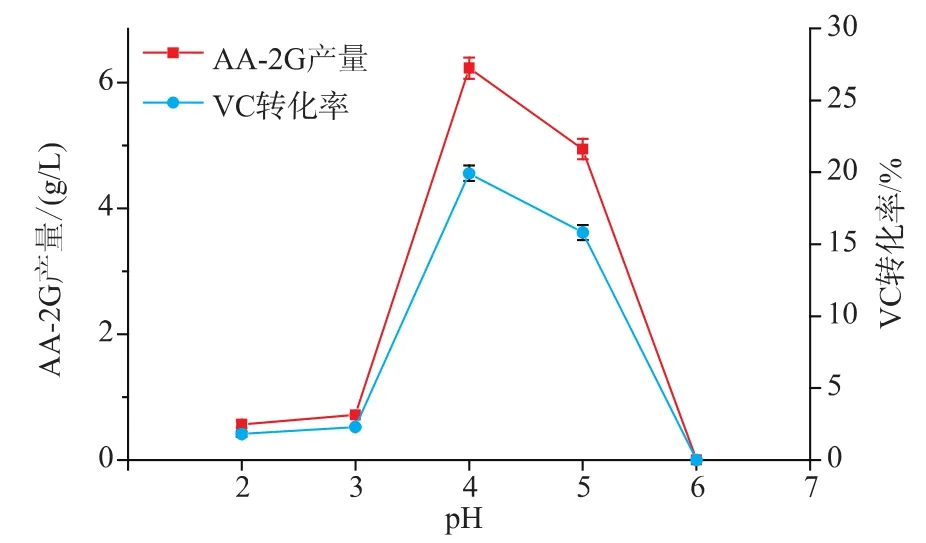
图8 pH对CGT-SL转化合成AA-2G的影响Fig.8 Effect of pH on AA-2G synthesis
2.9 正交试验设计
选取单因素优化中影响相对较大的因素:酶浓度、底物(VC)浓度、pH、温度 4个因素,以 AA-2G的产量为指标,选用L9(34)正交表进行正交试验,各水平因素见表1。
设计9组试验,各组试验结果及方差分析表见表2。由正交试验结果可知,最佳组合为:酶浓度79 U/mL,底物 VC为 14 g/L,pH 4.0,反应温度 20℃,得到AA-2G产量为6.20 g/L,与单因素组合优化的产量相比相差不大。
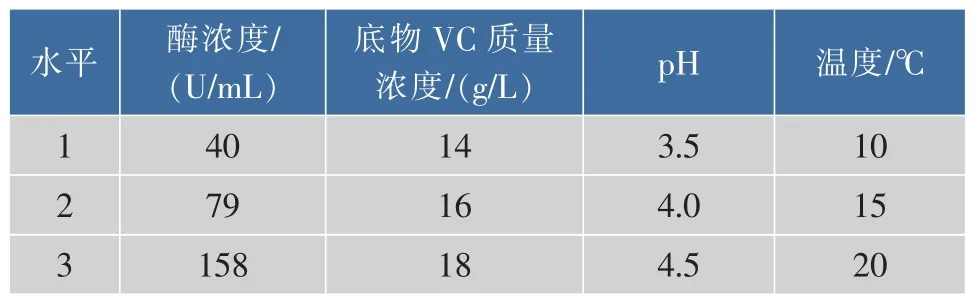
表1 各因素水平表Table 1 Level of various factors
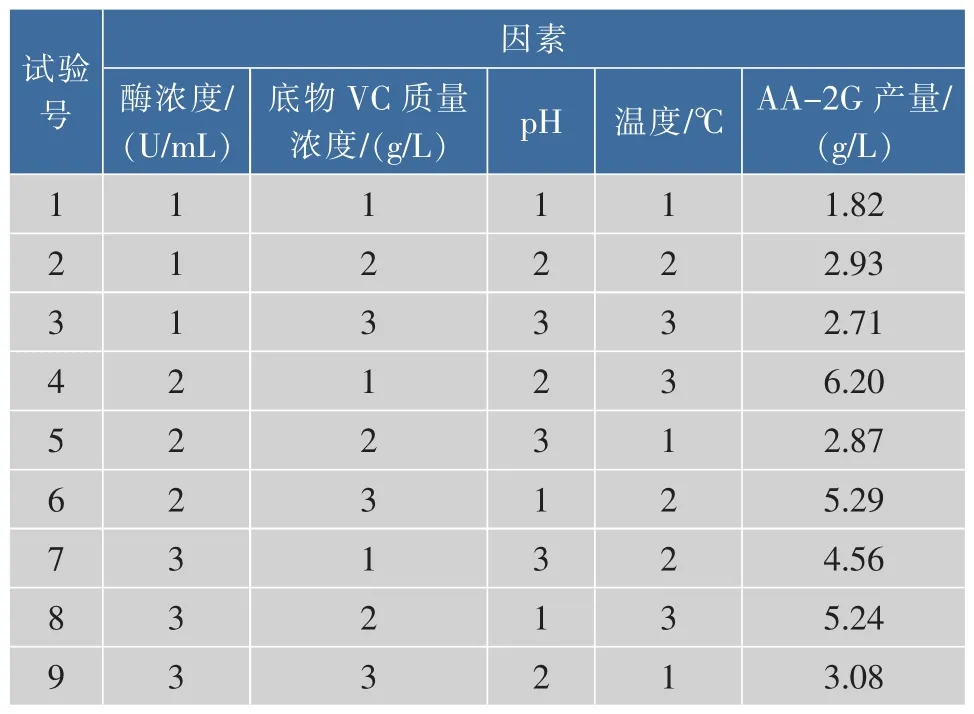
表2 AA-2G产量正交试验结果Table 2 Orthogonal test and the production of AA-2G
3 结 语
作者利用日本田野公司提供的环糊精糖基转移酶(CGT-SL),通过几种不同的糖基供体(β-环糊精、麦芽糖、可溶性淀粉、玉米糊精、蔗糖及葡萄糖)比较研究,发现其不能利用葡萄糖和蔗糖。在初始反应条件下,β-环糊精和可溶性淀粉作为糖基供体,AA-2G的产量分别为1.24 g/L和1.23 g/L。相比于其他糖基供体具有较大优势。从节约成本、糖基供体的溶解度和产量方面考虑,作者最终选择可溶性淀粉作为糖基供体。以可溶性淀粉和VC为底物转化合成AA-2G,产物通过HPLC/LC-MS分析,确定了转化反应液中含有AA-2G。在初始反应条件下,CGT-SL利用可溶性淀粉和VC转化合成AA-2G的产量为1.23 g/L。通过转化条件优化确定了CGT-SL转化合成AA-2G的最佳反应条件:酶浓度为79 U/mL,VC质量浓度为16 g/L,底物VC和可溶性淀粉的质量比为2∶4,最适温度15℃,最适pH 4.0,转化反应时间32 h,最终AA-2G的产量达到6.23 g/L,VC转化率为19.93%。与初始条件下相比,AA-2G的产量提高了4.06倍。
参考文献:
[1]NAIDU KA.Vitamin C in human health and disease is still a mystery?An overview[J].Nutrition Journal,2003,2(1):7.
[2]YAMAMOTO I,TAI A.The current state on development of novel vitamin derivatives[J].Nihon rinsho.Japanese Journal of Clinical Medicine,1999,57(10):2332-2338.
[3]KOUKI M,NORIO M,KYOKO F,et al.Comparison of ascorbic acid and ascorbic acid 2-O-α-glucoside on the cytotoxicity and bioavailability to low density cultures of fibroblasts[J].Biochemical Pharmacology,1992,44(11):2191-2197.
[4]YAMAMOTO I,SUGA S,MITOH Y,et al.Antiscorbutic activity of L-ascorbic acid 2-glucoside and its availability as a vitamin C supplement in normal rats and guinea pigs[J].Journal of Pharmacobio-Dynamics,1990,13(11):688-695.
[5]TATEMOTO H,OOTAKI K,SHIGETA K,et al.Enhancement of developmental competence after in vitro fertilization of porcine oocytes by treatment with ascorbic acid 2-O-α-glucoside during in vitro maturation[J].Biology of Reproduction,2001,65(6):1800-1806.
[6]WAKAMIYA H,SUZUKI E,YAMAMOTO I,et al.In situ intestinal absorption of 2-O-alpha-D-glucopyranosyl-L-ascorbic acid in guinea pigs[J].Journal of Nutritional Science and Vitaminology,1995,41(2):265-272.
[7]YAMASAKI H,NISHI K,MIYAKE T.Process for producing high 2-O-α-D-glucopyranosyl-L-ascorbic acid.US,6576446[P].2003-05-10.
[8]YAMAMOTO I,TANAKA M,MUTO N.Enhancement of in vitro antibody production of murine splenocytes by ascorbic acid 2-O-α-glucoside[J].International Journal of Immunopharmacology,1993,15(3):319-325.
[9]ZHENG M,ENDO T,ZIMMERMANN W.Synthesis of large-ring cyclodextrins by cyclodextrin glucanotransferases from bacterial isolates[J].Journal of Inclusion Phenomena and Macrocyclic Chemistry,2002,44(1-4):387-390.
[10]TANAKA M,MUTO N,YAMAMOTO I.Characterization of Bacillus stearothermophilus cyclodextrin glucanotransferase in ascorbic acid 2-O-α-glucoside formation[J].Biochim Biophy Acta,1991,1078(2):127-132.
[11]Van der Veen BA,Van Alebeek GJ,Uitdehaag JC,et al.The three transglycosylation reactions catalyzed by cyclodextrin glycosyltransferase from Bacillus circulans (strain 251) proceed via different kinetic mechanisms[J].European Journal of Biochemistry,2000,267(3):658-665.
[12]MANDAI T,YONEYAMA M,SAKAI S,et al.The crystal structure and physicochemical properties of L-ascorbic acid 2-glucoside[J].Carbohydrate Research,1992,232(2):197-205.
[13]JUN H K,BAE K M,KIM S K.Production of 2-O-α-D-glucopyranosyl L-ascorbic acid using cyclodextrin glucanotransferase from Paenibacillus sp[J].Biotechnology Letters,2001,23(21):1793-1797.
[14]ZHANG Z C,LI J H,LIU L,et al.Enzymatic transformation of 2-O-α-D-glucopyranosyl-L-ascorbic acid by α-cyclodextrin glucanotransferase from recombinant Escherichia coli[J].Biotechnology and Bioprocess Engineering,2011,16(1):107-113.
[15]AGA H,YONEYAMA M,SAKAI S,et al.Synthesis of 2-O-α-D-glucopyranosyl L-ascorbic acid by cyclomaltodextrin glucanotransferase from Bacillus stearothermophilus[J].Agricultural and Biological Chemistry,1991,55(7):1751-1756.
[16]韩瑞枝.Paenibacillus macerans环糊精葡萄糖基转移酶的分子改造及其合成糖基化维生素C的研究[D].无锡:江南大学,2013.
[17]LI Z,LI B,GU Z,et al.Extracellular expression and biochemical characterization of α-cyclodextrin glycosyltransferase from Paenibacillus macerans[J].Carbohydrate Research,2010,345(7):886-892.
[18]李兆丰.软化类芽孢杆菌α-环糊精葡萄糖基转移酶在大肠杆菌中的表达及其产物特异性分析[D].无锡:江南大学,2009.
[19]RUIZHI H.Molecular engineering of cyclodextrin glycosyltransferase and its application on glycoysl Vitamin C synthesis[D].Wu Xi:jiangnan university,2013.
[20]张子臣.酶法转化合成2-氧-α-D-吡喃葡萄糖基抗坏血酸[D].无锡:江南大学,2010.
