光谱法及分子模拟分析大豆皂苷II与牛血清白蛋白的相互作用
2018-03-27光翠娥桑尚源干建平李志刚
光翠娥, 桑尚源, 干建平, 林 芳, 李志刚
(1.食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122;2.黄冈师范学院 经济林木种质改良与资源综合利用湖北省重点实验室/大别山特色资源开发湖北省协同创新中心,湖北 黄冈438000)
大豆皂苷Ⅱ是一种五环三萜类齐墩果酸型单糖链皂苷,由非极性三萜苷元B的C-3羟基和极性三聚糖分子环状半缩醛上的羟基失水缩合而成,见图1。大豆皂苷Ⅱ是豆制品中皂苷的主要存在形式之一,已被发现具有促甲状腺分泌(保护肝脏)、抑制肾素活性(降低血压)、抗HSV-1疱疹病毒以及增强免疫原性(免疫佐剂)的功能[1]。
牛血清白蛋白(BSA)由582个氨基酸组成,其中包含两个色氨酸(Trp134和Trp212)和16个酪氨酸残基,因此具有荧光活性。BSA的三维结构类似于球状,由3个相似的结构域I、II和III组成,每一个结构域又由A和B两个亚结构域组成。BSA的亚结构域以槽口相对的方式形成圆筒状结构,疏水性氨基酸大多包埋于圆筒内部,构成疏水腔[2]。
BSA是哺乳动物血浆中的主要载体蛋白,具有储存和转运外源性小分子的重要功能。生理活性物质吸收进入体内后,由血清白蛋白通过各种生理膜运输到各组织器官,两者之间结合率与结合能力的不同,会影响到活性物质的作用强度和作用时间[2]。实验选用与人血清白蛋白结构相似、价格便宜、更易提纯的BSA,通过荧光光谱、圆二色光谱及分子模拟等研究活性小分子和BSA相互作用,为大豆皂苷Ⅱ的生物利用提供理论基础。
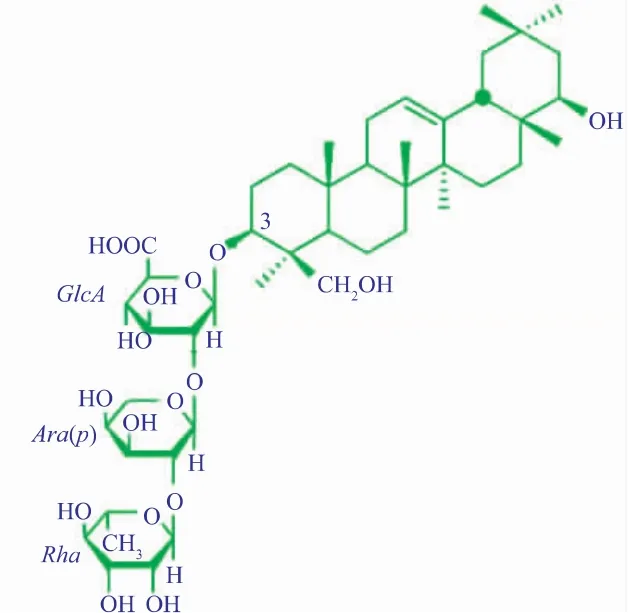
图1 大豆皂苷Ⅱ的化学结构Fig.1 Chemical structure of soyasaponinⅡ
1 材料与方法
1.1 材料与仪器
大豆皂苷Ⅱ(纯度91.7%):美国ChromaDex公司产品;BSA:Sigma公司产品;三羟甲基氨甲烷(Tris):国药集团试剂公司产品。Tris-HCl缓冲液:500 mL的0.1 mol/L Tris溶液中加入约420 mL的0.1 mol/L的盐酸,调节pH至7.4,精确加入5.8 g氯化钠,定容至1 000 mL,4°C保存待用。
FLUORMAX-4荧光光谱仪:美国HORIBA公司产品;MOS-450 AF-CD圆二色光谱仪:法国Bio-Logic公司产品;软件 Discover Studio(DS)2.5、LigPlot+分析软件:美国Accelrys软件公司产品。
1.2 方法
1.2.1 BSA的内源荧光光谱检测 用Tris缓冲液配制BSA与大豆皂苷Ⅱ不同比例的混合液。BSA的最终浓度为1 μmol/L,大豆皂苷Ⅱ的终浓度分别为0、0.5、1、2、4 μmol/L, 混合静置 30 min。 分别吸取200 μL Tris-HCl缓冲溶液 (pH 7.4)和样品注入2 mm比色皿中测定荧光光谱。室温下 (20℃),以295 nm为激发波长,狭缝为5 nm,在300~450 nm波长范围内扫描BSA样品的发射光得到内源荧光光谱图,重复扫描3次取平均值。空白为Tris-HCl缓冲溶液,荧光强度值为扣除空白后的相对值。
1.2.2 BSA的远紫外圆二色光谱检测 分别吸取200 μL Tris-HCl缓冲溶液 (pH 7.4)和样品注入2 mm比色皿中测定圆二色光谱,每次测量扣除Tris-HCl缓冲溶液的背景干扰。室温下(20℃)光谱测定条件是200~250 nm波长范围扫描,扫描速度为20 nm/min,响应时间为 2 s。
1.2.3 分子模拟 在蛋白质数据库 (PDB)中获取BSA晶体的三维结构模型数据文件 (登录号为3v03),使用DS2.5软件删除其中的配体小分子和水分子,补入缺失的氢原子,得到BSA晶体的完整三维结构。大豆皂苷Ⅱ的立体结构数据文件从网站www.chemical-book.com中搜索下载,采用PRODRG网 站 (http://davapc1.bioch.dundee.ac.uk/cgi-bin/prodrg)对大豆皂苷Ⅱ的立体结构进行加电荷和构象优化等预处理。以BSA的Trp213残基为中心,半径为13×10-8cm的球体范围为对接区域,使用DS软件中的Libdock模块进行刚性分子对接。对接程序参数设置如下:Docking Tolerance,0.25;Numbers of Hotspots,100;Docking Preference,High Quality;Conformation Method,FAST;Parallel Processing,False。从大豆皂苷Ⅱ构象集中选取打分函数LibDockscore得分最高者,将其对接复合物的文件导入Ligplot+软件中,得到蛋白与皂苷分子间相互作用网,进一步分析得到氢键和疏水相互作用位点[3]。
2 结果与分析
2.1 不同浓度大豆皂苷Ⅱ对BSA稳态内源荧光光谱的影响
BSA有两个色氨酸残基,一个Trp213在疏水腔内部,另一个Trp134在亚结构域IB表面[4]。以295 nm为激发波长,BSA的内源荧光基团色氨酸产生发射荧光。蛋白质与小分子作用,色氨酸对微环境的变化敏感而使荧光光谱发生改变。在稳态内源荧光光谱图2中,单纯BSA在334 nm出现最大吸收峰,随着大豆皂苷Ⅱ的添加,最大发射波长略微蓝移至333 nm;在BSA与大豆皂苷Ⅱ比例为1∶1、1∶2和1∶4时,峰型不变,但出现荧光猝灭,BSA荧光谱特征峰的相对强度为98%、98%和97%。因此,大豆皂苷Ⅱ与BSA发生弱相互作用,使色氨酸残基的微环境的疏水性增加,蛋白质分子构象发生改变,形成了发射弱的荧光复合体。
2.2 不同浓度大豆皂苷Ⅱ对BSA圆二色光谱的影响
蛋白质生色团的光活性中心对平面圆偏振光中的左、右圆偏振光的吸收不同,造成透射后偏振光矢量的振幅差,圆偏振光变成椭圆偏振光,即为圆二色性,不同波长对应的椭圆率称为圆二色光谱,小于250 nm的远紫外区圆二色光谱反映蛋白质肽键的圆二色性[5]。在圆二色光谱图3中,靠近209 nm和221 nm处出现的两个负肩峰为单纯BSA分子α螺旋结构的特征峰,吸收峰的强度可以反映蛋白α螺旋的变化。随着大豆皂苷Ⅱ(特别是4倍的皂苷)的加入,BSA的圆二色光谱的负椭圆率下降,原209 nm处的负峰移向高波数并且振幅减弱,说明皂苷的疏水作用引起微构象的变化,使肽链伸展,改变了BSA的二级结构。
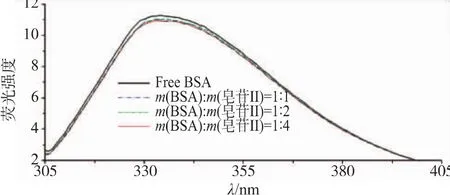
图2 不同浓度大豆皂苷Ⅱ对BSA内源荧光光谱的影响Fig.2 Fluorescencespectra ofBSA with different concentrations of soyasaponinⅡ

图3 大豆皂苷Ⅱ-BSA混合溶液的远紫外圆二色光谱图Fig.3 Far-UV CD spectra of the soyasaponin-BSA solutions
2.3 大豆皂苷Ⅱ与BSA相互作用的分子对接
DS工作站中Libdock模块的对接吻合度打分函数LibDockscore是对几何形状、化学环境以及能量的综合评价参数,也是根据配体与受体对接时的对接模式、亲和力和相对能量值等进行综合打分。LibDockscore大于100表示配体与受体能较好地结合,其值越大则表明对接产生的复合物构象越稳定,Poses是与配体受体蛋白对接时所得配体的构象数[3]。当大豆皂苷Ⅱ与BSA对接时,所得立体构象总数 Poses为 97,LibDockscore最高分为 188.485,表明两者可较好地稳定结合,所得复合物构象稳定。选取LibDockscore评分最高的构象,制作分子对接三维图。图4中,绿色为色氨酸残基,透明球中的线型模型分子为大豆皂苷Ⅱ的最优对接构象,由此可知皂苷处于“心型”BSA的疏水腔内。
2.4 大豆皂苷Ⅱ和BSA间的氢键和疏水相互作用
运用Ligplot+软件,得到最佳复合物分子间相互作用二维图,并通过HBPLUS程序计算氢键和疏水作用[6]。根据图5,表1总结了稳定的氢键作用,由此可知,BSA中的 4个氨基酸 Asp108、Asp111、Arg144及Arg458与大豆皂苷Ⅱ形成了6个氢键,其中Arg144与O46形成的氢键最短。同样地,从二维图5可知,BSA中的 15氨基酸 Ser109、Pro110、His145、Pro146、Leu189、Thr190、Ala193、Gln424、Ser428、Lys431、Val432、Arg435、Tyr451、Leu454 及 Ile455 参与了与大豆皂苷Ⅱ的疏水作用。
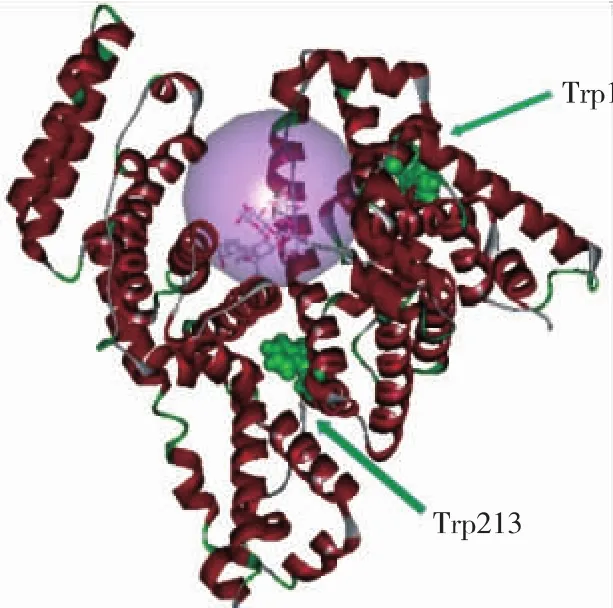
图4 大豆皂苷Ⅱ与BSA的对接三维图Fig.4 Molecular docking 3D-diagram of soyasaponinⅡand BSA
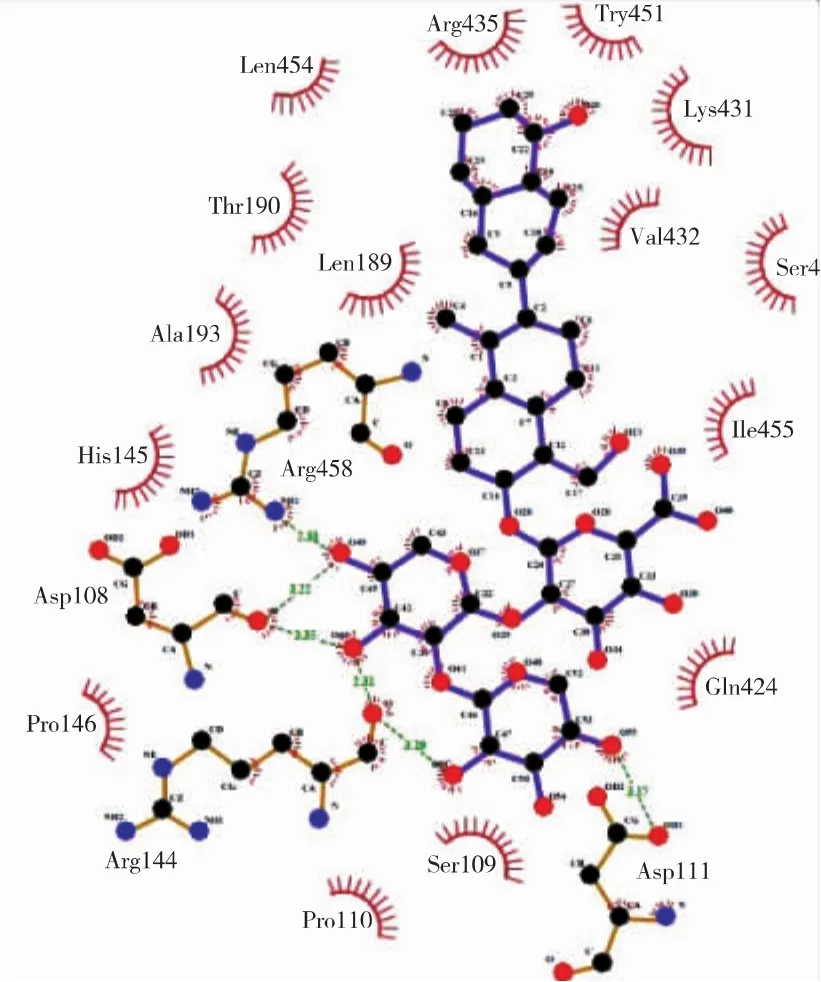
注:实心圆代表原子:红色为氧原子,黑色为碳原子,蓝色为氮原子。原子间的实线代表化学键:黄色为氨基酸残基的化学键,紫色为配体化学键。带标签的氨基酸代表BSA中与大豆皂苷Ⅱ相互作用的残基:红色并带有辐射状短线弧线的为参与疏水作用的残基,其它为参与氢键的残基,绿色虚线代表氢键作用。
根据以上相互作用的分析,使用DS工作站得到氢键和疏水相互作用的三维图。图6(a)中,大豆皂苷Ⅱ的三糖基链中第二个阿拉伯糖基、第三个鼠李糖基与BSA氨基酸残基有氢键作用。图6(b)中,参与疏水作用的氨基酸在BSA内部组成一个疏水性腔体(即代表静电中性点白色部分),大豆皂苷Ⅱ的疏水性配基齐墩果烷伸进BSA的这个疏水腔内,两者产生了疏水相互作用。
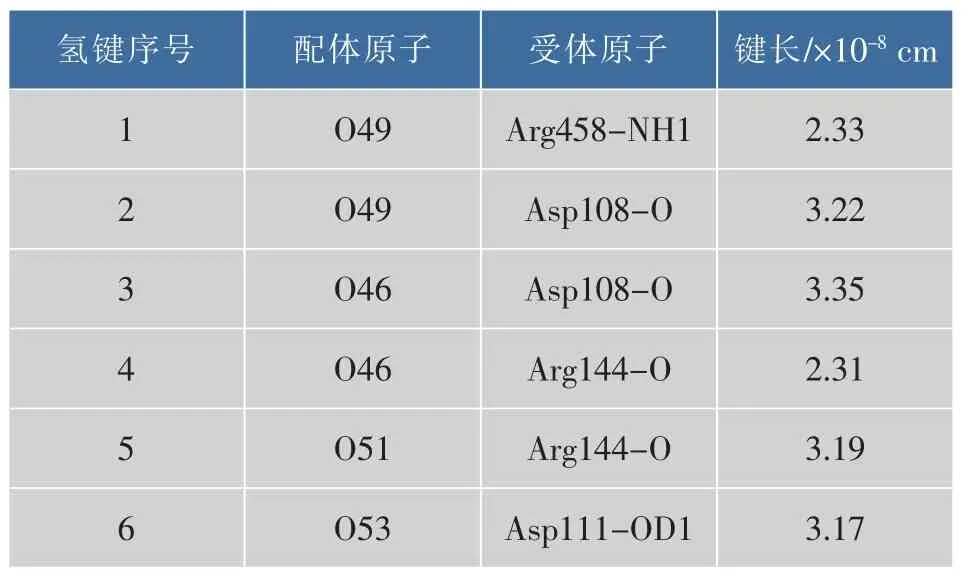
表1 大豆皂苷Ⅱ与BSA分子间氢键作用Table 1 Hydrogen bond interaction between soyasaponinⅡand BSA
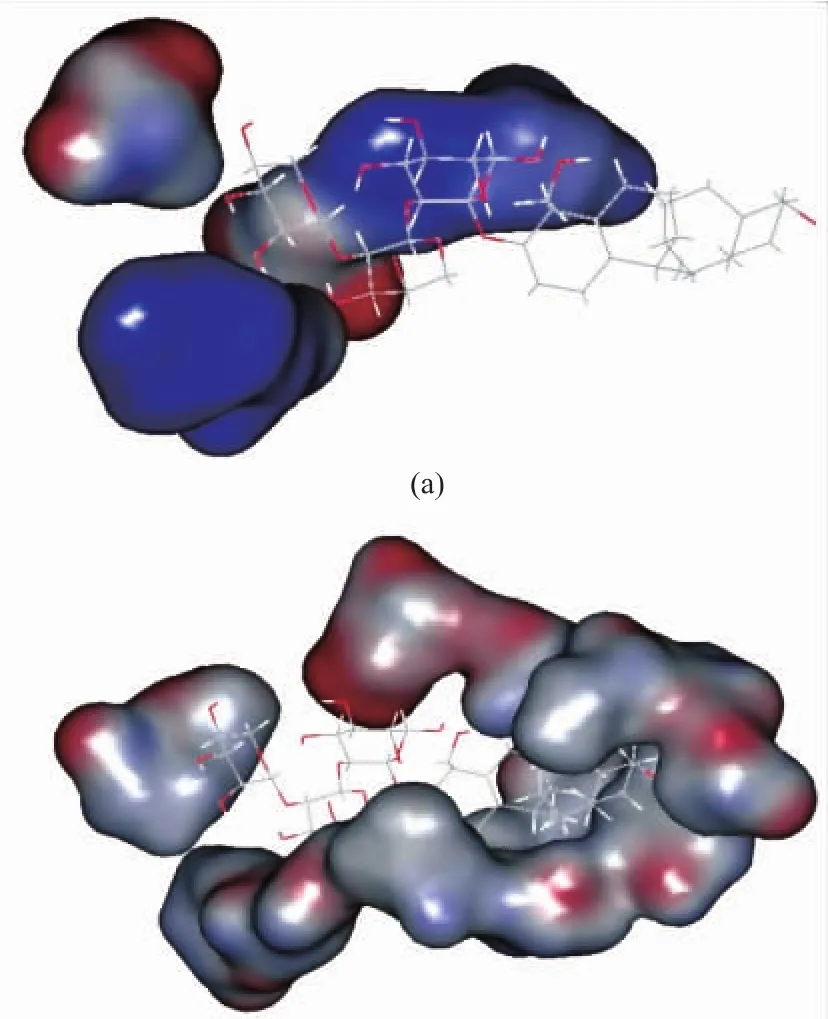
图6 大豆皂苷Ⅱ与BSA分子间氢键和疏水作用三维图Fig.6 3D diagrams of hydrogen bond and hydrophobic interactions between soyasaponinⅡand BSA
3 结 语
通过内源荧光光谱、圆二色光谱和分子建模方法研究了大豆皂苷Ⅱ与BSA之间的相互作用。BSA的内源荧光光谱表明蛋白与大豆皂苷Ⅱ作用后其立体构象发生变化,圆二色光谱显示大豆皂苷Ⅱ还对BSA的二级结构产生影响。计算机模拟分子对接表明大豆皂苷Ⅱ与BSA的结合稳定性较好,大豆皂苷Ⅱ的三糖基链中阿拉伯糖基和鼠李糖基部分与BSA形成氢键作用,参与其中的重要氨基酸有Asp108、Asp111、Arg144和 Arg458残基, 皂苷的配基三萜烯部分与BSA的15个氨基酸残基形成疏水相互作用。这些研究阐明了大豆皂苷Ⅱ与BSA的结合特点,为进一步开发大豆皂苷提供了参考依据。
参考文献:
[1]GUANG Cuie,CHEN Jie,SANG Shangyuan,et al.Biological functionality of soyasaponins and soyasapogenols[J].Journal of Agricultural and Food Chemistry,2014,62(33):8247-8255.
[2]唐金艳.光谱法研究三种药物与BSA的相互作用[D].黄石:湖北师范学院,2011.
[3]ZHANG Hailing,GUANG Cuie,JIANG Bo,et al.Molecular docking of soyasaponin I and its analogues with renin and the analysis of binding energy[J].Journal of Food Science and Biotechnology,2014,33(10):1056-1062.(in Chinese)
[4]MAJOREK K A,POREBSKI P J,DAYAL A,et al.Structural and immunologic characterization of bovine,horse,and rabbit serum albumins[J].Molecular Immunology,2012,52(3-4):174-182.
[5]SHEN Xingcan,LIANG Hong,HE Xiwen,et al.Recent trends and spectroscopic methods for analysis of the protein conformation with circular dichroism[J].Chinese Jounral of Analytical Chemistry,2004,32(3):388-394.(in Chinese)
[6]LASKOWSKI R A,SWINDELLS M B.LigPlot+:Multiple ligand-protein interaction diagrams for drug discovery[J].Journal of Chemical Information and Modeling,2011,51(10):2778-2786.
