基于面包酵母中海藻糖提取工艺优化及菌株筛选的高密度培养工艺
2018-03-20洪厚胜窦冰然郭会明
洪厚胜,窦冰然,郭会明
(1.南京工业大学生物与制药工程学院,江苏 南京 211816;2.南京工业大学化学与分子工程学院,江苏 南京 211816)
海藻糖亦可称作漏芦糖。其结构稳定,无毒性,是一种安全、可靠的天然糖类。海藻糖具有3 种异构体,包括α,α-海藻糖、β,β-海藻糖和α,β-海藻糖,但在自然界生物体内仅发现有α,α-海藻糖[1-3]。海藻可在高温、高压、干燥等环境下在细胞膜外产生保护膜,因而细胞中所含有海藻糖的含量越多,可有效提高细胞耐受性。面包酵母主要为活性干酵母的制备提供生产菌种,活性干酵母下游生产工艺中包括干燥脱水环节,对酵母细胞的活性会造成一定损失,高细胞耐受性可提高干燥脱水后活性干酵母的活菌率及发酵力[4-6]。相对于高效液相色谱(high performance liquid chromatography,HPLC)法及蒽酮比色法,酶-3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法测定酵母胞内海藻糖不受实验设备的限制,测定结果不易产生波动,结果较为精确[7-11]。以微波-浸提法利用微波破碎酵母细胞膜再通过三氯乙酸浸提细胞中的海藻糖,可有效保证酵母中的海藻糖被充分提取出来,进而将该工艺用于筛选高产海藻糖酵母,能够进一步提高实验的准确性[12-14]。
酵母的高密度培养特指酵母发酵液中菌体质量浓度在100 g/L之上的一种发酵方法[15-16],高密度培养的核心是在于选择合适的流加策略消除Crabtree效应。林俊涵[17]通过控制培养基中的底物浓度与成分组成,并在发酵过程成适时调节pH值,采用变温发酵方法,有效提高发酵液里的溶氧量,间歇地利用指数流加法流加培养基,将毕赤酵母产外源蛋白的产量提高了10%。郑苗等[18]调节了东方伊萨酵母的发酵培养基成分比例,并对摇床培养条件参数进行了优化,通过间歇发酵的方法实验发现可提高菌体数到1.71×109CFU/mL。面包酵母高密度培养的要求是在整个发酵周期尽可能多地得到酵母菌体,并且保证面包酵母的发酵力和活性,不能只追求高产量而忽视酵母本身的质量,如果面包酵母因高密度培养后发生老化现象或者活菌数过低,同样无法达到面包酵母的质量要求。能够影响面包酵母高密度培养的因素非常多,除去酵母细胞本身的菌体质量和活性,即接种进发酵罐中的面包酵母种子液的质量之外,外流加发酵过程中,各个培养阶段的碳源、氮源和磷源的流加量、发酵罐中发酵液的pH值、控温、发酵液中的溶解氧情况、消泡剂的添加量和一些促进面包酵母生长的促进因子如Mg2+都会决定面包酵母是否能够进行高密度培养[18-24]。首先在50 L自吸式发酵罐中采用溶氧反馈流加的碳源流加工艺进行发酵,在现有工艺的基础上改进营养源流加工艺,采用称量补料的方式对酵母培养中流加的碳源、氮源及磷源通过酵母生成量精确补料,有效提高面包酵母培养中的最大菌体浓度,并通过多次重复对该工艺进行了稳定性实验。同时,通过控制发酵过程中不同的乙醇体积分数水平,对比酵母生长曲线,确定了面包酵母培养过程中的最适乙醇体积分数,通过一系列流加工艺的优化,解除面包酵母发酵过程中的底物抑制,达到面包酵母高密度培养的目的,面包酵母为制备活性干酵母实验菌种,通过高含海藻糖菌株的筛选及高密度培养工艺的研究,为下游活性干酵母的制备提供了良好的耐受菌种及高质量的发酵液,为活性干酵母工业化生产提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种及试剂
安琪高活性干酵母由安琪酵母股份有限公司提供;面包酵母即酿酒酵母CICC 1532由中国工业微生物菌种保藏中心提供。
海藻糖酶(303 000 U/g) 上海普迈生物科技有限公司;海藻糖 国药集团化学试剂有限公司;糖蜜柳州市金黔湾糖蜜有限公司。
1.1.2 培养基
斜面培养基(酵母膏胨葡萄糖(yeast extract peptone dextrose,YPD)固体培养基):葡萄糖2 g/100 mL,酵母膏1 g/100 mL,蛋白胨2 g/100 mL,琼脂1.5~1.7 g/100 mL。
摇瓶培养基(YPD液体培养基):葡萄糖2 g/100 mL,蛋白胨2 g/100 mL,酵母膏1 g/100 mL。
发酵培养基:1)溶氧反馈流加:处理稀释后含糖量25%的甘蔗糖蜜37%,尿素(含氮量10 g/100 mL)14%,磷酸二氢铵(含磷量以P2O5计)1.2%,MgSO47.5 g,VB10.2 g,VB50.2 g,VB60.2 g,生物素0.1 g。2)称质量流加:糖蜜的处理:将甘蔗糖蜜稀释至23~25 °Bx,用硫酸调节pH值至5左右,加热煮沸至95 ℃,通风30 min后,保温70~80 ℃,静置8~12 h,使用前121 ℃,灭菌20 min;尿素:将尿素稀释为含氮量10 g/100 mL的溶液;磷酸二氢铵:将磷酸二氢铵稀释为以P2O5计含磷量10 g/100 mL的溶液;维生素及生物素的添加:在对发酵罐(含底水12.5 L)进行实消后添加VB10.2 g,VB50.2 g,VB60.2 g,生物素0.1 g。
1.2 仪器与设备
UVmini-1240紫外-可见分光光度计 日本岛津制作所;TGL-20B高速台式离心机 上海安亭科学仪器厂;50 L机械搅拌玻璃发酵罐 南京汇科生物工程设备有限公司;ZQWY-200全温振荡培养箱 上海知楚仪器有限公司;HH-2数显电子恒温水浴锅 江苏省金坛市宏华仪器厂;M1-L213B微波炉 美的微波炉制造有限公司。
1.3 方法
1.3.1 酵母内海藻糖的测定方法(酶-DNS法)的建立
首先利用DNS法进行葡萄糖标准曲线的制作[25],根据实验数据进行线性回归分析,得到回归方程:y=0.804 8x-0.044 3,R2=0.999 3,其线性高度显著。根据实验测定0.1%的海藻糖溶液分解后葡萄糖质量浓度为1.29 g/mL,代入换算式可知海藻糖分解后产生的葡萄糖量为原海藻糖含量的1.29 倍(n=1.29)。
1.3.2 酵母内海藻糖的酶-DNS法测定
称取1 g海藻糖存放在表面皿中,在110 ℃烘箱中烘干2 h。配制0.1 g/L海藻糖溶液。在25 mL定容比色管中加入0.1 g/L海藻糖溶液0.25 mL、海藻糖酶3.03 U及0.1 mol/L柠檬酸-柠檬酸钠缓冲溶液(pH 5.6)0.25 mL,混合均匀后置于40 ℃恒温水浴中反应1 h。反应完成后加入0.75 mL DNS溶液、0.5 mL蒸馏水,沸水浴中精确反应5 min,冷却到室温,定容至25 mL,以蒸馏水代替海藻糖作为空白对照,用紫外分光光度计在540 nm波长处测定其光密度值,对照DNS法测定葡萄糖标准曲线计算得到生成的葡萄糖含量,换算得出海藻糖含量。
酶-DNS法测定活性干酵母胞内海藻糖实验步骤:活性干酵母微波-浸提处理后,测得酶解前葡萄糖质量浓度,利用海藻糖酶酶解酵母胞内海藻糖测得酶解后葡萄糖质量浓度,计算增加的葡萄糖质量浓度,由下式得出海藻糖质量浓度:
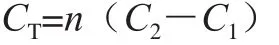
式中:CT为海藻糖质量浓度;C1、C2为酶解前、后的葡萄糖质量浓度;n为比例系数。
1.3.3 活性干酵母的胞内海藻糖提取工艺优化
1.3.3.1 单因素试验设计
通过单因素试验,对1.5 g活性干酵母胞内海藻糖提取工艺进行优化,设置5 个微波功率,分别为119、231、385、539、700 W(微波时间40 s、三氯乙酸浓度0.5 mol/L、三氯乙酸体积60 mL、浸提温度40 ℃、浸提时间120 min);5 个微波时间水平,分别为20、40、60、80、100 s(微波功率231 W、三氯乙酸浓度0.5 mol/L、三氯乙酸体积60 mL、浸提温度40 ℃、浸提时间120 min);5 个三氯乙酸浓度水平,分别为0.1、0.3、0.5、0.7、0.9 mol/L(微波功率231 W、微波时间40 s、三氯乙酸体积60 mL、浸提温度40 ℃、浸提时间120 min),5 个三氯乙酸体积水平,分别为20、40、60、80、100 mL(微波功率231 W、微波时间40 s、三氯乙酸浓度0.5 mol/L、浸提温度40 ℃、浸提时间120 min);5 个浸提温度水平,分别为10、25、40、55、70 ℃(微波功率231 W、微波时间40 s、三氯乙酸浓度0.5 mol/L、三氯乙酸体积60 mL、浸提时间120 min);5 个浸提时间水平,分别为30、60、90、120、150 min(微波功率231 W、微波时间40 s、三氯乙酸浓度0.5 mol/L、三氯乙酸体积60 mL、浸提温度40 ℃)。按照设定条件分别对1.5 g活性干酵母中的海藻糖进行提取,对比得到的海藻糖含量。设置3 次重复。
1.3.3.2 正交试验设计
为了进一步优化海藻糖提取工艺,在单因素试验的基础上,进行五因素三水平的正交试验,选取微波功率、微波时间、三氯乙酸浓度、三氯乙酸体积、浸提温度5 个因素,每个因素设置3 个水平,以在活性干酵母中提取的海藻糖含量作为评价指标进行正交试验,设置3 次重复,各因素与水平设计见表1。

表1 正交试验因素与水平Table 1 Levels of independent variables used for orthogonal array design
1.3.4 高产海藻糖面包酵母菌株的筛选
将斜面保藏的面包酵母菌种在超清工作台中用接种环接于YPD固体培养基上,30 ℃恒温培养培养2 d,挑取10 株单菌落进行斜面保藏,分别接种于装液量为40.0 mL的250 mL的装有YPD液体培养基的三角瓶内,30 ℃、200 r/min摇床振荡培养24 h。将培养的面包酵母菌种液10 000 r/min离心10 min,弃去上清液,分别称取1.5 g离心后酵母乳,使用优化后的微波-浸提工艺进行海藻糖提取,并测定其中海藻糖含量并进行对比。
1.3.5 50 L自吸式发酵罐溶氧反馈流加工艺
取一环斜面保藏的面包酵母菌种于一级种子培养基,以30 ℃、200 r/min YPD液体培养基摇瓶培养24 h为条件制备一级种子液;取一级种子液以接种量10%以30 ℃、200 r/min YPD液体培养基制备二级种子液2.5 L,将二级种子液接于50 L自吸式发酵罐中,以溶氧反馈流加方式,即当溶氧量快速上升为时间节点流加糖蜜,发酵26 h后,每2 h取样测定酵母湿质量浓度,绘制酵母发酵曲线。
1.3.6 50 L自吸式发酵罐称量补料高密度培养工艺
用1 L摇瓶以麦芽汁液体培养基(pH 4.8)培养,摇瓶装液量8.4%,接种量7.4%,摇床培养,培养温度30 ℃,转速200 r/min,培养10~12 h,至酵母湿质量浓度为35~37 g/L,制备二级种子液2.5 L;将上述种子液接种进含有12.5 L底水(VB10.2 g,VB50.2 g,VB60.2 g,生物素0.1 g)的50 L自吸式发酵罐中,以接种前一刻标定溶氧电极溶氧量为100%;糖蜜流加量按照发酵罐中当前酵母干质量的2.3倍添加,发酵结束前2 h,将糖蜜添加量减少50%~60%,直至发酵结束停止流加,尿素流加量为8 g/h,20 h后停止流加,磷酸二氢铵流加量为3 g/h,16 h后停止流加,每8 h加入25 g MgSO4,共加入3 次;发酵过程中通风量前9 h控制为以300 L/h为初始通风量,逐渐增加至2 400 L/h,直至发酵结束前1 h,减少至1 800 L/h;发酵过程中0~16 h发酵温度控制在31 ℃,16~21 h控制在32 ℃,22~24 h控制在33 ℃;发酵过程中前8 h,pH值控制在4.3~4.8之间,发酵中期控制在4.5~4.8之间,发酵结束前2 h控制在5.0~5.2之间;发酵26 h停止发酵,发酵过程中每2 h测定酵母湿质量浓度(10 000 r/min离心10 min)、乙醇体积分数、溶氧量、残糖量。
1.3.7 面包酵母高密度培养工艺稳定性实验
将上述称质量补料流加工艺在50 L自吸式发酵罐中进行5 批次重复实验对比发酵后最大酵母湿质量浓度,考察工艺稳定性。
1.3.8 乙醇体积分数对面包酵母高密度培养的影响
设定高密度培养过程中12 h后控制乙醇体积分数的不同水平,考察酵母的生长情况。将乙醇体积分数水平分别维持在4%、3%、2%、1.5%、1.0%、0.7%的水平线上每2 h测定乙醇体积分数及酵母湿质量浓度,对比酵母生长曲线。
1.3.9 发酵过程中参数测定
酵母湿质量浓度测定:离心称质量法;残糖量测定:DNS法;乙醇含量测定:蒸馏法;菌体数、发酵力测定:参照GB/T 20886—2007《食品加工用酵母》;溶氧量通过发酵罐中溶氧电极测定。
2 结果与分析
2.1 微波-浸提法提取活性干酵母内海藻糖工艺优化
2.1.1 微波功率对海藻糖含量的影响

图1 微波功率对海藻糖含量的影响Fig. 1 Effect of microwave power on the yield of trehalose
由图1可知,当微波功率为231 W时,可测得的活性干酵母中海藻糖含量最高,当微波功率小于231 W时,海藻糖含量逐渐减少,当功率大于231 W时,海藻糖含量随着功率的增加而降低。这可能是由于功率较小时无法破碎酵母细胞释放出海藻糖,而微波功率过大会导致酵母胞内海藻糖成分被破坏。
2.1.2 微波时间对海藻糖含量的影响
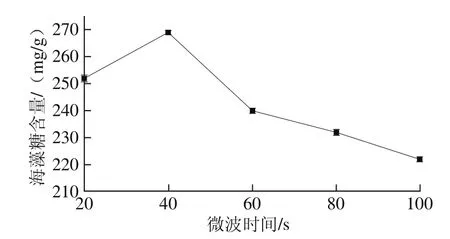
图2 微波时间对海藻糖含量的影响Fig. 2 Effect of microwave treatment duration on the yield of trehalose
由图2可知,微波时间为40 s时,测定得到活性干酵母内的海藻糖含量最高,微波时间小于40 s,海藻糖含量随着时间的推移而提高,当时间超过40 s时,海藻糖含量随着微波时间的延长而降低。由此确定微波时间为40 s。
2.1.3 三氯乙酸浓度对海藻糖含量的影响
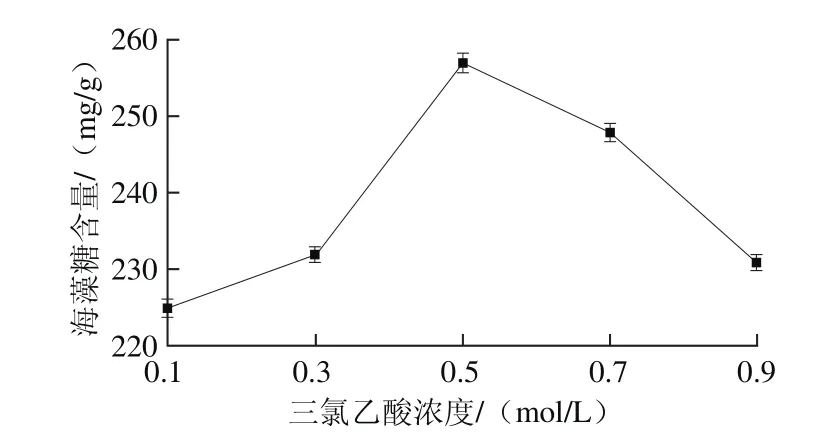
图3 三氯乙酸浓度对海藻糖含量的影响Fig. 3 Effect of trichloracetic acid concentration on the yield of trehalose
由图3可以看出,三氯乙酸浓度对海藻糖含量的影响表现为先升高后减少,当使用0.5 mol/L的三氯乙酸进行提取时,测得的海藻糖含量最高,因此确定最适三氯乙酸浓度为0.5 mol/L。所使用的三氯乙酸溶液的浓度较大时,可以促进蛋白质完全分离,海藻糖的灭酶效果也更加显著,但是三氯乙酸浓度过大,会出现酵母细胞壁发生皱缩的现象,降低海藻糖的溶出量,测得的海藻糖含量减少[26]。
2.1.4 三氯乙酸体积对海藻糖含量的影响
图4显示,当提取出1.5 g活性干酵母中的海藻糖时,加入60 mL三氯乙酸,得到海藻糖含量最大。当使用超过60 mL的三氯乙酸时,海藻糖提取量开始减少。由此确定最佳的三氯乙酸体积为60 mL。使用的三氯乙酸体积过少,无法充分提取出酵母中的海藻糖,但是三氯乙酸用量过大,会对海藻糖的提取产生抑制作用。

图4 三氯乙酸体积对海藻糖含量的影响Fig. 4 Effect of trichloracetic acid volume on the yield of trehalose
2.1.5 浸提温度对海藻糖含量的影响
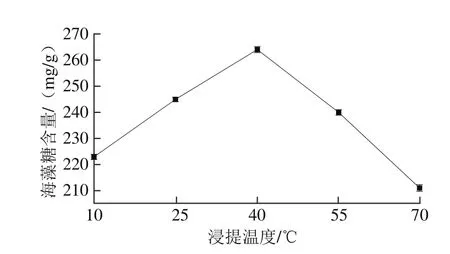
图5 浸提温度对海藻糖含量的影响Fig. 5 Effect of extraction temperature on the yield of trehalose
由图5可知,当浸提温度逐渐提高时,从活性干酵母中提取的海藻糖含量先增加之后又开始降低,分析可知伴随浸提温度的提高,加速了海藻糖从细胞中的溶出速度,但是过高的反应温度会破坏其中结构;当浸提温度为40 ℃时,测得的海藻糖含量最高。因此,最佳浸提温度为40 ℃。
2.1.6 浸提时间对海藻糖含量的影响

图6 浸提时间对海藻糖含量的影响Fig. 6 Effect of extraction time on the yield of trehalose
根据图6,根据浸提时间的延长,海藻糖的含量呈现随时间推移而增加的态势。当浸提时间在120~150 min范围内,海藻糖的含量已基本保持不变,曲线上升趋于平稳。这是因为微波处理会破碎酵母的细胞壁,提高了海藻糖的释放速率。因此,最佳浸提时间确定为150 min。
2.1.7 正交试验设计优化微波-浸提法提取酵母胞内的海藻糖提取工艺
确定以微波功率、微波时间、三氯乙酸浓度、三氯乙酸体积、浸提温度进行正交试验,因为浸提时间在120~150 min范围内对海藻糖的提取含量影响不大,所以选取150 min为最佳浸提时间。正交试验设计与结果见表2。
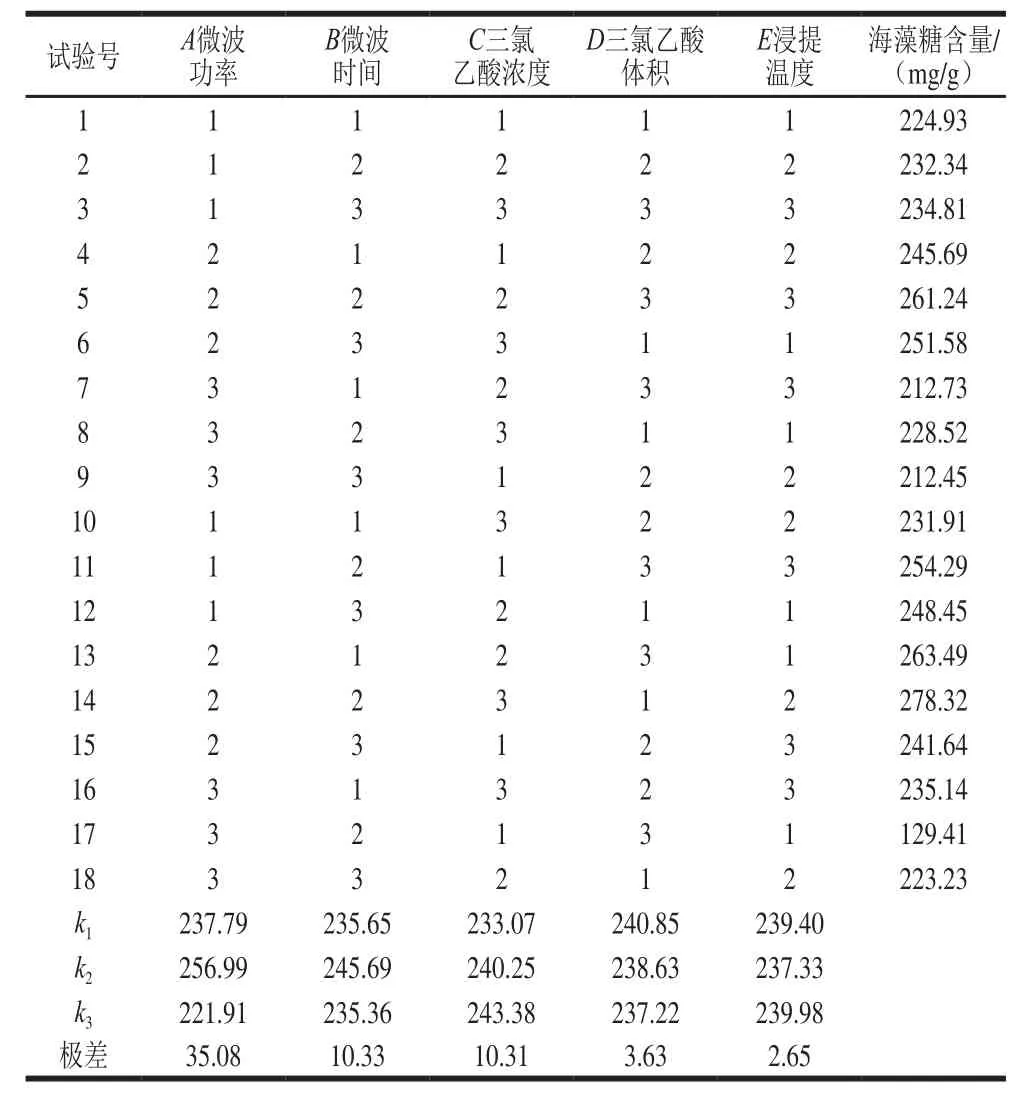
表2 正交试验设计与结果Table 2 Orthogonal array design with experimental results
由表2可以看出,对海藻糖提取工艺最大的影响因素是微波功率,之后为微波时间、三氯乙酸浓度、三氯乙酸体积,影响最小的因素是浸提温度。最优组合为A2B2C3D1E3,最优条件为:微波功率231 W、微波时间40 s、三氯乙酸浓度0.7 mol/L、三氯乙酸体积40 mL、浸提温度55 ℃、浸提时间150 min。该工艺条件下得到的海藻糖含量为280.15 mg/g,比优化前提高15.2%。
2.2 高产海藻糖面包酵母菌株的筛选

图7 10 株面包酵母菌株高产海藻糖筛选Fig. 7 Comparison of intracellular trehalose contents in 10 baker’s yeast
根据图7可以得出,7号面包酵母菌株胞内海藻糖含量相对高于其他菌株,海藻糖含量增高可确保面包酵母下游工艺的顺利进行,因此确定7号菌株为最佳菌种并进行斜面保藏,为下一步高密度培养作为实验菌种。
2.3 50 L自吸式发酵罐溶氧反馈流加工艺
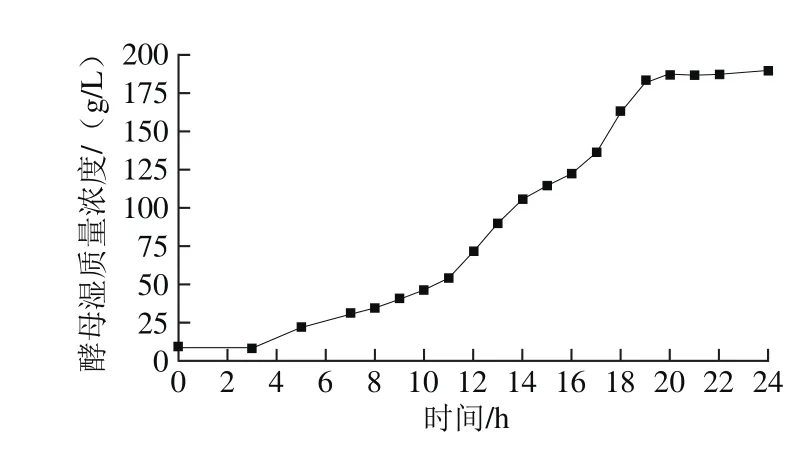
图8 面包酵母50 L自吸式发酵罐中溶氧反馈流加Fig. 8 Wet yeast biomass during fed-batch fermentation with feedback control of dissolved oxygen concentration
如图8所示,采用糖蜜溶氧反馈流加的发酵工艺用于50 L自吸式发酵罐培养面包酵母,在实验过程中只对碳源进行流加,其他营养源、维生素、生物素均进行一次性补料。采用溶氧反馈流加的方式在溶氧快速上升的节点代表发酵罐中的酵母的呼吸作用开始减弱,发酵液中的残糖无法保证发酵的顺利进行,此时开始流加糖蜜,恰好可以对碳源进行补充,给酵母生长提供足够的能量,在加入糖蜜后,可以观察到溶氧量再次回到20%~30%之间的水平上,酵母的代谢情况正常,残糖量与乙醇体积分数也在正常允许范围之内,这种补料方式充分考虑到了酵母对于残糖的利用问题,避免了残糖过多或者残糖不足造成的酵母发生无氧呼吸产生酒精的问题,实验证明,在50 L发酵罐中,培养过程中残糖量、乙醇体积分数小于1.5%,进入对数生长期之后发酵液中的溶氧量保持在20%~30%内。发酵完成时最大酵母湿质量浓度为198.34 g/L。
2.4 50 L自吸式发酵罐称量补料高密度培养
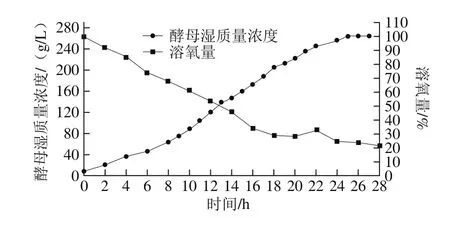
图9 面包酵母称质量补料流加中酵母湿质量浓度与溶氧情况Fig. 9 Wet yeast biomass and dissolved oxygen concentration during fed-batch fermentation with nutrient feeding
由图9可以看出,溶氧反馈流加可以得到较大的酵母湿质量浓度,但是如果需要进一步提高菌体浓度,就应探索新的流加方式,单一流加碳源已无法满足面包酵母的生长所需,尿素及磷酸二氢铵作为面包酵母的主要营养源同样应该准确的进行流加补料,而通过溶氧反馈流加发现,溶氧量每小时都会有一次的快速上升。所以在溶氧反馈流加的基础上提出了称质量流加补料工艺,该工艺是利用称质量系统将补料罐中的糖蜜、尿素、磷酸二氢铵按每小时已设定好的添加量进行自动流加,通过该工艺更加精确地控制了每小时酵母所需要的营养源的质量,充分消除了酵母发酵过程中的Crabtree效应[27-30]。在培养过程中同样测定残糖量与乙醇体积分数对酵母的代谢进行侧面评价。从图9可以看出,面包酵母发酵过程中的溶氧量从接种进发酵罐时开始快速下降,在对数生长期中期之后溶氧量稳定维持在20%~30%内,酵母的有氧呼吸情况良好,菌体在培养22 h之后进入平衡期,最大酵母湿质量浓度为264.82 g/L,相比于溶氧反馈流加最佳菌体湿质量浓度得到了进一步的提高,同时酵母接入发酵罐后的适应期相对减少,更快速的进入了对数生长期。

图10 面包酵母称质量补料流加中残糖量与乙醇体积分数变化Fig. 10 Changes in residual sugar and alcohol content during fedbatch fermentation with nutrient feeding

图11 面包酵母称质量补料流加中通气量变化Fig. 11 Change in oxygen flow rate during fed-batch fermentation with nutrient feeding
面包酵母发酵过程中的乙醇体积分数和残糖量变化曲线如图10所示,可以看出面包酵母进入对数生长期之后,残糖量一直维持在1.5%之内,在对数生长期的末期,残糖量接近于0,这是由于面包酵母在此时菌体湿质量浓度开始大幅度增加,从发酵罐中也可以观察到发酵液表面产生了一层浓密的泡沫,不断有大的气泡出现,酵母生长旺盛,糖蜜的流加量达到最大。乙醇体积分数虽然在4~12 h有小幅增加,但是一直可以控制在1.5%之内,在发酵后期保持一定的乙醇体积分数可以提高酵母发酵力,对后期制备活性干酵母有一定的辅助效果。通气量变化见图11,在酵母处于迟滞期时,通气量不宜过大,有可能造成发酵液的蒸发和菌体的损伤。在进入对数生长期之后,由于酵母呼吸旺盛,为了保证溶氧足够,将通气量维持2 500 L/h,确保能为对数生长期的面包酵母供给足够的氧气。
从实验数据可以看出,面包酵母的湿质量浓度达到260 g/L以上,发酵液中的菌体数量为4.56×109CFU/mL,发酵力可达到675 mL/h,已可以初步达到面包酵母工业化发酵水平,因此将称质量补料流加方法作为面包酵母的高密度发酵方法作进一步的研究。
2.5 面包酵母高密度培养工艺稳定性
为确保现有高密度培养工艺的可重复性与可行性,现进行5 个批次的相同工艺的重复实验以确定该工艺的稳定性。如图12所示,发酵过程中酵母最大湿质量浓度平均为250 g/L,有良好的可重复性,实验结果稳定性较强,可以达到面包酵母高密度培养要求,能够对面包酵母高密度培养工业化扩大生产给予一定的实验指导。

图12 面包酵母高密度发酵工艺稳定性实验Fig. 12 Stability of the high density fermentation process
2.6 乙醇体积分数水平对面包酵母高密度培养的影响
乙醇体积分数是判断面包酵母发酵过程中代谢情况的一个重要参考。维持低的乙醇体积分数可以确定酵母进行正常的有氧呼吸从而进行大量的繁殖,但是在对数平衡期保持酵母液中含有一定的乙醇可以避免成熟的面包酵母发生老化,从而导致发酵力降低的问题。由于面包酵母是用作生产活性干酵母的菌种,所以为确保活性干酵母的质量标准,就应充分保证酵母液中的酵母乳的质量较高,才可以在下游的干燥造粒等工艺后仍然有良好的发酵力。目前已提高的面包酵母的细胞内海藻糖含量可从一方面保证其在下游工艺中的活性不受到太大损失。在高密度发酵阶段如何确定菌体湿质量浓度最大的同时,不造成发酵力的降低是一个新的问题[31-33]。

图13 高密度培养实验中不同乙醇体积分数水平Fig. 13 High density culture experiments with different fixed levels of alcohol at 12 h

图14 不同乙醇体积分数水平下面包酵母生长情况对比Fig. 14 Comparison of wet yeast biomass at different alcohol levels
如图13所示,控制12 h后乙醇体积分数在设定值附近。由图14可以看出,乙醇体积分数在1.0%以上时酵母最大湿质量浓度均低于240 g/L,当乙醇体积分数在0.7%~1.0%之间,菌体最大湿质量浓度可维持250 g/L,同时测定发酵力,发现面包酵母发酵力在0.7%和1.0%的乙醇体积分数水平线上分别为653 mL/h和679 mL/h,均可达到质量要求,其他水平上酵母发酵力均小于600 mL/h,效果不理想。因此实验中可控制发酵过程中乙醇体积分数为0.7%~1.0%,可有效提高最大酵母湿质量浓度在250 g/L左右,并且可以确保面包酵母发酵后的发酵力达到650 mL/h以上。
面包酵母在50 L自吸式发酵罐中培养,通过称质量补料的高密度培养方法最大酵母湿质量浓度从198.34 g/L进一步提高到264.82 g/L,流加工艺的改进优化有效提高了酵母的菌体产量,相比于最初的发酵工艺最大菌体湿质量浓度提高了33.52%。
3 结 论
提高酵母胞内海藻糖含量可有效提高活性干酵母在下游干燥造粒过程中对于高温和迅速脱水等情况的耐受性。陈丽君等[34]通过对比不同海藻糖含量的面包酵母菌体的耐高温性能、耐酒精性能、抗冻性能等,研究发现海藻糖含量越高的酵母菌耐受性越高。宋晓丽[35]通过单因素及响应面试验优化酿酒酵母中海藻糖提取工艺,得到最优酵母中海藻糖得率为251.86 mg/g。酵母的高密度培养一直是发酵工业中的一个研究重点,赵晓丽等[36]通过对酿酒酵母进行高密度有氧发酵研究,发酵结束后酵母干质量浓度为9.63 g/L。荣博涵等[37]研究了对比了酿酒酵母中残糖反馈分批补料与连续流加补料方式对酿酒酵母高密度发酵的影响,通过控制不同方残糖梯度,发酵30 h后,最大酵母干质量浓度为29.29 g/L。将高产海藻糖酵母菌株与高密度发酵相结合进行研究,能一定程度上提高活性干酵母的产品质量。本实验采用单因素及正交试验方法优化了微波-浸提法提取酵母胞内海藻糖的工艺参数,确定了具体的工艺条件为:微波功率231 W、微波时间40 s、三氯乙酸浓度0.5 mol/L、三氯乙酸体积40 mL、浸提温度40 ℃、浸提时间150 min。该工艺条件下得到的海藻糖含量为280.15 mg/g,比优化前提高15.2%。以酶-DNS法测定提取后的海藻糖含量,通过菌种筛选出一株高产海藻糖菌株并对其进行高密度培养工艺的研究,以称质量流加作为面包酵母在50 L自吸式发酵罐中的高密度培养方式,发酵后的面包酵母最大湿质量浓度为264.82 g/L,相比于溶氧反馈流加培养后的最大湿质量浓度提高了33.52%。且该工艺稳定性良好,发酵过程中将乙醇体积分数控制在0.7%~1.0%之间,将有效提高酵母湿质量浓度且保证其发酵力在650 mL/h以上,发酵液中的菌体数量为4.56×109CFU/mL,最大酵母干质量浓度可达到58.32 g/L,可达到目前国内面包酵母高密度培养较高水平。
[1] 靳文斌, 李克文, 胥九兵, 等. 海藻糖的特性、功能及应用[J]. 精细与专用化学品, 2015, 23(1): 30-33. DOI:10.3969/j.issn.1008-1100.2015.01.008.
[2] 吕莹果, 王群学, 陈能飞. 胞内海藻糖含量对冷冻面团中酵母抗冻性的影响[J]. 食品与发酵科技, 2007, 43(1): 1-7. DOI:10.3969/j.issn.1674-506X.2007.01.001.
[3] 谭海刚, 李书巧, 关凤梅, 等. 从啤酒废酵母中提取海藻糖工艺的研究[J].酿酒科技, 2005(4): 78-80. DOI:10.3969/j.issn.1001-9286.2005.04.020.
[4] 和东芹, 肖冬光, 邹静. 面包酵母耐冷冻性影响因子的研究进展[J].食品与发酵工业, 2007, 33(5): 92-96. DOI:10.3321/j.issn:0253-990X.2007.05.023.
[5] 李滢冰, 池振明. 酵母中海藻糖与抗逆境的关系[J]. 食品研究与开发, 2000(4): 6-8. DOI:10.3969/j.issn.1005-6521.2000.04.002.
[6] 池振明, 梁丽琨, 朱开玲, 等. 酵母海藻糖的代谢与调控研究进展[J]. 中国海洋大学学报(自然科学版), 2006, 36(2): 209-214.DOI:10.3969/j.issn.1672-5174.2006.02.006.
[7] 韩少卿, 彭奇均, 舒菊霞. HPLC法测定酵母中海藻糖[J]. 中国食品添加剂, 2005(2): 107-109. DOI:10.3969/j.issn.1006-2513.2005.02.028.
[8] 谭海刚, 梅英杰, 关凤梅, 等. 蒽酮-硫酸法测定酵母中海藻糖的含量[J]. 现代食品科技, 2006, 22(1): 125-126. DOI:10.3969/j.issn.1673-9078.2006.01.050.
[9] FERREIRA J C, VMF P, PANEK A D, et al. Comparison of three different methods for trehalose determination in yeast extracts[J].Food Chemistry, 1997, 60(2): 251-254. DOI:10.1016/S0308-8146(96)00330-5.
[10] 王兰, 肖冬光, 张正. 酶-DNS比色法测定酵母海藻糖的研究[J]. 工业微生物, 2002, 32(2): 18-21. DOI:10.3969/j.issn.1001-6678.2002.02.005.
[11] 何钢, 刘嵬, 邬晓勇, 等. HPLC-RI法测定食用酵母的海藻糖含量[J]. 食品工业科技, 2015, 36(14): 49-52. DOI:10.13386/j.issn1002-0306.2015.14.001.
[12] 王宜磊, 朱陶, 孟国庆, 等. 啤酒酵母海藻糖提取工艺研究[J]. 安徽农业科学, 2014(33): 11884-11887. DOI:10.3969/j.issn.0517-6611.2014.33.095.
[13] 章银良, 刘庭淼, 张鑫, 等. 微波破碎酵母细胞提取海藻糖的研究[J]. 郑州轻工业学院学报(自然科学版), 2001, 16(4): 51-53.DOI:10.3969/j.issn.1004-1478.2001.04.014.
[14] 汤高奇, 钱志伟, 岳田利, 等. 猕猴桃酒酵母海藻糖积累条件优化[J]. 中国酿造, 2009, 28(6): 128-130. DOI:10.3969/j.issn.0254-5071.2009.06.041.
[15] 赵波, 赵文杰, 顾敏, 等. 硫酸铵与pH对酵母高密度发酵生产谷胱甘肽的影响[J]. 中国医药工业杂志, 2009, 40(3): 180-182.DOI:10.3969/j.issn.1001-8255.2009.03.008.
[16] OMAR S S, MERRIFIELD D L, KÜHLWEIN H, et al. Biofuel derived yeast protein concentrate (YPC) as a novel feed ingredient in carp diets[J].Aquaculture, 2012, 333(1): 54-62. DOI:10.1016/j.aquaculture.2011.12.004.
[17] 林俊涵. 毕赤酵母高密度发酵工艺的研究[J]. 中国生物工程杂志,2009, 29(5): 120-125. DOI:10.13523/j.cb.20090523.
[18] 郑苗, 邓泽元, 任志青, 等. 东方伊萨酵母高密度培养的研究[J]. 中国食品学报, 2016, 16(4): 96-103. DOI:10.16429/j.1009-7848.2016.04.014.
[19] 窦冰然, 郭会明, 骆海燕, 等. 耐高糖面包酵母发酵工艺优化[J]. 食品工业科技, 2016, 37(18): 208-212. DOI:10.13386/j.issn1002-0306.2016.18.031.
[20] 刘振云, 沈露, 解凤立, 等. 毕赤酵母菌分泌表达重组抑肽酶的高密度发酵工艺研究[J]. 东南大学学报(医学版), 2011, 30(5): 744-748.DOI:10.3969/j.issn.1671-6264.2011.05.020.
[21] 方尚玲, 马丽. 影响酵母自溶因素与条件的研究[J]. 粮食与饲料工业, 2000(3): 21-23. DOI:10.3969/j.issn.1003-6202.2000.03.010.
[22] 王成涛, 梁婧如, 尹胜, 等. 溶氧量对酿酒酵母及其工程菌的β-苯乙醇合成代谢的影响及调控效应[J]. 中国食品学报, 2016, 16(8): 78-86. DOI:10.16429/j.1009-7848.2016.08.012.
[23] 卫功元, 李寅, 堵国成, 等. 溶氧及pH对产朊假丝酵母分批发酵生产谷胱甘肽的影响[J]. 生物工程学报, 2003, 19(6): 734-739.DOI:10.3321/j.issn:1000-3061.2003.06.018.
[24] 张建勇, 王晓港, 王水莲, 等. 溶氧对重组毕赤酵母高密度发酵生产腺苷蛋氨酸的影响[J]. 药学研究, 2007, 26(7): 428-430.DOI:10.3969/j.issn.1672-7738.2007.07.025.
[25] 王俊丽, 聂国兴, 李素贞, 等. DNS法测定还原糖含量时最适波长的确定[J]. 河南农业科学, 2010, 39(4): 115-118. DOI:10.3969/j.issn.1004-3268.2010.04.032.
[26] 刘传斌, 李宁, 白凤武, 等. 酵母胞内海藻糖微波破细胞提取与传统提取比较[J]. 大连理工大学学报, 2001, 41(2): 169-172.DOI:10.3321/j.issn:1000-8608.2001.02.010.
[27] 尚红岩. 糖蜜发酵酒精生产中残糖的控制[J]. 甘蔗糖业, 2007(2):45-47. DOI:10.3969/j.issn.1005-9695.2007.02.009.
[28] HE X, HUAI W, TIE C, et al. Breeding of high ergosterol-producing yeast strains[J]. Journal of Industrial Microbiology & Biotechnology,2000, 25(1): 39-44. DOI:10.1038/sj.jim.7000004.
[29] MAGALHÃES V J, SUSCA F, LIMA F S, et al. Effect of feeding yeast culture on performance, health, and immunocompetence of dairy calves[J]. Journal of Dairy Science, 2008, 91(4): 1497-1509.DOI:10.3168/jds.2007-0582.
[30] 肖冬光, 张翠英, 吕烨. 酿酒酵母海藻糖含量与酒精和高温耐性的关系[J]. 中国科技论文, 2009, 4(9): 679-683. DOI:10.3969/j.issn.2095-2783.2009.09.012.
[31] 杨建刚, 马跃, 肖冬光, 等. 酿酒酵母酒精耐性研究进展[J]. 酿酒科技, 2006(11): 86-89. DOI:10.3969/j.issn.1001-9286.2006.11.026.
[32] 潘丰, 冯品如, 李寅. 酵母流加发酵生产中乙醇浓度的在线测量[J].食品与生物技术学报, 2000, 19(5): 488-490. DOI:10.3321/j.issn:1673-1689.2000.05.017.
[33] 杨士春. 氮源和无机盐对酵母菌发酵酒精浓度的影响[J]. 能源工程,2012(4): 50-54. DOI:10.3969/j.issn.1004-3950.2012.04.012.
[34] 陈丽君, 肖冬光, 郭学武, 等. 面包酵母海藻糖含量与酵母耐性之间的关系[J]. 食品工业科技, 2011, 32(8): 112-114. DOI:10.13386/j.issn1002-0306.2011.08.066.
[35] 宋晓丽. 饲用活性干酵母生产技术的研究[D]. 南京: 南京工业大学,2013: 34-45.
[36] 赵小丽, 甄玉国, 王兰惠, 等. 酿酒酵母高密度有氧发酵条件的研究[J].饲料工业, 2015(1): 50-54. DOI:10.13302/j.cnki.fi.2015.Z1.014.
[37] 荣博涵, 甄玉国, 赵小丽, 等. 不同补料方式对酿酒酵母高密度发酵的影响[J]. 中国酿造, 2015, 34(2): 72-75. DOI:10.11882/j.issn.0254-5071.2015.02.017.
