天麻提取物及其3 种主要成分对灰树花产胞外漆酶和菌丝体的影响
2018-03-20芦红云吴天祥聂文强
芦红云,吴天祥,2,*,钟 敏,聂文强
(1.贵州大学酿酒与食品工程学院,贵州 贵阳 550025;2.贵州大学明德学院,贵州 贵阳 550025)
漆酶是微生物中广泛存在的一种含铜多酚氧化酶,在食品[1-2]、环境[3]、生物漂白[4-5]等领域具广阔的应用前景,是近年来的研究热点。担子菌中的白腐菌是漆酶重要的生产者。灰树花(Grifola frondosa)属于白腐菌,在生产栽培时,分泌漆酶来降解底物秸秆皮壳中的木质素供自身生长。Nitheranont等[6]研究指出灰树花漆酶能有效应用于合成染料的脱色以及双酚A的降解。目前,外源添加物对真菌漆酶影响的研究主要集中在添加金属离子、芳香族化合物、有机酸等[7-10],对于添加中药成分的研究鲜有报道。齐艳兵等[11]研究表明酚类底物中的基团如—NH2、—OH、—OCH3及—CHCHCH3等,能够明显增强漆酶反应活性。同时,文献[12-14]指出一些中药药渣和中药提取物可显著促进真菌生长及漆酶的产生。
天麻作为贵州三宝之一,是一种名贵的中药材,其活性成分主要是以天麻素(gastrodin,GA)、对羟基苯甲醇(p-hydroxybenzyl alcohol,HA)、对羟基苯甲醛(p-hydroxylbenzaldehyde,HBA)为主的酚类、有机酸、甾醇、苷类等[15-17],这些物质的存在是研究天麻对漆酶活力影响的基础。Xing等[9]研究指出HBA能促进灰树花产漆酶,同时,课题组[16-21]前期研究也表明,天麻提取物及其主要成分能促进灰树花生长。
实验以灰树花菌株为研究对象,研究天麻提取物对灰树花产胞外漆酶和菌丝体生长的影响,并在此基础上分析天麻主要成分GA、HA、HBA[22]对灰树花生长和产漆酶的影响,来探明对其增效贡献最大的成分,并阐明作用机理,旨在为天麻提取物及主要成分诱导产漆酶提供理论依据。GA、HA、HBA的结构式如图1所示。

图1 GA、HA、HBA的结构式Fig. 1 Structures of GA, HA and HBA
1 材料与方法
1.1 材料、试剂及培养基
灰树花菌株(菌种编号:5.404) 中国普通微生物菌种保藏管理中心;天麻(Rhizoma gastrodiae)贵州省德江县天麻种植基地。
GA、HA、HBA 美国Sigma公司;2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)、L-天冬酰胺美国Amrescoa公司;其余试剂均为市售分析纯。
斜面培养基:马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基;液体种子培养基:葡萄糖30 g/L,蛋白胨2 g/L,酵母膏6 g/L,KH2PO40.5 g/L,MgSO4·7H2O 0.5 g/L;pH值自然;发酵培养基(每1 L含有如下物质)[9]:葡萄糖10 g,L-天冬酰胺5 g,Na2HPO40.475 g,KH2PO40.453 g,MgSO4·7H2O 0.5 g,CaCl2·2H2O 0.013 g,酵母膏提取物1 g,VB125 mg,痕量溶液1 mL(痕量溶液组成:柠檬酸铁4.8 g/L,ZnSO4·7H2O 2.64 g/L,MnCl2·4H2O 2.0 g/L,COCl2·6H2O 0.4 g/L,CuSO4·5H2O 0.4 g/L)。
1.2 仪器与设备
BXM-30R立式灭菌锅 上海博讯实业有限公司医疗设备厂;SW-CJ-1D净化工作台 苏州净化设备有限公司;TGL-20M台式高速冷冻离心机 长沙迈佳森仪器设备有限公司;TS-2102C恒温振荡器 上海天呈仪器有限公司;UV-1800双光速紫外-可见光光度计 上海欣茂仪器有限公司;1100高效液相色谱(high performance liquid chromatography,HPLC)仪及检测器、5TC-C18色谱柱 美国Agilent公司。
1.3 方法
1.3.1 斜面种子培养
从母种试管中挑取黄豆粒大小菌丝块接种于PDA斜面中部,25 ℃恒温培养,至菌丝长满整个斜面,转置4 ℃保存。
1.3.2 液体种子培养
用接种勺在斜面菌种管中取1 勺细小菌丝体,接种于液体种子培养基中,三角瓶装液量为200 mL/500 mL,加入少许细小玻璃珠,于25 ℃、150 r/min摇床中培养6 d。
1.3.3 发酵培养
无菌条件下,按10%的接种量,用移液枪取5 mL种子液接于发酵培养基中,250 mL三角锥形瓶装液量为50 mL,于150 r/min的摇床中25 ℃条件下培养。
1.3.4 天麻提取物和粗酶液的制备
天麻粉制备:天麻洗净,55 ℃烘干,粉碎后过80目备用。
天麻醇提物制备:准确称取上述10 g的天麻粉末,加入100 mL 75%乙醇溶液。25 ℃浸提48 h后过滤,60 ℃减压除去乙醇。加25 mL蒸馏水重溶后过滤,即得到2.5 mL/g的天麻醇提物。
天麻水提物制备:将上述10 g的天麻粉末加入到100 mL的蒸馏水中。25 ℃浸提48 h后过滤得到滤液,60 ℃减压浓缩,定容至25 mL,即得到2.5 mL/g的天麻水提物。
粗酶液制备:将发酵液经8 层纱布过滤,滤液在转速为6 000 r/min条件下4 ℃低温离心10 min。
1.3.5 外源诱导实验
分别向液体培养基中加入不同体积分数的天麻提取物、GA、HBA、HA及不同质量的天麻粉末,使其达到设定的最终质量浓度,并以此为实验组,以未额外加入任何外源物的液体培养基为对照组。两者均经过高压灭菌,再接入种子液。发酵一定时间后,进行指标测定,以考察所添加的外源诱导物对灰树花菌丝体生长和诱导产胞外漆酶的影响。
1.3.6 指标测定
1.3.6.1 菌丝体生物量的测定
菌丝体生物量用来评价灰树花的生长情况。液体培养过滤后得到菌丝体,将其用蒸馏水冲洗3 次,于数显鼓风干燥箱中60 ℃烘干至恒量,其质量即为菌丝体生物量。
1.3.6.2 漆酶活力测定[23]
以ABTS为底物,2.5 mL反应体系中含有1 mL 0.03 g/100 mL ABTS、1 mL pH 2.2磷酸二氢钠-柠檬酸缓冲溶液和0.5 mL粗酶液。在1 cm的比色皿中,将缓冲液和底物混匀后再加入酶液,在25 ℃反应3 min后,在420 nm波长处测吸光度的增加值。煮沸15 min灭活的粗酶液经相同处理后为对照组。酶活力定义:每分钟使1 μmol ABTS转化所需的酶量为1 个活力单位(U)。计算公式如下:

式中:ΔA为吸光度的差值;V总为反应体系总体积/mL;V酶为酶液体积/mL;ε=3.6×104L/(mol·cm);L为比色皿直径/mm;Δt为反应时间差/s。
1.3.7 HPLC分析[22]
1 mL发酵液经膜过滤(0.22 μm)后,用HPLC检测。条件如下:色谱柱:Agilent TC-C18(4.6 mm×250 mm,5 μm);流动相:0.1%磷酸溶液(流动相A)和乙腈(流动相C)。洗脱梯度:0~35 min,3%~30% C;35~45 min,30%~70% C。流速1 mL/min,柱温30 ℃,进样量20 μL,检测波长221 nm。
1.4 统计方法
采用SPSS 17.0软件分析实验数据显著性;Origin 7.5软件作图。
2 结果与分析
2.1 灰树花菌丝体生长曲线及产漆酶情况
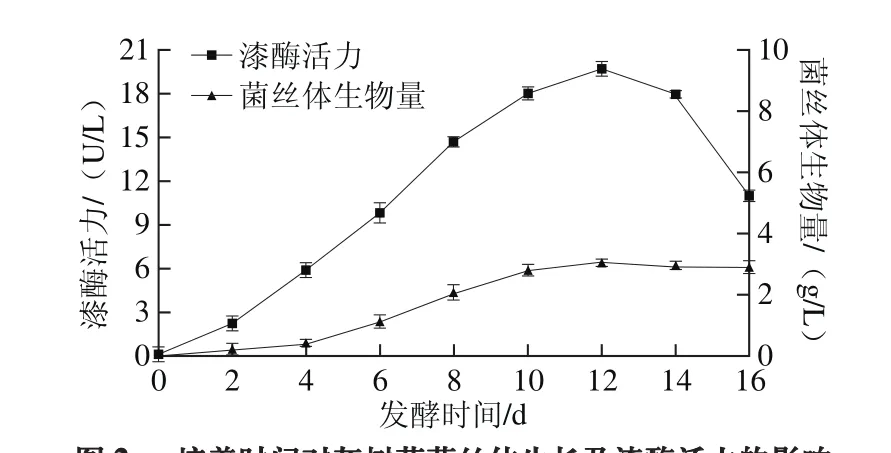
图2 培养时间对灰树花菌丝体生长及漆酶活力的影响Fig. 2 Effect of culture period on mycelial growth and laccase activity of G. frondosa
在无外源添加物的灰树花液体发酵培养基中,每隔1 d随机取3 瓶发酵液,测定其胞外漆酶活力和菌丝体生物量。由图2可知,摇床培养至12 d时灰树花漆酶活力和菌丝体生物量达到峰值,分别为19.63 U/L、3.06 g/L。1~4 d,灰树花处于调整期,产漆酶活力较低,发酵液中菌丝球极少;4~10 d,灰树花进入指数生长期,漆酶的活力迅速升高,发酵液呈微黄透明,菌丝球体积逐步变大,新长出来的细小菌丝球较多;10~12 d,灰树花菌体生长进入稳定期,其所产漆酶活力达到峰值,发酵液颜色逐步加深,菌丝球边缘齐整;12 d以后,随着菌丝体进入衰亡期,漆酶活力逐渐降低,发酵液颜色渐深而且黏度增加,菌体出现自溶现象。因此,培养最佳周期为12 d。纵观整个培养阶段可知,灰树花所产漆酶活力较低,与尹立伟[24]、Sun Shujing[25]等研究结果一致。王宜磊等[12]研究出枸杞子水提物能提高真菌胞外漆酶活力。后期实验将以天麻提取物为诱导物来研究其对漆酶活力的影响,以期提高漆酶活力。
2.2 不同质量浓度的天麻粉末及提取物对灰树花漆酶和菌丝体的影响
在装有灰树花液体培养基的三角瓶中,分别添加质量浓度为1~7 g/L的天麻粉末和天麻提取物(天麻粉末经过水提或乙醇提取后的到的物质)。发酵培养12 d后,研究外源诱导物对灰树花菌体生长和产胞外漆酶活力的影响。由图3、4可知,外源物对灰树花菌丝体和胞外漆酶活力均有显著的促进作用。从整体看,随着外源物质量浓度提高,灰树花生物量和漆酶活力均呈现先增加至峰值后再降低的趋势,出现这种趋势的原因可能是天麻中除了含有诱导漆酶分泌芳香族化合物和糖苷类物质外[26],还含有一定量抑制真菌活性的有机酸(酯)类挥发油性成分和生物碱[27],当质量浓度不断增大时,糖苷类物质和芳香族化合物的诱导作用逐步达到最大值,继续增加药渣质量浓度,其中挥发油性成分和生物碱抑菌活性的作用逐渐显现,漆酶活力和菌丝体生物量又逐渐下降。
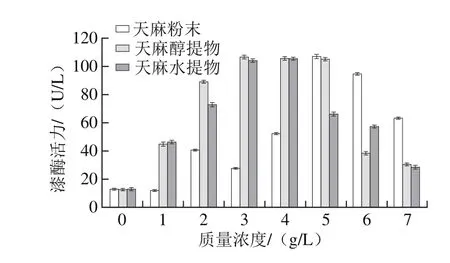
图3 添加物质量浓度对灰树花漆酶活力的影响Fig. 3 Effect of R. gastrodiae extract concentration on laccase activity of G. frondosa

图4 添加物质量浓度对灰树花菌丝体生长的影响Fig. 4 Effect of R. gastrodiae extract concentration on biomass production by G. frondosa
由图3可得出,天麻提取物的提取方式不同对诱导漆酶活力的影响不明显。在3 g/L天麻醇提物、4 g/L天麻水提物、5 g/L天麻粉末的诱导下,漆酶活力均达到峰值,分别为(106.46±1.25)、(105.25±1.24)U/L和(107.07±1.4)U/L。图4中,在3 g/L天麻醇提物、2 g/L天麻水提物、4 g/L天麻粉末诱导下,菌丝体生物量达到各自的峰值,分别为(10.03±0.06)、(5.88±0.14)、(9.03±0.07)g/L,且差距显著。
因此,选择3 g/L的天麻醇提物作为诱导物添加到灰树花深层发酵中,此时对菌丝体生长和漆酶的促进作用最大,分别为(10.03±0.06)g/L、(106.46±1.25)U/L,相较于空白组,分别提高了1.62 倍和7.41 倍(P<0.05)。有理由推测天麻醇提物中存在某些对灰树花菌丝体生长和产漆酶增效的成分。
2.3 天麻醇提物中3种主要成分的HPLC分析


图5 天麻醇提物(a)和GA(b)、HA(c)、HBA(d)标准品的HPLC图Fig. 5 HPLC chromatograms of R. gastrodiae extract and GA, HA and HBA standards
因含外源添加物的灰树花液体培养基需经高压灭菌,且基于课题组前期研究表明,天麻提取物灭菌操作后组分含量发生变化,活性成分GA、HBA、HA的含量会上升[28]。故利用灭菌后的天麻提取物进行HPLC分析,来探明天麻醇提物中对灰树花漆酶活力具有最显著促进作用的主要成分。由图5a可知,灭菌后的3 g/L的天麻醇提物主要成分有GA、HA、HBA等,计算出各成分的含量分别为5.556、1.265、1.417 mg/g。
2.4 天麻主要成分对灰树花漆酶活力和菌丝体生长的影响
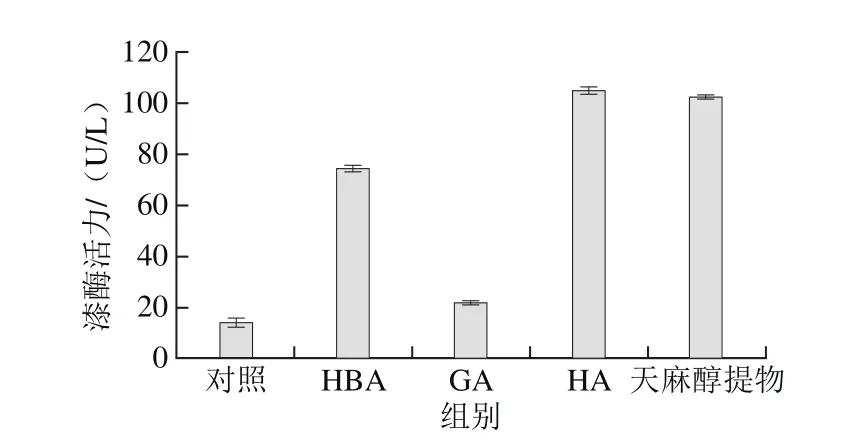
图6 天麻醇提物和3 种天麻成分对灰树花漆酶活力影响的比较Fig. 6 Comparative effects of 3 g/L R. gastrodiae extract, GA, HA and HBA on laccase activity of G. frondosa

图7 天麻醇提物和3 种天麻成分对灰树花菌丝体生长影响的比较Fig. 7 Comparative effects of 3 g/L R. gastrodiae extract, GA, HA and HBA on mycelial biomass production by G. frondosa
将3 g/L的天麻醇提物和相应含量的3 种主要成分添加到灰树花液体培养中作为实验组,对照组中不含任何外源添加物,考察对灰树花生长和产漆酶起关键作用的主要成分。由图6、7可以看出,相较于对照组,实验组中添加的外源物均能有效促进灰树花菌丝体生长和其分泌的胞外漆酶活性。
由图6可知,HA、HBA和天麻醇提物对漆酶活力有明显促进作用。HA、HBA促进漆酶活力可能与苯环中含有羟基有关[11]。添加HA时酶活力最大为(104.14±1.28)U/L,相比添加3 g/L天麻醇提物的实验组,其酶活力提高10.25%,说明相较于添加天麻醇提物,HA对漆酶活力的促进作用更强。由图7可知,灰树花液体培养添加HBA时菌丝体的生物量为(8.92±0.12)g/L,与添加天麻醇提物的实验组菌丝体生物量(8.07±0.19)g/L相比,菌丝体生物量提高9.17%。说明前者更能促进菌丝体的生长,其原因可能是天麻醇提物存在某些抑制真菌生长的物质,与2.2节的分析一致。
2.5 不同浓度的HA、HBA、GA对漆酶活力的影响

图8 不同浓度HA、HBA、GA对灰树花漆酶活力影响的比较Fig. 8 Effect of different concentrations of HA, HBA and GA on laccase activity of G. frondosa
为确定天麻3种主要成分对漆酶影响最佳添加量,分别称取7.4、7.3、17.2 mg的HA、HBA和GA溶于10 mL蒸馏水中配成溶液。按一定的体积梯度添加到每瓶液体培养基中,使灰树花液体培养基中HA、HBA和GA最终浓度分别为0.01、0.05、0.1、0.2、0.3、0.4 mmol/L。发酵12 d后,根据每瓶中测得的漆酶活力考察3种成分对漆酶的影响。如图8所示,漆酶活力随着HA、HBA浓度的增加呈现先上升后下降的趋势,然而漆酶活力并没有随GA浓度增加而明显上升,甚至较早出现稳步下降的趋势。与对照组相比,HA浓度在0.05~0.3 mmol/L、HBA浓度在0.05~0.2 mmol/L均能显著促进漆酶活力(P<0.05),其中,HA浓度在0.2 mmol/L时,灰树花胞外漆酶活力促进作用最佳,此时漆酶活力值为(97.53±1.96)U/L,相较于对照组提高了3.65 倍。因此,在所添加的3 种天麻主要成分中,0.2 mmol/L HA对促进漆酶活力的贡献最大。
2.6 不同浓度的HA、HBA、GA对菌丝体生物量的影响

图9 不同浓度HA、HBA、GA对灰树花菌丝体生物量影响的比较Fig. 9 Effects of different concentrations of HA, HBA and GA on mycelial biomass production by G. frondosa
按照一定的体积梯度向装有50 mL灰树花液体培养基中添加少量HBA、HA及GA,使得这些成分最终浓度分别为0.2~1.4 mmol/L,发酵12 d后测菌丝体生物量。由图9可知,菌丝体生物量均随着添加物浓度的升高先上升后下降;其中HBA浓度在1 mmol/L时对菌丝体生物量的促进作用达到最大值,为(6.17±0.16)g/L,相较于对照组提高了2.13 倍。因此,3 种添加物中,HBA对菌丝体生物量促进作用最大。
3 结 论
实验开展了关于天麻提取物对灰树花深层培养中的产胞外漆酶和菌丝体生长影响的研究。通过比较培养时间对漆酶和菌丝体干质量的影响,得出了灰树花液体培养的最佳培养周期是12 d;添加不同质量浓度的天麻提取物于灰树花液体培养基,测定出当加入3 g/L的天麻醇提物时,此时菌丝体生物量和漆酶活力均达峰值,分别为(10.03±0.06)g/L、(106.46±1.25)U/L,相较于对照组,分别提高了1.62 倍和7.41 倍。其诱导漆酶机理可能是这些外源添加物中存在某些结构中含有芳基和羟基化合物,而芳基和羟基是漆酶作用底物的特征官能团,所以它们能够诱导菌体分泌更多的漆酶[29-30]。
利用HPLC对3 g/L的天麻醇提物的成分进行分析,得到GA、HA、HBA的含量分别为5.556、1.265、1.417 mg/g,将其与3 g/L的天麻醇提物分别添加到培养基中作为实验组,相较于空白组,这些外源添加物均能有效促进灰树花菌体生长和漆酶活力。其中,HA能显著促进灰树花分泌的漆酶活力;HBA能显著增大灰树花的生物量,与吴彩云等[21]研究结果一致。天麻醇提物成分复杂,影响漆酶活力的物质也较多。天麻醇提物中是否存在某些物质较对羟基苯甲醇对漆酶活力具有更强的促进作用,需要进一步研究。
[1] CHEN H, JI A G, QIU S, et al. Covalent conjugation of bovine serum album and sugar beet pectin through Maillard reaction laccase catalysis to improve the emulsifying properties[J]. Food Hydrocolloids, 2016,40(17): 116-124. DOI:10.1016/j.foodhyd.2016.12.004.
[2] 张充, 陆兆新. 小麦面粉强筋改良酶制剂研究进展[J]. 食品科学,2013, 34(9): 324-329. DOI:10.7506/spkx1002-6630-201309065.
[3] JURADO M, PRIETO A, MARTÍNEZALCALÁ A, et al. Laccase detoxification of steam-exploded wheat straw for second generation bioethanol[J]. Bioresource Technology, 2009, 100(24): 6378-6384.DOI:10.1016/j.biortech.2009.07.049.
[4] LIN Y Q, ZHANG Z, TIAN Y S, et al. Purification and characterization of a novel laccase from Coprinus cinereus and decolorization of diあerent chemically dyes[J]. Molecular Biology Reports, 2013, 40(2):1487-1494. DOI:10.1007/s11033-012-2191-x.
[5] JIANG M, TEN Z, DING S J, et al. Decolorization of synthetic dyes by crude and purified laccases from Coprinus comatus grown under different cultures: the role of major isoenzyme in dyes decolorization[J]. Applied Biochemistry and Biotechnology, 2013,169(2): 660-672. DOI:10.1007/s12010-012-0031-z.
[6] NITHERANONT T, WATANABE A, SUZUKI T, et al.Decolorization of synthetic dyes and biodegradation of bisphenol A by laccase from the edible mushroom, Grifola frondosa[J].Bioscience Biotechnology & Biochemistry, 2011, 75(9): 1845-1847.DOI:10.1271/bbb.110329.
[7] ZHUO R, YUAN P, YANG Y, et al. Induction of laccase by metal ions and aromatic compounds in Pleurotus ostreatus HAUCC 162 and decolorization of different synthetic dyes by the extracellular laccase[J]. Biochemical Engineering Journal, 2017, 117(5): 156-165.DOI:10.1016/j.bej.2016.09.016.
[8] SARAIVA J A, TAVARES A P M. Effect of the inducers veratryl alcohol, xylidine, and ligninosulphonates on activity and thermal stability and inactivation kinetics of laccase from Trametes versicolor[J]. Applied Biochemistry and Biotechnology, 2012, 167(4):685-693. DOI:10.1007/s12010-012-9719-3.
[9] XING Z T, CHENG J H, TAN Q, et al. Effect of nutritional parameters on laccase production by the culinary and medicinal mushroom, Grifola frondosa[J]. World Journal of Microbiology and Biotechnology, 2006, 22(8): 799-806. DOI:10.1007/s11274-006-9163-z.
[10] 张津京, 陈明杰, 冯志勇, 等. 芳香族化合物对斑玉蕈菌丝生物量、漆酶活力及其转录水平的影响[J]. 菌物学报, 2016, 35(9): 1130-1138. DOI:10.13346/j.mycosystema.150175.
[11] 齐艳兵, 朱吉人, 孙尧金, 等. 漆酶与酚类模式底物的结合及反应活性的理论研究[J]. 高等学校化学学报, 2014, 35(4): 776-783.DOI:10.7503/cjcu20131287.
[12] 王宜磊, 周长路. 枸杞子水提物对采绒革盖菌木质纤维素酶和木质素酶活性的影响[J]. 食用菌学报, 2000, 7(1): 23-26. DOI:10.16488/j.cnki.1005-9873.2000.01.006.
[13] 岳鹍, 潘志恒, 孙勇民, 等. 中药药渣发酵生产毛云芝菌漆酶培养基的工艺研究[J]. 食品与机械, 2015, 31(5): 47-50. DOI:10.13652/j.issn.1003-5788.2015.05.011.
[14] 杨丽红, 叶选怡, 凌庆枝, 等. 中药渣固体发酵亮菌产漆酶研究[J]. 安徽农业科学, 2013, 41(6): 2396-2398. DOI:10.13989/j.cnki.0517-6611.2013.06.032.
[15] YU S J, KIM J R, LEE C K. Gastrodia elata Blume and an active component, p-hydroxybenzyl alcohol reduce focal ischemic brain injury through antioxidant related gene expressions[J]. Biological &Pharmaceutical Bulletin, 2005, 28(6): 112-120.
[16] WU C Y, WU T X. Effect of the main ingredients of Rhizoma gastrodiae on mycelial biomass and exopolysaccharide productions by submerged culture of Grifola frondosa[J]. International Journal of Food Science & Technology, 2015, 50(8): 134-143. DOI:10.1111/ijfs.12831.
[17] XU X B, WU T X, TANG Q L. Changes in gastrodia tuber ethanol extracts during Grifola frondosa fermentation[J]. Chemistry of Natural Compounds, 2016, 52(1): 74-77. DOI:10.1007/s10600-016-1550-6.
[18] XU X B, WU T X, WANG F, et al. The eあect of exopolysaccharide biosynthesis and related enzyme activities of Grifola frondosa by the addition of ethanol extracts from traditional Chinese medicine,Gastrodia tuber[J]. African Journal of Biotechnology, 2012, 11(15):3656-3662. DOI:10.5897/AJB11.3744.
[19] WANG N, WU T X, ZHANG Y, et al. Experimental analysis on the effect of addition of Rhizoma gastrodiae on mycelia and exopolysaccharide productions by submerged culture of Grifola frondosa[J]. African Journal of Biotechnology, 2012, 11(20): 4666-4672. DOI:10.5897/AJB12.195.
[20] 朱俊杰, 吴天祥, 吴彩云, 等. 对羟基苯甲醇对灰树花产胞外多糖的影响及其发酵动力学[J]. 食品科学, 2016, 37(19): 123-127.DOI:10.7506/spkx1002-6630-201619021.
[21] 吴彩云, 吴天祥, 朱俊杰, 等. 对羟基苯甲醛等3 种天麻成分对灰树花胞外多糖生物合成的影响[J]. 食品科学, 2016, 37(7): 83-87.DOI:10.7506/spkx1002-6630-201607016.
[22] 徐晓宝, 吴天祥, 张勇, 等. 灰树花发酵过程天麻成分变化的HPLC检测方法研究[J]. 中国酿造, 2012, 31(5): 182-185.
[23] LI F, ZHU X W, LI N Y, et al. Screening of lignocellulose-degrading superior mushroom strains and determination of their CMCase and laccase activity[J]. The Scientific World Journal, 2014, 2014(7): 154-160. DOI:10.1155/2014/763108.
[24] 尹立伟, 池玉杰, 王雪童, 等. 灰树花的系统发育分析和主要木质素降解酶的测定[J]. 林业科学研究, 2010, 23(4): 574-580.DOI:10.13275/j.cnki.lykxyj.2010.04.019.
[25] SUN S J, LI X J, RUAN L Y, et al. A novel breeding strategy for new strains of Hypsizygus marmoreus and Grifola frondosa based on ligninolytic enzymes[J]. World Journal of Microbiology and Biotechnology, 2014, 30(7): 2005-2013. DOI:10.1007/s11274-014-1624-1.
[26] 卓睿. 白腐真菌漆酶及同工酶基因家族的克隆表达调控研究[D]. 武汉:华中科技大学, 2015: 143-157.
[27] DAISY P, MATHEW S, SUVEENA S, et al. A novel terpenoid from elephantopus scaber-antibacterial activity on Staphylococcus aureus:a substantiate computational approach[J]. International Journal of Biomedical Science, 2008, 4(3): 196-203.
[28] WANG N, WU T X, ZHANG Y, et al. Experimental analysis on the main contents of Rhizoma gastrodiae extract and inter-transformation throughout the fermentation process of Grifola frondosa[J]. Archives of Pharmacal Research, 2013, 36(3): 314-321. DOI:10.1007/s12272-013-0029-2.
[29] 张莉. 白腐菌(Trametes pubescecs MB89)漆酶酶学性质及其对酚类化合物的降解特性研究[D]. 杨凌: 西北农林科技大学, 2009: 53-55.
[30] PAULA N, PEKKA M, ANNELE H, et al. Syringyl-type simple plant phenolics as mediating oxidants in laccase catalyzed degradation of lignocellulosic materials: Model compound studies 10th EWLP,Stockholm, Sweden, August 25-28, 2008[J]. Holzforschung, 2009,63(6): 699-704. DOI:10.1515/HF.2009.066.
