粪便钙卫蛋白、降钙素原在溃疡性结肠炎及腹泻型肠易激综合征诊断中的临床意义
2018-02-15牛丽娜李艳梅刘小方
牛丽娜 李艳梅 刘小方
溃疡性结肠炎(Ulcerative colitis, UC)一种病因尚不十分清楚的结肠和直肠慢性非特异性炎症性疾病。近几年来,UC已成为我国最常见的消化道疾病之一[1]。其表现为腹痛、腹泻、间断黏液脓血便、里急后重和不同程度的全身症状。腹泻型肠易激综合征(Diarrhea-predominant irritable bowel syndrome, IBS-D),其主要表现为腹泻伴腹痛,或明显的腹部不适感,其在肠易激综合征(Irritable bowel syndrome, IBS)中约占34.0%[2],其发病可能与肠道运动异常、内脏感觉异常、肠道菌群失调等有关,而无肠道器质性病变。
UC和IBS-D在症状上都有腹泻,而且,越来越多的UC患者在发病早期会表现IBS-D症状,仅仅通过临床表现很难鉴别这两种疾病,我们主要是通过肠镜及病理活检来诊断。但是,肠镜检查价格相对较贵,患者准备过程复杂、操作时痛苦大、不易被接受,不便用于复查,延误诊断和治疗的风险较高[3]。而且,对于UC患者,处于活动期时常常会忽略潜在的肠外表现及肠道菌群感染,导致治疗效果欠佳。因此,临床上迫切需要一种简单、无创、敏感、经济、特异性强且易于推广的方法来协助鉴别诊断UC与IBS-D。
钙卫蛋白(Calcium guard, CP)[4-5]是一种来源于中性粒细胞和巨噬细胞的钙-锌结合蛋白质,可存在于尿液、粪便、血浆等。存在于粪便中的CP称为粪便钙卫蛋白(Fecal calcium, FC),室温下,FC可在大便中稳定存活1周左右,且不易被各种酶类所破坏,优于以往的粪便标记物。韩玮等[6]研究发现,活动期UC患者的结肠黏膜和黏膜下可见大量CP阳性的中性粒细胞和巨噬细胞表达,其含量明显高于非炎症部位黏膜和正常对照。FC在评估UC活动性、反映黏膜炎症方面有一定价值[7]。降钙素原(Procalcitonin,PCT)是一种无激素活性的降钙素前肽糖蛋白,在健康状态下几乎检测不到,在病理状态下,可从白细胞、肝脏、肾脏、胰腺等中释放。1993年,Assicot等[8]首次发布可将PCT作为细菌感染的初期标志物之一。2001年,PCT被作为脓毒症诊断的指标之一[9]。目前认为PCT多在细菌感染时诱导产生,是用于检测严重细菌感染的重要观察指标[10]。国内近几年研究发现[11-12],PCT水平是一个判断UC病情活动和反映UC病情严重程度的较好指标。当PCT > 0.1 μg/g时,是预测重度UC的较好阈值。
本研究的目的主要是通过ELISA法定量检测FC浓度,通过罗氏701生化分析仪测定血液PCT,明确FC、PCT在UC及IBS-D患者中的含量变化,从而探讨FC、PCT在协助诊断UC、IBS-D的临床价值。
材料与方法
一、实验对象
选取2016年12月至2017年12月在内蒙古医科大学附属医院就诊的UC患者(UC组)60例,IBS-D患者(IBS-D组)30例,体检健康者(对照组)30例。其中,UC组根据UC活动性评估,分为缓解期(20例)、活动期(40例)。UC活动期患者根据病变累及范围,分为全结肠型(20例)和部分结肠、直肠型(20例)。本研究经内蒙古医科大学附属医院医学伦理委员会批准,纳入研究者均自愿参加,并签署知情同意书。
二、诊断标准
UC诊断标准依据2012年中华医学会消化病学分会炎症性肠病协作组制定的《中国炎症性肠病诊断治疗规范的共识意见》[13],病变范围分类采用蒙特利尔(Montreal)法[14],IBS-D诊断依据罗马Ⅲ标准[2]。入选者排除标准:①严重心、肝、肾、胰腺、神经等重要脏器和血液、系统性疾病等;②活动性胃、十二指肠溃疡,消化道肿瘤;③孕妇、哺乳期妇女;④长期服用质子泵抑制剂、激素类或非甾体消炎药、免疫抑制剂者;⑤直肠或肛周疾病;⑥酗酒者、肥胖者、吸毒者、药瘾者、精神病患者。
三、仪器与试剂
1. 仪器
高精度单道加液器(量程为0.5 ~ 10 μL,2 ~20 μL等);多空漩涡混合器;低频振荡器;台式高速离心机;普通冰箱;天平;酶标仪(450 nm检测波长滤光片,570 nm或630 nm校正波长滤光片);离心管(容量为1.5 mL,5mL等);一次性吸头(量程为0.5 ~ 10 μL,2 ~ 20 μL等);37 ℃恒温箱;电冰箱(4 ℃,-20 ℃);罗氏701生化分析仪;肠镜(型号:Q-240I)。
2. 试剂
人粪便钙卫蛋白ELISA试剂盒;人FC样品;FC提取液;纯净水或蒸馏水。
四、实验方法
1. FC测定流程
(1)FC提取:留取受检者粪便5 ~ 10 g,-20 ℃下长期保存。使用时将样本缓慢解冻至2 ~ 8 ℃,分析前平衡至室温。
1)将贴上标签的空5 mL离心管和接种环称重;
2)用接种环挑取50 ~ 100 mg粪便样本放入离心管,并加入49倍体积的提取液,盖紧盖子;
3)将样本放入多空漩涡混合器,用最高速度充分震荡15 min;
4)放入台式高速离心机,用3 000 × g离心5 min;
5)提取1 mL人粪便上清液到无菌的1.5 mL离心管中,为其编号,放入-20 ℃冰箱中保存;
(2)检测前准备工作
1)将试剂盒从冰箱中取出,待其温度至室温后进行ELISA实验。
2)按1∶25比例用双蒸水稀释浓缩洗涤液。未用完的放回。
3)人FC标准品:取标准品稀释液1.0 mL与冻干人FC标准品在试剂管中混合,轻轻摇晃,使其充分溶解(浓度为2 000 pg/mL),为其编号①,以便后续根据实验需要进行稀释。
4)标准品稀释方法(图1):取7支相对无菌的试剂管,分别加入300 μL标准品稀释液,编号为②、③、④、⑤、⑥、⑦、⑧。从第①管内取出300 μL加入到第②管,混匀后,再从第②管取出300 μL加入到第③管,以此类推至第⑦管。第⑧管作为阴性对照使用,只加入标准品稀释液。
5)生物素化人FC抗体工作液:用抗体稀释液将浓缩生物素化抗体按1:100比例进行稀释,配置成生物素化抗体工作液。
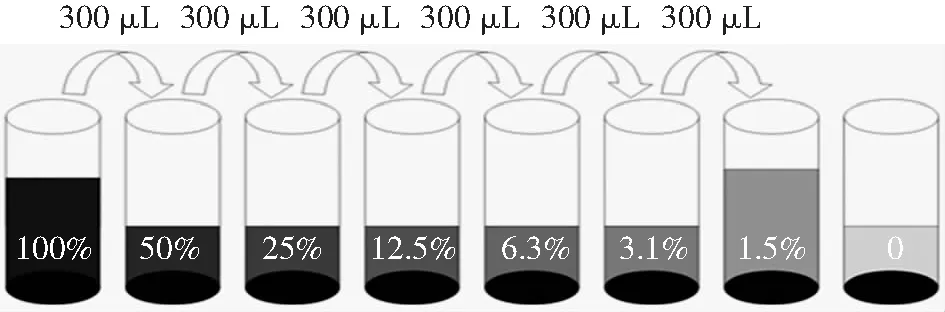
图1 标准品稀释方法示意图
6)酶结合物工作液:用酶结合物稀释液将浓缩酶结合物按1∶100比例稀释,配置成酶结合物工作液。
7)TMB显色工作液:使用前30 min,将TMB显色液A和TMB显色液B按9∶1的比例配制成TMB显色工作液。
(3)ELISA实验
1)将试验所需板条从密封袋中取出;
2)预留空白孔;
3)将标本或不同浓度人FC标准品(0 pg/mL孔加标准品稀释液)按100 μL/孔的量分别加入相应孔中,37 ℃恒温箱孵育90 min;
4)按(2)中步骤5)制备生物素化人FC抗体工作液;
5)洗板2次;
6) 向孔中分别按100 μL/孔的量加入生物素化人FC抗体工作液,37 ℃恒温箱孵育60 min;
7) 按(2)中步骤6)制备酶结合物工作液,室温避光放置;
8) 洗板3次;
9)除空白孔外,向孔中分别按100 μL/孔的量加入酶结合物工作液,37 ℃恒温箱,避光孵育30 min;
10)洗板5次;
11)向包括空白孔在内的所有孔中分别按100 μL/孔的量加入TMB显色工作液,37℃恒温箱避光孵育,当标准曲线出现明显的颜色梯度时,即可终止实验;
12)最后,向孔中按100 μL/孔的量加入终止液,混匀后即刻测量OD(450 nm)值。
(4)PCT测定
空腹8 h后于次晨取静脉血5 mL用罗氏701生化分析仪进行测定。
五、统计方法
采用SPSS 22.0软件对实验数据进行统计处理。计算各组FC、PCT的中位数、四分位间距、全距,组间比较采用非参数检验Kruskal-Wallis H检验,P< 0.05具有统计学意义。绘制受试者工作特征曲线(ROC曲线),计算FC、PCT鉴别UC与IBS-D的敏感性和特异性。应用Sperman检验,计算FC、PCT与UC内镜下分期、累及范围的相关性。
结 果
一、探索性统计分析
经正态性检验,各组FC、PCT水平符合非正态分布,因此通过计算中位数(M)、四分位间距(P25-P75)、全距(Min-Max),了解浓度分布情况(表1),并采用非参数检验Kruskal-Wallis H进行组间比较。本研究中UC组FC水平显著高于IBS-D组和对照组,差异均有统计学意义(P< 0.05);IBS-D组与对照组比较,FC水平差异无统计学意义(P> 0.05)。UC活动期FC水平显著高于缓解期,差异有统计学意义(P< 0.05);UC活动期(部分结肠、直肠型)与UC活动期(全结肠型)之间比较,FC水平差异有统计学意义(P< 0.05)。同时,UC组PCT水平显著高于IBS-D组和对照组,差异有统计学意义(P< 0.05);IBS-D组与对照组比较,PCT水平差异无统计学意义(P> 0.05);UC活动期PCT水平显著高于缓解期,差异有统计学意义(P< 0.05);UC活动期(部分结肠、直肠型)与UC活动期(全结肠型)之间比较,PCT水平差异无统计学意义(P> 0.05)。见表1。

表1 各组FC、PCT含量检测结果
二、敏感性和特异性分析
1. FC鉴别UC与IBS-D的敏感性和特异性
图2为FC鉴别UC与IBS-D的ROC曲线,曲线下面积为0.798(95% CI:0.682-0.914;P=0.000)。计算各个坐标点的约登指数(敏感性+特异性-1),得到点SEN 0.883(1-SPE 0.200)为最佳临界点,其对应的临界值为255.887 μg/g,此时FC鉴别UC与IBS-D的敏感性和特异性分别为88.3%和80.0%。

图2 UC和IBS-D组FC含量ROC曲线(曲线下面积为0.798;95% CI:0.682-0.914;P=0.000)
2. FC鉴别UC活动期与UC缓解期的敏感性和特异性
图3 为FC鉴别UC活动期与UC缓解期的ROC曲线,曲线下面积为0.666(95%CI:0.514-0.819;P=0.037)。计算各个坐标点的约登指数,得到点SEN 0.825(1-SPE 0.400)为最佳临界点,其对应的临界值为447.997 μg/g,此时FC鉴别UC活动期与UC缓解期的敏感性和特异性分别为82.5%和60%。
3. FC鉴别UC活动期(全结肠型)与UC活动期(部分结肠、直肠型)的敏感性和特异性
图4为FC鉴别UC活动期(全结肠型)与UC活动期(部分结肠、直肠型)的ROC曲线,曲线下面积为0.777(95% CI:0.631-0.924;P=0.003)。计算各个坐标点的约登指数,得到点SEN 0.750(1-SPE 0.250)为最佳临界点,其对应的临界值为662.932μg/g,此时FC鉴别UC活动期(全结肠型)与UC活动期(部分结肠、直肠型)的敏感性和特异性分别为75%和75%。
4. PCT鉴别UC与IBS-D的敏感性和特异性
图5为PCT鉴别UC与IBS-D的ROC曲线,曲线下面积为0.861(95%CI:0.780-0.943;P=0.000)。计算各个坐标点的约登指数,得到点SEN 0.817(1-SPE 0.200)为最佳临界点,其对应的临界值为0.393 μg/g,此时PCT鉴别UC与IBS-D的敏感性和特异性分别为81.7%和80%。

图5 UC和IBS-D PCT含量ROC曲线(曲线下面积为0.861;95%CI:0.780-0.943;P=0.000)
5. PCT鉴别UC活动期与UC缓解期的敏感性和特异性
图6为PCT鉴别UC活动期与UC缓解期的ROC曲线,曲线下面积为0.740(95% CI:0.599-0.881;P=0.003)。计算各个坐标点的约登指数,得到点SEN 0.750(1-SPE 0.250)为最佳临界点,其对应的临界值为0.420 μg/g,此时PCT鉴别UC与IBS-D的敏感性和特异性分别为75%和75%。
6. PCT鉴别UC活动期(全结肠型)与UC活动期(部分结肠、直肠型)的敏感性和特异性
图7为PCT鉴别UC活动期(全结肠型)与UC活动期(部分结肠、直肠型)的ROC曲线,曲线下面积为0.691(95% CI:0.528-0.855;P=0.039)。计算各个坐标点的约登指数,得到点SEN 0.600(1-SPE 0.400)为最佳临界点,其对应的临界值为0.480 μg/g,此时PCT鉴别UC与IBS-D的敏感性和特异性分别为60%和60%。

图6 UC活动期和UC缓解期PCT含量ROC曲线(曲线下面积为0.740;95% CI:0.599-0.881;P=0.003)

图7 UC全结肠型与UC部分结肠、直肠型PCT含量ROC曲线(曲线下面积为0.691;95% CI:0.528-0.855;P=0.039)
三、相关关系分析
FC与UC内镜下分期高度正相关(rs=0.806,P< 0.05);FC与UC内镜下累及范围呈正相关关系(rs=0.593,P< 0.05);PCT与UC内镜下分期呈正相关关系(rs=0.720,P< 0.05);PCT与UC内镜下累及范围无显著相关性(rs=0.119,P=0.464)。
讨 论
临床观察发现,约31%的UC患者有IBS-D症状,因此对两者的鉴别比较困难[15]。当前临床上对UC、IBS-D的临床诊断主要依赖临床症状、体征、内镜及病理学组织检查,但因大多患者临床资料不完善,致使诊断相对较困难。
本研究以内蒙古医科大学附属医院就诊并确诊为UC的患者60例、IBS-D组患者30例、对照组30例为实验对象,进行了FC、PCT的探索性统计分析、敏感性和特异性分析、相关性分析。结果表明,FC含量在UC组中位值为600.506 μg/g, 在IBS-D组为108.637 μg/g,UC与IBS-D、对照组差异均有统计学意义(P< 0.05),IBS-D与对照组差异无统计学意义(P> 0.05);以255.887 μg/g为临界值时,88.3%的患者可排除IBS-D,明显优于ESR、CRP等指标[16],其余的患者就可以安排下一步的肠镜检查及活检明确诊断,既可以减少结肠镜检查给假阳性患者带来的痛苦和风险,也减轻了患者的经济负担。同时,国内外大量研究表明,FC鉴别UC与IBS的敏感性和特异性均在90%以上[17-18]。且当FC水平≤ 40 μg/g时,仅有≤1%的可能性患者有UC[19-20]。
本文统计结果表明,FC含量在UC活动期的中位值为688.699 μg/g,缓解期为400.029 μg/g,通过ROC曲线分析发现,以447.997 μg/g为临界值时,FC鉴别UC活动期与缓解期的敏感性为82.5%,FC含量与患者内镜下分期高度正相关(rs=0.806),表明FC与UC患者内镜下黏膜炎症活动性明显相关,这与国外研究结果相似[21-22]。也就是说,FC检测可较好地判断UC是否活动,并能较为准确地反应病情的动态变化。但本文FC鉴别UC活动期和UC缓解期的特异性仅为60%,与王志红等[23]研究结果偏差较大(以450.3 μg/g为临界值时,FC判断UC是否活动的特异性为90%),这是由于本文所选择的大多数缓解期病人主要根据临床表现,如大便频数、血便、腹痛、一般情况、并发症及血沉等情况,采用CAI评分系统(0分为缓解期)进行活动指数评定来判断UC缓解期,主观性强,而无内镜下病理支持,可能导致误差较大。以662.932 μg/g为临界值时,FC在鉴别UC活动期(全结肠型)、UC活动期(部分结肠、直肠型)的敏感性为75%和75%,FC含量与患者内镜下累及范围呈正相关关系(rs=0.593),可见全结肠型累及范围广、炎症更重,临床上可考虑将FC用于评估UC累及范围的参考指标。
本文结果提示FC水平是一种可靠敏感的生化标志物,可用于临床鉴别诊断UC、IBS-D的辅助指标,同时帮助临床医生对UC疾病累及范围、治疗过程中分期情况进行临床评估,为疾病的诊治提供一个重要的客观指标。
本文研究表明,PCT含量在UC组的中位值为0.456 μg/g,在IBS-D组为0.021 μg/g,UC组与IBS-D组、对照组比较,差异均有统计学意义(P< 0.05);IBS-D组PCT浓度与对照组比较,差异无统计学意义(P> 0.05);当以0.393 μg/g为临界值时,PCT在鉴别诊断UC、IBS-D的敏感性为81.7%和80%,较FC检测值低。然而,本研究结果同时显示,活动期UC患者的PCT水平明显高于缓解期UC患者(P< 0.05),PCT与UC内镜下分期呈正相关关系(rs=0.720),提示血清PCT升高的程度与UC患者的病情活动密切相关。分析认为,越来越多的证据表明UC与肠腔内的细菌感染有关[24],PCT主要是由细菌毒素与炎性细胞因子共同刺激而产生,它是细菌感染所引起的败血症和其他相关感染的一种可靠标志物,这与本文的研究结果相吻合。
FC虽可作为监测肠道炎症的指标,但其也存在一些不足。首先,其也会受到饮酒、药物(如非甾体类抗炎药及质子泵抑制剂)等的影响,糖皮质激素、免疫抑制剂对FC是否有影响目前尚未见报道;其次,粪便中含有较多杂质,在粪便称重、提取上清液过程中会产生些许误差,影响FC的检测结果;再者,FC作为一种炎性标记物,其浓度在细菌性肠炎、肠息肉、克罗恩病等肠道炎症疾病中也会升高,造成检测时出现假阳性;但有文献表明[25]。以上三个方面使FC检测结果存在一定假阳性和假阴性。因此,怎样提高FC检测在肠道疾病中的准确性及取样最佳时间的选择仍然值得进一步研究。
另一方面,临床发现,越来越多的活动期UC患者会伴发潜在的肠外感染(如脓毒血症、坏疽性脓皮病、增殖性脓性口腔炎)而不易被发现;同时,某些UC患者可能合并其他肠道菌群感染(如痢疾杆菌、大肠杆菌),使临床症状加重,对于药物治疗效果欠佳,反复不愈,对进一步诊治造成困扰。FC检测仅仅是针对肠道黏膜炎症情况,与肠外感染无关,而且,对于是否是感染性、自身免疫性炎症无特异性,但PCT不受自身免疫活动影响,仅与感染有关。因此,将FC与PCT联合用于检测UC、UC合并肠道感染与肠外感染是否有意义是下一步研究方向。
