乌司他丁对糖尿病脓毒症大鼠急性肾损伤的保护作用
2018-02-06曹玥陈虎陈凯陈畅张宗泽
曹玥,陈虎,陈凯,陈畅,张宗泽
(武汉大学中南医院麻醉科,湖北武汉 430071)
糖尿病患者每年都需要花费大量的医疗资源,而据报道,至2035年,全球范围内糖尿病的患病人数将从现在的3.82亿增长至5.92亿[1]。糖尿病患者患病后各种并发症众多,以感染为最。糖尿病患者外科手术后感染易导致脓毒症的发生,脓毒症是急性肾损伤(AKI)的首要病因,也是危重患者死亡的重要原因之一[2]。因此,如何改善糖尿病患者术后严重感染所致AKI,从而降低糖尿病患者术后病死率对临床工作有重要意义。
乌司他丁(UTI)是一种广谱的蛋白酶抑制剂,能够抑制多种蛋白酶、脂水解酶、糖水解酶和不良刺激引起的炎性因子的释放[3-4]。但是,UTI对于糖尿病患者合并脓毒症时的肾脏保护作用未见报道,作用机制不明。因此,本研究拟观察UTI对2型糖尿病脓毒症大鼠AKI的保护作用,同时探讨其对全身炎性反应,氧化应激反应和肾脏局部缺氧反应的影响,为今后糖尿病合并脓毒症患者的治疗提供重要的理论依据。现将其实验结果及临床意义报道如下。
1 材料与方法
1.1 动物选取与分组 SPF级同批健康雄性SD大鼠60只,体质量180~220 g,购于武汉大学动物实验中心。造模前2周常规喂养,前一晚禁食不禁饮。随机选取10只喂以普通饲料,作为空白对照组(C组)。剩余50只喂以高脂饲料,动物饲料主要参照张新杰等[5]使用的方法自行配制。喂养5周后,高脂组按30 mg·kg-1体质量腹腔单次注射链脲佐菌素(STZ),注射3 d后,以随机血糖≥16.7 mmol·L-1为2型糖尿病大鼠造模成功。选取成模大鼠40只,随机分为4组(n=10):糖尿病组(D组)、糖尿病假手术组(S组)、糖尿病脓毒症组(DS组)、糖尿病脓毒症UTI预处理组(U组)。
1.2 糖尿病脓毒症大鼠模型 采用李宝贵等[6]的盲肠结扎穿孔术(CLP)方法构建糖尿病脓毒症大鼠模型。首先采用2%戊巴比妥钠溶液(2 mL·kg-1)对DS组和U组大鼠进行腹腔麻醉,麻醉后固定,常规消毒铺单,腹正中线作10 mm切口,以“3-0”丝线盲肠根部结扎,注意避免回肠和盲肠肠系膜血管。用18#穿刺针两次贯通穿刺盲肠壁,各挤出0.1 mL肠内容物,最后将盲肠还纳腹腔,逐层缝合腹壁切口,术后禁食,自由饮水。U组大鼠手术前1 h给予UTI 10万U·kg-1,生理盐水稀释至1 mL尾静脉缓慢注射(5 min)。对S组大鼠,常规麻醉消毒,开腹找到盲肠,将其拉出腹外放置1 min,之后还纳关腹。
1.3 检测指标 代谢笼收集各组大鼠术后12 h尿液标本,双抗体两步夹心酶联免疫吸附法(ELISA)行尿微量白蛋白(UMA)定量检测。称体质量,碱性苦味酸法测血尿肌酐,计算内生肌酐清除率(Ccr)。HE染色法观察肾组织病理改变。ELISA法检测血清肿瘤坏死因子-α(TNF-α)和白细胞介素-18(IL-18)的含量。硫代巴比妥酸(TBA)法检测血清中丙二醛(MDA)含量,黄嘌呤氧化酶法测定大鼠血清超氧化物歧化酶(SOD)活性。Western blot法检测肾组织低氧诱导因子-1α(HIF-1α)的蛋白表达。
1.4 统计学方法 采用SPSS 19.0统计软件进行处理。计量资料以s表示,多组间比较采用单因素方差分析(ANOVA),两组间比较采用最小显著差异法(LSD),P<0.05为差异有统计学意义。
2 结果
2.1 肾脏病理学改变 对照组的肾小球和肾小管结构正常,近曲小管管壁充盈,胞质丰富,胞核蓝染,边界清晰;D组及S组肾小球大致正常,而肾小管上皮细胞出现病理损害,可见浊肿现象,部分细胞核淡染;DS组较D组及S组损害更加严重,肾小球肾和小管明显浊肿,管腔狭窄,基底膜增厚,且细胞核淡染,部分核出现浓缩、破碎甚至溶解;U组肾小球结构大致正常,体积有增大,少量肾小管上皮细胞出现浊肿,部分细胞核淡染,但总体的病理损伤较DS组明显减轻。见图1。
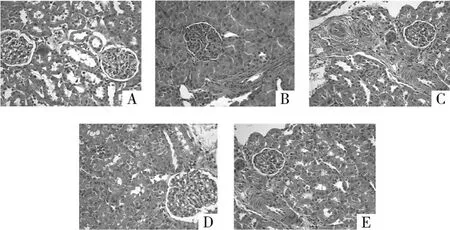
图1 各组大鼠肾组织的病理学结果(HE染色×400)
2.2 UMA含量变化 各组间UMA含量不全相同(P<0.05);与C组相比,其余各组UMA均升高(P<0.01);D组与S组间差异无统计学意义(P>0.05);与S组相比,DS组及U组UMA均升高(P<0.01);与DS组相比,U组UMA降低(P<0.05)。见表1。
2.3 Ccr变化 各组间Ccr不全相同(P<0.05);与C组相比,其余各组Ccr均降低(P<0.01);D组与S组间差异无统计学意义(P>0.05);与S组相比,DS组及U组 Ccr降低(P<0.05);与 DS组相比,U组Ccr升高(P<0.05)。见表1。
2.4 血清IL-18和TNF-α含量变化 各组间血清IL-18和TNF-α含量均不全相同(P<0.05);与 C组相比,其余各组血清 IL-18、TNF-α均升高(P<0.01);D组与S组间的血清IL-18、TNF-α含量均差异无统计学意义(P>0.05);与S组相比,DS组血清IL-18、TNF-α均升高(P<0.05);与 DS组相比,U组血清 IL-18、TNF-α降低(P<0.05)。见表1。
2.5 血清MDA含量及SOD活性变化 各组间血清MDA含量及SOD活性均不全相同(P<0.05);与C组相比,其余各组血清MDA含量均升高(P<0.01),SOD活性均下降(P<0.01);D组与S组间血清MDA含量和SOD活性差异无统计学意义(P>0.05);与 S组相比,DS组 MDA含量均升高(P<0.05),DS组 SOD活性下降(P<0.05),U组MDA含量均升高(P<0.05)、SOD活性下降(P<0.05);与DS组相比,U组血清MDA含量下降(P<0.05),SOD活性升高(P<0.05)。见表1。
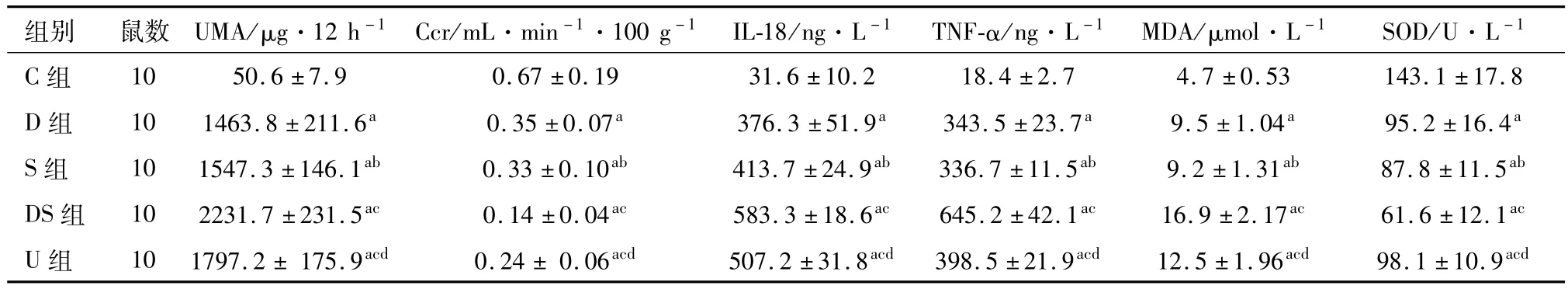
表1 各组不同大鼠各个指标比较/x±s
2.6 肾组织HIF-1α蛋白表达变化 各组间肾组织HIF-1α蛋白表达不全相同(P<0.05);与C组相比,其余各组肾组织HIF-1α蛋白表达均升高(P<0.01);D组与S组间肾组织HIF-1α蛋白含量差异无统计学意义(P>0.05);与S组相比,DS组大鼠肾组织的HIF-1α蛋白表达均升高(P<0.01),U组HIF-1α蛋白表达也升高(P<0.05);与DS组相比,U组肾组织HIF-1α蛋白表达降低(P<0.05)。见图2。
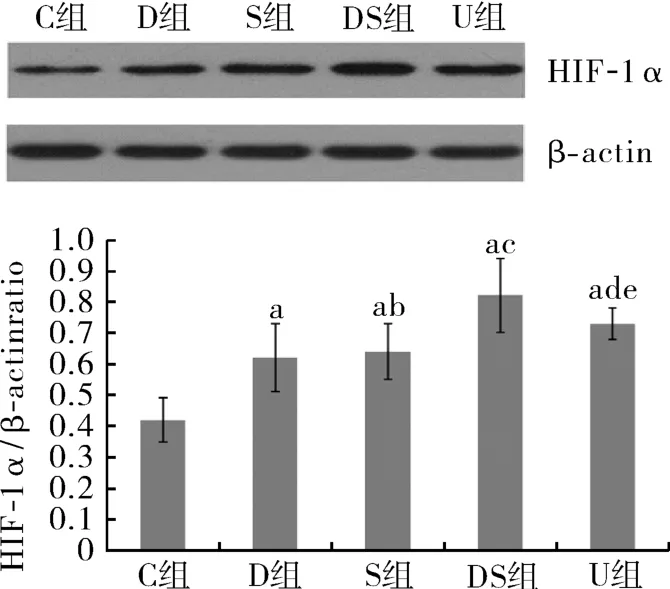
图2 肾脏组织中AIF-1α蛋白表达水平
3 讨论
2型糖尿病(T2DM)是一种复杂多样的疾病,其发病与胰腺β细胞分泌胰岛素相对减少和渐进性的胰岛素抵抗导致高糖血症有关[7]。T2DM动物模型众多,主要有实验性、自发性和转基因性T2DM动物模型[8]。本实验采用高脂饲料加小剂量STZ一次性腹腔注射来建立T2DM大鼠模型。这种方法能在使用小剂量STZ破坏大鼠胰岛β细胞功能的同时,辅以高脂饲料造成外周组织对胰岛素的敏感性降低,形成类似的T2DM模型。然后我们在T2DM基础上采用CLP建立大鼠脓毒症模型,相对于其他直接注射LPS等成分构建脓毒症模型的实验方法来说,这种动物模型模仿了人类肠道手术后细菌感染导致脓毒症的渐进性临床情境,而不是采用毒素进行一次性打击造成脏器损伤。有研究显示,在行CLP术后,机体高动力循环状态将会持续8 h(术后2 h到术后10 h),机体在术后16 h左右开始进入低动力的虚弱状态,可持续到20 h左右[9]。另外有研究证实,雌性大鼠在同时行CLP和卵巢切除术后12 h到20 h间的死亡率达到33%,而糖尿病雌性大鼠在同时行CLP和卵巢切除术后6 h到20 h的死亡率则达到40%[10]。本实验也存在对大鼠行糖尿病和脓毒症的双重打击,故本实验选择在CLP术后12 h收集大鼠的血液和肾脏标本进行相关指标的检测,这样能在达到实验目标的同时,使实验结束时大鼠的死亡率最低。最后,本实验结果证明,相较于对照组,DS组肾脏肾小球肾小管均严重受损,糖尿病脓毒症大鼠AKI模型构建成功。
UTI是从人类尿液中提纯萃取出的含有143个氨基酸的糖蛋白,分子量为67 kDa,能够有效抑制多种酶和不良刺激引起的炎性因子的释放,同时也能够通过稳定溶酶体的细胞膜、吸收氧自由基以及阻止炎性因子的释放来改善微循环。此外,许多研究显示,UTI对于AKI都有保护作用[11-12]。而目前关于UTI对患有糖尿病的肠源性脓毒症大鼠导致AKI的保护作用的研究尚未见报道。而且,在某些患者经历较大手术如心肺转流术时,使用UTI治疗后测量患者肾脏生物标记物后,发现UTI对于AKI不具有保护性作用[13]。在本研究中,U组相对于DS组,肾脏病理损伤明显减轻,尿中微量白蛋白的含量明显降低,Ccr明显升高。结果说明,在糖尿病脓毒症大鼠发生AKI时,UTI对于的肾脏功能有明显保护作用。
TNF-α是脓毒症级联反应中重要的炎性因子,早期出现,促进脓毒症发生发展。IL-18是一种新型的促炎因子,在脓毒症发病过程中,IL-18起重要作用,而且与脓毒症的严重程度密切相关。有研究发现,在脂多糖(LPS)刺激之前予以UTI预处理治疗,血清TNF-α含量能够显著降低,炎性反应明显减轻[14]。但是,UTI在某些实验模型中的抗炎作用并不十分显著。在失血性休克患者中使用UTI,患者血中炎性因子如TNF-α和IL-6水平并没有明显变化[15]。也有研究发现,UTI能够降低LPS刺激的单核细胞中TNF-α的含量,但是这种降低幅度并不明显,不能充分证明UTI抗炎作用的有效性[16]。而在本实验中发现,大鼠血清中的TNF-α和IL-18,相对于D组和S组,DS组明显升高;而相对于DS组,U组明显下降。脓毒症感染可以明显加重糖尿病大鼠的全身炎性反应,使用UTI能够明显减轻在发生糖尿病脓毒症时的全身炎性反应,延缓脓毒症发病过程。
氧自由基损伤是糖尿病脓毒症时肾脏损伤的重要机制之一,脓毒症时大量炎性因子释放诱导活性氧的产生,造成机体内氧化-还原状态失衡,引起氧化应激,最终导致肾脏损伤,糖尿病更会加速这一过程的发生发展。MDA是脂质过氧化反应重要的代谢终产物之一,其浓度能够直接反映出机体氧化损伤程度;SOD是机体内清除氧自由基的首要物质,其活性水平高低能够反应机体抗氧化能力的强弱。本实验中,相对于D组和S组,DS组大鼠血清中的MDA含量升高,SOD活性降低;相对于DS组,U组大鼠血清中的MDA含量降低,SOD活性升高,变化趋势与肾脏受损严重程度相关。这说明脓毒症感染明显加重糖尿病大鼠的全身氧化应激反应;而UTI也是通过减少全身MDA释放,提升SOD活性水平,从而减少氧自由基,减轻氧化应激反应,来保护肾脏功能。
肾脏组织血流量大,耗氧量高,对缺血缺氧反应敏感,易受缺氧损伤。而HIF-1α是特异性介导细胞低氧反应的核转录因子。HIF-1α的蛋白稳定性受细胞内氧浓度的调节,在正常的氧环境中HIF-1α的含量很低,因为在正常氧浓度时,HIF-1α可以持续产生,但是却很快被脯氨酰羟基化酶羟基化,最终被泛素-蛋白酶系统分解;在缺氧时,细胞中的脯氨酰羟基化酶活性降低,HIF-1α不能被分解,于是在细胞中大量积聚[17]。因此,肾脏中HIF-1α蛋白的表达水平能够直接反映肾脏的缺氧情况。在本实验中发现,肾脏HIF-1α蛋白表达水平,DS组相对于D组和S组明显升高,U组相对于DS组明显降低。这说明在糖尿病脓毒症大鼠肾脏组织中显著缺氧,而UTI能够改善肾脏缺氧状态,降低HIF-1α表达,保护肾脏功能。
本实验成功构建大鼠糖尿病脓毒症致AKI模型,证实UTI预处理能有效改善大鼠的肾功能,减轻AKI,其机制可能与UTI能够抑制炎性反应、降低氧化应激、改善肾脏缺氧情况有关。
[1] LHEVEDER R,NOLAN T.International Diabetes Federation[J].Diabetes Research and Clinical Practice,2013,101(3):349-351.
[2] SCHOR N.Acute renal failure and the sepsis syndrome[J].Kidney Int,2002,61(2):764-776.
[3] 张红梅,刘培,盛春风,等.乌司他丁对脓毒症膈肌p38MAPK信号通路的影响[J].重庆医学,2013,42(18):2117-2119.
[4] 薛霞,肖正大,王淑芳,等.乌司他丁对糖尿病大鼠的肾脏保护作用及其机制[J].山东大学学报(医学版),2012,50(1):1-4.
[5] 张新杰,刘建坤,高冬梅,等.吡咯烷二硫代氨基甲酸酯对2型糖尿病大鼠肾脏的保护作用[J].中国病理生理杂志,2012,28(10):1807-1811.
[6] 李宝贵,王丹丹,解珂,等.黄芪多糖对2型糖尿病合并脓毒症大鼠胰腺线粒体氧化应激损伤的保护作用[J].江苏医药,2011,37(8):894-896.
[7] CHENG D.Prevalence,predisposition and prevention of type IIdiabetes[J].Nutr Metab(Lond),2005,2:29.
[8] SRINIVASAN K,RAMARAOP.Animal models in type2 diabetes research:an overview[J].Indian J Med Res,2007,125(3):451-472.
[9] REMICK DG,NEWCOMB DE,BOLGOS GL,et al.Comparison of the mortality and inflammatory response of two models of sepsis:lipopolysaccharide vs.cecal ligation and puncture[J].Shock,2000,13(2):110-116.
[10]UYANIK A,UNAL D,UYANIK MH,et al.The effects of polymicrobial sepsis with diabetes mellitus on kidney tissues in ovariectomized rats[J].Ren Fail,2010,32(5):592-602.
[11]GAO C,HUAN J,LI W,et al.Protective effects of ulinastatin on pancreatic and renal damage in rats following early scald injury[J].Burns,2009,35(4):547-552.
[12]YANG Q,LIU X,LIU M,et al.Ulinastatin-mediated protection against zymosan-induced multiple organ dysfunction in rats[J].Biologicals,2010,38(5):552-556.
[13]OH SY,KIM JC,CHOIYS,et al.Effects of ulinastatin treatment on myocardial and renal injury in patients undergoing aortic valve replacement with cardiopulmonary bypass[J].Korean JAnesthesiol,2012,62(2):148-153.
[14]HUANGN,WANGF,WANGY,et al.Ulinastatin improves survival of septic mice by suppressing inflammatory response and lymphocyte apoptosis[J].JSurg Res,2013,182(2):296-302.
[15]PARK KH,LEE KH,KIM H,et al.The Anti-inflammatory effects of ulinastatin in trauma patients with hemorrhagic shock[J].Journal of Korean Medical Science,2010,25(1):128.
[16]AOSASA S,ONO S,MOCHIZUKI H,et al.Mechanism of the inhibitory effect of protease inhibitor on tumor necrosis factor alpha production of monocytes[J].Shock,2001,15(2):101-105.
[17]FREDE S,BERCHNER-PFANNSCHMIDT U,FANDREY J.Regulation of hypoxia-inducible factors during inflammation[J].Meth Enzymol,2007,435:405-419.
