质膜Ca2+-ATPase和钙调节异常在恶性肿瘤发生发展中的作用及研究进展
2018-02-06聂绪彪徐靖宇文国容金海庹必光
聂绪彪,徐靖宇,文国容,金海,庹必光
(遵义医学院附属医院消化内科,贵州遵义 563003)
细胞内钙离子(Ca2+)平衡的紊乱是导致恶性肿瘤的发生发展、侵袭转移的重要因素。而钙通道蛋白或者钙泵的表达异常将会导致细胞内Ca2+平衡的紊乱从而导致肿瘤的发生发展。而质膜Ca2+-ATPase(PMCA)的作用则是将细胞内Ca2+排出细胞以维持细胞内的低钙环境,从而维持细胞正常的生理功能。当PMCA表达异常,则将会导致细胞内Ca2+平衡的紊乱。目前,很多研究发现PMCA在各种癌细胞系及临床肿瘤患者的组织样本中异常表达。因此,本文将对PMCA和钙调节异常在各种恶性肿瘤的发生发展中的作用及研究进展进行综述。
1 质膜PMCA的结构与功能
质膜PMCA是P型ATPase家族的一员,它位于细胞的质膜并以ATP为能量将细胞内的Ca2+排出胞外。它与其他的转运系统及可溶性钙结合蛋白一起维持细胞内的钙平衡。PMCA的分子量是140 kD,是P型ATPase家族中最大的[1]。PMCA由一条肽链构成,10个跨膜α螺旋组成。其中80%为亲水肽段并位于胞质中,包含催化ATP水解的结构域、钙调蛋白结合区域以及蛋白激酶的调节位点等功能区域。PMCA由4种基因(PMCA1-4)编码分别产生4种亚型,这4种基因分别位于不同的染色体,PMCA1位于12q21-23,PMCA2位于3p25.3,PMCA3位于 Xq28,而PMCA4位于1q25-q32。由于4种亚型在一级结构的N端和C端的胞质区存在差异,在转录时将会出现不同的剪切方式,可产生20多种不同的PMCA剪切体。而且,这4种亚型在组织分布以及功能上也存在明显的差异[2]。PMCA1被认为是管家基因,在各种细胞及组织中均普遍表达。但近年来研究发现PMCA1b在小肠黏膜上皮细胞表达,并在小肠黏膜对钙的吸收过程中发挥了重要作用[3]。而且PMCA1的表达也受除Ca2+本身以外的其他大量的因子调节[4]。PMCA4则主要在心脏、胰腺及血管内皮细胞中表达,在人类红细胞的钙转运中发挥了主要作用。研究还发现PMCA4不仅仅与钙转运相关还与其他的钙信号调节有关。与PMCA1及PMCA4不同,PMCA2及PMCA3只在一些特定的组织中表达。PMCA2主要存在于神经系统及乳腺,而PMCA3则主要在神经系统及骨骼肌表达。PMCA的活性受多种因素调节,比如钙调蛋白。当细胞内Ca2+浓度增加时,Ca2+绑定钙调蛋白(CaM)形成Ca2+-CaM复合物进而结合并激活PMCA从而排除细胞内Ca2+以维持细胞内钙平衡。但由于PMCA 4种亚型的结构特征的差异,使得与钙调蛋白的亲和力也不同。PMCA1及PMCA4与钙调蛋白有很低的亲和力,而PMCA2及PMCA3则相反。但是PMCA2、PMCA3把细胞内Ca2+排除细胞外的效率明显比其他两种亚型更高,这可能与它们的组织分布不同及各种细胞对钙处理的需求不同有关[5]。钙信号的形成主要是由Ca2+流入细胞和排除细胞的速率决定的。钙信号可以表现为振荡波或则单一的钙波信号,后者可能是瞬时的也可能是持续的钙信号。目前的研究只是证明PMCA作为Ca2+排除系统的一部分,但PMCA各个亚型的作用并没有被大量的研究,主要的原因是缺乏PMCA各个亚型特异性的抑制剂。可以肯定的是,不管PMCA表达的增加还是减少均会导致细胞内钙的流入或减少从而导致钙信号的改变。但为了弄清PMCA各个亚型的具体作用,目前已经建立了各种基因敲出小鼠模型。研究证明,敲出了PMCA1的小鼠收缩压会明显升高[6],而敲出了PMCA2的小鼠会出现平衡失调和听力障碍,敲出了PMCA4的小鼠则出现了男性的不育症[7]。这些结果表明PMCA的各个亚型对于细胞功能的维持发挥了至关重要的作用,他们的表达或调节异常将导致各种疾病的发生。此外,Ca2+在细胞的增殖及凋亡的过程中发挥了重要作用而PMCA负责清除细胞内Ca2+,这也预示着PMCA在各种恶性肿瘤的进程中可能发挥了极其重要的作用。
2 钙调节异常与恶性肿瘤
Ca2+在细胞的信号级联反应的激活中是普遍存在的第二信使。它参与调控细胞的各种生理过程,包括细胞周期的调控、基因转录转录激活、代谢及肌肉的收缩等。正常情况下,细胞内Ca2+水平总是维持在静息状态和激活状态之间,而这个水平的维持是通过大量钙通道及钙转运蛋白的调节实现的。当细胞内的Ca2+浓度异常增加或减少,那么将会导致各种疾病的发生,比如钙超载会引起心肌缺血/再灌注损伤,从而诱发急性心肌梗死[8]。此外,细胞内Ca2+的调节在恶性肿瘤的发生发展中也发挥了重要作用[9]。恶性肿瘤细胞包括几个特征:自给自足、接触抑制丧失、无限增殖、易侵袭转移及破坏正常的细胞组织[10]。大量的研究证明钙信号与细胞周期密切相关,在细胞周期的关键环节发挥了重要作用,包括细胞进入G1期及G1/S、G2/M的转化,这就预示着钙信号在对肿瘤细胞增殖的调控中扮演了重要角色。肿瘤细胞的生长取决于肿瘤细胞的微环境,比如氧含量、pH值、生长因子及其他的信号分子,而钙信号与此仍密切相关。比如:基质交感分子1(STIM1)通过与缺氧诱导因子-1α(HIF-1α)的相互作用介导了钙池操纵性钙内流(SOCE)从而促进肝细胞癌的发生和发展[11]。此外,钙信号在肿瘤细胞迁移、侵袭、凋亡和转移中也发挥了重要作用。比如抗凋亡分子Mcl-1通过与电压门控离子通道(VDAC)的相互作用介导了线粒体基质对钙的吸收从而促进了肺癌细胞的迁移[12]。这些结果表明细胞内Ca2+转运的调节异常可以促进肿瘤细胞的增殖、抑制凋亡以及促进肿瘤细胞的侵袭、转移等。而钙通道蛋白或者钙泵则主要参与对细胞内钙的调节,因此,钙通道蛋白或者钙泵在肿瘤的发生发展过程中发挥了重要的作用[13]。瞬时受体电位通道8(TRPM8)是一种离子通道蛋白,在活化时它允许钠离子、Ca2+进入细胞。研究报道在前列腺癌细胞系中TRPM8表达增加,抑制TRPM8的表达后癌细胞的增殖能力会降低,TRPM8通道很有可能成为前列腺癌的一种生物学预测标记及治疗靶点[14]。Ca2+通道TRPV6表达水平与前列腺癌、结肠癌、乳腺癌及卵巢癌等癌症的临床分期密切相关,从而被认为可能是治疗这些癌症的靶点[15-16]。在雌激素受体阴性的乳腺癌细胞中TRPV6是高表达的,抑制TRPV6的表达会减少癌细胞的增殖,而且TRPV6的高表达与乳腺癌患者的不良预后密切相关[17]。同样,Ca2+通道 TRPV4在肿瘤内皮细胞中低表达,敲出TRPV4基因会促进肿瘤血管的生成从而促进肿瘤的生长。而且利用TRPV4的激动剂(GSK1016790A)与抗癌药物顺铂组合,通过诱导血管成熟显著抑制了野生型小鼠的肿瘤生长,这些结果表明TRPV4通道是肿瘤血管生成的关键调节因子,可能成为抗肿瘤血管生成治疗的新靶点[18]。研究也发现肌/内质网 Ca2+-ATPase(SERCA)各种亚型表达水平的改变与许多恶性肿瘤有关,包括肺癌、结肠癌、前列腺癌和骨髓性白血病等[19-20];比如SERCA3在肺腺癌细胞中低表达会导致内质网钙稳态的异常,从而影响癌细胞的分化[19]。分泌途径 Ca2+-ATPase(SPCA)在乳腺癌、结肠癌、前列腺癌等恶性肿瘤中的也被大量的研究[21]。研究发现SPCA1在基底细胞样(basal-like)乳腺癌中高表达,但在Luminal型乳腺癌中低表达[22]。这些研究结果证明钙通道蛋白或则钙泵在肿瘤的发生发展中发挥了重要的作用。目前已经有很多研究发现质膜PMCA与某些特异性的恶性肿瘤的发生发展过程密切相关。接下来我们将复习这些文献并详细阐述PMCA在这些恶性肿瘤中表达水平的改变及其如何通过对细胞内Ca2+转运的调节从而促进肿瘤的发生。
3 质膜PMCA与恶性肿瘤
研究发现质膜PMCA在各种恶性肿瘤中表达异常,包括乳腺癌、结肠癌、胰腺癌、肝癌等。1997年,第1次报道转染了SV40的皮肤成纤维细胞、肺成纤维细胞PMCA1b和PMCA4amRNA水平明显降低。之后的研究发现在ZR-75-1乳腺癌细胞系中,PMCA2mRNA水平是高表达的,而在正常的184B5细胞系中则是低表达的[23]。随后,VanHouten等[24]研究发现在T47D乳腺癌细胞系中,过表达PMCA2会导致细胞内钙降低从而抑制癌细胞的凋亡。而且,他们还发现,PMCA2的高表达与乳腺癌患者的不良预后密切相关,这些结果表明PMCA2的高表达在乳腺癌的发生发展中发挥了重要作用,其机制可能是通过降低细胞内钙的水平从而使癌细胞避免进入凋亡途径,从而导致了乳腺癌的不断演进。相反,沉默PMCA2会抑制MDA-MB-231乳腺癌细胞的增殖及增加癌细胞对细胞毒类药物阿霉素的敏感性[25]。研究发现在各种乳腺癌细胞系中,破坏PMCA2和钙调磷酸酶之间的相互作用可以导致calcineurin/NFAT通路的激活,从而上调促凋亡蛋白FAS配体的表达进而促进癌细胞的凋亡。而且破坏PMCA2和钙调磷酸酶之间的相互作用还可以增加癌细胞对化疗药物紫杉醇的敏感性[26]。此外,在SKBR3乳腺癌细胞系中,PMCA2与HER2蛋白、热休克蛋白90(HSP-90)的表达水平和功能密切相关,敲出PMCA2基因会导致HER2、HSP-90的表达减少和功能下降。其主要机制是PMCA2通过调节HER2和HSP-90在癌细胞膜上的定位及信号传导从而诱导癌细胞的增殖和抑制癌细胞的凋亡[27]。值得一提的是,在MDA-MB-231乳腺癌细胞系中,尽管沉默PMCA1或者PMCA4对细胞活性却没有影响,但沉默PMCA1会增加由Ca2+载体介导的细胞坏死,而沉默 PMCA4会增强由 Bcl-2抑制剂(ABT-263)诱导的细胞凋亡作用[28]。因此,以上研究说明PMCA在乳腺癌中发挥了重要作用,特别是PMCA2可以通过与钙调磷酸酶、HER2蛋白和热休克蛋白90(HSP-90)等之间的相互作用从而促进癌细胞的增殖和减少癌细胞的凋亡,这为我们临床上乳腺癌患者的治疗策略带来了新的启示。
PMCA除了在乳腺癌中表达异常,在消化系统的恶性肿瘤中的表达和功能仍然值得我们重视。研究发现在超过40%的口腔鳞状细胞癌和癌前病变患者的临床标本中,PMCA1蛋白的表达水平是降低的,这是第一次在临床恶性肿瘤中探索PMCA所发挥的作用[29]。随后的研究发现胃、结肠癌细胞的分化与钙稳态的变化有关,而PMCA表达的改变在其中则发挥了重要作用。Aung等[30]发现在大量的低分化的进展期结肠癌患者组织样本中,PMCA4的表达是显著降低的,在HT-29结肠癌细胞的分化过程中,PMCA4的表达是明显上调的,而PMCA1的表达则是没有明显改变。同样,在各种未分化的胃、结肠癌细胞系中,PMCA1b蛋白的表达是上调的,而PMCA4b的表达水平则是明显降低的[31]。研究也发现与正常组织相比,PMCA4 mRNA在结肠癌组织中的表达水平是明显降低的。而且在HT29结肠癌细胞系中,通过沉默PMCA4发现由ATP和神经降压素引起的[Ca2+]CYT反应增加了,但并没有增加癌细胞对由肿瘤坏死因子(TNF)所诱导的细胞凋亡。这表明PMCA4的表达降低增加了癌细胞对某些生长刺激的敏感性,而通过稳定的过表达PAMA4则会减少癌细胞增殖[32]。也有研究发现在结肠癌伴淋巴结转移的患者组织中PMCA4蛋白的表达是降低[33],而在肠型和杯状细胞型结肠癌细胞的分化中,PMCA4b是高表达,PMCA1b的表达则没有明显变化[34]。而且,PMCA在肝细胞癌、胰腺癌中也扮演了重要的角色。在AS-30D肝癌细胞系中,PMCA4 mRNA的表达明显降低[35]。在人类胰腺导管腺癌细胞系中,PMCA可以利用糖酵解ATP的能量从而维持癌细胞内低钙的环境进而维持癌细胞的生存[36]。因此,以上研究表明PMCA在消化系统的恶性肿瘤中发挥了重要的作用。特别是在一些胃、结肠癌中,PMCA4基因的差异表达可能作为癌细胞分化程度高低的一种特异性的生物学标记,这为消化系统肿瘤的治疗提供了新的思路和科学依据。
此外,最近的研究报道在皮肤黑色素瘤细胞中,PMCA4b的表达是显著减少的,而PMCA4b的过表达则会明显抑制癌细胞的迁移和转移,其机制可能是通过MAPK信号通路调节了PMCA4b的表达[37]。
目前,很多研究报道了关于PMCA在各种恶性肿瘤中的表达改变,PMCA表达的改变可能作为一些恶性肿瘤的生物学特征(表1)。但仍需要证实在癌细胞系中PMCA的改变是否真的和临床肿瘤患者样本中表达的改变一致。同样,PMCA的表达改变是否真的和肿瘤患者的预后等相关。在某些情况下,PMCA表达的改变可能是由于与获得肿瘤表型相关的钙信号的改变而引发的补偿性变化。近年来,一些研究也试图了解在一些癌细胞系中沉默或过表达PMCA所产生的影响,这些研究表明PMCA可能是癌细胞增殖或者凋亡的潜在的调节因子。有些恶性肿瘤可能与PMCA的下调有关,但其他的恶性肿瘤可能与PMCA的表达上调有关。由于PMCA各种亚型在不同的肿瘤中差异表达有可能发挥不同的作用,这就引发了一个关于PMCA是增加还是减少导致肿瘤发生的问题。这可能取决于钙信号调节细胞功能各种各样的过程,换一个说法就是钙信号(例如响应的幅度)决定细胞的命运[38]。关于PMCA表达水平的改变与细胞内钙信号、肿瘤细胞增殖及凋亡的关系总结如图1。当PMCA的表达相对减少,细胞内钙会相对增加,这会增加细胞对生长、迁移等刺激的反应,从而促进癌细胞的增殖。但如果PMCA的表达过度减少,这会导致细胞内钙显著增加,从而使细胞对凋亡刺激更加敏感,进而促进细胞的凋亡。因此,选择性的压力刺激可能会因为PMCA表达相对降低导致癌细胞对凋亡刺激的不敏感从而导致癌细胞的克隆增殖。文献报道,在HT29结肠癌细胞系中,通过沉默PMCA4发现由ATP和神经降压素引起的[Ca2+]CYT反应增加了,但并没有增加癌细胞对由肿瘤坏死因子(TNF)所诱导的细胞凋亡。这表明PMCA4的表达降低增加了癌细胞对某些生长刺激的敏感性[32]。对于某些PMCA表达上调的恶性肿瘤,这些肿瘤细胞能更有效的排除细胞内钙,这就减少了其对凋亡刺激的敏感性,从而创造一个更有利于自身生长的环境。其实,从某种意义上来说,也是[Ca2+]CYT反应的增加从而促进了癌细胞的增殖。因此,适当的压力刺激,PMCA表达的增加或适当降低可以使癌细胞的内钙维持在一个适宜其自身生存的水平。
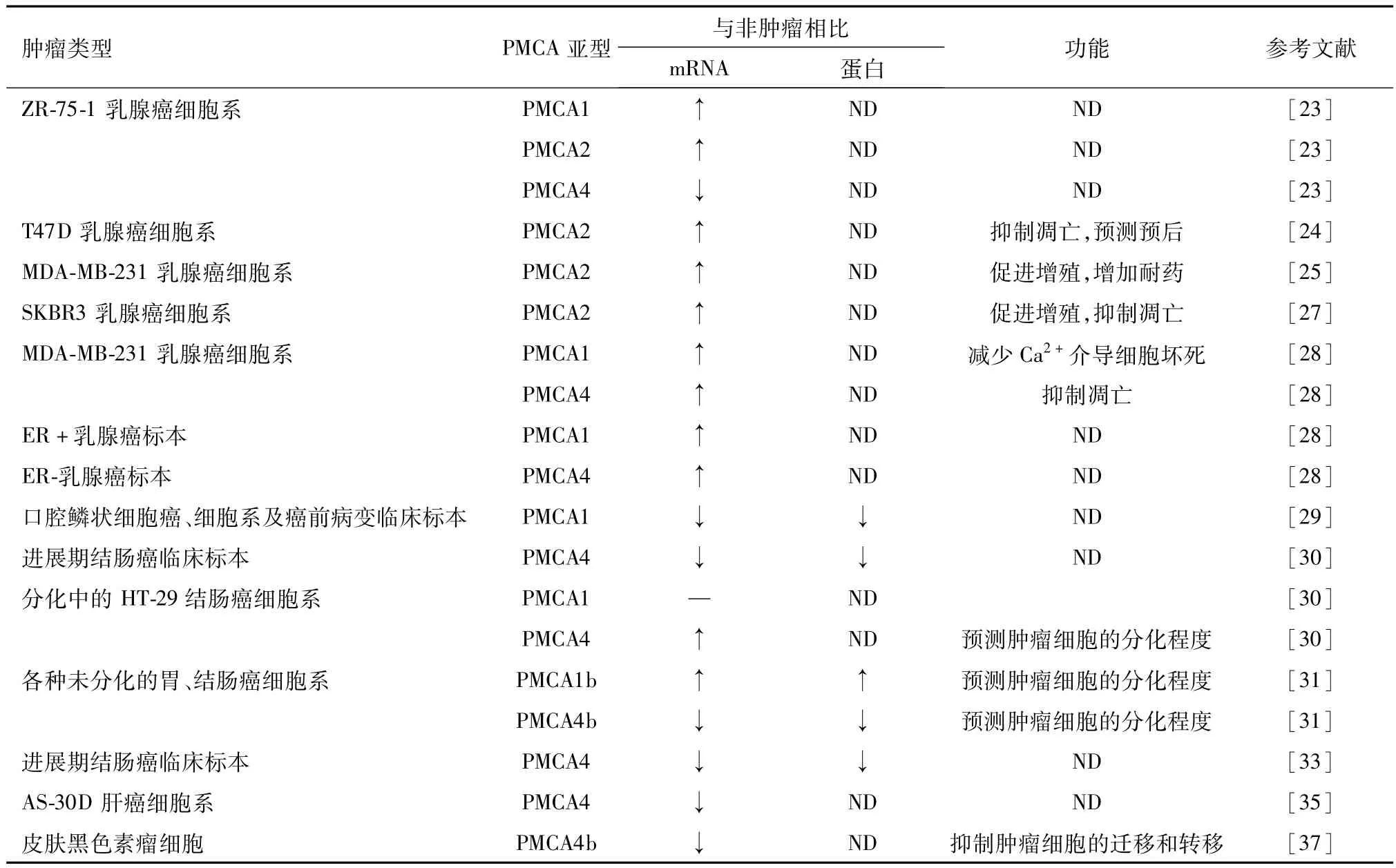
表1 PMCA在各种肿瘤细胞系及临床肿瘤患者标本中的表达改变

图1 质膜PMCA表达水平的改变与细胞质Ca2+水平及恶性肿瘤细胞增殖、凋亡的关系
4 结论及展望
Ca2+是细胞内普遍存在的第二信使,参与细胞的各种各样的生理、生化过程,而细胞内Ca2+平衡的紊乱则是导致恶性肿瘤的发生发展、侵袭转移的重要因素。因此,钙通道蛋白或者钙泵在这些过程中发挥了重要的作用。近年来,越来越多关于肿瘤细胞如何通过对钙信号的调节从而维持其自身的增殖、迁移等的研究。虽然对于质膜PMCA的研究不像其他的Ca2+通道或钙泵一样广泛,但在各种癌细胞系中,也有很多研究证明了PMCA的改变可能会作为某些癌细胞的生物学特征,而且这在部分临床肿瘤患者样本研究中得到证明。目前,已经初步探索了关于PMCA在恶性肿瘤中表达的改变以及如何通过对钙信号的调节从而调控肿瘤细胞生物学行为的机制。以后的研究也会更多注重PMCA和钙调节异常与肿瘤患者预后之间的关系、PMCA各种亚型在肿瘤的发生发展中的作用及其潜在的分子机制,为以后临床上恶性肿瘤的治疗策略提供新的理论依据。
[1] PADÁNYI R,PÁSZTY K,HEGEDÜSL,et al.Multifaceted plasma membrane Ca(2+)pumps:From structure to intracellular Ca(2+)handling and cancer[J].Biochim Biophys Acta,2016,1863(6 Pt B):1351-1363.
[2] KREBSJ.The plethora of PMCA isoforms:Alternative splicing and differential expression[J].Biochim Biophys Acta,2015,1853(9):2018-2024.
[3] DIAZ DE BARBOZA G,GUIZZARDI S,TOLOSA DE TALAMONI N.Molecular aspects of intestinal calcium absorption[J].World J Gastroenterol,2015,21(23):7142-7154.
[4] PIGNATARO MF,DODES-TRAIAN MM,GONZáLEZ-FLECHA FL,et al.Modulation of plasma membrane Ca2+-ATPase by neutral phospholipids:effect of the micelle-vesicle transition and the bilayer thickness[J].JBiol Chem,2015,290(10):6179-6190.
[5] BRINI M,CALìT,OTTOLINI D,et al.The plasma membrane calcium pump in health and disease[J].FEBS J,2013,280(21):5385-5397.
[6] KOBAYASHI Y,HIRAWA N,TABARA Y,et al.Mice lacking hypertension candidategene ATP2B1 in vascular smooth musclecells show significant blood pressure elevation[J].Hypertension,2012,59(4):854-860.
[7] GIACOMELLO M,DE MARIO A,SCARLATTI C,et al.Plasma membrane calcium ATPases and related disorders[J].Int J Biochem Cell Biol,2013,45(3):753-762.
[8] 刘家军,李小燕,杜成芬,等.丹参酮Ⅱ A磺酸钠对急性心肌梗死大鼠心肌组织间液钙离子与心功能的影响[J].安徽医药,2016,20(4):643-646.
[9] PREVARSKAYA N,OUADID-AHIDOUCH H,SKRYMA R,et al.Remodelling of Ca2+transport in cancer:how it contributes to cancer hallmarks[J].Philos Trans R Soc Lond,B,Biol Sci,2014,369(1638):20130097.
[10]PENNATI M,CIMINO-REALE G,GATTI L,et al.Strategies to Strike Survival Networks in Cancer[J].Crit Rev Oncog,2016,21(3/4):269-308.
[11]LI Y,GUO B,XIE Q,et al.STIM1 Mediates Hypoxia-Driven Hepatocarcinogenesis via Interaction with HIF-1[J].Cell Rep,2015,12(3):388-395.
[12]HUANG H,SHAH K,BRADBURY NA,et al.Mcl-1 promotes lung cancer cell migration by directly interacting with VDACto increase mitochondrial Ca2+uptake and reactive oxygen species generation[J].Cell Death Dis,2014,5:e1482.
[13]DÉLIOT N,CONSTANTIN B.Plasma membrane calcium channels in cancer:Alterations and consequences for cell proliferation and migration[J].Biochim Biophys Acta,2015,1848(10 Pt B):2512-2522.
[14]PÉREZ DE VEGA MJ,GÓMEZ-MONTERREY I,FERRER-MONTIEL A,et al.Transient receptor potential melastatin 8 channel(TRPM8)modulation:cool entryway for treating pain and cancer[J].Journal of Medicinal Chemistry,2016,59(22):10006-10029.
[15]RAPHAËL M,LEHENKYI V,VANDENBERGHE M,et al.TRPV6 calcium channel translocates to the plasma membrane via Orai1-mediated mechanism and controls cancer cell survival[J].Proc Natl Acad Sci USA,2014,111(37):E3870-E3879.
[16]LEHENKYI V,RAPHAËL M,PREVARSKAYA N.The role of the TRPV6 channel in cancer[J].JPhysiol(Lond),2012,590(6):1369-1376.
[17]PETERS AA,SIMPSON PT,BASSETT JJ,et al.Calcium channel TRPV6 as a potential therapeutic target in estrogen receptor-negative breast cancer[J].Mol Cancer Ther,2012,11(10):2158-2168.
[18]ADAPALA RK,THOPPIL RJ,GHOSH K,et al.Activation of mechanosensitive ion channel TRPV4 normalizes tumor vasculature and improves cancer therapy[J].Oncogene,2016,35(3):314-322.
[19]ARBABIAN A,BROULANDJP,APÁTIÁ,et al.Modulation of endoplasmic reticulum calcium pump expression during lung cancer cell differentiation[J].FEBSJ,2013,280(21):5408-5418.
[20]DANG D,RAO R.Calcium-ATPases:Gene disorders and dysregulation in cancer[J].Biochim Biophys Acta,2016,1863(6 Pt B):1344-1350.
[21]FENG MY,RAO R.New insights into store-independent Ca2+entry:secretory pathway calcium ATPase 2 in normal physiology and cancer[J].International Journal of Oral Science,2013,5(2):71-74.
[22]GRICE DM,VETTER I,FADDY HM,et al.Golgi calcium pump secretory pathway calcium ATPase 1(SPCA1)is a key regulator of insulin-like growth factor receptor(IGF1R)processing in the basal-like breast cancer cell line MDA-MB-231[J].JBiol Chem,2010,285(48):37458-37466.
[23]LEE WJ,ROBERTS-THOMSON SJ,MONTEITH GR.Plasma membrane calcium-ATPase 2 and 4 in human breast cancer cell lines[J].Biochem Biophys Res Commun,2005,337(3):779-783.
[24]VANHOUTEN J,SULLIVAN C,BAZINET C,et al.PMCA2 regulates apoptosis during mammary gland involution and predicts outcome in breast cancer[J].Proc Natl Acad Sci USA,2010,107(25):11405-11410.
[25]PETERSAA,MILEVSKIY MJ,LEE WC,et al.The calcium pump plasma membrane Ca(2+)-ATPase 2(PMCA2)regulates breast cancer cell proliferation and sensitivity to doxorubicin[J].Sci Rep,2016,6:25505.
[26]BAGGOTT RR,MOHAMED TM,OCEANDY D,et al.Disruption of the interaction between PMCA2 and calcineurin triggers apoptosis and enhances paclitaxel-induced cytotoxicity in breast cancer cells[J].Carcinogenesis,2012,33(12):2362-2368.
[27] JEONG J,VANHOUTEN JN,DANN P,et al.PMCA2 regulates HER2 protein kinase localization and signaling and promotes HER2-mediated breast cancer[J].Proc Natl Acad Sci USA,2016,113(3):E282-E290.
[28]CURRY MC,LUK NA,KENNY PA,et al.Distinct regulation of cytoplasmic calcium signals and cell death pathways by different plasma membrane calcium ATPase isoforms in MDA-MB-231 breast cancer cells[J].J Biol Chem,2012,287(34):28598-28608.
[29]SAITO K,UZAWA K,ENDO Y,et al.Plasma membrane Ca2+ATPase isoform 1 down-regulated in human oral cancer[J].Oncol Rep,2006,15(1):49-55.
[30]AUNG CS,KRUGER WA,PORONNIK P,et al.Plasma membrane Ca2+-ATPase expression during colon cancer cell line differentiation[J].Biochem Biophys Res Commun,2007,355(4):932-936.
[31]RIBICZEY P,TORDAI A,ANDRIKOVICS H,et al.Isoform-specific up-regulation of plasma membrane Ca2+ATPase expression during colon and gastric cancer cell differentiation[J].Cell Calcium,2007,42(6):590-605.
[32]AUNG CS,YE W,PLOWMAN G,et al.Plasma membrane calcium ATPase 4 and the remodeling of calcium homeostasis in human colon cancer cells[J].Carcinogenesis,2009,30(11):1962-1969.
[33]RÜSCHOFF JH,BRANDENBURGER T,STREHLER EE,et al.Plasma membrane calcium ATPase expression in human colon multistep carcinogenesis[J].Cancer Invest,2012,30(4):251-257.
[34]RIBICZEY P,PAPPB,HOMOLYA L,et al.Selective upregulation of the expression of plasma membrane calcium ATPase isoforms upon differentiation and 1,25(OH)2D3-vitamin treatment of colon cancer cells[J].Biochem Biophys Res Commun,2015,464(1):189-194.
[35]DELGADO-COELLOB,SANTIAGO-GARCÍA J,ZARAIN-HERZBERG A,et al.Plasma membrane Ca2+-ATPase mRNA expression in murine hepatocarcinoma and regenerating liver cells[J].Mol Cell Biochem,2003,247(1/2):177-184.
[36]JAMESAD,PATEL W,BUTT Z,et al.The Plasma Membrane Calcium Pump in Pancreatic Cancer Cells Exhibiting the Warburg Effect Relies on Glycolytic ATP[J].Journal of Biological Chemistry,2015,290(41):24760-24771.
[37]HEGEDU~S L,GARAY T,MOLNÁR E,et al.The plasma membrane Ca2+pump PMCA4b inhibits the migratory and metastatic activity of BRAF mutant melanoma cells[J].Int J Cancer,2017,140(12):2758-2770.
[38]MONTEITH GR,PREVARSKAYA N,ROBERTS-THOMSON SJ.The calcium-cancer signalling nexus[J].Nat Rev Cancer,2017,17(6):367-380.
