盐酸米托蒽醌聚乙二醇化脂质体的制备及对A549细胞体外抗肿瘤作用的研究
2018-02-06凌云程婷宋礼华
凌云,程婷,宋礼华
(1.绩溪县食品药品监督管理局,安徽 绩溪 245300;2.安徽安科生物工程(集团)股份有限公司,安徽合肥 230088)
盐酸米托蒽醌(Mitoxantrone,DHAD)是一种具有蒽环结构的广谱抗肿瘤抗生素,通过其自身化学结构的“嵌插”机制,可阻断肿瘤细胞DNA的合成、转录,对多种临床常见的肿瘤细胞有明确疗效[1-3]。但该药具有较明显的骨髓抑制、心脏毒性及白细胞减少等不良反应[4-5]。将抗肿瘤药物制备成脂质体,可改变药物的分布性质,从而实现对药物动力学的优化,减少不良反应[6]。在制备脂质体时,通过添加聚乙二醇(PEG)磷脂,将高分子材料嵌插入脂质体结构从而改变脂质体表面性质,可显著提高脂质体的稳定性,延长血循环时间提高药物作用效果。随着研究的不断深入,PEG修饰技术与包封药物的释放性能之间的关系、是否会对释药造成负面影响,目前研究观点仍未达成一致意见[7-8]。为探索PEG化修饰对脂质体制剂细胞毒作用的影响,本课题制备了DHAD PEG化脂质体(DHAD-PEG-L),以DHAD水溶液模拟常规DHAD制剂为参比、以人非小细胞肺癌A549细胞为模型开展细胞药效学试验,从而明确DHAD减毒增效的改造方向,以期提高药物化疗效果,减少不良反应,提高患者生存质量。
1 材料与方法
1.1 仪器 细胞培养箱(2123-TC,SHEL-LAB);倒置显微镜(OLYMPUS);光吸收读板机(Molecular Devices);超净工作台(苏净);冷冻离心机(BECKMAN);细胞培养瓶、96孔培养板(Costar);Sephadex G-25葡聚糖凝胶柱(Pharmacia);高效液相色谱(Waters);紫外检测仪(上海琪特);Nano ZS粒度分析仪(Malvern)。
1.2 试剂 DHAD原料药(湖北健源化工,纯度>99%);PEG化空白脂质体由安徽安科生物工程股份有限公司协助制备(成分规格:氢化磷脂8.8 g·L-1、PEG磷脂 2.95 g·L-1、胆固醇 2.95 g·L-1);RPMI 1640培养基、小牛血清及胰蛋白酶(GiBco);MTT(Solarbio);L-谷氨酰胺、Triton100、丙酮酸钠、二甲亚砜(DMSO)均购自国药集团有限公司(分析纯)。
1.3 细胞 A549人非小细胞肺癌细胞株(由安徽安科生物工程股份有限公司提供)。
1.4 方法
1.4.1 主动载药法制备脂质体药物 移取适量空白PEG化脂质体至透析袋,置1 000倍体积的生理盐水中透析10 h,置换PEG脂质体外相液,并以1.0 mol·L-1NaOH溶液调节外相pH值至7.4附近。精密移取4.5 mL空白PEG脂质体和0.5 mL DHAD溶液(10.0 g·L-1)至试管中混匀,60℃恒温水浴孵育30 min,即得载药PEG化脂质体DHAD-PEG-L。
1.4.2 载药脂质体的理化表征 粒径和Zeta电位:以适量生理盐水对DHAD-PEG-L进行稀释后,使用粒度电位分析仪进行测定,计算平均粒径、电位和粒径分布。包封率:使用Sephadex G-25葡聚糖凝胶柱洗脱脂质体溶液,流动相为生理盐水,洗脱速度1.0 mL·min-1;收集脂质体峰,以Triton-100溶解破坏脂质体膜后使用HPLC以标准曲线法测定包封药物的含量,参照以下公式计算包封率[9]。

1.4.3 细胞复苏及培养 A549细胞以37℃温水融化复苏,以1 000~2 000 r·min-1转速离心3~5 min。小心吸去上清液,加入1.0 mL预热的细胞培养液,将细胞吹散后转移至培养瓶。补充 RPMI 1640培养基4.0 mL,并添加10%的小牛血清。置于培养箱中37℃常规培养(CO2浓度5%)。A549细胞消化传代频率为1次/周,换液间隔为3 d。
1.4.4 细胞增殖抑制试验 取对数生长期的A549细胞,用RPMI 1640培养基配制单细胞悬液(每毫升细胞个数1.0×105个),以每孔100.0μL接种于96孔板,37℃常规培养(CO2浓度5%)4 h。实验设3组:分别将DHAD-PEG-L、DHAD溶液和空白脂质体稀释成 250、25、2.5、0.25、0.025、0.002 5 mg·L-1共6个梯度浓度作为制剂测试组。其中,空白脂质体的稀释方法以4.5 mL空白PEG脂质体加入0.5 mL生理盐水溶液的混合物为原液,参照含药组进行同倍数稀释。DHAD-PEG-L每孔加药量为100.0μL,另设置空白对照组(加入生理盐水与肿瘤细胞)和校零组(单纯培养基)。继续培养48 h后,每孔加入5.0 g·L-1的MTT溶液20.0μL,震荡混匀后继续培养4 h后以2 000 r·min-1转速离心10 min,弃上清液,每孔加入 DMSO 150.0μL,震荡溶解结晶后以读板机进行光吸收扫描,设定波长490 nm,记录数据并分析。
1.5 统计学方法 半数抑制浓度IC50值的计算:每组吸光度A490nm均值依以下公式求算细胞抑制率,并使用SPSS 17.0统计软件计算IC50值。

DHAD-PEG-L、DHAD溶液和空白PEG脂质体在不同浓度下对A549细胞抑制作用的结果,使用SPSS17.0软件进行数据处理。以单因素方差分析法对肿瘤细胞抑制作用进行组间比较,以P<0.05认为差异有统计学意义。
2 结果
2.1 脂质体的理化性质 经粒度电位分析仪检测,本实验制备获得的DHAD-PEG-L平均粒径为(103.6±2.8)nm,平均Zeta电位为(-12.2±1.0)mV,粒径分布 D10平均值为(38.2±1.1)nm,D50平均值为(79.6±2.5)nm,D90平均值为(160.7±3.1)nm。各批次DHAD-PEG-L的粒径、粒径分布和Zeta电位检测结果如表1所示。
上述DHAD-PEG-L经柱层析、表面活性剂破膜处理后通过HPLC进行定量分析,计算获得3批次DHAD-PEG-L的包封率分别为(95.2±2.4)%、(94.3±1.6)%和(95.8±1.8)%,平均包封率为(95.1±1.9)%。
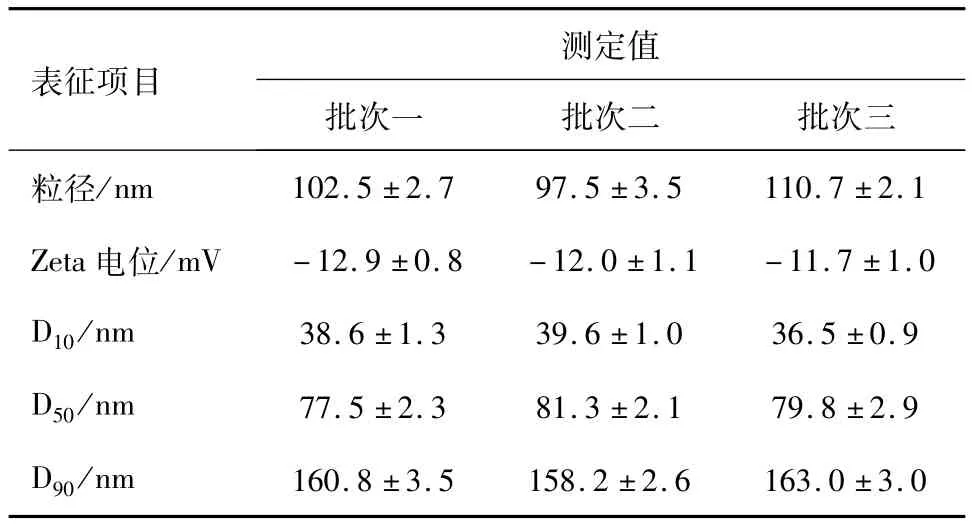
表1 DHAD-PEG-L的粒径参数及Zeta电位/x±s
2.2 IC50值 DHAD-PEG-L、DHAD溶液对 A549细胞作用48 h后的IC50值分别为(1.561±0.09)、(0.862±0.02)。
2.3 肿瘤细胞抑制作用的差异性 经方差分析,各组的制剂类型因素和浓度因素有交互效应(F=13 770.736、P<0.001),说明不同制剂对 A549细胞的抑制作用随浓度变化而变化。三组制剂在不同浓度时细胞抑制率的组间比较采用单因素方差分析法,结果显示DHAD-PEG-L组、DHAD溶液组各浓度的细胞抑制率差异有统计学意义,表明两种含药制剂均能抑制 A549细胞增殖(FPEG=26 754.289、PPEG<0.001;FDHAD=16 753.559、PDHAD<0.001);空白脂质体组各浓度间差异无统计学意义(F空白脂质体=0.929、P空白脂质体=0.496),推断空白脂质体对A549细胞增殖没有抑制作用。在相同浓度条件下,不同制剂组细胞抑制率的组间比较采用单因素方法分析后进行两两比较,结果均差异有统计学意义。其中,当药物浓度范围在0.002 5~0.25 mg·L-1时,DHAD-PEG-L的细胞抑制作用显著强于DHAD溶液;当浓度在2.5~250 mg·L-1时,DHAD-PEG-L的细胞抑制作用显著弱于DHAD溶液。见表2。
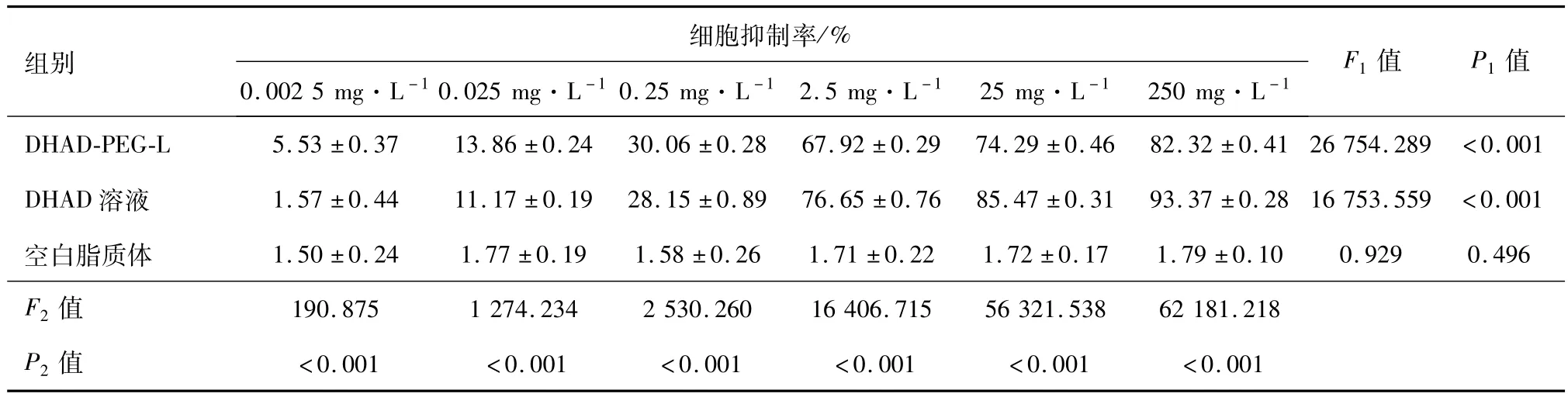
表2 不同浓度的DHAD-PEG-L、DHAD溶液和空白脂质体对A549细胞的抑制作用/x±s

图1 两种制剂对A549细胞增殖抑制作用的显微成像图(浓度0.25 mg·L-1)
通过显微成像图可以直观看出,当药物浓度为0.25 mg·L-1时,经 DHAD-PEG-L作用的 A549细胞凋亡明显,PEG修饰脂质体的优势开始展现。见图1。
3 讨论
鉴于临床上以DHAD治疗人非小细胞肺癌应用较为常见,本研究选择A549细胞和MTT法开展细胞抑制实验研究,方法简捷、可靠性高。值得注意的是,MTT法的常用扫描波段540~595 nm会与DHAD吸收波长范围(500~700 nm)发生干扰,因此本研究选择490 nm波长作为折中[10-11],实验取得良好效果。
本研究表明,与高浓度药物组(≥2.5 mg·L-1)相比较时,PEG脂质体药物并未体现药效学优势,癌细胞的抑制作用反比常规制剂低,这可能与PEG脂质体表面的毛线团状分子屏障有关,降低了肿瘤细胞与药物的直接接触和摄取。当药物浓度下降接近至常规用药血药浓度(≤0.25 mg·L-1)时,其细胞抑制作用开始优于常规制剂,其机制可能与脂质体包封高浓度药物,使药物局部浓度远高于普通溶液状态有关[12],当载药PEG脂质体被细胞摄取或附着于表面进行局部释放时,可在肿瘤细胞局部形成高浓度作用区域,增强细胞抑制作用。这对于降低药物的全身血药浓度、实现靶向给药从而减少或减轻患者的不良反应有着重要意义。
脂质体制剂经PEG修饰后可获得更长的血循环时间达到病灶[13]。本研究在理论上证实了注射相同剂量的PEG脂质体药物,相较于常规制剂,预期可使肿瘤部位获得更高的药物浓度,更好的抑制肿瘤生长,使患者耐受量增加,药物毒副作用下降,减少不良反应。然而,低浓度药物组的PEG脂质体对A549细胞总体抑制率不足10%,这表明在今后的研究中,应当加大载药工艺和包封工艺的研究,并对细胞摄取机制进一步探索,优化脂质体膜材料的成分组成和结构,增强药物在肿瘤细胞局部的毒性杀伤作用,从总体上优化肿瘤的治疗效果。
[1] 王志群,陈石,吕燕妮,等.米托蒽醌与B-DNA相互作用的分子模拟[J].化学学报,2010,68(6):551-556.
[2] 林庆志,邓伟国.米托蒽醌联合阿糖胞苷或长春新碱疗法对急性白血病的临床疗效[J].福建医药杂志,2015,37(1):92-94.
[3] 艾一玖,王伟,葛星瑶,等.中低剂量米托蒽醌治疗急性白血病的临床观察[J].吉林医药学院学报,2016,37(3):206-207.
[4] 张晓丽,刘延方,谢新生,等.米托蒽醌、托泊替康联合阿糖胞苷治疗成人难治复发急性白血病的临床疗效观察[J].中国现代医学杂志,2015,25(22):101-104.
[5] 马军.蒽环类药物心脏毒性的防治[J].中国处方药,2013,11(5):34-35.
[6] 王冠杰,赵娅娟,董济民.脂质体和厚朴酚联合热疗对腺样囊性癌增殖的协同抑制作用[J].安徽医药,2016,20(7):1237-1240.
[7] 张迪,徐缓,胡美娜,等.脂质体面临的聚乙二醇“窘境”及其解决方法[J].药学学报,2015,50(3):252-260.
[8] 吴琼.聚乙二醇修饰的多西他赛长循环脂质体的研究[D].广州:广州中医药大学,2013.
[9] 凌云,戎隆富,孙彦华,等.盐酸米托蒽醌聚乙二醇化脂质体的制备及包封率考察[J].现代生物医学进展,2012,12(34):6637-6642.
[10]ZHONG M,MA X,SUN C,et al.MicroRNAs reduce tumor growth and contribute to enhance cytotoxicity induced by gefitinib in nonsmall cell lung cancer[J].Chem Biol Interact,2010,184(3):431-438.
[11]RHO JK,CHOI YJ,LEE JK,et al.Epithelial to mesenchymal transition derived from repeated exposure to gefitinib determines the sensitivity to EGFR inhibitors in A549,a non-small cell lung cancer cell line[J].Lung Cancer,2009,63(2):219-226.
[12]谢雨礼,苏红.抗肿瘤药物多柔比星脂质体[J].药学与临床研究,2010,18(2):107-111.
[13]王立英,刘雨萌,吴丽艳,等.藤黄酸长循环脂质体制备及药动学研究[J].中草药,2016,47(8):1309-1314.
