盐酸表柔比星质量标准的比较与探讨
2018-02-06汤慧吴玉祥张萍阚家义
汤慧,吴玉祥,张萍,阚家义
(1.芜湖市食品药品检验中心生测室,安徽芜湖 241000;2.安徽省食品药品检验研究院抗生素室,安徽合肥 230051)
表柔比星由意大利Farmitalia Carlo Erba公司开发,是多柔比星(阿霉素)的换代产品,1984年12月首次在意大利上市,1998年在中国上市。在美国1999年获得批准,2000年上市[1]。注射用盐酸表柔比星为盐酸表柔比星加适宜赋形剂或(和)抑菌剂制成的无菌冻干品,其主要成分盐酸表柔比星的结构如图1。
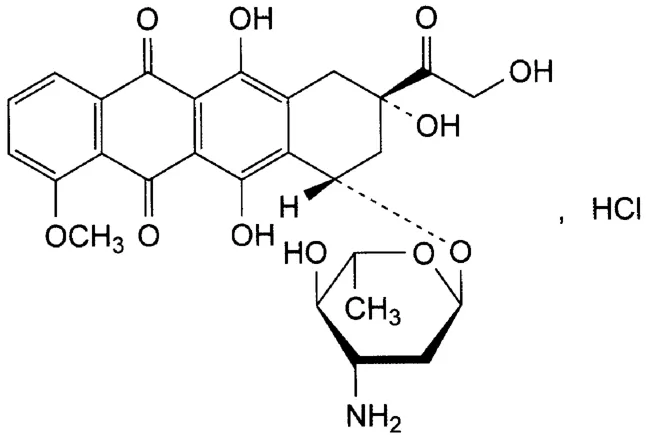
图1 盐酸表柔比星的结构
表柔比星主要用于恶性淋巴瘤、乳腺癌、肺癌等癌症的治疗,有研究表明表柔比星对抑制膀胱癌的复发也有一定作用[2]。其不良反应与多柔比星相似,但程度较低,尤其是心脏毒性和骨髓抑制毒性。目前,国内获批的企业除辉瑞制药外,还有浙江海正药业股份有限公司、山东新时代药业有限公司和北京协和药厂,共4家生产企业,6个批准文号。
经查询,《欧洲药典》(EP)、《英国药典》(BP)、《美国药典》(USP)、《日本药局方》(JP)和《中国药典》2015版5部药典均收载了盐酸表柔比星的质量标准,BP还收载了表柔比星注射液的质量标准,而注射用盐酸表柔比星国内现行质量标准也有4种。本文通过对各质量标准中检验项目的比对,并结合实际检验工作对其可行性进行评价,为进一步完善该品种的检验标准提供参考。
1 现行5部国内外药典中盐酸表柔比星标准的比对
最新版 EP[3]、BP[4]、USP40-NF35[5]、JP[6]和《中国药典》2015版二部[7]均收载了盐酸表柔比星的质量标准,现将各质量标准的检验项目比对见表1。
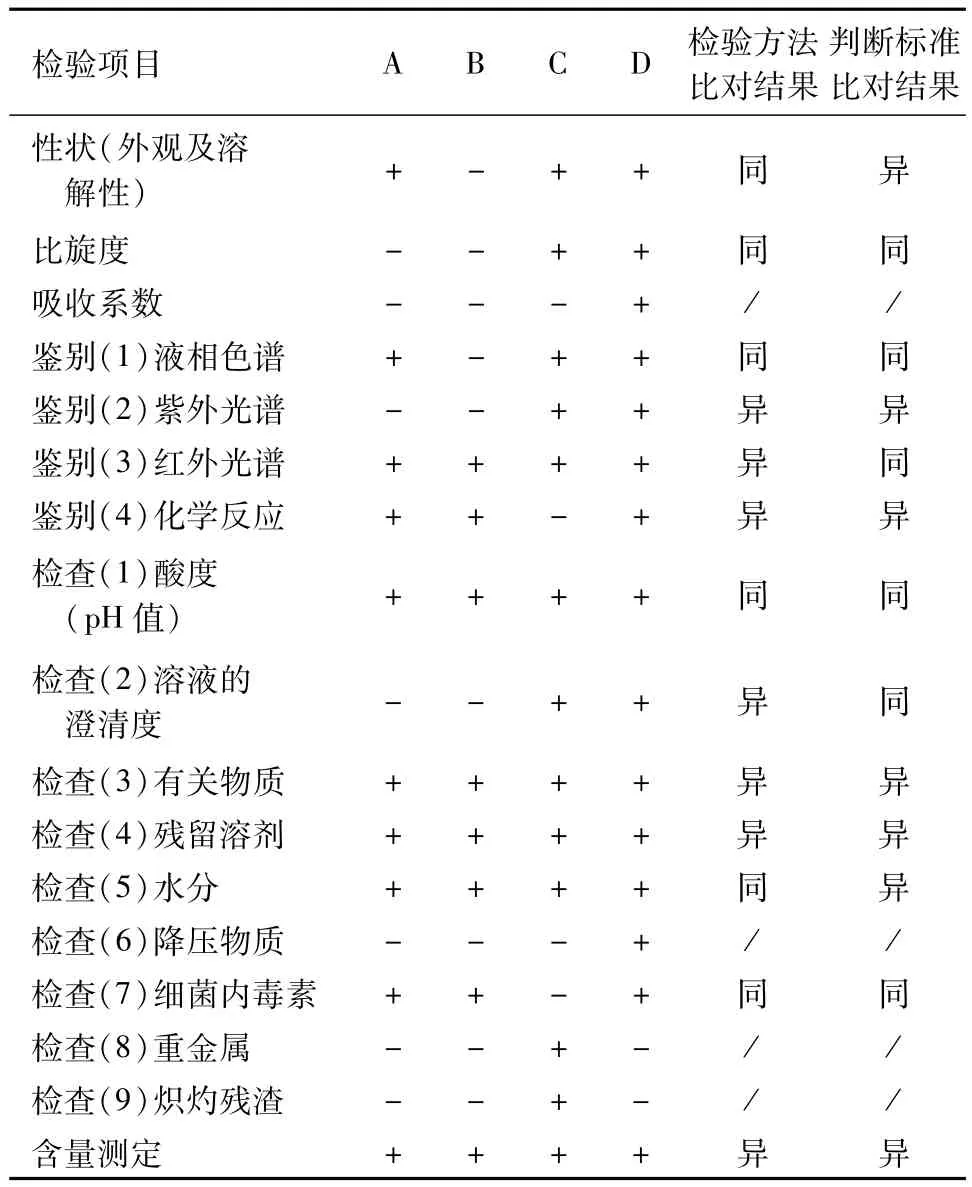
表1 5部药典中盐酸表柔比星质量标准检验项目的比对
从表1中可以看出,虽然5部药典所收载的盐酸表柔比星质量标准对检验项目设置存在差异,但主要检验项目大体相同,均包括红外光谱鉴别、酸度(pH)、水分、有关物质、残留溶剂和含量测定,而这些项目的检验方法和判断标准又存在一定的差异,如:红外光谱鉴别,USP40-NF35中要求样品磨细后分散在矿物油中,而其它标准是采用溴化钾压片法。水分含量JP为不超过8.0%,其它标准是不超过4.0%。JP控制丙酮、乙醇、正丙醇和甲醇4种残留溶剂,USP40-NF35、EP和BP只控制丙酮的残留量(不超过1.5%),《中国药典》2015版二部则对乙醇、丙酮和二氯甲烷的残留量进行控制。含量测定只有JP采用的是内标法,其它标准采用外标法。在有关物质检查项下,5部药典在检验方法和判断标准上差异较大:JP采用的是内标法;USP40-NF35利用相对保留时间定位,控制的杂质除总杂质(不超过3.0%)和其它单个杂质外还包含了多柔比星酮、柔红霉素酮等7种,相关的限度见表2;EP和BP的检验方法及控制的杂质与USP40-NF35相同,但在判断标准有差异;而《中国药典》2015版二部采用的是自身对照法,对多柔比星酮、多柔比星、总杂质和其它单个杂质的量进行控制。
USP40-NF35中盐酸表柔比星的检验项目设置相对较少,但涉及质量安全的主要检验项目均有设置,尤其是有关物质检查项下控制杂质种类最多;JP设置检验项目多,但对药品生物安全方面的降压物质和细菌内毒素控制欠缺;《中国药典》2015年版二部检验项目最齐全,除重金属和炽灼残渣外,对其它可能影响药品质量的各项指标几乎都进行了控制,能全面地反映涉及药品安全的主要因素。
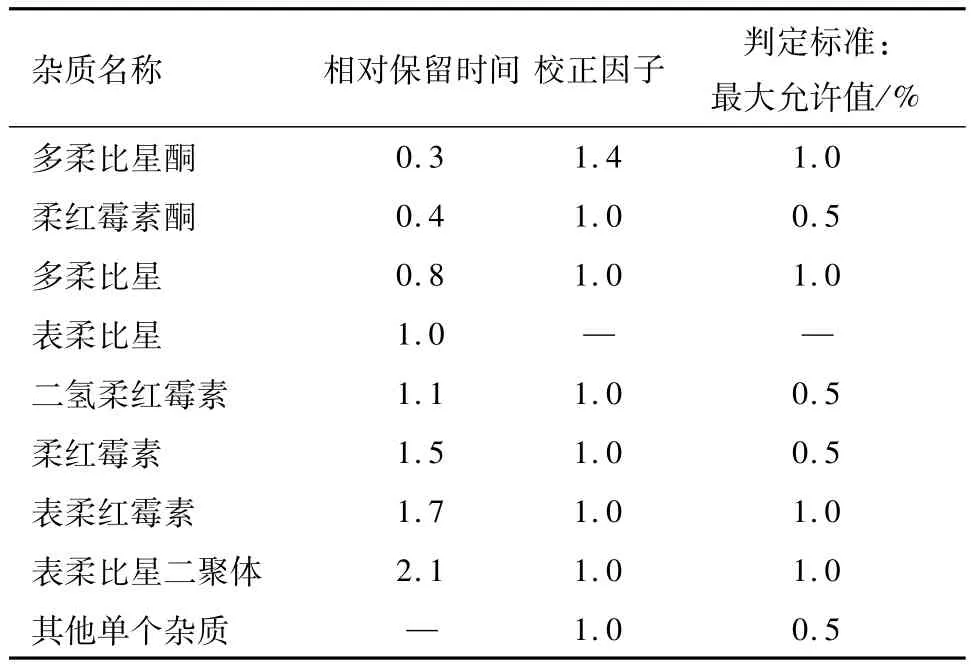
表2 USP40-NF35杂质检查
2 4种国内现行的注射用盐酸表柔比星质量标准的比对
注射用盐酸表柔比星国内现行质量标准为《中国药典》2015年版二部[7]、国家食品药品监督管理局标准YBH03762011[8]、国家食品药品监督管理局标准YBH02502011[8]和国家食品药品监督管理总局标准 YBH02252014[9],为方便表述和比较,依次编号为标准a、b、c、d。现将各质量标准设置的检验项目比对见表3。
从表3可知,标准c对性状的规定与标准a、b、d略有差异,为鲜红色或橙红色的疏松块状物;有引湿性。检查项下羟苯甲酯、溶解时限和降压物质这三个检验项目设置不一致,有关物质、含量测定在检验方法和判断标准上也有所差异。标准b中有关物质检查在检验方法和判断标准上与其它3个标准有很大差异,它不仅对药典标准中控制的多柔比星酮、盐酸多柔比星、单个最大杂质峰和总杂质峰有规定,还要求柔红霉酮、柔红霉醇、柔红霉素、表柔红霉素和表柔比星二聚物不得过相应的限度。含量测定项目下,标准a、b、c、d系统适用性实验有差异,且标准d含量测定的判断标准高于其它标准,按平均含量计算,含盐酸表柔比星(C27H29NO11·HCl)为标示量的92.0%~108.0%。
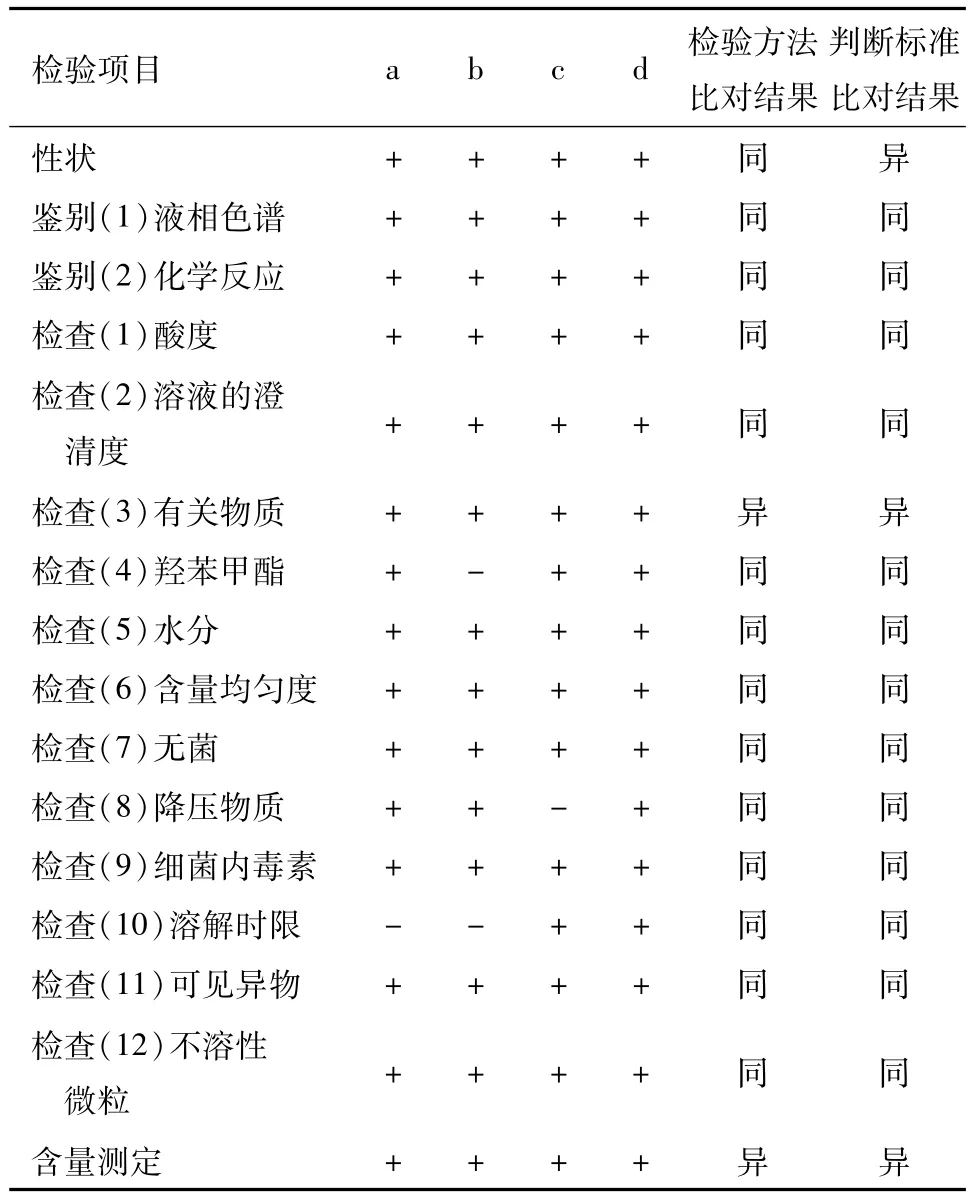
表3 注射用盐酸表柔比星国内不同质量标准中检验项目比对
3 结果与讨论
笔者于2014年和2016年承接了本所注射用盐酸表柔比星的检验任务,共3个批次,执行的质量标准分别为国家食品药品监督管理局标准YBH03762011、《中国药典》2015年版二部和国家食品药品监督管理总局标准YBH02252014。
在检验过程中发现,国家食品药品监督管理局标准YBH03762011有关物质检查项下,要求多柔比星酮、柔红霉酮、柔红霉醇、柔红霉素、表柔红霉素5种杂质对照品来制备杂质峰鉴别溶液,由于杂质对照品难以购买,在一定程度上增加了该项目的检验难度。建议参照USP40-NF35中盐酸表柔比星有关物质项下的方法,通过对盐酸表柔比星进行相应的处理获得杂质峰鉴别溶液,然后通过相对保留时间定位各杂质峰,这样不仅降低了检验难度也大大节约了检验成本,有利于基层药检所对该品种检验工作的顺利开展。同样,《中国药典》2015年版二部中含量测定项下的多柔比星酮对照品也可以考虑用相对保留时间来替代。
在含量测定方法上,上述3种质量标准存在差异,通过探索性研究发现,山东新时代药业有限公司和北京协和药厂的药品按照国家食品药品监督管理局标准YBH03762011检验,含量均符合规定,已有研究表明辉瑞制药(无锡)有限公司的药品按该标准检测,含量也符合规定[10],因此可以考虑将注射用盐酸表柔比星国内现行4个质量标准中含量测定方法进行统一。检查项下的降压物质和溶解时限2个检验项目对控制药品质量安全有很重要的作用,建议各标准都将其列入必检项目,从而保证药品用药安全,质量可控。
通过对5部药典中盐酸表柔比星质量标准的比对易知,EP、BP、USP和JP中该品种标准所设置的检验项目《中国药典》几乎都有相应设置,表明《中国药典》在不断完善的过程中逐渐与国外药典标准接轨,正努力朝国际化方向发展。注射用盐酸表柔比星国内现行的4个质量标准的检验项目基本相似,检验方法和判断标准也只有部分有差异,为了简化药检机构的检验工作,便于对该品种进行监测和质量分析,保证其在治疗过程中的安全有效,建议统一标准。
[1] 贾淼,裘鹏程,倪国伟,等.大孔树脂法纯化盐酸表柔比星[J].中国抗生素杂志,2016,41(4):271-276.
[2] 毕晓军,李健,范连慧,等.表柔比星对膀胱癌细胞中 miR-21表达的影响[J].安徽医药,2016,20(7):1268-1270.
[3] COUNCIL OF EUROPE.European Pharmacopoeia 9.0[S].Strasbourg:European Directorate for the Quality of Medicines&Health-Care Council of Europe,2016,2145.
[4] BRITISH PHARMACOPOEIA COMMISSION.British Pharmacopoeia 2017[S].British Pharmacopoeia Commission,2016.
[5] THE UNITED STATESPHARMACOPOEIAL CONVENTION US.Pharmacopoeia National Formulary USP 40-NF 35[S].US Pharmacopoeial Convention,2016:3423.
[6] THE JAPANESE PHARMACOPOEIA EXPERT COMMITTEES.The Japanese Pharmacopoeia Seventeenth Edition[S].The Japanese Ministry of Health,Labour and Welfare,2016:872-874.
[7] 国家药典委员会.中国药典(二部)[S].北京:中国医药科技出版社,2015.
[8] 国家食品药品监督管理局国家药品标准(修订)颁布件2[J].中国药品标准,2008,9(2):96-111.
[9] 国家食品药品监督管理总局.国家食品药品监督管理总局发布《2013年度食品药品监管统计年报》[J].上海医药,2015,36(1):29.
[10]张萍.2013~2015年注射用盐酸表柔比星的质量分析报告[J].海峡药学,2016,28(8):86-89.
