过量表达黄烷酮3-羟化酶基因(AaF3H)提高青蒿中青蒿素的含量
2018-02-01张婷婷马嘉伟王路尧唐克轩赵静雅
张婷婷, 马嘉伟, 王路尧, 唐克轩, 李 杉, 赵静雅*
1.上海交通大学农业与生物学院, 交大-复旦-诺丁汉植物生物技术研发中心, 上海 200240; 2.华南理工大学生物科学与工程学院, 广州 510006
青蒿素是从青蒿(ArtemisiaannuaL.)中分离到的一种含过氧基团的倍半萜内酯化合物[1],在治疗疟疾时,它不仅疗效好,而且毒性低,因此联合国卫生组织提出,将以青蒿素为基础的联合疗法(artemisinin combination therapies,ACTs)作为医治由疟原虫叮咬引起的疟疾的最佳方法[2]。研究发现青蒿素只在青蒿分泌型腺毛中合成,而分泌型腺毛多数存在于青蒿的叶、花蕾中[3]。目前,青蒿素主要来源于植物提取,但是其含量仅为植物青蒿叶片干重的0.1%~1.00%[4,5],导致青蒿素的价格昂贵,无法满足市场需求。青蒿素的生物合成途径现已基本阐明,利用过量表达青蒿素合成途径关键酶基因的方法提升青蒿素的含量,以及利用转录因子调控青蒿素的合成已成为近几年的研究热点。
在高等植物中,黄酮类物质作为最为重要的次生代谢产物,广泛地参与到植物的生长发育、呼吸作用以及光合作用等过程中[6,7]。在苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)和肉桂酸4-羟化酶(cinnamate 4-hydroxylase,C4H)等酶的作用下将苯丙氨酸(phenylalanine,Phe)转化为香豆酰辅酶A(coumaroyl-CoA)。紧接着在查耳酮合成酶(chalcone synthase,CHS)和查耳酮异构酶(chalcone isomerase,CHI) 等一系列酶的作用下生成二氢黄酮醇类化合物如二氢山柰素,而二氢山柰素则是合成黄烷酮和花色素过程中必不可少的(图1)[8,9]。AaPAL1是黄酮类化合物合成的关键酶基因,将其在青蒿中过量表达,得到的转基因青蒿中青蒿素的含量显著提升[10]。这说明,在青蒿中过量表达黄酮类化合物合成途径中的关键酶基因可以显著提高青蒿素的含量。黄烷酮3-羟化酶(F3H),位于整个黄酮类化合物代谢途径的核心位置,控制合成途径的代谢方向(图1)。它催化柚皮素生成二氢山柰酚(dihydro-kaempfero,DHK),DHK作为重要中间产物,进一步合成花色素和异黄酮等次生代谢产物[11~13]。目前,青蒿中的AaF3H基因全长已被克隆[14],但是该基因对于青蒿素的影响仍然未知。
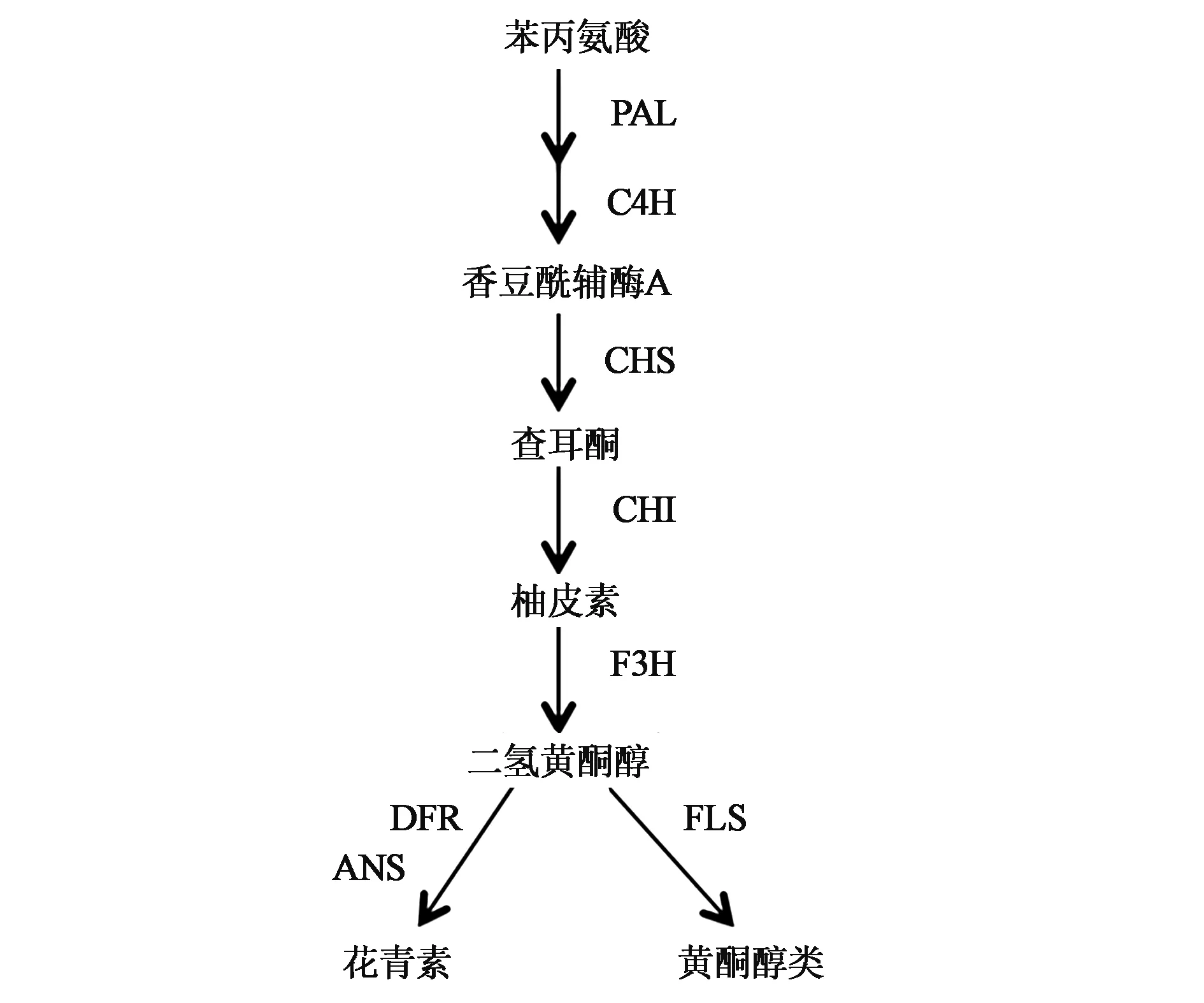
图1 类黄酮生物合成途径Fig.1 Flavonoid biosynthetic pathway.注:DFR:二氢黄酮醇-4-还原酶;ANS:花青素合成酶;FLS:黄酮醇合成酶。
本研究从青蒿中克隆了AaF3H,全长为1 095 bp,编码364个氨基酸。并进一步构建了AaF3H的过表达载体并稳定转化青蒿,通过HPLC测定野生型和转基因青蒿中的青蒿素含量,以期证明在青蒿中过量表达AaF3H可以显著地提高青蒿素的含量。
1 材料和方法
1.1 实验材料
1.1.1实验材料 本实验所用的青蒿种子储存于交大-复旦-诺丁汉植物生物技术研发中心。青蒿的生长条件为:16 h光照、8 h黑暗,于25℃~27℃人工气候室培养,适时浇灌,用于DNA和RNA提取。
1.1.2实验试剂 KOD-plus酶(日本东洋纺绩株式会社)、pJET1.2载体(美国Thermo 公司)、Taq酶(PremixTaq®Version 2.0,日本TaKaRa公司)、植物总RNA提取试剂盒(RNAprep pure Plant Kit,天根生化科技(北京)有限公司)、反转录试剂盒(PrimeScriptTMRT reagent kit,日本TaKaRa公司)、SYBR Ex Script RT-PCR kit定量试剂盒、Southern Blot试剂盒(美国GE 医疗集团)。
1.1.3实验仪器 NanoDropTM2000、Peltier Thermal Cycler PTC200定量PCR仪器(美国Bio-Rad公司)。
1.2 AaF3H的载体构建
根据AaF3H的全长序列,使用Primer 5.0设计一对引物(AaF3H-F、AaF3H-R,序列见表1),以青蒿cDNA为模板进行PCR,反应体系为:cDNA 2 μL,AaF3H-F 1 μL,AaF3H-R 1 μL,Mg2+2 μL,dNTP mix 5 μL,10×KOD-Plus buffer 5 μL,KOD-Plus 1 μL,补充ddH2O至50 μL。PCR反应程序(使用KOD-Plus酶)为:94℃ 5 min;94℃ 30 s,55℃ 30 s,68℃ 1 min,共35个循环;68℃ 10 min。将最终产物连接到pJET1.2载体中并测序。再以测序正确的pJET-AaF3H质粒为模板,设计第二对引物(AaF3H-PHB-F、AaF3H-PHB-R,序列见表1)进行PCR扩增,在引物的上游添加酶切位点BamHⅠ,在引物的下游添加酶切位点XbaⅠ,反应体系(将引物更换为AaF3H-PHB-F、AaF3H-PHB-R)和程序与扩增AaF3H相同(使用KOD-Plus酶)。使用BamHⅠ和XbaⅠ双酶切最终产物以及带有黄色荧光蛋白(yellow fluorescent protein,YFP)的空表达载体pHB-YFP,回收后,使用T4 DNA连接酶连接并且转化大肠杆菌感受态细胞,获得重组质粒pHB-AaF3H-YFP,并转化农杆菌EHA105。
1.3 青蒿的转化
先用75%的乙醇浸泡青蒿种子1 min,然后在10%的次氯酸钠中浸泡10 min,不断晃动直至种子充分接触液体,再用无菌水反复冲洗数次。将处理过的种子平铺于不带抗性的MS固体培养基[15]上,放置于人工气候室培养,待幼苗长到4~5 cm后,剪下无菌苗叶片在25℃下与带有AaF3H基因的农杆菌EHA105共培养2 d[16]。然后,将处理后得到的青蒿外植体置于发芽筛选培养基上,并在25℃、16 h光照/8 h黑暗的条件下培养2周,经过2~3次继代后,便可获得带潮霉素抗性的丛生芽。挑选长势较好、带潮霉素抗性的丛生芽剪下,转入生根培养基,待其生根便可获得具有潮霉素抗性的再生青蒿植株,上述培养基参考Zhang等[17]的配方。根部形成后(约12~15 d),将生根植株转移到生长室内的土壤盆中,适时浇水。经过2~3个月的生长,将它们移植到温室进一步培育。
1.4 阳性转基因青蒿验证
用CTAB法[18]提取转基因青蒿叶片的DNA,根据AaF3H的编码区序列及载体上的YFP序列分别在AaF3H编码区和YFP区域设计上下游引物(AaF3H-F和pHB-YFP-R,序列见表1)。使用Taq酶进行PCR扩增。反应体系为:2×PremixTaq10 μL,AaF3H-F 1 μL,pHB-YFP-R 1 μL,DNA模板1 μL,ddH2O 7 μL。PCR反应程序为:94℃ 10 min;94℃ 30 s,55℃ 30 s,72℃ 1 min,共35个循环; 72℃ 10 min。随后,进行琼脂糖凝胶电泳检测。
1.5 实时荧光定量PCR
选取生长5个月左右的野生型青蒿植株,分别提取根、茎、幼叶、老叶、幼芽、花蕾和花的RNA,反转录为cDNA。其中,幼叶是第1~2片叶 (从顶端分生组织开始计数),老叶是第10~16片叶。根据植物总RNA提取试剂盒的操作步骤提取总RNA。分别使用1%的琼脂糖凝胶电泳和NanoDropTM2000检测所提RNA的完整性、纯度和浓度。根据反转录试剂盒的操作说明将提取的RNA反转录成cDNA。将cDNA用无菌水稀释50倍后作模板,在冰上配制实时定量PCR反应体系(体系由试剂盒提供)。使用Primer 5.0设计引物(Aa-Actin-F、Aa-Actin-R、AaF3H-Rt-F、AaF3H-Rt-R,序列见表1),根据Zhang等[17]的方法,进行实时荧光定量PCR分析,使用肌动蛋白AaActin作为参照基因。
实时荧光定量PCR程序如下: 95℃ 10 min;95℃ 20 s,55℃ 20 s,72℃ 20 s,共40个循环; 72℃ 10 min。反应结束即可获得相应的扩增曲线和溶解曲线,以此为依据绘制标准曲线。本研究采用Ct比较法,并运用2-ΔΔCt法处理数据[19],实验重复3次。
提取生长20周左右的野生型和转基因青蒿的第1片叶(从顶端分生组织计数)的RNA,并将RNA反转录合成cDNA。使用Primer 5.0设计引物(Aa-Actin-F、Aa-Actin-R、AaF3H-Rt-F、AaF3H-Rt-R、AaADS-F、AaADS-R、AaCYP71AV1-F、AaCYP71AV1-R、AaDBR2-F、AaDBR2-R,序列见表1)进行实时荧光定量PCR分析,实验重复3次,方法同上。
1.6 Southern Blot分析
使用CTAB法大量提取野生型青蒿叶片的DNA以验证AaF3H在青蒿基因组中的拷贝数。将DNA(60 μg/样品)在37℃下分别用EcoRⅠ、BamHⅠ和KpnⅠ酶切过夜,经1%琼脂糖凝胶电泳分离,然后将产物转移到尼龙膜上。设计一对引物(AaF3H-Southern-F1、AaF3H-Southern-R1,序列见表1)进行PCR扩增,反应体系为:cDNA 2 μL,AaF3H-Southern-F1 1 μL,AaF3H-Southern-R1 1 μL,Mg2+2 μL,dNTP mix 5 μL,10×KOD-Plus buffer 5 μL,KOD-Plus 1 μL,补充ddH2O至50 μL。PCR反应(使用KOD-Plus酶)程序为:94℃ 5 min;94℃ 30 s,55℃ 30 s,68℃ 1 min,共35个循环;68℃ 10 min。将其产物标记为杂交探针,并按照试剂盒说明书进行后续操作。

表1 实验所用引物序列Table 1 Primers used in the experiment.
注:下划线表示BamHⅠ和XbaⅠ的酶切位点。
为了分析转基因植物,用CTAB法大量提取新鲜野生型和转基因青蒿叶片的DNA,设计一对引物(AaF3H-Southern-F2、AaF3H-Southern-R2,序列见表1)进行PCR扩增,PCR反应体系(将引物更换为AaF3H-Southern-F2、AaF3H-Southern-R2)和程序与验证拷贝数的PCR相同。将DNA(60 μg/样品)用EcoRⅠ在37℃下酶切过夜后,按照试剂盒说明书进行后续操作。
1.7 HPLC测定青蒿素含量
使用在温室培育20周的植物,选取适量的组合式叶子样品(从顶端分生组织计数,1个分支上的幼叶、老叶平均分布)在45℃烘箱烘48 h,磨成粉末后通过HPLC测定青蒿素。具体操作如下:准确称取0.1 g 青蒿干叶粉末,置于2 mL的离心管中,加入1 mL甲醇,将溶液轻轻混合并用超声波处理器处理,处理条件为:55 Hz 30 min,12 000 r/min离心10 min,取上清液于新离心管中,再在沉淀中加入1 mL甲醇,重复上述步骤。通过0.22 μm滤膜过滤溶液后,将200 μL样品导入HPLC,HPLC仪器的使用条件参照Zhang等[20]的方法,样品重复3次。青蒿素出峰时间为4.5 min左右,进样体积为20 μL,结果使用Empower(Waters’ chromatography data software)软件进行分析。
2 结果与分析
2.1 AaF3H的克隆
使用Primer 5.0设计基因特异引物,从青蒿cDNA中扩增出AaF3H基因片段,全长为1 095 bp,编码364个氨基酸。经Southern Blot分析,结果表明AaF3H在青蒿基因组中只有1个拷贝(图2)。
使用Vector NTI®Advance 11.5进行AaF3H与其他植物物种F3H的氨基酸序列的比对,结果表明,AaF3H和多个其他物种F3H的氨基酸序列的相似性超过50%。相似度分别为银杏(Ginkgobiloba,AAU93347.1)60.5%,拟南芥(Arabidopsisthaliana,AEE78766.1)75.6%,番茄(Solanumlycopersicum,AEK99074.1)74.2%,棉花(Gossypiumhirsutum,ABM64799.1)74.9%,葡萄(Vitisvinifera,CAA53579.1)73.5%,苹果(Malusdomestica,BAB92997.1)73.9%,西洋梨(Pyruscommunis,AGL81347.1)73.9%。其中,青蒿AaF3H与拟南芥F3H相似度最高。
利用Mega 5软件,将青蒿AaF3H与其他物种F3H进行进化树分析。如图3所示,青蒿AaF3H在系统进化中与拟南芥AtF3H的亲缘关系比较近,处于相同的进化分支。在拟南芥中,AtF3H可以影响花青素、黄酮醇等次生代谢产物的合成[21]。

图2 青蒿AaF3H Southern blot分析Fig.2 Southern blot analysis of AaF3H in A. annua.注:M:DNA marker; 1,2,3分别代表野生型青蒿叶片DNA经EcoRⅠ、BamHⅠ和KpnⅠ酶切过夜的产物。

图3 AaF3H与其他物种F3Hs氨基酸序列的系统进化树分析Fig.3 Phylogenetic tree of the amino acid sequences of AaF3H and other F3Hs.注:CsF3H:茶树(AAT68774.1);GmF3H:大豆(ACA81459.1);GhF3H:棉花(ABM64799.1);VvF3H:葡萄(CAA53579.1):SlF3H:番茄(AEK99074.1);CaF3H:喜树(ARO92271.1);拟南芥:AtF3H(AEE78766.1);PhF3H:矮牵牛(SCV44659.1);AaF3H:青蒿;ZmF3H:玉米(NP_001130275.1);MdF3H:苹果(BAB92997.1);PcF3H:西洋梨(AGL81347.1);MsF3H:绿绒蒿(AGT50302.1);HvF3H:大麦(ACH42080.1)。
2.2 AaF3H在青蒿不同组织中的表达分析
按1.5中的实验方法,选择培养合适的青蒿植株,取根、茎、幼叶、老叶、花和花蕾组织,提取获得各组织的总RNA并反转录为cDNA。使用实时荧光定量PCR分析AaF3H基因在根、茎、幼叶、老叶、花蕾和花中的相对表达量。采用2-ΔΔCt法处理数据,结果表明AaF3H在青蒿所有的组织中都有表达,且在青蒿花中的表达量最高,其次是花蕾、老叶和幼叶,而在根中表达量最低(图4)。
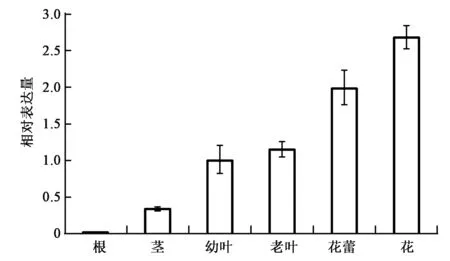
图4 AaF3H在青蒿不同组织中的表达模式Fig.4 The expression pattern of AaF3H in different organizations of A. annua.
2.3 过量表达AaF3H的转基因青蒿的鉴定
用带有AaF3H基因的农杆菌EHA105侵染青蒿的叶片,然后通过潮霉素筛选获得再生植株。 在2~3个月的生长后,取转基因青蒿叶片,提取DNA,通过PCR检测转基因植物,共获得39个独立的转基因株系(图5)。
2.4 转基因青蒿中AaF3H的表达检测
为了验证过量表达AaF3H的转基因青蒿中AaF3H转录水平的表达量,用野生型和转基因青蒿叶片的总RNA进行实时荧光定量PCR分析。结果表明,与野生型相比,AaF3H基因在转基因植株中的表达量增加了6.23~11.9倍,从中选择4株表达量较高的转基因青蒿(pHB-AaF3H-5、pHB-AaF3H-13、pHB-AaF3H-24、pHB-AaF3H-33)用于后续分析(图6A)。用CTAB法提取野生型植株和4个转基因青蒿植株的DNA进行Southern Blot分析。结果表明,AaF3H表达质粒已经整合到4个转基因植株的基因组中(图6B)。
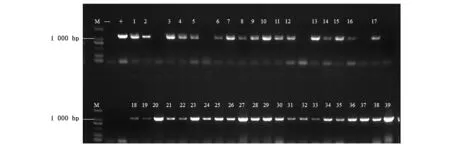
图5 pHB-AaF3H转基因青蒿的PCR鉴定结果Fig.5 PCR detection results of pHB-AaF3H transgenic A. annua plants.注:M:Marker; +:阳性对照(质粒); -:阴性对照(野生型),1~39:转基因青蒿。

图6 青蒿植株中AaF3H的实时荧光定量PCR结果(A)和Southern blot分析(B)Fig.6 Real-time fluorescent quantitative PCR results of AaF3H (A) and Southern Blot analysis (B) of transgenic A. annua plants.注:M: Marker; CK:野生型植株; 5,13,24,33:分别表示转基因青蒿株系5,13,24,33。*表示与野生型相比差异显著(P<0.05)。
2.5 过量表达AaF3H对关键酶基因表达的影响
在青蒿素合成途径中,异戊烯焦磷酸(isopentenyl pyrophosphate,IPP)和二甲基丙烯基焦磷酸(dimethylallyl pyrophosphate,DMAPP)分别由胞质中的甲瓦龙酸(mevalonicacid,MVA)途径和质体中的非甲羟戊酸(2-C-甲基-D-赤藓醇-4-磷酸,2-C-methyl-D-eythritol-4-phosphate,MEP)途径生成,是青蒿素合成的重要中间产物,它们进一步合成法尼基焦磷酸(farnesyl pyrophosphate,FPP)。FPP经过紫穗槐-4,11-二烯合成酶(ADS)、紫穗槐-4,11-二烯氧化酶(CYP71AV1)、乙醛脱氢酶(aldehyde dehydrogenase,ALDH1)、青蒿醛Δ11(13)双键还原酶(DBR2)的催化而转化成青蒿酸和二氢青蒿酸,最后生成青蒿素B和青蒿素。其中,AaADS、CYP71AV1、AaDBR2存在于青蒿素特有的生物合成途径中,其表达量与青蒿素含量紧密相关[22]。
为了研究AaF3H过量表达是否影响了青蒿素的生物合成,采用实时荧光定量PCR方法检测转基因青蒿中青蒿素生物合成关键酶基因的表达。从图7中可以看出,转基因植株中AaADS、AaCYP71AV1、AaDBR2的相对表达水平最高分别为野生型的2.34倍、2.7倍、2.01倍。结果表明,过量表达AaF3H提高了青蒿素合成途径中关键酶基因的表达。
2.6 过量表达AaF3H对青蒿素含量的影响
为了进一步验证过量表达AaF3H对青蒿素的影响,选取在温室培育20周左右的野生型和转基因青蒿的叶片进行青蒿素含量的测定。HPLC分析结果显示,转基因青蒿植株中青蒿素的含量与野生型相比有显著提高。其中,转基因青蒿植株中青蒿素含量最高的是野生型的1.95倍(图8)。这表明,在青蒿中过量表达AaF3H基因可以显著提高植株中的青蒿素含量。

图7 转基因青蒿植株中关键酶基因的实时荧光定量PCR结果Fig.7 Real-time fluorescent quantitative PCR results of key enzymes genes in transgentic A. annua plants.注:A:AaADS在转基因青蒿株系中的表达谱;B:AaCYP71AV1在转基因青蒿株系中的表达谱;C:AaDBR2在转基因青蒿株系中的表达谱。CK为野生型植株。*表示实验组数据与CK相比差异显著(P<0.05)。
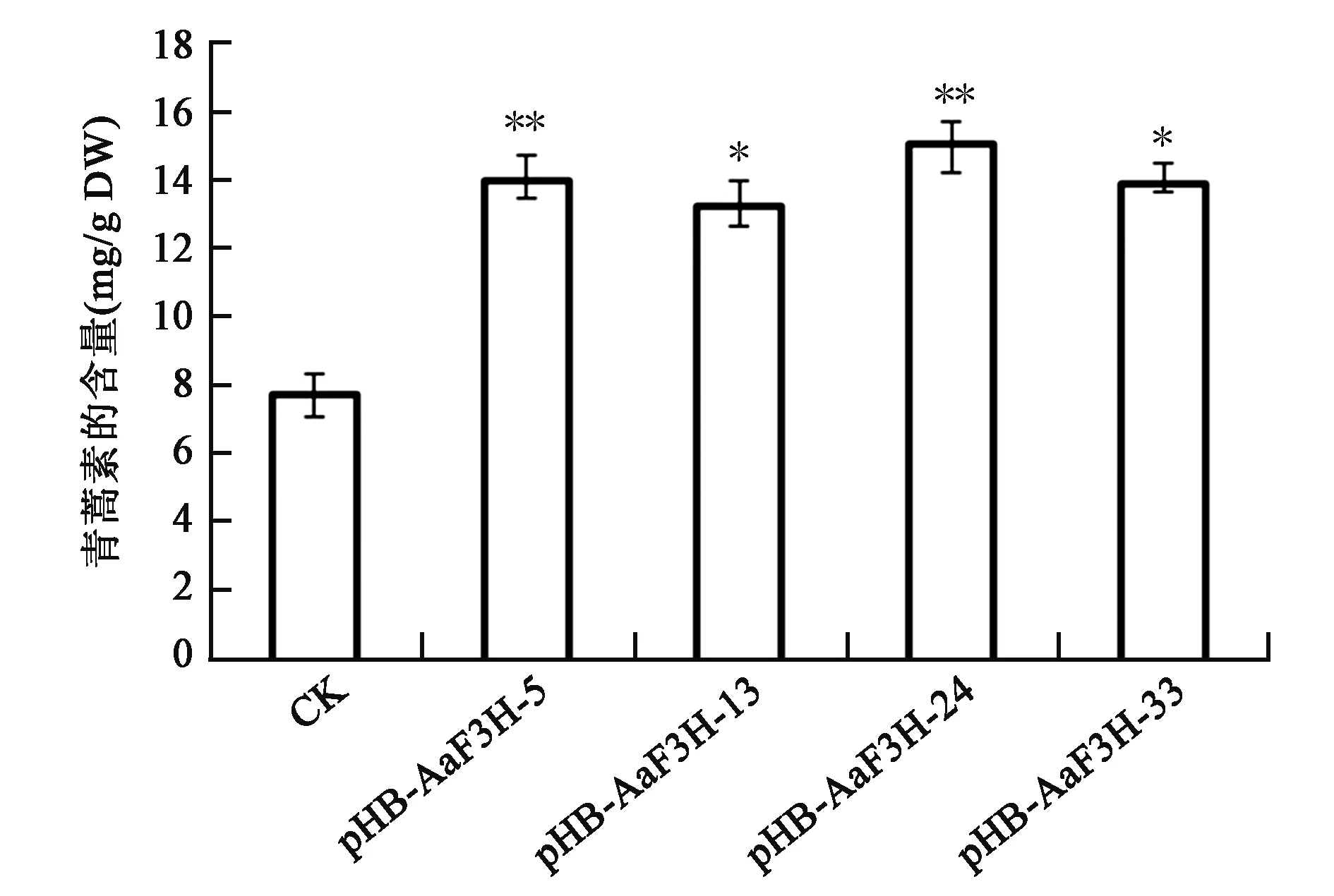
图8 转基因植株中青蒿素的含量Fig.8 The artemisinin content in regenerated A. annua plants.注:CK为野生型植物(非转基因植物),其他为转基因植株。*和**表示实验组数据与CK相比差异达到显著(P<0.05)和极显著水平(P<0.01)。
3 讨论
青蒿素药用价值高,但青蒿作为青蒿素的主要来源,因其青蒿素含量低导致青蒿素价格昂贵,而无法满足市场需求。近年来,对于青蒿素合成的研究正逐步深入,利用转基因技术来提高青蒿中青蒿素的含量已经成为研究热点。
研究表明,一些萜类化合物、苯丙烷和黄酮类化合物等次生代谢产物储存在植物的腺毛中,保护植物免受昆虫捕食和其他生物胁迫[23,24]。类黄酮生物合成途径已基本被揭示,在各种植物中,已经克隆了类黄酮生物合成的相关基因,如肉桂酸羟化酶基因(C4H)、黄烷酮3-羟化酶基因(F3H)、查耳酮异构酶基因(CHI)、苯丙氨酸氨裂解酶基因(PAL)和查耳酮合成酶基因(CHS)等。但只有少数基因在植物体内的催化活性被鉴定并验证[11]。研究表明,在番茄中,CHI可以影响萜类和黄酮类化合物在番茄叶片中的积累[13]。在青蒿中,抑制AaC4H的表达,转基因青蒿中反式肉桂酸(trans-cinnamic acid,t-Ca)和水杨酸(salicylic acid,SA)含量升高,从而促进青蒿素的合成[25]。Xiong等[14]克隆了青蒿苯丙烷途径中的1个关键酶基因AaF3H,该基因在花青素含量高的青蒿植株中比在花青素含量低的植株中表达量高。
本研究克隆的AaF3H,经Southern Blot分析显示,其在青蒿基因组中是单拷贝基因。通过构建AaF3H的过表达载体并稳定转化青蒿,获得转基因青蒿植株。实时荧光定量PCR的结果显示,在转基因青蒿中,AaF3H的表达量相比野生型显著提高,同时,青蒿素合成途径中的关键酶基因AaADS、AaCYP71AV1、AaDBR2的表达量在转基因青蒿中都有所提高。转基因青蒿植物中青蒿素含量最高的是野生型青蒿中青蒿素含量的1.95倍。从而,可以推测AaF3H在青蒿素的合成中有重要作用,尽管具体的调控机制仍然未知,但是本研究结果对于降低青蒿素生产的成本有重大的实践意义。此外,本研究也为探究苯丙烷途径与青蒿素合成途径之间的关系提供了分子基础。
[1] Yin H, Kjaer A, Fretté X C.etal.. Chitosan oligosaccharide and salicylic acid up-regulate gene expression differently in relation to the biosynthesis of artemisinin inArtemisiaannuaL. [J]. Proc. Biochem., 2012, 47(11): 1559-1562.
[2] Ferreira J F S, Janick J. Floral morphology ofArtemisiaannuawith special reference to trichomes [J]. Int. J. Plant Sci., 1995, 156(6): 807-815.
[3] Olsson M E, Olofsson L M, Lindahl A L,etal.. Localization of enzymes of artemisinin biosynthesis to the apical cells of glandular secretory trichomes ofArtemisiaannuaL. [J]. Phytochemistry, 2009, 70(9): 1123-1128.
[4] Abdin M Z, Israr M, Rehman R U,etal.. Artemisinin, a novel antimalarial drug: Biochemical and molecular approaches for enhanced production [J]. Planta Med., 2003, 69 (4): 289-299.
[5] Shen Q, Chen Y F, Wang T,etal.. Overexpression of the cytochrome P450 monooxygenase (cyp71av1) and cytochrome P450 reductase (cpr) genes increased artemisinin content inArtemisiaannua(Asteraceae) [J]. Genet. Mol. Res., 2012, 11(3): 3298-3309.
[6] Hirsch A M, Bauer W D, Bird D M,etal.. Molecular signals and receptors: Controlling rhizosphere interactions between plants and other organisms[J]. Ecology, 2003, 84(4): 858-868.
[7] Patra N, Srivastava A K. Enhanced production of artemisinin by hairy root cultivation ofArtemisiaannuain a modified stirred tank reactor [J]. Appl. Biochem. Biotechnol., 2014, 174(6): 2209-2222.
[8] 方从兵, 宛晓春,江昌俊. 黄酮类化合物生物合成的研究进展(综述) [J]. 安徽农业大学学报, 2005, 32(4): 498-504.
[9] Winkel-Shirley B. Fiavonoid biosynthesis: A colorful model for genetics, biochemistry, cell biology, and biotechnoiogy [J]. Plant Physiol., 2001, 126(2): 485-493.
[10] Zhang Y, Fu X, Hao X,etal.. Molecular cloning and promoter analysis of the specific salicylic acid biosynthetic pathway gene phenylalanine ammonia-lyase (AaPAL1) fromArtemisiaannua[J]. Biotechnol. Appl. Biochem., 2016, 63(4): 514-524.
[11] Holton T A, Cornish E C. Genetics and biochemistry of anthocyanin biosynthesis [J]. Plant Cell, 1995, 7(7): 1071-1083.
[12] Dixon R A, Xie D Y, Sharma S B. Proanthocyanidins——a final frontier in flavonoid research? [J]. New Phytol., 2005, 165(1): 9-28.
[13] Kang J H, McRoberts J, Shi F,etal.. The flavonoid biosynthetic enzyme chalcone isomerase modulates terpenoid production in glandular trichomes of tomato [J]. Plant Phys., 2014, 164(3): 1161-1174.
[14] Xiong S, Tian N, Long J H,etal.. Molecular cloning and characterization of a flavanone 3-Hydroxylase gene fromArtemisiaannuaL. [J]. Plant Physiol. Biochem., 2016, 105: 29-36.
[15] Murashige T, Skoog F. A revised medium for rapid growth and bio assays with tobacco tissue cultures [J]. Physiol. Plantarum., 1962, 15(3): 473-497.
[16] McCormick S, Niedermeyer J, Fry J,etal.. Leaf disc transformation of cultivated tomato (L.esculentum) usingAgrobacteriumtumefaciens[J]. Plant Cell Rep., 1986, 5(2): 81-84.
[17] Zhang F, Lu X, Lv Z,etal.. Overexpression of theArtemisiaorthologueof ABA receptor, AaPYL9, enhances ABA sensitivity and improves artemisinin content inArtemisiaannuaL. [J]. PLoS ONE, 2013, 8(2): e56697.
[18] Chen D H, Ronald P C. A rapid DNA minipreparation method suitable for AFLP and other PCR applications [J]. Plant Mol. Biol. Rep., 1999, 17(1): 53-57.
[19] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCtmethod [J]. Methods, 2001, 25(4): 402-408.
[20] Zhang L, Jing F Y, Li F P,etal.. Development of transgenicArtemisiaannua(Chinese wormwood) plants with an enhanced content of artemisinin, an effective anti-malarial drug, by hairpin-RNA-mediated gene silencing [J]. Biotechnol. Appl. Biochem., 2009, 52: 199-207.
[21] Owens D K, Crosby K C, Runac J,etal.. Biochemical and genetic characterization ofArabidopsisflavanone 3β-hydroxylase [J]. Plant Physiol. Biochem., 2008, 46(10): 833-843.
[22] Shen Q, Yan T X, Fu X Q. Transcriptional regulation of artemisinin biosynthesis inArtemisiaannuaL. [J]. Sci. Bull., 2016, 61(1): 18-25.
[23] Nagel J, Culley L K, Lu Y,etal.. EST analysis of hop glandular trichomes identifies an O-Methyltransferase that catalyzes the biosynthesis of xanthohumol [J]. Plant Cell., 2008, 20(1): 186-200.
[24] Aziz N, Paiva N L, May G D,etal.. Profiling the transcriptome of alfalfa glandular trichomes [J]. Planta, 2005, 221(1): 28-38.
[25] Kumar R, Vashisth D, Misra1 A,etal.. RNAi down-regulation of cinnamate-4-hydroxylase increases artemisinin biosynthesis inArtemisiaannua[J]. Sci. Rep., 2016, 6: 26458.
