MeJA浸种对干旱胁迫下玉米种子萌发及幼苗生理特性的影响
2018-01-27李兆举徐新娟齐红志王二歌宋思艺王晓桠赵博文
李兆举,徐新娟,2*,齐红志,王二歌,宋思艺,王晓桠,赵博文
(1.河南科技学院,河南 新乡 453003; 2.现代生物育种河南省协同创新中心,河南 新乡 453003;3.河南省农业科学院 农业经济与信息研究所,河南 郑州 450002)
干旱是当前气候变化下最不可预测、不可避免的非生物胁迫之一,也是世界范围内限制作物产量的主要因素之一。干旱胁迫对植物的伤害主要表现为细胞脱水、膜系统受破坏以及酶活性受影响,从而导致细胞代谢紊乱,最终影响植物的生长发育。植物在长期的适应过程中形成了各种各样抵抗或适应逆境的能力,如降低膜受损程度、增加细胞渗透调节物质(如糖、脯氨酸等)、提高保护酶活性等方式,而外源物质在此过程中扮演着重要的角色。因此,如何通过外源诱导物质提高植物的抗旱性一直是世界范围内的研究热点[1-3]。
茉莉酸甲酯(Methyl Jasmonate,MeJA)属于茉莉酸类物质(Jasmonates,JAs),是一种存在广泛且具有广谱生理效应的新型植物激素。MeJA可作为一种内源信号分子,诱导植物对逆境的适应性和对病原菌的防御性,而且MeJA具有对环境无毒害作用和使用方法简单等特点。大量研究表明,外源MeJA容易透过细胞膜作为信号分子参与植物抗逆胁迫,提高植物的抗逆能力[2-5]。潘瑞炽等[1]很早就发现,MeJA能够使花生幼苗矮化、叶片变小而厚,降低叶片蒸腾,增加叶片内源脱落酸、脯氨酸含量,提高过氧化物酶活性。研究发现,在干旱处理下喷施MeJA可显著提高水稻叶片的水势和叶绿素含量,降低质膜透性,增强水稻幼苗的抗旱性[6]。已有研究表明,MeJA浸种能够抑制玉米的株高、根长和茎根干质量,但对抗旱性不同的玉米品种抑制效应不同[7]。Abdelagwad等[8]发现,在不同的田间持水量下一定浓度的MeJA浸种可以改善玉米植株的生长指标,增加生长素含量,降低脱落酸含量,提高抗氧化酶活性及茎秆的氮、磷、钾含量。以往的研究表明,MeJA对增强玉米抗旱性具有一定的效应,但MeJA调节玉米幼苗生长、提高幼苗抗旱性的机制尚不明确。鉴于此,以玉米为材料,研究MeJA浸种对干旱胁迫下种子萌发,幼苗生长,幼苗叶绿素、脯氨酸、丙二醛(MDA)含量,相对电导率,超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性的影响,旨在探讨MeJA调节玉米幼苗生长、提高幼苗抗旱性的可能机制,为生产中提高玉米抗旱性的实践管理提供理论参考。
1 材料和方法
1.1 供试材料
供试玉米种子为新单29,由河南省新乡市农业科学院提供。
1.2 试验方法
选择大小一致、健康饱满、完整无伤痕的玉米种子,先用75%乙醇消毒1 min,然后用10% H2O2溶液消毒10 min,蒸馏水冲洗5次,分别置于0(CK,干旱胁迫)、0.025(T1)、0.25(T2)、2.5(T3)、25(T4)、250(T5)μmol/L MeJA溶液中浸种24 h。种子取出后均匀摆放在铺有3层滤纸、直径为15 cm的培养皿中,每皿50粒,每个处理重复3次,在每个处理的培养皿中加入12 mL 15%的PEG-6000溶液(以3层滤纸润湿且有少量剩余为适),种子上覆盖2层滤纸,同时以蒸馏水浸种后不进行干旱处理(以蒸馏水代替15% PEG-6000溶液,CK1)作为清水对照。于25 ℃培养箱中萌发,光周期为16 h/d,光照强度为76 μmol/(m2·s),隔天在底部和上部各加入4 mL 15%的PEG-6000溶液以保持湿润并持续胁迫,直至萌发终止。逐日统计发芽种子数,“露白”视为发芽。
1.3 测定指标
1.3.1 发芽指标 根据下列公式计算发芽指标:发芽率=发芽种子数/供试种子数×100%,发芽势=前7 d发芽种子数/供试种子数×100%。
1.3.2 幼苗生长指标 萌发结束后,从每个培养皿中随机选取10株幼苗,蒸馏水冲洗干净后用滤纸吸干表面水分,用直尺测量主根长和株高,用电子天平称量幼苗鲜质量。
1.3.3 幼苗生理指标 分别测定整株幼苗的相关生理指标[9-10]:采用TTC法测定发芽结束后的幼苗根系活力[9]。叶绿素含量测定采用分光光度法;糖含量测定采用蒽酮比色法;相对电导率测定采用电导法;脯氨酸含量测定采用酸性茚三酮法;MDA含量测定采用硫代巴比妥酸法;SOD活性测定采用氮蓝四唑(NBT)法,以每分钟抑制氮蓝四唑光还原50%为1个酶活性单位;POD活性测定采用愈创木酚法,CAT活性测定采用紫外吸收法,POD和CAT活性均以每分钟内吸光值变化0.01为1个酶活性单位。
1.4 数据处理
采用软件SAS 10.0和Microsoft Excel 2003进行统计学分析并作图,采用ANOVA方差分析、LSD法进行多重比较。
2 结果与分析
2.1 MeJA浸种对干旱胁迫下玉米种子发芽的影响
如图1所示,干旱胁迫显著降低玉米种子的发芽率和发芽势,与CK1相比,CK的发芽率和发芽势分别降低48.1%和54.6%。随着MeJA浸种浓度的增加,干旱胁迫下玉米种子的发芽率和发芽势均呈先升高后降低的变化趋势,其中,0.025~2.5 μmoL/L MeJA浸种处理较CK显著提高玉米种子的发芽率和发芽势,且0.25 μmoL/L MeJA浸种时达到最大值,分别为83.8%和79.6%,分别比CK增加66.3%和93.2%,但仍显著低于CK1;25 μmoL/L MeJA浸种时,玉米种子的发芽率和发芽势与CK差异不显著;250 μmoL/L MeJA浸种时玉米种子的发芽率和发芽势均显著低于CK。
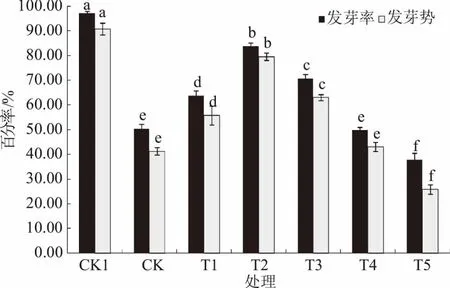
不同字母表示同一指标不同处理间差异显著(P<0.05),下同图1 MeJA浸种对干旱胁迫下玉米种子发芽率和发芽势的影响
2.2 MeJA浸种对干旱胁迫下玉米幼苗生长的影响
由图2可见,干旱胁迫下,玉米幼苗的主根长、株高、鲜质量和根系活力均显著降低,CK分别比CK1降低22.4%、28.1%、47.2%和24.2%。0.025~25 μmoL/L MeJA浸种后,干旱胁迫下玉米幼苗的主根长显著增加,在0.25 μmoL/L时达到最大值,分别比CK1和CK显著增加26.4%和62.9%;株高和幼苗鲜质量呈现较为一致的变化趋势,均在0.25 μmoL/L MeJA浸种时达到最大值,此时显著低于CK1组高于CK,分别比CK增加18.5%和28.0%;0.025、0.25、2.5、25 μmoL/L MeJA浸种显著提高干旱胁迫下玉米幼苗的根系活力,分别是CK的2.4倍、3.1倍、3.3倍、2.6倍。250 μmoL/L MeJA浸种时4个指标均显著低于CK。
2.3 MeJA浸种对干旱胁迫下玉米幼苗叶绿素、糖和脯氨酸含量的影响
由图3可见,干旱胁迫显著降低幼苗的叶绿素含量。随着MeJA浸种浓度的增加,干旱胁迫下玉米幼苗叶绿素含量呈先增加后降低的趋势,在0.25 μmoL/L时达到最大值,比CK增加30.5%,但2.5、0.025 μmoL/L MeJA浸种处理间无显著差异,25、250 μmoL/L MeJA浸种处理则急剧降低,仅为CK的80.0%和53.7%。与叶绿素含量变化不同,干旱胁迫下糖和脯氨酸含量均显著增加,分别比CK1增加31.3%和29.0%;MeJA浸种处理后糖含量随着浸种浓度的增加而显著下降,0.025、0.25、2.5、25、250 μmoL/L MeJA浸种处理分别比CK降低6.5%、19.8%、31.1%、50.3%、85.6%,而脯氨酸含量则随浸种浓度的增加表现为先增加后降低,0.25、2.5 μmoL/L MeJA浸种处理脯氨酸含量较高
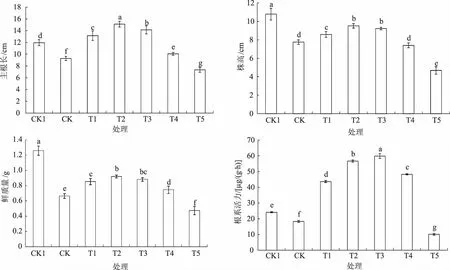
图2 MeJA浸种对干旱胁迫下玉米幼苗主根长、株高、鲜质量及根系活力的影响
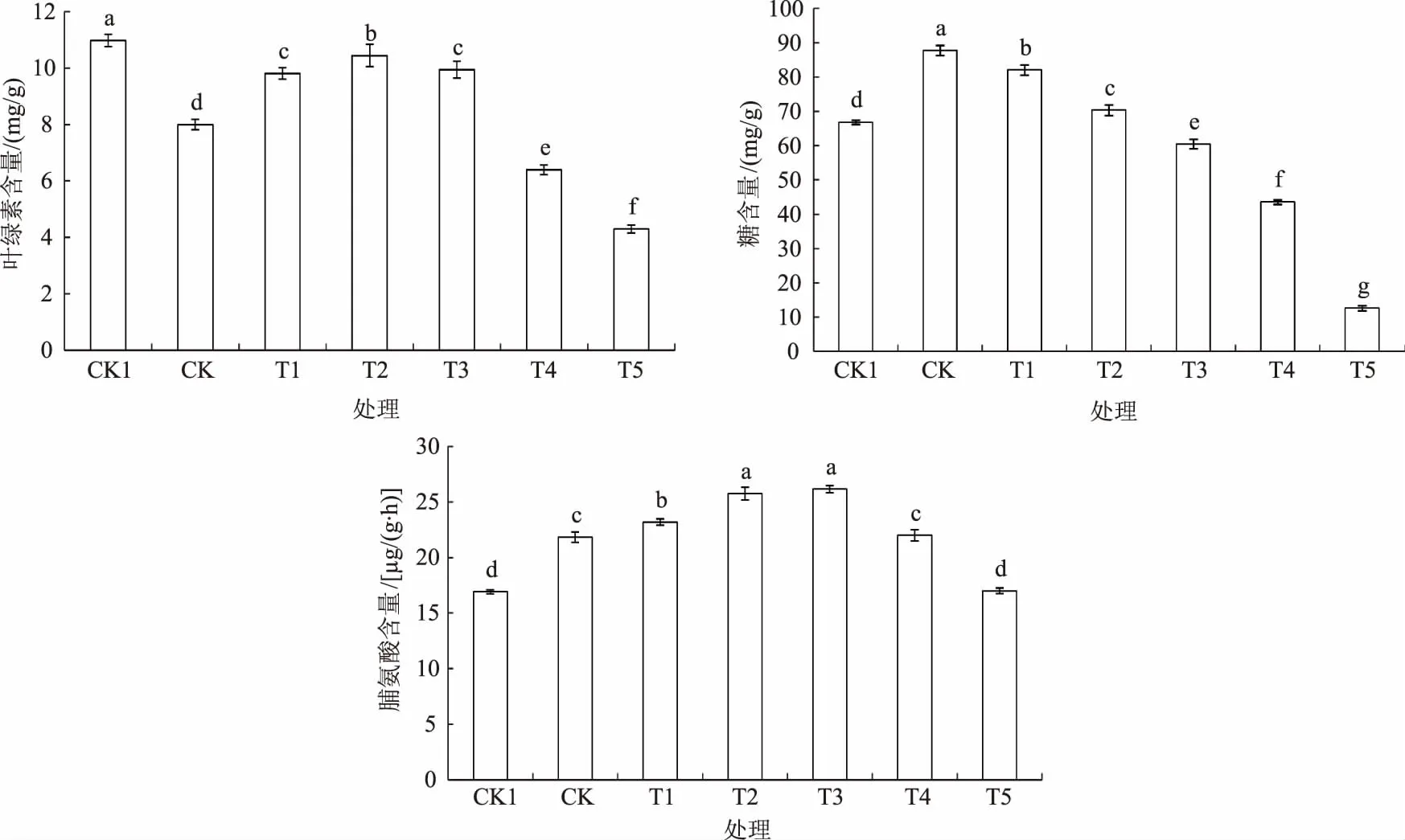
图3 MeJA浸种对干旱胁迫下玉米幼苗叶绿素、糖和脯氨酸含量的影响
且差异不显著,较CK分别增加17.9%、19.8%,均显著高于其他处理。
2.4 MeJA浸种对干旱胁迫下玉米幼苗相对电导率和MDA含量的影响
由图4可知,干旱胁迫下玉米幼苗的相对电导率比CK1显著增加21.4%。低浓度MeJA浸种后相对电导率显著下降,以0.25 μmoL/L浸种最低,比CK降低14.7%;高浓度MeJA浸种则呈现相反的趋势,25、250 μmoL/L MeJA浸种处理分别比CK增加了4.3%和27.8%。MDA含量在干旱胁迫下急剧增加,是CK1的2.1倍,MeJA浸种后MDA含量均显著下降,低浓度处理之间差异并不显著,其中0.25、250 μmoL/L MeJA浸种处理分别比CK降低48.4%、27.6%。
2.5 MeJA浸种对干旱胁迫下玉米幼苗SOD、POD、CAT活性的影响
由图5可知,干旱胁迫显著提高SOD、POD活性,分别比CK1增加12.6%和77.4%。0.025~25 μmoL/L MeJA浸种后2种酶活性均显著增加,0.25 μmoL/L MeJA浸种处理SOD、POD活性分别比CK增加25.6%、27.1%,之后随着浸种浓度增加SOD活性显著下降,而POD活性在25 μmoL/L MeJA浸种时下降显著,250 μmoL/L时2种酶的活性均显著低于CK,分别为CK的85.4%和55.2%。干旱胁迫下CAT活性显著下降,仅为CK1的42.0%;随着MeJA浸种浓度增加,干旱胁迫下CAT活性开始增加,在0.25 μmoL/L时达到最大值,比CK增加65.7%,与2.5 μmoL/L MeJA处理差异不显著,之后显著下降,25 μmoL/L与CK无显著差异,但250 μmoL/L时比CK降低21.8%。
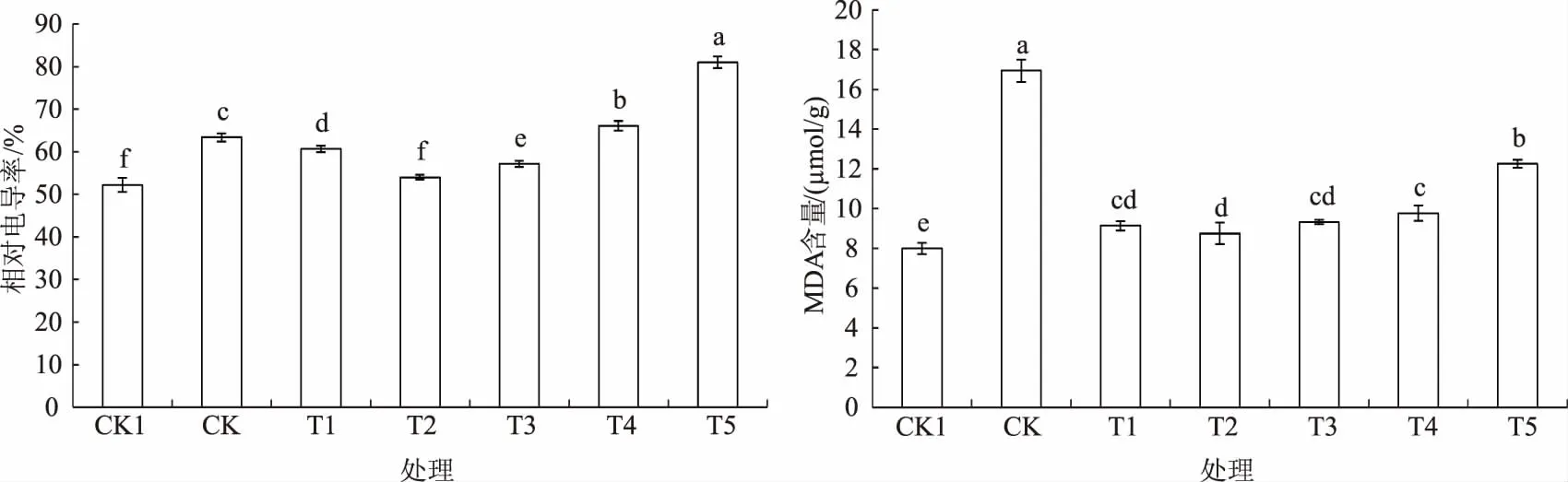
图4 MeJA浸种对干旱胁迫下玉米幼苗相对电导率和MDA含量的影响
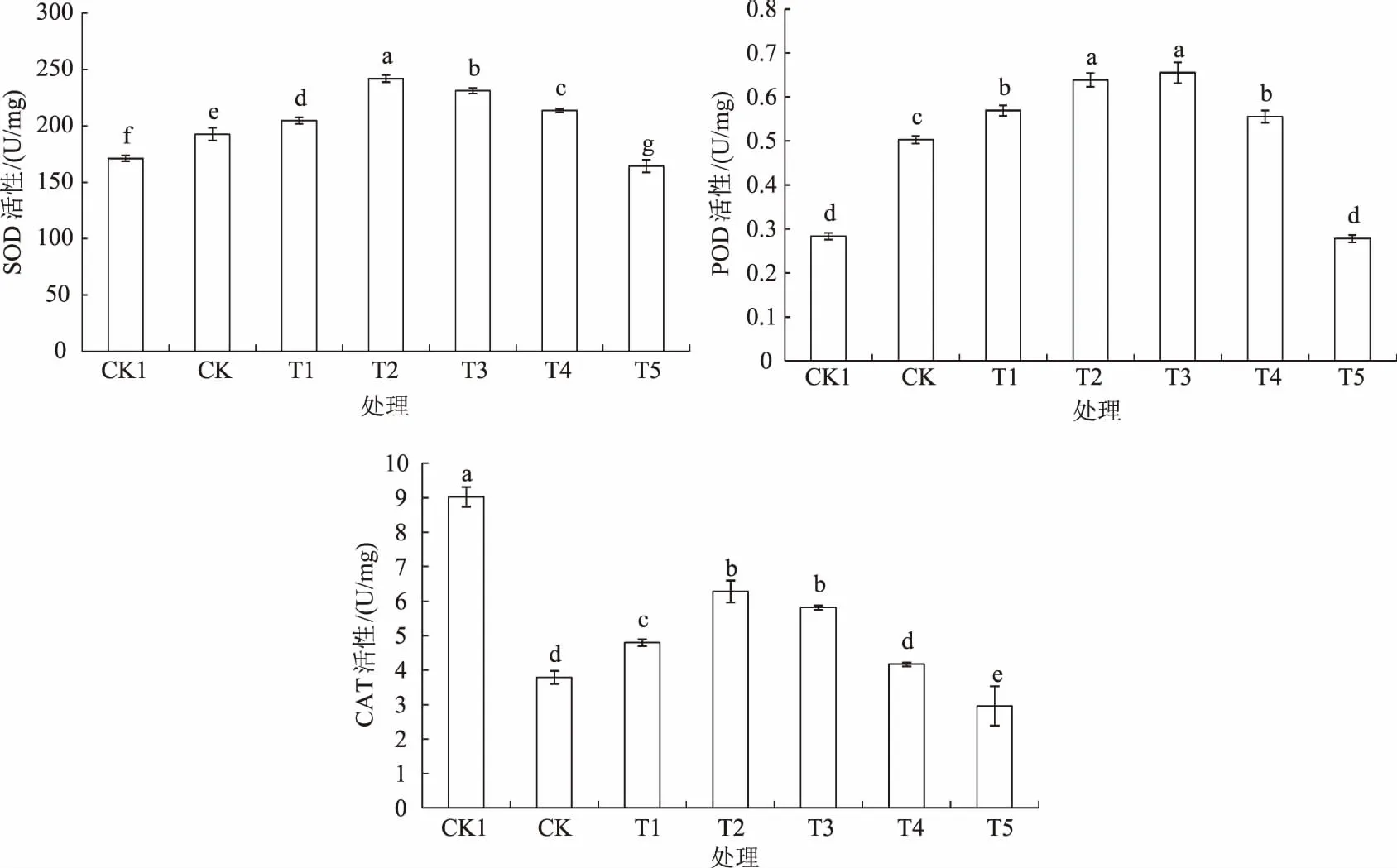
图5 MeJA浸种对干旱胁迫下玉米幼苗SOD、POD、CAT活性的影响
3 结论与讨论
种子发芽率是衡量种子质量好坏的重要指标,发芽势是鉴别种子发芽整齐度的主要指标。MeJA浸种能够抑制水稻种子的萌发[11],本研究中应用低浓度(0.25 μmoL/L)MeJA浸种可以改善干旱胁迫对玉米种子萌发的抑制,显著提高种子的萌发率,这与在棉花上的研究结果[12]相似。根系作为植物重要的吸收器官和合成器官,其生长情况直接影响地上部的生长,较强的根系活力在干旱胁迫下更为重要[13]。本研究中,干旱胁迫显著降低玉米幼苗的主根长、株高和鲜质量,抑制根系活力,低浓度MeJA浸种使干旱胁迫下玉米幼苗的主根长、株高、鲜质量和根系活力均呈增加趋势,受干旱胁迫的抑制作用减弱,但MeJA浓度过高(≥25 μmoL/L)时4个指标则显著降低,这与杨艺等[12]的研究结果一致,表明低浓度外源MeJA可在一定程度上缓解干旱胁迫所造成的伤害。
外源引入MeJA主要通过诱导植物产生一些防御化合物及抗氧化剂来提高作物的抗旱性[14]。糖和脯氨酸是重要的渗透调节物质,干旱胁迫下二者可以降低细胞的渗透势,从而提高细胞的吸水性。干旱胁迫导致二者含量显著增加,糖有助于提高细胞的吸水能力,脯氨酸作为水溶性最强的氨基酸,具有防止细胞脱水的作用,二者含量的提高均有助于提高抗旱性。本研究中,不同MeJA浸种浓度下二者含量的变化并不相同,这与棉花上的研究结果[12]一致。干旱胁迫使植物细胞膜系统受到伤害,透性增加,细胞膜透性的大小可用组织的相对电导率来衡量,其数值在一定程度上可以反映细胞的受害情况;MDA是植物组织在逆境下发生脂质过氧化的主要产物之一,其含量可以表示脂质过氧化的程度。与水稻[6]、油菜[15]上的研究结果相似,本研究结果表明,干旱胁迫下玉米幼苗的相对电导率和MDA含量显著增加,低浓度外源MeJA浸种能够显著降低干旱胁迫下相对电导率和MDA含量,以0.25 μmoL/L处理效果最好,表明MeJA浸种在一定程度上缓解了渗透胁迫造成的氧化损伤,降低了细胞膜的受害程度,有助于提高作物的抗旱性。SOD、POD和CAT是与植物抗旱性密切相关的抗氧化保护酶[16],本研究中SOD、POD活性在干旱胁迫下显著增加,外源MeJA浸种后则继续显著增强,这与邹燕等[15]的研究结果相一致。蒋明义等[16]很早就提出,干旱胁迫下CAT活性的下降及POD活性的上升可能与植物种类和抗旱性强弱有关,本研究中CAT活性在干旱胁迫下降低,而MeJA浸种处理则得到显著改善,这也许是玉米品种本身的抗旱性所决定的。3种酶活性的变化均表明,干旱胁迫下MeJA浸种可增加玉米幼苗中的保护酶活性,从而提高植物的抗氧化能力[17]。
综上,低浓度外源MeJA浸种能够促进干旱胁迫下玉米种子萌发和幼苗生长,提高幼苗的脯氨酸含量,降低幼苗相对电导率和MDA含量,增强抗氧化保护酶的活性,高浓度MeJA浸种则显著抑制种子萌发及幼苗生长。实践中应注意控制MeJA的浸种浓度,以低浓度(0.25 μmoL/L)为宜。
[1] 潘瑞炽,古焕庆.茉莉酸甲酯对花生幼苗生长和抗旱性的影响[J].植物生理学报,1995,21(3):215-220.
[2] 金微微,张会慧,王炎,等.茉莉酸甲酯对干旱及复水下烤烟幼苗光合特性及和抗氧化酶的影响[J].干旱区地理,2011,34(6):933-940.
[3] Li D M,Guo Y K,Qian L,etal.The pretreatment of cucumber with methyl jasmonate regulates antioxidant enzyme activities and protects chloroplast and mitochondrial ultrastructure in chilling-stressed leaves[J].Sci Hortic,2012,143(1):135-143.
[4] 白妙莲,付永琦,何永明,等.茉莉酸甲酯浸种对水稻幼苗白叶枯病抗性及抗氧化酶活性的影响[J].中国水稻科学,2014,28(4):419-426.
[5] 李荣冲,沈亮余,梁晶龙,等.高湿胁迫下茉莉酸甲酯对紫苏种子萌发及生理特性的影响[J].西北植物学报,2012,32(2):312-317.
[6] 董桃杏,蔡昆争,曾任森.干旱胁迫下茉莉酸甲酯对水稻叶片质膜透性及无机离子含量的影响[J].华北农学报,2010,25(1):136-140.
[7] 李玲.MJ对抗旱性不同的两个玉米品种茎和根生长的影响[J].华南师范大学学报(自然科学版),1998(2):33-36.
[8] Abdelagwad Z A,Khalafaallah A A,Abdallah M M.Impact of methyl jasmonate on antioxidant activity and some biochemical aspects of maize plant grown under water stress[J].Agricultural Science,2014,5(12):1077-1088.
[9] 张志良,瞿伟菁,李小方.植物生理生化实验指导[M].北京:高等教育出版社,2009.
[10] 李合生.植物生理生化实验原理和技术[M].3版.北京:高等教育出版社,2000.
[11] 汤日圣,王红,曹显祖.MeJA对水稻种子萌发和秧苗生长的调控效应[J].作物学报,2002,28(3):333-338.
[12] 杨艺,常丹,王艳,等.茉莉酸与茉莉酸甲酯预处理对干旱胁迫下棉花种子萌发和秧苗生理特性的影响[J].西北植物学报,2015,35(2):302-308.
[13] Kondo M,Pablico P P,Aragones D V,etal.Genotypic and environmental variations in root morphology in rice genotypes under upland field condition[J].Plant Soil,2003,255(1):189-200.
[14] Shakeel A A,Mohsin T,Saddam H,etal.Exogenously applied methyl jasmonate improves the drought tolerance in wheat at early and late developmental stages[J].Acta Physiol Plant,2016,38(1):25-36.
[15] 邹燕,王瑞雪,沈亮余,等.渗透胁迫下外源茉莉酸甲酯对油菜种子生理特性的影响[J].西北植物学报,2011,31(3):564-568.
[16] 蒋明义,荆家海,王韶唐.渗透胁迫对水稻幼苗膜脂过氧化及体内保护系统的影响[J].植物生理学报,1991,17(1):80-84.
[17] 单长卷,张胜利.干旱胁迫下植物抗氧化的信号物质调控研究进展[J].河南农业科学,2010(11):133-137.
