魁蚶母源大防御素在子代发育早期的动态变化*
2018-01-12刘志鸿周丽青孙秀俊王泽江杨爱国
吴 彪 刘志鸿 周丽青 孙秀俊 王泽江 杨爱国①
(1. 中国水产科学研究院黄海水产研究所农业部海洋渔业可持续发展重点实验室 青岛 266071;2. 山东省五莲县许孟镇水利站 日照 262315)
魁蚶(Scapharca broughtonii)是一种大型冷温性蚶类, 广泛分布于太平洋西部沿岸, 因其个体大、肉味鲜美, 并富含蛋白质和多种维生素, 在国内外市场深受喜爱, 是我国黄、渤海区的重要经济贝类(吴彪等,2012)。最近几年, 由于消费市场及增殖放流活动对魁蚶的需求量激增, 带动了苗种繁育产业蓬勃发展。魁蚶营体外受精、体外发育的生殖方式, 卵子排出体外后的受精、发育等过程完全暴露于水环境中。处在开放水体中的胚胎或者幼体非常容易受到病原微生物的侵染, 导致胚胎孵化率下降、幼体生长缓慢, 甚至死亡, 严重影响人工繁育魁蚶的幼苗出库率和苗种质量。胚胎发育早期, 个体自身免疫系统尚未形成或发育不完善, 除受精膜第一道免疫防线外, 多数水产动物能够通过卵子从母体获得免疫因子而具备一定的免疫力, 即母源性免疫。因此, 母源免疫因子对胚胎早期的正常发育具有重要的免疫保护作用。
母源免疫研究已在哺乳类、鸟类、爬行类等多种动物中广泛开展(Bandrick et al, 2014; Blanco et al,2015), 但在水产动物中的相关研究起步较晚, 已有的报道主要集中在鱼、虾等少数物种(Huang et al,1999; Swain et al, 2009)。在高等的脊椎动物中, 通过免疫母体来增强子代免疫力已经得到广泛应用, 如用黏液囊病病毒疫苗免疫母鸡, 其子代卵黄囊中有不同水平的黏液囊病病毒抗体存在, 能够对子代早期发育发挥免疫保护作用(Grindstaff et al, 2006)。目前高等动物的相关研究多关注于抗体的传递和作用,但是关于水产动物的一些研究已经证明, 除抗体外,补体、溶菌酶、凝集素等非特异性免疫因子也能够通过卵子传递给子代, 发挥重要的免疫功能(Yousif et al, 1991; Olafsen, 1996; Løvoll et al, 2006; Wang et al,2009), 尤其是对主要依靠非特异性免疫系统进行机体免疫反应的软体动物更重要。目前关于贝类的研究报道较少, 母源性免疫因子的转移特点及在子代早期的变化规律尚不清楚, 明确该问题是开发利用母源免疫的前提和基础, 对提高贝类胚胎和幼虫早期免疫力具有重要的理论意义和实用价值。
大防御素(big-defensin), 是一种富含半胱氨酸的抗菌肽, 最先在鳖(Saito et al, 1995)中发现, 后来在菲律宾蛤仔(Ruditapes philippinesis)(Wei et al, 2003;Zhao et al, 2010)、海湾扇贝(Argopecten irradians)(Zhao et al, 2007)、虾夷扇贝(Patinopecten yesoensis)(于赫男, 2012)、长牡蛎(Crassostrea gigas)(Rosa et al,2015)、三角帆蚌(Hyriopsis cumingii)(Wang et al, 2014)等多种贝类中也被证实存在, 且具有广谱的抗革兰氏阴性菌、革兰氏阳性菌及真菌的生物活性, 发挥重要的免疫保护作用。Li等(2012)克隆获得了魁蚶大防御素基因cDNA序列, 为本研究的开展奠定了前期基础。本研究拟通过实时荧光定量 PCR(quantitative real-time PCR, qRT-PCR)和酶联免疫吸附测定(enzyme linked immunosorbent assay, ELISA)技术从mRNA和蛋白质水平上检测魁蚶胚胎及幼虫发育早期大防御素的表达变化, 以明确大防御素从母体向子代传递和表达规律。
1 材料与方法
1.1 魁蚶苗种繁育及样品收集
实验用的魁蚶亲贝取自山东省长岛县海区, 在亲本自然繁育期前一个月从海区捕获后转移至育苗车间升温促熟。性腺成熟后, 利用升温过滤海水刺激以诱导亲本产卵、排精, 建立两个同父异母半同胞家系。同一母本的卵细胞在受精后即刻被平均分成两组,一组在22°C的充气海水中孵化、培育, 为对照组; 另一组则在含有5×108CFU/L鳗弧菌(Vibrio anguillarum)的同条件海水中培育, 为鳗弧菌胁迫处理组。培育期间, 以投喂金藻为主, 配合小球藻等其他单胞藻, 日换水2—3次。
实验样品的收集时间分别为: 卵细胞期、受精卵期、多细胞期、囊胚期、担轮幼虫前期、担轮幼虫后期、D形幼虫期和壳顶幼虫期。用500目或300目筛绢在上述各幼体发育时期随机收集实验材料。材料固定方法如下, RNA提取材料: 加入Trizol后, 液氮速冻后保存于–80°C; 蛋白质提取材料: 样品先置于预冷的无菌Tris-HCl缓冲液中(pH8.0), 4°C下超声波细胞破碎仪将样品充分破碎, 6000×g离心30min后, 取上清液氮速冻, 保存于–80°C。
1.2 RNA的提取及qRT-PCR检测
总RNA的提取参考Zheng等(2015)的方法, 并稍作修改。样品去除Trizol后, 分别经过Solution D、氯仿/异戊醇、β-巯基乙醇充分裂解, 水饱和酚/氯仿/异戊醇两次抽提, 异丙醇/醋酸钠沉淀、75%乙醇两次洗涤后, RNA溶于RNA-free水中, 并加入DNaseⅠ去除基因组DNA。运用超微量分光光度计(A260/A280值)和琼脂糖电泳检测RNA浓度及完整性。根据试剂盒PrimeScript™ RT reagent Kit(TaKaRa)说明书合成cDNA第一条链用于qRT-PCR实验。
以上各时间点样品中大防御素 mRNA表达水平通过 qRT-PCR进行检测, 具体操作方法参照 Wu等(2015)的方法进行。根据已有的魁蚶大防御素基因的cDNA序列(GenBank登录号: JQ782659), 用 Primer Premier 5.0设计 qRT-PCR 引物(序列为 F:ACCTTTTGTTGTCCACG, R: TGTTCTACACCACCC TC), 选用魁蚶 β-actin基因作为内参基因(引物序列为F: GGTTACACTTTCACCACCACAG, R: ACCGG AAGTTTCCATACCTAAGA)。qRT-PCR在仪器LineGene 9600(BIOER)上进行, 反应体系为25μL, 具体包括: ExTaq12.5μL、正反向引物(10μmol/L)各0.5μL、cDNA模板2μL、灭菌蒸馏水9.5μL。具体反应程序为: 94°C预变性 2min, 94°C变性30s, 62°C退火30s, 72°C延伸30s, 40个循环。内参基因与目的基因分管同时进行, 每个样品重复3次, 利用仪器软件计算各样品 Ct值, 数据取平均值。将卵细胞时期mRNA含量作为参照1, 采用2–Ct△△法对基因表达量进行相对定量分析(Livak et al, 2001)。运用SPSS软件, 采用t检验法检测每个相同发育时期处理组与正常组之间的差异性, 单因素方差分析不同发育时期表达量差异, 差异显著水平设为P<0.05, 极显著水平为P<0.01。
1.3 魁蚶大防御素蛋白水平的ELISA检测
魁蚶大防御素抗体由艾比玛特生物医药有限公司提供, 利用抗原蛋白免疫健康兔子七次后纯化获得。不同发育时期大防御素蛋白含量通过 ELISA检测, 具体操作参照刘帅帅等(2013)的方法进行。主要过程为: 运用 BCA法测定每份样品总蛋白浓度并调整至浓度一致后, 取200μL样品加入酶标板, 4°C过夜后弃去残液, 之后用PBST洗涤3次; 用300μL10%的脱脂奶粉于 37°C中孵育 2h, 去掉封闭液并用PBST洗板3次; 加入1:1000稀释的魁蚶大防御素抗体 100μL, 37°C 孵育 2h, PBST洗涤 3次; 加入 1∶2000稀释的辣根过氧化物酶标记的羊抗兔二抗100μL, 37°C 孵育 2h, PBST 洗涤 4次; 加入 100μL 辣根酶底物 TMB溶液, 避光条件下 37°C条件下反应10min后, 加入2mol/L的硫酸50μL以终止反应。用PBS溶液代替样品作为阴性对照, 其余条件与上述相同。每个样品设置三个平行, 酶标仪读取OD450吸光值。以制备抗体时所用的蛋白抗原为标准品制作标准曲线和曲线方程, 通过方程用OD值计算各样品中大防御素蛋白的浓度。将卵细胞时期大防御素蛋白含量视为参照 1, 计算每个发育时期蛋白含量的相对值,绘制蛋白表达变化趋势图。差异显著性检验与上述qRT-PCR差异分析方法相同。
2 结果
2.1 mRNA水平的动态变化
魁蚶大防御素 mRNA在两个魁蚶家系的幼虫发育早期表达变化如图1所示。从图1中可以看出, F1、F2两家系的对照组和胁迫处理组 mRNA的变化趋势基本相同, 即先降后升, 但家系之间、以及同家系对照组和处理组之间在变化幅度和时间上有一定差别。结合表 1的差异显著性分析结果发现, 在 F1家系中,大防御素在卵细胞受精后开始降低, 对照组和处理组分别在囊胚期和多细胞期达到最低值, 分别为卵细胞期的0.27倍和0.23倍, 之后开始上调表达; 正常组中, 多细胞期、囊胚期的表达量极显著低于卵细胞期(P<0.01), 经多细胞期的最低值后上调, 至 D形幼虫期达到最高值, 差异达到显著水平(P<0.05); 而胁迫处理组, 除了受精卵期, 其余各发育期的表达量与卵细胞期相比均达到了极显著差异, 经囊胚期最低值后开始不断升高, 壳顶幼虫期达到卵细胞期的 3.8倍; 对照组与处理组相比, 对照组在多细胞期极显著高于处理组, 在壳顶幼虫期极显著低于处理组, 囊胚期之后的各阶段, 处理组高于正常组, 但差异不显著。F2家系与F1表现出基本相同的变化趋势, 也是先下降至最低, 之后担轮幼虫前期开始显著上调; 担轮幼虫期至壳顶幼虫期, 正常组和处理组的表达量与卵细胞期的表达均达到了显著或极显著水平; 两组之间, 受精卵期、囊胚期、壳顶幼虫期具有显著差异。
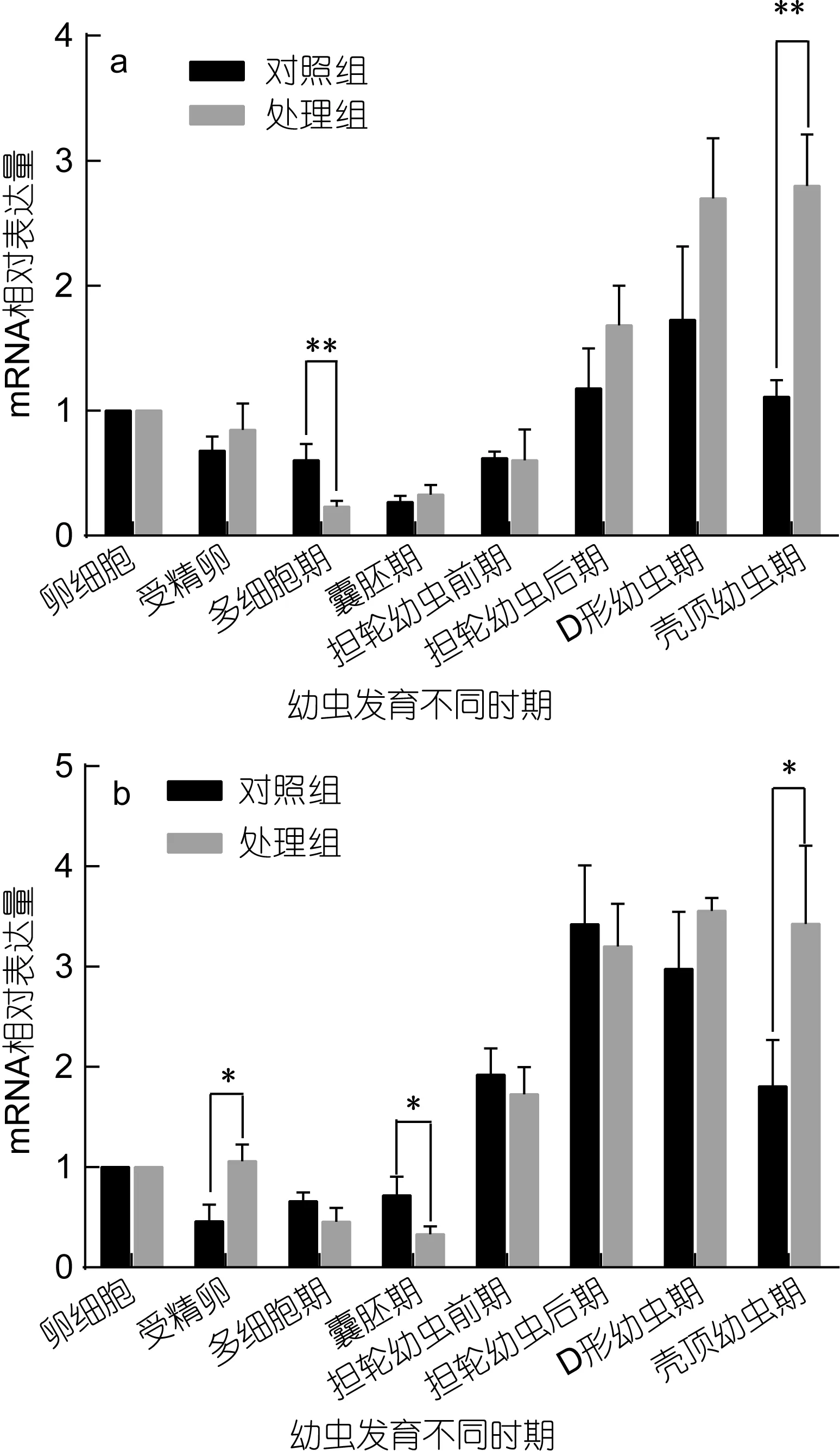
图1 魁蚶大防御素mRNA在魁蚶幼虫不同发育时期的变化Fig.1 The big-defensin mRNA during the early-larvae developmental stage of S. broughtonii
2.2 蛋白水平的动态变化
大防御素蛋白水平的表达变化如图2所示, 显著性检验结果见表 2。结果表明, 大防御素蛋白在魁蚶幼体早期发育阶段与 mRNA的变化趋势基本相似,同样表现为先下降后升高, 而且在升高阶段, 处理组表达量普遍高于正常组。F1家系中, 正常组蛋白从受精后开始下降, 多细胞期、囊胚期下降至极显著水平,之后开始逐渐升高, 但均未达到显著水平; 而处理组,多细胞期、囊胚期、担轮幼虫前期、壳顶幼虫期与卵细胞期有极显著差异, D形幼虫期则具有显著差异;两组之间, 处理组从囊胚期之后高于对照组, 但只有囊胚期和担轮幼虫前期时差异达到显著(P<0.05)。F2家系趋势与F1基本相同, 囊胚期前, 处理组低于正常组; 担轮幼虫前期之后, 处理组高于对照组, 其中担轮幼虫前期、担轮幼虫后期和壳顶幼虫期的差异达到显著水平(P<0.05)。
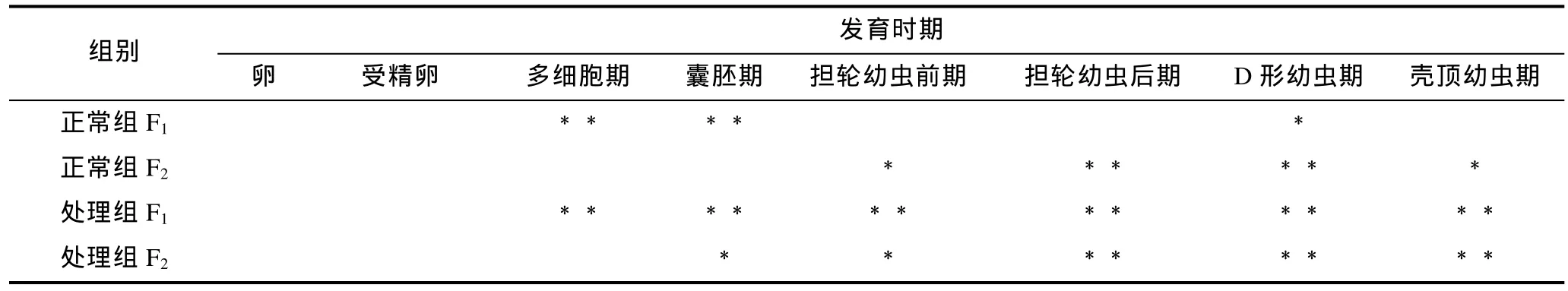
表1 魁蚶大防御素mRNA变化的显著性检验Tab.1 Significance test on big-defensin mRNA
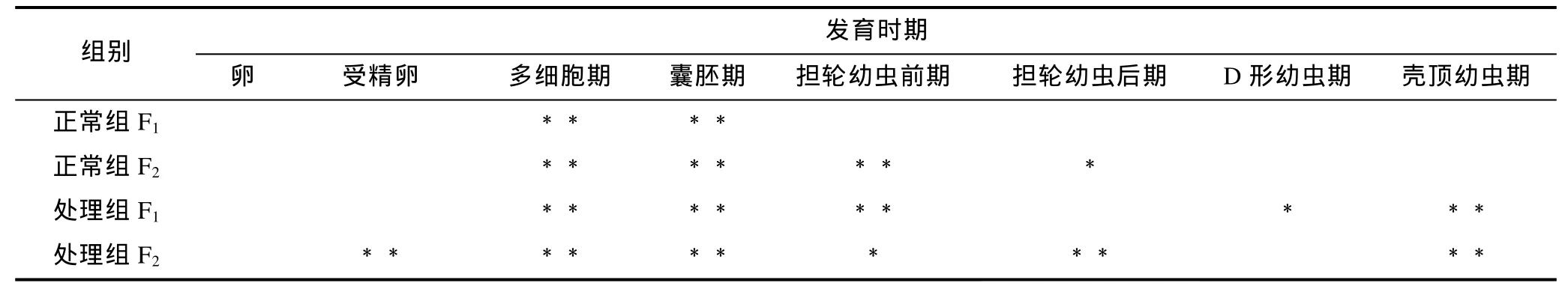
表2 魁蚶大防御素蛋白变化的显著性检验Tab.2 Significance test on big-defensin protein
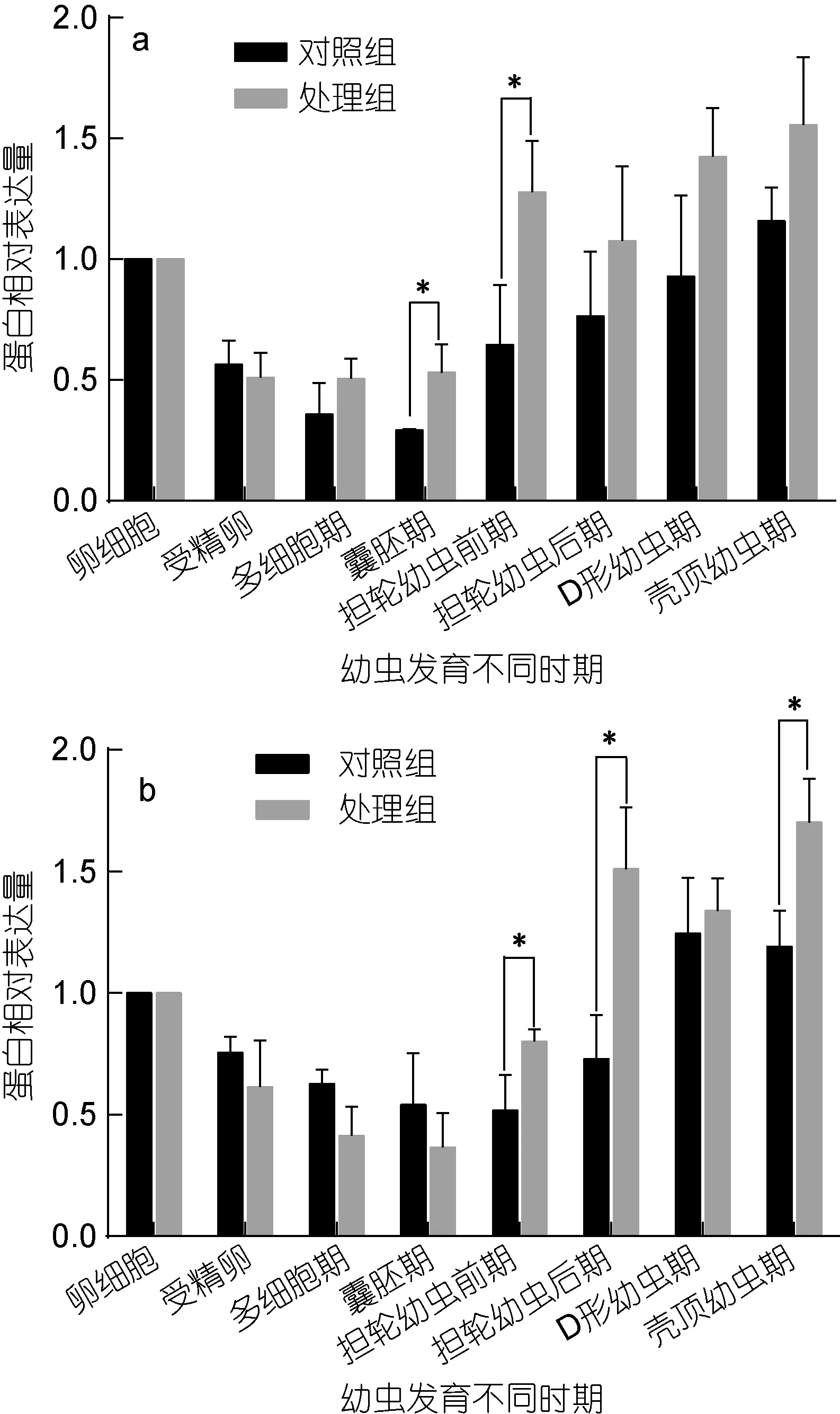
图2 魁蚶大防御素蛋白在魁蚶幼虫不同发育时期的动态变化Fig.2 The big-defensin protein during the early-larvae developmental stage of S. broughtonii
3 讨论
传代免疫效应是母体免疫力通过母源性物质传递给后代, 从而使子代拥有一定的免疫能力。母体产生的一些抗体以及凝集素、溶菌酶等先天性免疫因子从母体向子代传递, 并发挥免疫保护作用, 已经在很多动物中得到证实(张士璀等, 2007; Wanget al, 2009,2010, 2012)。与脊椎动物研究相比, 目前有关无脊椎动物母源免疫方面的研究报道较少。不过, 也有研究证明一些头索动物、软体动物也同样存在这种被动的母体免疫。如, 刁明月(2015)在文昌鱼(Branchiostoma lanceolatum)1—2细胞期的受精卵液中发现了以蛋白和mRNA存在的α2巨球蛋白, 并证实这种母源性蛋白发挥了重要的抑菌作用; 岳峰(2013)在栉孔扇贝(Chlamys farreri)卵细胞中发现有 CfCu/Zn-SOD、CfLBP/BPI、CfLBP、CfLec-3和CfLYZ的mRNA和蛋白表达。本研究在魁蚶卵细胞期检测到了大防御素mRNA和蛋白, 这与上述的研究结果相一致, 进一步证实了无脊椎动物先天免疫因子的母源传递现象。
认识免疫因子在子代的传递表达规律是母源免疫的重要研究内容, 也是开发利用母源免疫的前提和基础。通过对两个魁蚶家系幼虫不同发育阶段的检测, 本研究发现大防御素 mRNA和蛋白的表达规律基本一致, 即自受精后开始持续下降, 一般至囊胚期都维持在比较低的水平, 从担轮幼虫期开始, 含量开始迅速上升, 这与已有的研究报道结果相似。大西洋鲑(Salmo salar)卵细胞中的抗体在受精后开始下降,经过孵化期、仔鱼期, 直至幼鱼自身合成抗体, 水平开始迅速上升(Olsenet al, 1997); 王鸿淼(2012)运用Western检测发现斑马鱼(Danio rerio)母源性 IgM从受精后开始减少, 至第5天检测不到抗体。这些结果说明, 母源性的免疫因子在卵细胞受精后开始被逐步消耗, 含量不断下降, 直至幼体开始自身合成, 含量开始升高。本研究中, 魁蚶大防御素含量基本在担轮幼虫期开始升高, 而且 mRNA的变化幅度比蛋白水平更大, 这表明此时的魁蚶幼虫可能已经开始自身合成大防御素。岳峰(2013)发现栉孔扇贝模式识别受体(pattern recognition receptor, PRR)分子CfPGRP-S1、CfLGBP、CfLec-1和CfLec-3的 mRNA在担轮幼虫期开始大量表达, 利用整体免疫荧光定位进一步证实了其表达部位最早是出现在担轮幼虫基部的两侧对称细胞中, 认为此时是扇贝免疫系统的最早形成期。这可以解释本研究中大防御素含量为什么在担轮幼虫期开始升高, 同时也说明魁蚶的免疫系统也可能在此时形成, 当然, 这还需要更多的证据来证明。
免疫刺激能够增强免疫因子的表达, 这在许多物种中已有报道。如, 鳗弧菌刺激能够增强虾夷扇贝(Patinopecten yessoensis)卵黄蛋白原(Wu et al,2015)、魁蚶铁蛋白(Zheng et al, 2016)及半乳糖凝集素(郑利兵等, 2015)这些免疫因子的表达等。本研究中, 担轮幼虫之前, 处理组与对照组大防御素的表达量基本相当, 互有高低; 而之后的时期, 处理组表达量基本高于对照组, 但差异未全部都达到显著水平。这与魁蚶成体受到鳗弧菌刺激后的响应情况有差别。Li等(2012)研究了鳗弧菌刺激魁蚶成体后,血细胞和肝胰腺中大防御素mRNA的动态变化, 结果表明, 刺激 8h后血细胞中的表达量显著升高, 至16h时上调至最高值; 肝胰腺中的表达量在24h达到最高值。而且, 最高值分别是对照组的 10.25倍和5.14倍。可见, 担轮幼虫期后的幼体对鳗弧菌刺激的响应与成体相似, 受刺激后大防御素均上调表达,但是响应程度不如成体。这可能是由于幼体免疫系统发育并不完善, 再加上鳗弧菌没有进行灭活而具有致病性, 可能会使得部分幼虫机体发育受阻而影响其免疫活性因子的合成。岳峰(2013)的研究表明,用灭活的鳗弧菌对栉孔扇贝亲贝进行免疫刺激后,许多免疫分子的蛋白表达在子代卵细胞、胚胎或幼虫中均明显升高, 且免疫刺激组的抗菌活力显著高于对照。这给我们新的提示, 在充分了解先天免疫因子在子代表达规律前提下, 结合母源免疫开发提高母源免疫因子含量的方法, 能够有效增强子代的免疫抵抗力, 可以为科学制定提高子代早期成活率的策略提供理论依据, 对魁蚶苗种繁育产业发展具有重要的现实意义。
4 结论
本文通过qRT-PCR和ELISA检测了魁蚶胚胎及幼体早期发育过程中大防御素在 mRNA水平和蛋白质水平上的动态变化, 发现母源性大防御素能够通过卵细胞传递给子代, 并在卵子受精后被逐渐消耗。幼体发育至担轮幼虫期可能具备了自身合成大防御素的能力, 使幼体体内大防御素含量增加, 并且鳗弧菌刺激能够促进其增加幅度。
刁明月, 2015. α2巨球蛋白在文昌鱼受精卵中的存在及其抑菌作用分析——头索动物母源性免疫新证据. 青岛: 中国海洋大学硕士论文, 14—51
于赫男, 2012. 虾夷扇贝大防御素基因的克隆、表达及G—型溶菌酶基因的启动子分析. 大连: 辽宁师范大学硕士学位论文, 14—23
王鸿淼, 2012. 斑马鱼(Danio rerio)母源性抗体的传递及其对子代的保护作用. 青岛: 中国海洋大学硕士论文, 23—54
刘帅帅, 姚 琳, 马丽萍等, 2013. 贝类中 3种组织血型抗原ELISA检测方法的建立与分型. 中国水产科学, 20(1): 211—216
吴 彪, 梁 超, 杨爱国等, 2012. 基于 SSR 标记的魁蚶(Scapharca broughtonii)不同群体遗传结构的分析. 海洋与湖沼, 43(4): 863—869
张士璀, 李 欣, 汲广东, 2007. 鱼类免疫系统的早期发生.中国海洋大学学报, 37(4): 557—562
岳 峰, 2013. 栉孔扇贝免疫系统发生及母源免疫的初步研究.青岛: 中国科学院研究生院(海洋研究所)博士学位论文,61—104
郑利兵, 吴 彪, 刘志鸿等, 2015. 魁蚶(Scapharca broughtonii)半乳糖凝集素(SbGal)基因 cDNA的克隆及表达分析. 海洋与湖沼, 46(5): 1061—1070
Bandrick M, Theis K, Molitor T W, 2014. Maternal immunity enhances Mycoplasma hyopneumoniaevaccination induced cell-mediated immune responses in piglets. BMC Veterinary Research, 10(1): 124
Blanco J C G, Pletneva L M, Oue R O et al, 2015. Maternal transfer of RSV immunity in cotton rats vaccinated during pregnancy. Vaccine, 33(41): 5371—5379
Grindstaff J L, Hasselquist D, Nilsson J Å et al, 2006.Transgenerational priming of immunity: maternal exposure to a bacterial antigen enhances offspring humoral immunity.Proceedings of the Royal Society B: Biological Sciences,273(1600): 2551—2557
Huang C C, Song Y L, 1999. Maternal transmission of immunity to white spot syndrome associated virus (WSSV) in shrimp(Penaeus monodon). Developmental & Comparative Immunology, 23(7—8): 545—552
Li M, Zhu L, Zhou C Y et al, 2012. Molecular characterization and expression of a novel big defensin (Sb-BDef1) from ark shell, Scapharca broughtonii. Fish & Shellfish Immunology,33(5): 1167—1173
Livak K J, Schmittgen T D, 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2–CT△△Method. Methods, 25(4): 402—408
Løvoll M, Kilvik T, Boshra H et al, 2006. Maternal transfer of complement components C3-1, C3-3, C3-4, C4, C5, C7, Bf,and Df to offspring in rainbow trout (Oncorhynchus mykiss).Immunogenetics, 58(2—3): 168—179
Olafsen J A, 1996. Lectins: models of natural and induced molecules in invertebrates. In: Cooper E L ed. Invertebrate Immune Responses. Berlin Heidelberg, Germany: Springer,49—76
Olsen Y A, Press C M, 1997. Degradation kinetics of immunoglobulin in the egg, alevin and fry of Atlantic salmon, Salmo salar L., and the localisation of immunoglobulin in the egg. Fish & Shellfish Immunology,7(2): 81—91
Rosa R D, Alonso P, Santini A et al, 2015. High polymorphism in big defensin gene expression reveals presence–absence gene variability (PAV) in the oyster Crassostrea gigas.Developmental & Comparative Immunology, 49(2):231—238
Saito T, Kawabata S, Shigenaga T et al, 1995. A novel big defensin identified in horseshoe crab hemocytes: isolation,amino acid sequence, and antibacterial activity. Journal of Biochemistry, 117(5): 1131—1137
Swain P, Nayak S K, 2009. Role of maternally derived immunity in fish. Fish & Shellfish Immunology, 27(2): 89—99
Wang H M, Ji D R, Shao J Z et al, 2012. Maternal transfer and protective role of antibodies in zebrafish Danio rerio.Molecular Immunology, 51(3—4): 332—336
Wang G L, Xia X L, Li X L et al, 2014. Molecular characterization and expression patterns of the big defensin gene in freshwater mussel (Hyriopsis cumingii). Genetics and Molecular Research, 13(1): 704—715
Wang Z P, Zhang S C, 2010. The role of lysozyme and complement in the antibacterial activity of zebrafish (Danio rerio) egg cytosol. Fish & Shellfish Immunology, 29(5):773—777
Wang Z P, Zhang S C, Tong Z et al, 2009. Maternal transfer and protective role of the alternative complement components in zebrafish Danio rerio. PLoS One, 4(2): e4498
Wei Y X, Guo D S, Li R G et al, 2003. Purification of a big defensin from Ruditapes philippinesis and its antibacterial activity. Acta Biochimica Et Biophysica Sinica, 35(12):1145—1148
Wu B, Liu Z H, Zhou L Q et al, 2015. Molecular cloning,expression, purification and characterization of vitellogenin in scallop Patinopecten yessoensis with special emphasis on its antibacterial activity. Developmental & Comparative Immunology, 49(2): 249—258
Yousif A N, Albright L J, Evelyn T P T, 1991. Occurrence of lysozyme in the eggs of coho salmon Oncorhynchus kisutch.Diseases of Aquatic Organisms, 10(1): 45—49
Zhao J M, Li C H, Chen A Q et al, 2010. Molecular characterization of a novel big defensin from clam Venerupis philippinarum. PLoS One, 5(10): 13480
Zhao J M, Song L S, Li C H et al, 2007. Molecular cloning,expression of a big defensin gene from bay scallop Argopecten irradians and the antimicrobial activity of its recombinant protein. Molecular Immunology, 44(4):360—368
Zheng L B, Liu Z H, Wu B et al, 2016. Ferritin has an important immune function in the ark shell Scapharca broughtonii.Developmental & Comparative Immunology, 59: 15—24
Zheng L B, Wu B, Liu Z H et al, 2015. A manganese superoxide dismutase (MnSOD) from ark shell, Scapharca broughtonii:molecular characterization, expression and immune activity analysis. Fish & Shellfish Immunology, 45(2): 656—665
