尿紧张素Ⅱ诱导人皮肤成纤维细胞增殖和α平滑肌肌动蛋白表达的机制研究
2018-01-09罗丽敏李军刘劲松朱红王郧莲刘菡
罗丽敏 李军 刘劲松 朱红 王郧莲 刘菡
442000湖北十堰,湖北医药学院附属东风医院皮肤科(罗丽敏、刘劲松、朱红、王郧莲、刘菡);湖北医药学院附属太和医院心内科(李军)
·论著·
尿紧张素Ⅱ诱导人皮肤成纤维细胞增殖和α平滑肌肌动蛋白表达的机制研究
罗丽敏 李军 刘劲松 朱红 王郧莲 刘菡
442000湖北十堰,湖北医药学院附属东风医院皮肤科(罗丽敏、刘劲松、朱红、王郧莲、刘菡);湖北医药学院附属太和医院心内科(李军)
目的探讨尿紧张素Ⅱ(UⅡ)对体外培养人正常皮肤成纤维细胞(NF)增殖和α平滑肌肌动蛋白(α⁃SMA)表达的生物学功能影响及调控机制。方法原代培养NF,采用反转录PCR和Western印迹法分别检测UⅡ及其受体mRNA和蛋白表达水平。采用CCK8法观察不同浓度(10⁃10、10⁃9、10⁃8、10⁃7、10⁃6mol/L)UⅡ作用0、6、12、24、48 h对NF增殖的影响,筛选出UⅡ最佳作用浓度为10⁃8mol/L,刺激时间为24 h。将NF分为5组:对照组(不含UII)、UⅡ组、UⅡ +尼卡地平(钙通道阻断剂,10⁃5mol/L)组、UⅡ +PD98059[丝裂原活化的蛋白激酶(MAPK)抑制剂,10⁃5mol/L]组和UⅡ + 环孢素[钙蛋白激酶(CaM PK)阻断剂,10⁃5mol/L]组,UⅡ浓度均为10⁃8mol/L,刺激NF 24 h后,采用CCK8法检测各组NF的增殖活性,以实时定量荧光PCR和Western印迹法分别检测各组α⁃SMA mRNA与蛋白的相对表达水平。结果NF表达UⅡ受体,不表达UⅡ。对照组、UⅡ组、UⅡ+尼卡地平组、UⅡ+PD98059组和UⅡ+环孢素组NF细胞增殖活性(A450值)分别为1.036±0.046、1.405±0.158、1.121±0.109、1.192±0.089和1.141±0.056,组间差异有统计学意义(F=9.587,P<0.01),UⅡ组高于对照组、UⅡ+尼卡地平组、UⅡ+PD98059组、UⅡ+环孢素组(q值分别为8.263、6.355、4.774、5.912,均P<0.05)。5组间NF细胞α⁃SMA mRNA与蛋白的相对表达量差异亦均有统计学意义(F值分别为6.351、7.045,均P<0.01),且UⅡ组α⁃SMA mRNA及蛋白表达量均高于另4组(均P<0.05)。结论UⅡ可能通过钙通道、MAPK和CaM PK通路诱导NF增殖和α⁃SMA的表达。
尿紧张素类;成纤维细胞;细胞增殖;肌动蛋白类;瘢痕;尿紧张素类受体
皮肤组织创伤愈合是体内各种细胞、细胞因子和细胞外基质相互作用的结果,成纤维细胞是皮肤创伤愈合的关键效应细胞,血管活性因子是内环境中影响皮肤病理生理变化的重要因素[1]。而成纤维细胞的增殖和α平滑肌肌动蛋白(α⁃SMA)的表达在皮肤组织的创伤愈合过程中发挥重要作用。尿紧张素Ⅱ(urotensinⅡ,UⅡ)是一种新型活性肽,UⅡ及其受体广泛分布于全身多种脏器,是目前已报道的体内最强的收缩血管活性肽[2]。我们发现,UⅡ能促进正常皮肤成纤维细胞(normal dermal fibroblast,NF)迁移及Ⅰ型胶原蛋白产生和分泌[3]。本研究中我们离体原代培养NF,验证NF是否表达UⅡ及其受体,并探讨UⅡ对NF增殖和α⁃SMA表达的影响及其调控机制。
材料与方法
一、材料
1.皮肤标本:标本取自湖北医药学院附属东风医院泌尿外科3~9岁男性儿童包皮环切术后切掉的正常包皮组织。本研究通过湖北医药学院附属东风医院医学伦理委员会批准,儿童监护人均签署知情同意书。
2.主要试剂:兔抗人UⅡ多克隆抗体、兔抗人UⅡ受体和兔抗人α⁃SMA单克隆抗体(英国Abcam公司),兔抗人3-磷酸甘油醛脱氢酶(GAPDH)单克隆抗体(上海康成生物工程有限公司),辣根过氧化物酶标记的羊抗兔IgG(武汉博士德生物工程有限公司),UⅡ[圣克鲁斯生物技术(上海)有限公司],尼卡地平、PD98059和环孢素(德国Calbiochen公司),胰酶细胞消化液、BCA蛋白浓度测定试剂盒和细胞计数试剂盒CCK8(上海碧云天生物技术有限公司),胎牛血清和高糖DMEM血清(美国Gibco公司),中性蛋白酶Ⅱ(美国Roche公司),总RNA提取试剂Trizol(美国Invitrogen公司),cDNA反转录试剂盒、反转录PCR(RT⁃PCR)试剂盒和实时荧光定量PCR试剂盒(美国Applied Biosystems公司)。
二、方法
1.细胞培养:原代培养方法见参考文献[4]。临床收集的正常包皮组织标本,用含青链霉素的磷酸盐缓冲溶液(PBS)冲洗,75%乙醇消毒,修剪去除皮下组织,将组织块剪成1~2 cm2,加入含0.25%的中性蛋白酶Ⅱ的溶液于4℃冰箱过夜,隔日取出组织块,去除表皮,将组织块剪成1 mm3大小平铺于培养瓶中,37℃、5%CO2培养箱培养4 h后加入含10%胎牛血清的DMEM培养基继续培养,72 h后换液,以后隔日换液,待细胞贴壁生长到80%融合,用0.25%胰酶消化传代,取3~5代原代培养的NF进一步实验。
2.反转录PCR检测UⅡ和UⅡ受体mRNA表达和实时定量荧光PCR检测α⁃SMA mRNA表达:NF总RNA提取和mRNA反转录参照试剂公司说明书进行。反转录PCR反应条件:95℃预变性5 min;94℃变性45 s,60℃退火45 s,72℃延伸45 s,重复35个循环;最后72℃延伸10 min,产物用含溴化乙锭的1%琼脂糖凝胶电泳检测mRNA表达量。实时定量荧光PCR反应条件:95℃预变性10 min;95℃变性15 s,60℃退火1 min,重复40个循环,根据荧光信号绘制基因的扩增曲线和熔解曲线,用2⁃ΔΔCt的方法计算UⅡ、UⅡ受体、α⁃SMA的mRNA相对表达量。以β肌动蛋白作内参。UⅡ、UⅡ受体、α⁃SMA和β肌动蛋白引物由生工生物工程(上海)股份有限公司合成(表1)。
3.Western印迹法检测α⁃SMA蛋白表达:裂解培养的NF后以BCA法测定蛋白浓度,每孔上样20 μg蛋白,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),湿法电转移至聚偏二氟乙烯膜上,5%脱脂奶粉室温封闭1 h,加入一抗:兔抗人UⅡ多克隆抗体(稀释比例1∶500)、兔抗人UⅡ受体单克隆抗体(1∶1 000)、兔抗人α⁃SMA单克隆抗体(1∶1 000)或兔抗人GAPDH单克隆抗体(阳性参照,1∶2 000),4℃冰箱孵育过夜,加入二抗即辣根过氧化物酶标记的羊抗兔IgG(1∶2 000),室温孵育2 h,增敏化学发光法显影。实验结果予Image Lab软件分析,以目的条带灰度值与内参条带灰度值的比值表示目的蛋白的相对表达水平。
4.CCK8法检测NF的细胞活性:取处于对数生长期、生长状态良好的NF,用DMEM培养基调整细胞密度到2 × 104个/ml,接种于96孔板(100 μl/孔),设4个复孔,同时设空白对照组,37℃、5%CO2培养箱培养过夜,使NF贴壁;次日倒掉培养液,加入含不同干预药物的DMEM培养基孵育24 h;隔日在每孔中加入10 μl WST⁃8溶液,37 ℃、5%CO2培养箱中继续孵育4 h,取出96孔板,在酶标仪中检测各孔450 nm波长处吸光度(A450值)。

表1 反转录PCR和实时定量荧光PCR引物序列
三、鉴定UⅡ和UⅡ受体在NF中的表达
采用前述方法,取3~5代原代培养的NF,提取RNA及蛋白后,分别采用反转录PCR和Western印迹法鉴定UⅡ和UⅡ受体在NF中的表达。
四、检测UⅡ浓度与作用时间对NF增殖的影响
以UⅡ浓度为 0(浓度对照组)、10⁃10、10⁃9、10⁃8、10⁃7、10⁃6mol/L的无血清DMEM培养液孵育NF 细胞24 h,采用CCK8法检测NF细胞的增殖活性,用酶标仪读取A450值,筛选出UⅡ促进NF细胞增殖的最佳浓度用于后续的实验。NF中加入外源性UⅡ(浓度为10⁃8mol/L),予无血清DMEM培养液孵育0(时间对照组)、6、12、24、48 h后,CCK8法检测NF细胞的增殖活性,用酶标仪读取A450值,筛选出UII促进NF细胞增殖的最佳作用时间用于后续实验。
五、检测通路阻断剂对UⅡ促进NF增殖与α⁃SMA表达的影响
将NF接种于细胞培养板,待细胞贴壁生长并达到80%融合时,用含1%BSA的DMEM培养液同步培养NF细胞24 h,然后同时加入不同的药物进行干预,具体分组如下:对照组(不含UII)、10⁃8mol/L UⅡ组、10⁃8mol/L UⅡ+10⁃5mol/L尼卡地平(钙通道阻断剂)组、10⁃8mol/L UⅡ+10⁃5mol/L PD98059[丝裂原活化的蛋白激酶(MAPK)抑制剂]组和10⁃8mol/L UⅡ+10⁃5mol/L环孢素[钙蛋白激酶(CaM PK)阻断剂]组。药物刺激NF 24 h后采用CCK8法检测各组NF细胞的增殖活性,用酶标仪读取A450值;采用实时荧光定量PCR和Western印迹法分别检测α⁃SMA mRNA和蛋白的表达水平。
六、统计方法
用GraphPad Prism 5.0软件进行统计分析,计量资料用±s表示。所有实验重复最少3次,结果采用方差齐性检验。多组间比较采用单因素方差分析,组间多重比较采用LSD检验。P<0.05表示差异有统计学意义。
结 果
一、UⅡ和UⅡ受体在NF中的表达
NF在基因和蛋白水平均不表达UⅡ,但表达UⅡ受体。见图1、2。
二、不同浓度UⅡ及作用时间对NF增殖的影响
0(对照组)、10⁃10、10⁃9、10⁃8、10⁃7、10⁃6mol/L UⅡ组间NF的增殖活性(A值)差异有统计学意义(F=6.810,P< 0.01),10⁃9、10⁃8、10⁃7、10⁃6mol/L 组(1.248 ±0.082、1.359 ± 0.105、1.305 ± 0.098、1.258 ± 0.044)高于对照组(1.027± 0.158)(q值分别为4.842、7.274、6.091、5.074,均P< 0.05);而10⁃10mol/L UⅡ组与对照组比较,差异无统计学意义。以10⁃8mol/L时的增殖活性最高,将该浓度用于后续实验。
10⁃8mol/L UⅡ刺激NF 0(对照组)、6、12、24、48 h后细胞增殖活性(A值)组间差异有统计学意义(F=7.059,P< 0.01),12、24、48 h时(1.201 ± 0.053、1.268±0.093、1.206±0.071)高于对照组(1.033±0.090)(q值分别为4.956、6.918、5.092,均P< 0.05);而6 h UⅡ组与对照组比较,差异无统计学意义;以24 h时最高,用于后续实验。
三、不同信号通路阻断剂对UⅡ促进NF增殖及α⁃SMA表达的影响
对照组、UⅡ组、UⅡ+尼卡地平组、UⅡ+PD98059组、UⅡ+环孢素组间NF细胞增殖活性(A值)差异有统计学意义(P<0.01),UⅡ组高于对照组、UⅡ+尼卡地平组、UⅡ+PD98059组、UⅡ+环孢素组(q值分别为 8.263、6.355、4.774、5.912,均P< 0.05)。见表2。α⁃SMA mRNA、蛋白相对表达量组间差异均有统计学意义(P<0.01)。UⅡ组α⁃SMA mRNA表达量高于对照组、UⅡ+尼卡地平组、UⅡ+PD98059组、UⅡ+环孢素组(q值分别为6.339、5.583、4.972、5.145,均P< 0.05);α⁃SMA蛋白表达量亦高于另4组(q值分别为6.511、4.798、5.496、6.190,均P< 0.05)。见表2、图3。
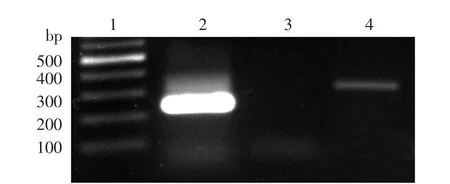
图1 反转录PCR鉴定尿紧张素Ⅱ及其受体mRNA在成纤维细胞中的表达 1:标准参照物,2:β肌动蛋白(285 bp),3:尿紧张素Ⅱ(141 bp),4:尿紧张素Ⅱ受体(319 bp)
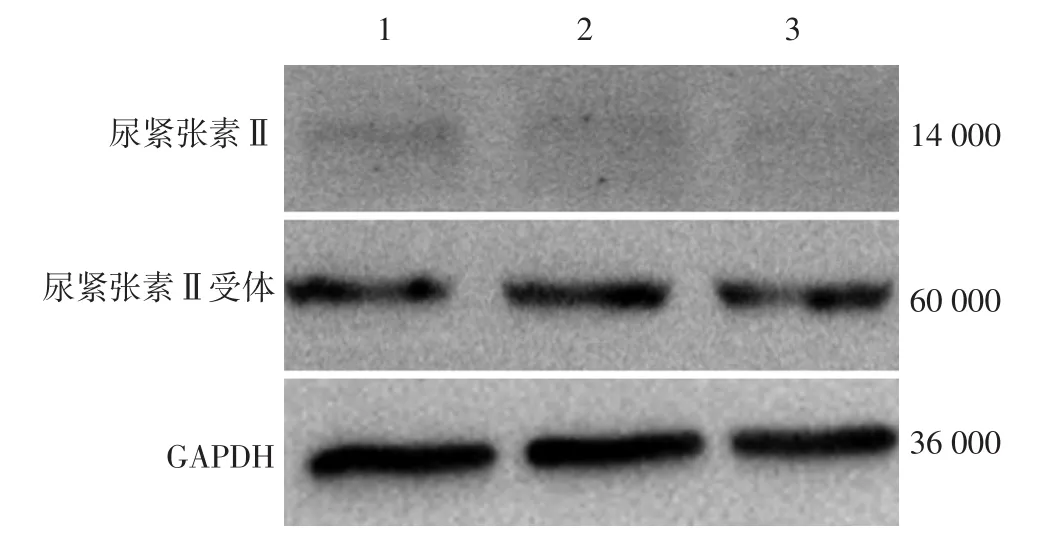
图2 Western印迹鉴定尿紧张素Ⅱ及其受体在成纤维细胞中的表达 1、2、3为成纤维细胞蛋白样本序号
表2 不同信号通路阻断剂对尿紧张素Ⅱ(UⅡ)促进成纤维细胞增殖及α平滑肌肌动蛋白(α⁃SMA)表达的影响(±s)
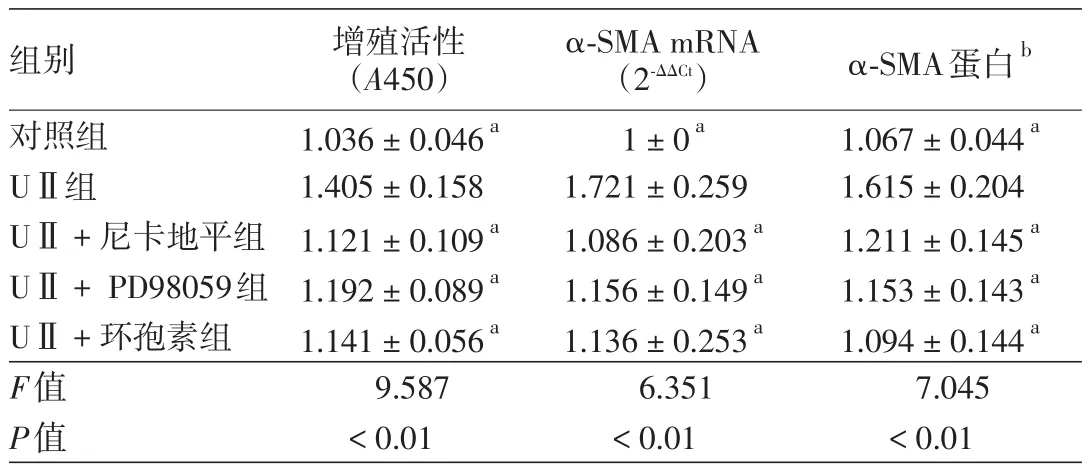
表2 不同信号通路阻断剂对尿紧张素Ⅱ(UⅡ)促进成纤维细胞增殖及α平滑肌肌动蛋白(α⁃SMA)表达的影响(±s)
注:n=5。a与UⅡ组相比差异有统计学意义,P<0.05;b以目的条带与内参条带灰度值的比值表示
增殖活性(A450)1.036±0.046a 1.405±0.158 1.121±0.109a 1.192±0.089a 1.141±0.056a 9.587<0.01组别对照组UⅡ组UⅡ+尼卡地平组UⅡ+PD98059组UⅡ+环孢素组F值P值α⁃SMA mRNA(2⁃ΔΔCt)1±0a 1.721±0.259 1.086±0.203a 1.156±0.149a 1.136±0.253a 6.351<0.01 α⁃SMA蛋白b 1.067±0.044a 1.615±0.204 1.211±0.145a 1.153±0.143a 1.094±0.144a 7.045<0.01
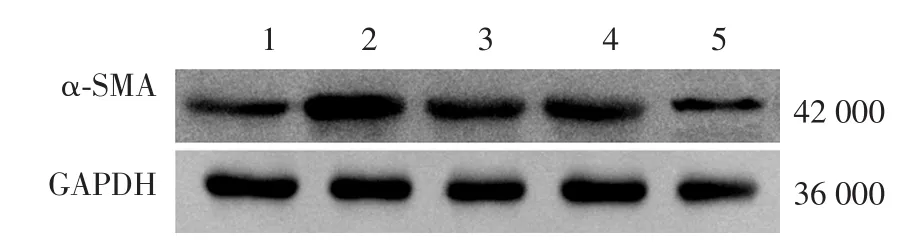
图3 不同信号通路阻断剂对尿紧张素Ⅱ(UⅡ)促进成纤维细胞α平滑肌肌动蛋白(α⁃SMA)表达的影响 1~5:分别为对照组、UⅡ组、UⅡ+尼卡地平组、UⅡ+PD98059组、UⅡ+环孢素组
讨 论
皮肤创伤后,NF的增殖和迁移是创面愈合的关键因素[1]。α⁃SMA是成纤维细胞向肌成纤维细胞发生表型转化的重要标志,成纤维细胞持续向肌成纤维细胞转化,使创面收缩,加速创口愈合。一般情况下,肌成纤维细胞很快消失,然而病理状态下肌成纤维细胞的持续存在会导致病理性瘢痕和皮肤组织纤维化[5⁃6]。
UⅡ首先由Pearson等[7]于1980年从硬骨鱼尾垂体分离出来,是一种类似于生长抑素的环状结构血管活性肽。人源UⅡ于1998年由Coulouarn等[8]发现,是一种强烈的血管收缩因子,其基因位于染色体1p36 ~ 1p32。1999年Ames等[9]首次证实,人体内存在一种孤立的G蛋白偶联受体GPR14,是UⅡ的特异性受体,具有7个跨膜段,后来将其命名为UⅡ受体,又称为孤儿受体。UⅡ和UⅡ受体分布于体内多种组织和器官,广泛表达于心血管系统、肺脏、中枢神经、肾脏和代谢系统等脏器[10]。UⅡ可能参与组织和器官纤维化的发生,Remst等[11]研究认为,UⅡ可促进骨性关节炎滑膜纤维化的进程。Pehlivan等[12]认为,血浆UⅡ水平升高可能与硬皮病纤维化有关,而应用UⅡ拮抗剂帕洛舒仑(palosuran)后能减缓硬皮病病情的进展[13]。因此,UⅡ和UⅡ受体可能成为皮肤组织纤维化治疗干预的一个潜在靶点。
我们在前期工作中发现,UⅡ能促进NF产生和分泌Ⅰ型胶原蛋白,同时发现UⅡ能促进NF迁移,上述作用能不同程度地被Ca2+、CaM PK及MAPK阻断剂抑制,提示UⅡ可以诱导NF迁移和胶原分泌,并且与Ca2+、CaM PK及MAPK等通路相关[3]。但上述实验仅从旁分泌的角度对UⅡ的功能进行了初步探讨,未能证实NF上是否存在UⅡ及其受体。我们发现原代培养的NF不表达UⅡ基因和蛋白,而UⅡ受体则均有表达,提示UⅡ不能由NF合成,其生物学效应不是由自分泌,而是通过旁分泌的方式来起作用。CCK8增殖实验进一步证实,UⅡ能促进NF增殖,在UⅡ为10⁃8mol/L刺激24 h时达到最大效应。我们同时发现,UⅡ也能促进NF中α⁃SMA mRNA和蛋白表达增加,促进向肌成纤维细胞表型转化。加入钙通道阻断剂尼卡地平、CaM PK阻断剂环孢素和MAPK阻断剂PD98059后,UⅡ促NF增殖、α⁃SMA表达的作用被不同程度抑制,提示UⅡ促NF增殖和α⁃SMA表达的作用与Ca2+、CaM PK和MAPK通路相关。
本研究在前期工作的基础上进一步证实NF上存在UⅡ受体,UⅡ主要通过旁分泌方式来实现其对NF增殖和α⁃SMA表达的调控。由于血管活性因子是皮肤维持内环境稳定的重要因素,而UⅡ在皮肤新陈代谢和创伤修复过程中具有重要作用,所以UⅡ对NF增殖和α⁃SMA表达的调控机制研究可能为皮肤创伤愈合、病理性瘢痕及硬皮病等疾病的防治开拓新的途径。
[1]Tracy LE,Minasian RA,Caterson EJ.Extracellular matrix and dermal fibroblast function in the healing wound[J].Adv Wound Care(New Rochelle),2016,5(3):119 ⁃136.DOI:10.1089/wound.2014.0561.
[2]Vaudry H,Leprince J,Chatenet D,et al.International Union of Basic and Clinical Pharmacology.XCⅡ.UrotensinⅡ,urotensinⅡ⁃related peptide,and their receptor:from structure to function[J].Pharmacol Rev,2015,67(1):214 ⁃258.DOI:10.1124/pr.114.009480.
[3]罗丽敏,李军,刘菡,等.尾加压素Ⅱ对皮肤成纤维细胞表达Ⅰ型胶原蛋白的影响[J].中华皮肤科杂志,2014,47(8):566⁃569.DOI:10.3760/cma.j.issn.0412⁃4030.2014.08.010.
[4]王林林,杜为,张健,等.优化贴壁法人皮肤成纤维细胞的原代培养[J].南京医科大学学报(自然科学版),2014,34(1):124⁃126.DOI:10.7655/NYDXBNS20140130.
[5]Shi HX,Lin C,Lin BB,et al.The anti⁃scar effects of basic fibroblast growth factor on the wound repairin vitroandin vivo[J/OL].PLoS One,2013,8(4):e59966[2016⁃10⁃13].https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3615060/.DOI:10.1371/journal.pone.0059966.
[6]Hinz B.Myofibroblasts[J].Exp Eye Res,2016,142:56⁃70.DOI:10.1016/j.exer.2015.07.009.
[7]Pearson D,Shively JE,Clark BR,et al.Urotensin Ⅱ:a somatostatin⁃like peptide in the caudal neurosecretory system of fishes[J].Proc Natl Acad Sci U S A,1980,77(8):5021⁃5024.
[8]Coulouarn Y,Lihrmann I,Jegou S,et al.Cloning of the cDNA encoding the urotensinⅡprecursor in frog and human reveals intense expression of the urotensinⅡgene in motoneurons of the spinal cord[J].Proc Natl Acad Sci U S A,1998,95(26):15803⁃15808.DOI:10.1073/pnas.95.26.15803.
[9]Ames RS,Sarau HM,Chambers JK,et al.Human urotensin⁃Ⅱ is a potent vasoconstrictor and agonist for the orphan receptor GPR14[J].Nature,1999,401(6750):282⁃286.DOI:10.1038/45809.
[10]Ross B,McKendy K,Giaid A.Role of urotensinⅡ in health and disease[J].Am J Physiol Regul Integr Comp Physiol,2010,298(5):R1156⁃1172.DOI:10.1152/ajpregu.00706.2009.
[11]Remst DF,Blaney DEN,van der Kraan PM.Unravelling osteoarthritis⁃related synovial fibrosis:a step closer to solving joint stiffness[J].Rheumatology(Oxford),2015,54(11):1954⁃1963.DOI:10.1093/rheumatology/kev228.
[12]Pehlivan Y,Onat AM,Comez G,et al.Urotensin⁃Ⅱ in systemic sclerosis:a new peptide in pathogenesis[J].Clin Rheumatol,2011,30(6):837⁃842.DOI:10.1007/s10067⁃011⁃1688⁃3.
[13]Demir T,Turkbeyler I,Kaplan DS,et al.Effectiveness of palo⁃suran in bleomycin ⁃induced experimental scleroderma[J].Inflammation,2013,36(1):75⁃79.DOI:10.1007/s10753⁃012⁃9521⁃y.
Mechanisms underlying the urotensin Ⅱ ⁃induced proliferation of and α ⁃smooth muscle actin expressioninhumandermalfibroblasts
LuoLimin,LiJun,LiuJinsong,ZhuHong,WangYunlian,LiuHan Department of Dermatology,Dongfeng General Hospital,Hubei University of Medicine,Shiyan 442000,Hubei,China(Luo LM,Liu JS,Zhu H,Wang YL,Liu H);Department of Cardiology,Taihe Hospital,Hubei University of Medicine,Shiyan 442000,Hubei,China(Li J)
Liu Han,Email:liuhansy@medmail.com.cn
ObjectiveTo evaluate the effects of urotensin Ⅱ on cell proliferation of and α⁃smooth muscle actin(α ⁃SMA)expression in normal human dermal fibroblasts(NFs),and to explore their regulatory mechanisms.MethodsNFs were isolated from foreskin tissues and subjected to primary culturein vitro.Reverse transcription PCR and Western blot analysis were performed to measure the mRNA and protein expression of urotensin Ⅱ and its receptor,respectively.Cell counting kit⁃8(CCK⁃8)assay was conducted to estimate the proliferation of NFs,which were treated with urotensinⅡat different concentrations of 0,10⁃10,10⁃9,10⁃8,10⁃7and 10⁃6mol/L for 0,6,12,24 and 48 hours separately,and then the optimal concentration and duration of urotensin Ⅱ exposure were selected to be 10⁃8mol/L and 24 hours respectively.Some cultured NFs were divided into 5 groups:control group receiving no treatment,UⅡgroup treated with 10⁃8mol/L urotensin Ⅱ,UⅡ+nicardipine group treated with 10⁃8mol/L urotensin Ⅱ and the calcium channel blocker nicardipine at the concentration of 10⁃5mol/L,UⅡ+PD98059 group treated with 10⁃8mol/L urotensin Ⅱ and the mitogen activated protein kinase(MAPK)inhibitor PD98059 at the concen⁃tration of 10⁃5mol/L,and UⅡ+cyclosporine group treated with 10⁃8mol/L urotensin Ⅱ and the calcium⁃dependent protein kinase(CaM PK)inhibitor cyclosporine at the concentration of 10⁃5mol/L.After 24⁃hour treatment,CCK⁃8 assay was conducted to evaluate the proliferation of NFs in the above groups,real⁃time fluorescence⁃based quantitative PCR and Western blot analysis were performed to determine the mRNA and protein expression of α⁃SMA respectively.ResultsUrotensin Ⅱ receptor was expressed in NFs,but urotensinⅡwas not.The proliferative activity of NFs significantly differed among the control group,UⅡgroup,UⅡ+nicardipine group,UⅡ+PD98059 group and UⅡ+cyclosporine group(the mean absorbance value at 405 nm:1.036±0.046,1.405±0.158,1.121±0.109,1.192±0.089 and 1.141±0.056,respectively;F=9.587,P<0.01),and the UⅡ group showed significantly higher proliferative activity of NFs compared with the control group,UⅡ+nicardipine group,UⅡ+PD98059 group and UⅡ+cyclosporine group(q=8.263,6.355,4.774 and 5.912,respectively,allP< 0.05).There were significant differences in the mRNA and protein expression of α⁃SMA among the 5 groups(F=6.351,7.045,bothP<0.01),and the mRNA and protein expression of α⁃SMA was significantly higher in the UⅡ group than in the other 4 groups(allP< 0.05).ConclusionUrotensinⅡ may induce the proliferation of and α⁃SMA expression in NFs through calcium channels,MAPK and CaM PK pathways.
Urotensins;Fibroblasts;Cell proliferation;Actins;Cicatrix;Receptor,urotensins
Fund programs:Science and Technology R&D Program of Shiyan City(15Y54);Science and Technology Special Program of Taihe Hospital in Shiyan City(2014PY03)
刘菡,Email:liuhansy@medmail.com.cn
10.3760/cma.j.issn.0412⁃4030.2017.12.008
十堰市科学技术研究与开发项目(15Y54);十堰市太和医院科研专项计划(2014PY03)
2016⁃12⁃12)
朱思维 颜艳)
