重楼皂苷Ⅰ对人黑素瘤A375细胞增殖和凋亡的影响
2018-01-09龙剑文罗晶尹绪文卫静贺琪李恒石全皮先明
龙剑文 罗晶 尹绪文 卫静 贺琪 李恒 石全 皮先明
430061武汉,湖北中医药大学第一临床学院皮肤科[龙剑文(现在湖北省中医院皮肤科,430061武汉)];湖北省中医院皮肤科(罗晶、尹绪文、卫静、贺琪、李恒、石全、皮先明)
·论著·
重楼皂苷Ⅰ对人黑素瘤A375细胞增殖和凋亡的影响
龙剑文 罗晶 尹绪文 卫静 贺琪 李恒 石全 皮先明
430061武汉,湖北中医药大学第一临床学院皮肤科[龙剑文(现在湖北省中医院皮肤科,430061武汉)];湖北省中医院皮肤科(罗晶、尹绪文、卫静、贺琪、李恒、石全、皮先明)
目的研究重楼皂苷Ⅰ对人黑素瘤A375细胞增殖和凋亡的影响及相关机制。方法采用CCK8法测定0(对照组)、1.5、3.0、6.0 mg/L重楼皂苷Ⅰ对正常人黑素细胞和A375细胞增殖的影响;Hoechst33258荧光染色法观察细胞凋亡形态;流式细胞仪检测A375细胞周期变化及细胞凋亡水平;荧光染料(DCFH⁃DA)测定A375细胞内活性氧的变化;罗丹明123染色测定线粒体膜电位变化;利用分光光度法检测重楼皂苷Ⅰ处理后的A375细胞内ATP和上清液中乳酸、葡萄糖含量;Western印迹法检测A375细胞内Bcl⁃2、Bcl⁃2相关X蛋白(Bax)、活化的半胱氨酸天冬氨酸蛋白水解酶3、细胞周期蛋白D1、丙酮酸激酶同工酶2(PKM2)表达。多组均数比较采用单因素方差分析,组间多重比较采用SNK⁃q检验。结果在工作浓度内重楼皂苷Ⅰ对正常人黑素细胞增殖无明显影响,但能明显抑制A375细胞的增殖(P<0.01);荧光显微镜下发现,重楼皂苷Ⅰ处理后的A375细胞出现明显的凋亡形态。0(对照组)、1.5、3.0、6.0 mg/L重楼皂苷Ⅰ分别处理A375细胞后,随重楼皂苷Ⅰ浓度增加,细胞凋亡率(分别为4.25%±1.27%、10.03%±1.49%、36.62%±1.97%、44.11%±2.47%)逐渐升高(F=665.7,P<0.01),G0/G1期细胞比例(分别为54.13% ±2.57%、67.35% ±3.79%、74.39% ±3.29%、82.29%±3.99%)亦渐增多(F=71.81,P<0.01);细胞内活性氧呈明显上升趋势,细胞线粒体膜电位呈明显下降趋势(P<0.01);细胞内ATP含量下降(P<0.01),培养液中乳酸含量下降,葡萄糖含量上升(P< 0.01);细胞Bax、cleaved⁃caspase⁃3蛋白表达增多,但Cyclin D1、Bcl⁃2和PKM2蛋白表达下降(P<0.01)。结论重楼皂苷Ⅰ可能通过激活细胞内活性氧的产生,引起线粒体膜电位下降,诱导A375细胞凋亡,并通过抑制PKM2、细胞周期蛋白D1表达,使细胞阻滞于G0/G1期。
黑素瘤;细胞系,肿瘤;细胞凋亡;活性氧;细胞增殖;重楼皂苷Ⅰ
肿瘤细胞在代谢上表现出较强的糖酵解活性,通过消耗大量葡萄糖并产生乳酸来满足生长和增殖的需求,这种现象被称为Warburg效应[1]。丙酮酸激酶是糖酵解过程中的重要代谢酶之一,研究表明,丙酮酸激酶同工酶2(PKM2)的高表达与黑素瘤患者的预后负相关[2]。重楼是中医治疗肿瘤的常用药物之一,其有效成分重楼皂苷Ⅰ对多种细胞增殖具有抑制作用[3⁃5],但对黑素瘤细胞作用如何目前尚不清楚。本研究观察重楼皂苷Ⅰ对黑素瘤A375细胞增殖和凋亡的影响,以及对Bcl⁃2、Bcl⁃2相关X蛋白(Bax)、活化的半胱氨酸天冬氨酸蛋白酶3(cleaved⁃caspase⁃3)、细胞周期蛋白D1(cyclin D1)、PKM2蛋白表达的影响。
材料与方法
一、材料
重楼皂苷Ⅰ(中国药品生物制品检定所,批号111590⁃201509)用二甲亚砜(DMSO,沈阳化学试剂厂)溶解,用Dulbecco改良Eagle培养基(DMEM)稀释,DMSO终体积分数≤0.1%;人黑素瘤A375细胞(武汉大学中国典型培养物保藏中心);100 U/L青霉素和100 μg/L链霉素、细胞计数试剂盒CCK8(武汉博士德生物公司);胰蛋白酶、乳酸试剂盒、Hoechst 33258染色剂、Propidium Iodide染色剂、罗丹明123染色剂(美国Sigma公司);胎牛血清、DMEM细胞培养基、M254黑素细胞培养基、人黑素细胞生长添加成分(HMGS)添加剂(美国Gibco公司);膜联蛋白V/碘化丙锭(Annexin⁃V/PI)凋亡检测试剂盒(美国BD公司);活性氧簇(ROS)探针 DCFH⁃DA(美国Invitrogen公司);葡萄糖试剂盒、ATP试剂盒(英国Abcam公司);辣根过氧化物酶标记的β肌动蛋白抗体(上海兴悠生物科技有限公司);PKM2、Cyclin D1、Bax、Bcl⁃2、cleaved⁃caspase⁃3 抗体(美国 Cell signal technology公司);增强化学发光试剂盒(瑞典Amersham Biosciences公司);流式细胞仪(美国BD公司)。
二、方法
1.细胞培养:取A375细胞,用含10%胎牛血清、青霉素(100 U/ml)及链霉素(100 mg/L)的DMEM培养液,于37℃、5%CO2下培养,胰酶消化传代,取对数生长期细胞试验。根据文献[6]自健康男性包皮中提取黑素细胞(经湖北省中医院医学伦理委员会批准,受试者均签署知情同意书),在M254培养基(含HMGS)中培养,钙离子结合蛋白S100免疫组化染色证实纯度超过95%。
2.重楼皂苷Ⅰ对正常黑素细胞增殖的影响:将对数生长期正常人黑素细胞消化后,按5×104/孔接种于96孔板中,培养24 h,分为只含有培养基和CCK8的空白组以及0(对照组)、1.5、3.0、6.0、9.0、12.0 mg/L重楼皂苷Ⅰ组,每组6孔,培养48 h后,加入CCK8 10 μl,待培养液显色后,用酶标仪测各孔450 nm波长处吸光度(A值),以细胞存活率表示细胞的增殖程度。细胞存活率(%)=[(A1-A3)/(A2-A3)]×100%,A1~A3分别为试验组、对照组、空白组A值。
3.重楼皂苷Ⅰ对A375细胞增殖的影响:将对数生长期A375细胞消化后,于96孔板中培养24 h,分为0(对照组)、1.5、3.0、6.0 mg/L重楼皂苷Ⅰ组,各组培养48 h后,加入CCK8 10 μl,待培养液显色,用酶标仪测各孔450 nm波长处A值。
4.Hoechst 33258荧光法观察细胞凋亡形态:取对数生长期细胞消化,制备活细胞悬液,按每孔5×104/L接种于预先置入玻璃盖玻片的6孔培养板中,每孔加细胞悬液2 ml,培养24 h,试验分组同方法3,孵育48 h后,吸尽培养液,磷酸盐缓冲液(PBS)洗2遍,每孔加入4%甲醛溶液固定,PBS洗涤细胞,Hoechst 33258染色,于荧光显微镜下观察细胞形态。
5.流式细胞仪检测细胞凋亡率:取对数生长期A375细胞,按5×104/L置于细胞培养瓶内,每瓶加细胞悬液2 ml,培养24 h,试验分组同方法3,孵育48 h,收集细胞,1 000 r/min离心(半径10 cm),弃上清液,PBS洗涤,收集细胞,在冰浴中避光进行如下操作:用试剂盒中结合缓冲液悬浮细胞,调节细胞为5× 104/L,加入Annexin⁃FITC和PI染色液,混匀后孵育15 min,于1 h内用流式细胞仪检测细胞凋亡,凋亡细胞包括早期凋亡和晚期凋亡细胞。
6.流式细胞仪检测A375细胞周期变化:取对数生长期细胞,调整细胞浓度至5.0×104/L,接种于6孔板,培养24 h,试验分组同方法3,培养48 h,消化,1 000 r/min离心(半径10 cm),弃上清液,预冷PBS重悬细胞,离心洗涤3次,用体积分数为70%的乙醇4℃固定过夜。测定前用PBS洗去乙醇,加入含有核糖核酸酶RNase的0.05%PI染色液,避光染色30 min后,上流式细胞仪分析细胞DNA含量的变化。
7.重楼皂苷Ⅰ对A375细胞内ROS和线粒体膜电位水平的影响[7]:取对数生长期A375细胞,按5×104/L置于细胞培养瓶内,每瓶加细胞悬液2 ml,培养24 h,试验分组同方法3,孵育48 h,收集细胞,洗涤,消化,收集,重悬细胞,各组部分细胞加入ROS探针 DCFH⁃DA 10 μmol/L,孵育60 min,PBS洗涤3次,消化后收集细胞,重悬,流式细胞仪检测荧光强度,进而测定细胞内ROS水平变化。部分细胞加入罗丹明123 1 mmol/L,孵育30 min,重悬细胞,上流式细胞仪检测荧光强度,观察线粒体膜电位变化。
8.重楼皂苷Ⅰ对A375细胞ATP含量及培养上清液乳酸和葡萄糖含量的影响:取对数期细胞消化制成细胞悬液,按2×105/L置于细胞培养瓶内,每瓶加细胞悬液2 ml,培养24 h,试验分组同方法3,孵育48 h。收集细胞,根据ATP测试盒说明书测定ATP含量;收集上清液,根据乳酸和葡萄糖测试盒说明书测定上清液乳酸和葡萄糖含量。
9.Western 印迹法检测 A375细胞 Bax、Bcl⁃2、cleaved⁃caspase⁃3、Cyclin D1、PKM2蛋白表达:取对数生长期A375细胞,培养24 h,试验分组同方法3,孵育48 h,收集细胞,提取总蛋白,用二喹啉甲酸法蛋白定量,上样,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳后,转膜,PBS洗膜,5%脱脂牛奶封闭l h;PBS洗膜后加入一抗,4℃过夜;PBS洗膜,加入辣根过氧化物酶标记的二抗孵育0.5 h;洗膜,用增强化学发光试剂盒检测。结果扫描后,用Quantity one图像分析软件分析,用各目的蛋白灰度值与β肌动蛋白灰度值的比值代表各检测蛋白的相对表达量。
三、统计学方法
采用SPSS13.0软件分析。数据以±s表示,若符合正态分布及方差齐性,多组间均数比较采用单因素方差分析,组间两两比较采用SNK⁃q检验。P<0.05为差异有统计学意义。
结 果
一、重楼皂苷Ⅰ对正常黑素细胞增殖的影响
对照组黑素细胞存活率为99.22%±1.83%,1.5、3.0、6.0、9.0、12.0 mg/L 重楼皂苷Ⅰ组分别为97.36%±2.56%、97.19%±1.23%、97.02%±1.40%、89.86%±2.58%、80.86%±2.66%,6组存活率差异有统计学意义(F=67.98,P< 0.01);1.5、3.0、6.0 mg/L重楼皂苷Ⅰ组与对照组比较,差异无统计学意义(q值分别为1.14、1.29、1.43,均P>0.05),9.0、12.0mg/L重楼皂苷Ⅰ组低于对照组(q值分别为7.44、15.00,P<0.05)。因此以下试验选定重楼皂苷Ⅰ的工作浓度为1.5、3.0、6.0 mg/L。
二、重楼皂苷Ⅰ对A375细胞增殖的影响
0(对照组)与1.5、3.0、6.0 mg/L重楼皂苷Ⅰ组A375细胞存活率(表1)差异有统计学意义(F=45.73,P<0.01),细胞存活率随重楼皂苷Ⅰ浓度的增加而降低,相邻两组间差异均有统计学意义(q值分别为8.51、7.53、4.48,P< 0.05)。
三、重楼皂苷Ⅰ对A375细胞凋亡率的影响
经Hoechst染色,对照组A375细胞大而饱满,呈均匀蓝色荧光。重楼皂苷Ⅰ处理组细胞核可见浓染致密的颗粒荧光,细胞缩小;随重楼皂苷Ⅰ浓度增加,细胞出现典型的凋亡形态,高倍镜下可观察到细胞变小,胞核皱缩、碎裂,染色质浓缩,聚集在核膜边缘,形成染色质边集。见图1。
AnnexinV/PI双染法结果显示,0(对照组)与1.5、3.0、6.0 mg/L重楼皂苷Ⅰ组A375细胞凋亡率差异有统计学意义(F=665.7,P<0.01),细胞凋亡率随重楼皂苷Ⅰ浓度增加而升高,相邻两组间差异均有统计学意义(q值分别为 7.62、35.06、9.87,P<0.05)。见图2,表1。
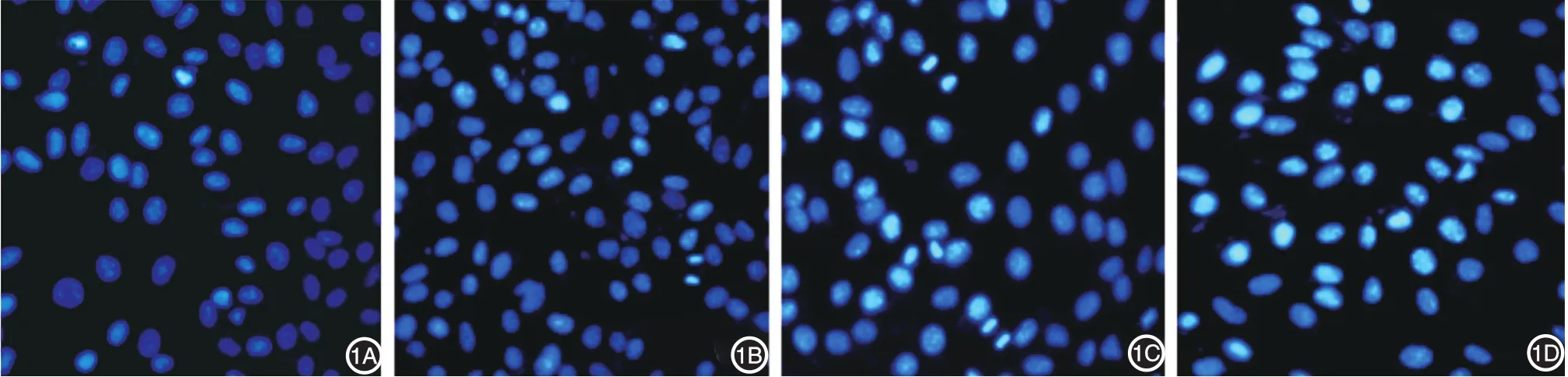
图1 荧光显微镜下观察重楼皂苷Ⅰ处理后各组A375细胞凋亡形态变化(Hoechst 33258染色×200) 1A~1D:分别为0、1.5、3.0、6.0 mg/L重楼皂苷Ⅰ组。随重楼皂苷Ⅰ浓度增加,细胞出现典型的凋亡形态,高倍镜下可观察到细胞变小,胞核皱缩、碎裂,染色质浓缩,聚集在核膜边缘,形成染色质边集
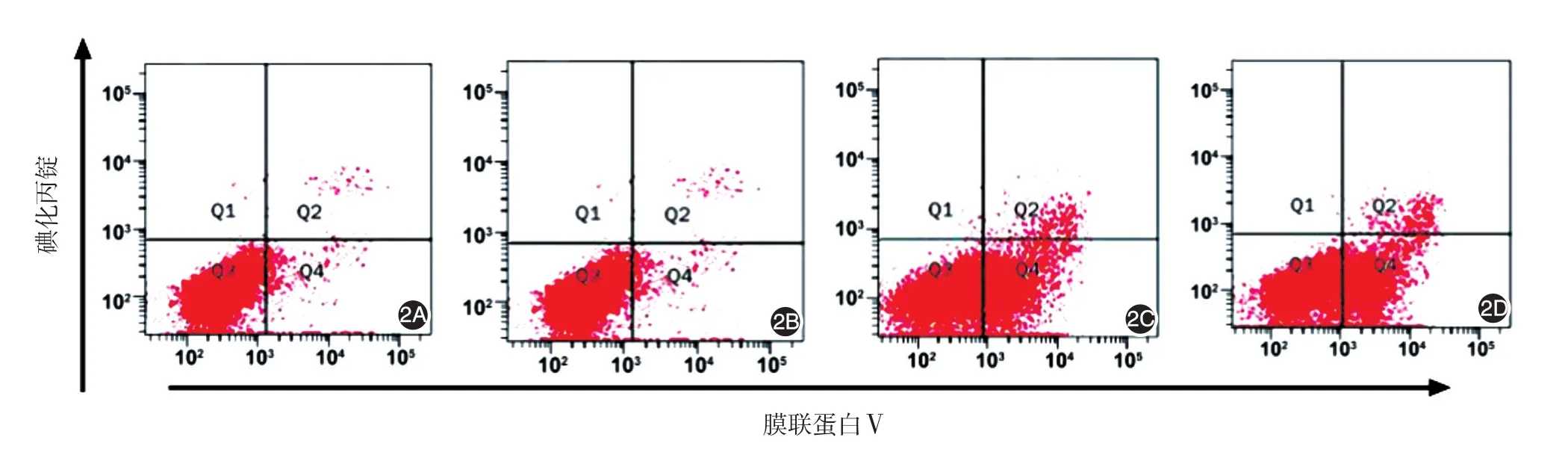
图2 重楼皂苷Ⅰ对A375细胞凋亡率的影响 2A~2D:分别为0、1.5、3.0、6.0 mg/L重楼皂苷Ⅰ组;Q1代表坏死细胞,Q2代表晚期凋亡细胞,Q3代表正常细胞,Q4代表早期凋亡细胞
表1 不同浓度重楼皂苷Ⅰ对A375细胞的影响(±s)
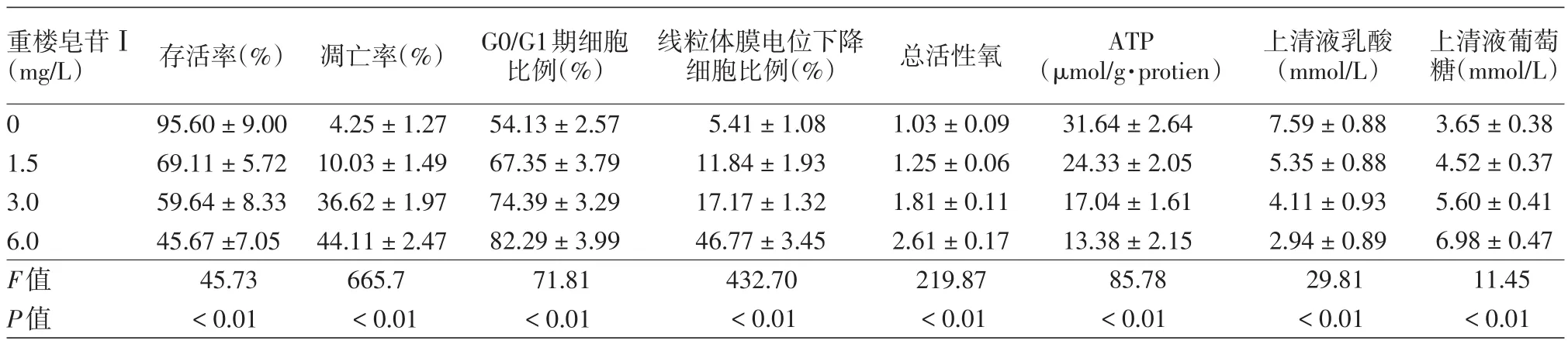
表1 不同浓度重楼皂苷Ⅰ对A375细胞的影响(±s)
注:n=6
线粒体膜电位下降细胞比例(%)5.41±1.08 11.84±1.93 17.17±1.32 46.77±3.45 432.70<0.01重楼皂苷Ⅰ(mg/L)0 1.5 3.0 6.0 F值P值存活率(%)95.60±9.00 69.11±5.72 59.64±8.33 45.67±7.05 45.73<0.01凋亡率(%)4.25±1.27 10.03±1.49 36.62±1.97 44.11±2.47 665.7<0.01 G0/G1期细胞比例(%)54.13±2.57 67.35±3.79 74.39±3.29 82.29±3.99 71.81<0.01总活性氧1.03±0.09 1.25±0.06 1.81±0.11 2.61±0.17 219.87<0.01 ATP(μmol/g·protien)31.64±2.64 24.33±2.05 17.04±1.61 13.38±2.15 85.78<0.01上清液乳酸(mmol/L)7.59±0.88 5.35±0.88 4.11±0.93 2.94±0.89 29.81<0.01上清液葡萄糖(mmol/L)3.65±0.38 4.52±0.37 5.60±0.41 6.98±0.47 11.45<0.01
四、重楼皂苷Ⅰ对A375细胞周期变化的影响
0(对照组)与1.5、3.0、6.0 mg/L重楼皂苷Ⅰ组A375细胞G0/G1期细胞比例(表1)差异有统计学意义(F=71.81,P<0.01),且随重楼皂苷Ⅰ浓度增加而升高,相邻两组间差异均有统计学意义(q值分别为9.38、4.99、5.60,P< 0.05)。见表1。
五、重楼皂苷Ⅰ对A375细胞线粒体膜电位的影响
0(对照组)与1.5、3.0、6.0 mg/L重楼皂苷Ⅰ组A375细胞线粒体膜电位下降的细胞比例(表1)差异有统计学意义(F=432.70,P<0.01),且随重楼皂苷Ⅰ浓度增加而升高,相邻两组间差异均有统计学意义(q值分别为7.32、6.06、33.66,P< 0.05)。见表1。
六、重楼皂苷Ⅰ对A375细胞ROS、ATP、培养上清液乳酸及葡萄糖含量的影响
0(对照组)与1.5、3.0、6.0 mg/L重楼皂苷Ⅰ组A375细胞ROS、ATP、上清液乳酸及葡萄糖含量差异均有统计学意义(均P<0.01),且随重楼皂苷Ⅰ浓度增加,细胞内活性氧呈明显上升趋势,ATP含量下降(P<0.01),培养液中乳酸含量下降,葡萄糖含量上升,差异均有统计学意义(P<0.01或0.05)。见表1。
七、重楼皂苷Ⅰ对A375细胞凋亡相关蛋白表达的影响
0(对照组)与1.5、3.0、6.0 mg/L重楼皂苷Ⅰ组A375细胞Bcl⁃2、Bax、cleaved caspase⁃3表达差异均有统计学意义(表2),且随重楼皂苷Ⅰ浓度增加,Bcl⁃2蛋白表达下降,而细胞Bax、cleaved⁃caspase⁃3蛋白表达增多,相邻两组间比较,差异均有统计学意义(P<0.01或0.05)。见图3、表2。
八、重楼皂苷Ⅰ对A375细胞Cyclin D1、PKM2蛋白表达的影响
0(对照组)与1.5、3.0、6.0 mg/L重楼皂苷Ⅰ组A375细胞Cyclin D1、PKM2蛋白表达差异均有统计学意义(P<0.01),且随重楼皂苷Ⅰ浓度增加,Cyclin D1和PKM2蛋白表达下降。见表2、图4。
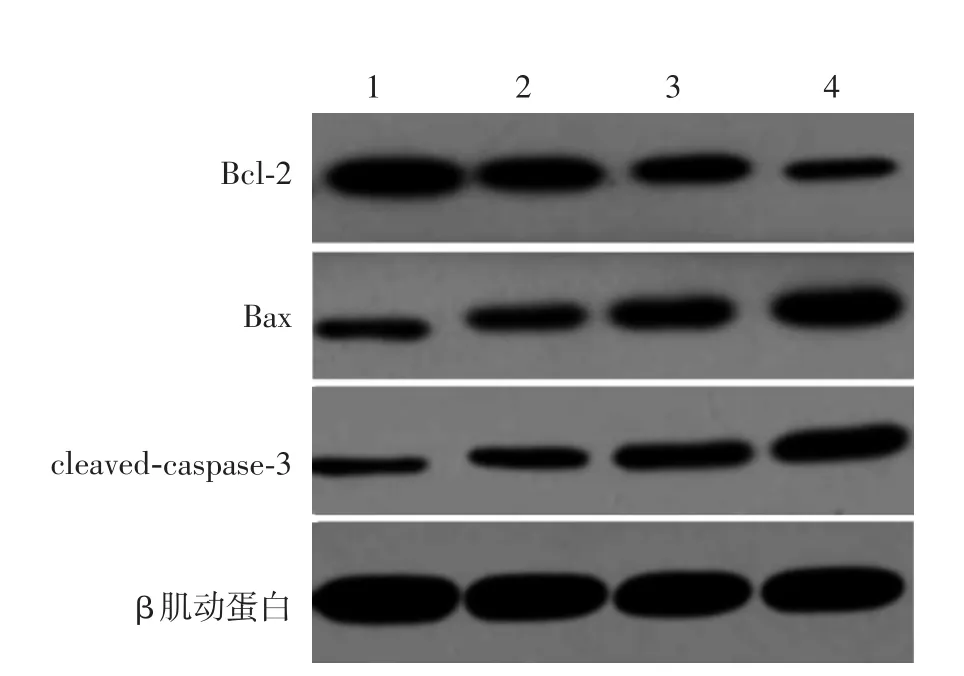
图3 Western印迹法检测重楼皂苷Ⅰ对A375细胞凋亡相关蛋白表达的影响 1~4:0、1.5、3.0、6.0 mg/L重楼皂苷Ⅰ处理组;cleaved⁃caspase⁃3:活化半胱氨酸天冬氨酸蛋白酶3

图4 重楼皂苷Ⅰ对A375细胞肌肉丙酮酸激酶同工酶2(PKM2)、细胞周期蛋白D1(cyclin D1)表达的影响 1~4:分别为对照组和1.5、3.0、6.0 mg/L重楼皂苷Ⅰ处理组
表2 不同浓度重楼皂苷Ⅰ处理A375细胞Bcl⁃2、Bax、cleaved⁃caspase⁃3、周期蛋白D1、PKM2的表达(±s)
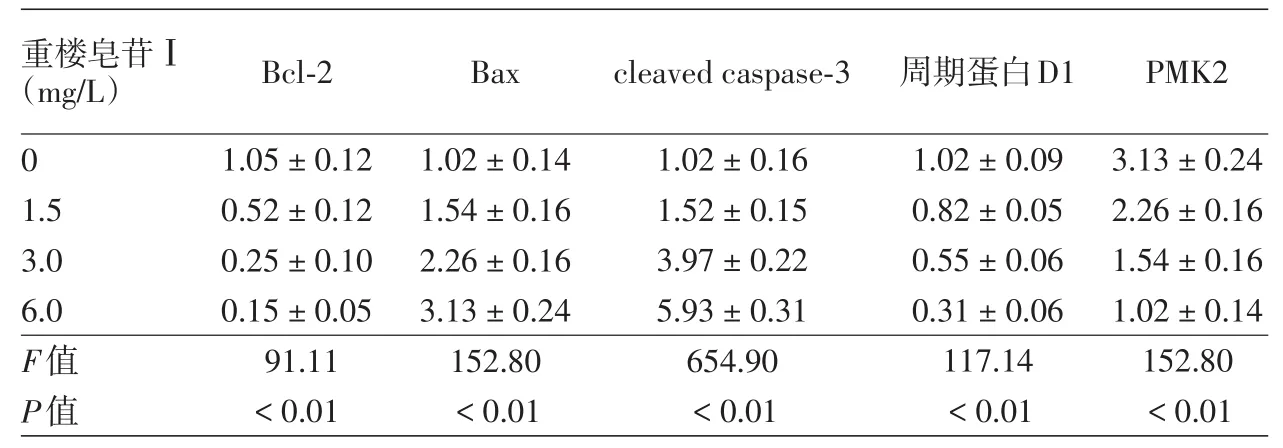
表2 不同浓度重楼皂苷Ⅰ处理A375细胞Bcl⁃2、Bax、cleaved⁃caspase⁃3、周期蛋白D1、PKM2的表达(±s)
注:n=3。经SNK⁃q检验,各检测指标相邻两组间比较,差异均有统计学意义。cleaved⁃caspase⁃3,活化的半胱氨酸天冬氨酸蛋白酶3;PKM2,丙酮酸激酶同工酶2
0 1.5 3.0 6.0 F值P值1.05±0.12 0.52±0.12 0.25±0.10 0.15±0.05 91.11<0.01 1.02±0.14 1.54±0.16 2.26±0.16 3.13±0.24 152.80<0.01 1.02±0.16 1.52±0.15 3.97±0.22 5.93±0.31 654.90<0.01 1.02±0.09 0.82±0.05 0.55±0.06 0.31±0.06 117.14<0.01 3.13±0.24 2.26±0.16 1.54±0.16 1.02±0.14 152.80<0.01
讨 论
药理研究显示,重楼具有抗肿瘤生物学活性,活性成分主要是甾体皂苷类,重楼皂苷Ⅰ是其重要成分之一[8]。有研究表明,重楼皂苷Ⅰ对多种肿瘤细胞具有增殖抑制作用,但对皮肤成纤维细胞和气管上皮细胞等非肿瘤细胞无细胞毒性作用[9]。
本研究表明,1.5、3.0、6.0 mg/L重楼皂苷Ⅰ对正常人黑素细胞增殖无影响,而A375细胞增殖能力随重楼皂苷Ⅰ浓度升高而逐渐降低,提示重楼皂苷Ⅰ具有抑制A375细胞增殖的活性。细胞增殖调控存在两个重要调控点即G1/S期和G2/M期,当正向调节因子积累到越过G1/S期临界点的浓度水平,细胞就会按照一定的顺序完成整个周期,所以G1/S期是细胞周期的重要节点[10]。Cyclin D1是G1/S调控点的关键因子之一[11]。PKM2作为糖酵解酶主要定位于细胞质,还可以单体形式迁移入细胞核与β连环蛋白结合,促进组蛋白去乙酰化酶3从Cyclin D1基因启动子解离,促进Cyclin D1表达,进而加速肿瘤细胞周期进程[12]。我们研究发现,重楼皂苷Ⅰ处理后A375细胞G0/G1期细胞比例明显增多,细胞阻滞于G1期,凋亡率明显上升,提示重楼皂苷Ⅰ能够调控细胞周期;同时我们还发现,重楼皂苷Ⅰ处理后A375细胞PKM2、Cyclin D1的表达明显下降,提示重楼皂苷Ⅰ可能通过下调PKM2蛋白的表达,抑制Cyclin D1的表达,从而使细胞在G1期被阻滞。糖酵解是葡萄糖在酶的催化下降解成丙酮酸,在缺氧条件下进一步被还原为乳酸,并生成ATP的过程;肿瘤细胞需依赖糖酵解产生ATP来进行增殖,因此抑制糖酵解就会降低细胞内ATP水平和培养液中乳酸含量[13],进一步抑制肿瘤细胞的增殖。重楼皂苷Ⅰ作用于A375细胞后,PKM2表达明显下降,细胞内ATP含量和培养液中乳酸含量减少,且上清液中葡萄糖含量增加,进一步提示重楼皂苷Ⅰ可以通过下调PKM2蛋白表达,抑制A375细胞糖酵解途径,从而抑制细胞增殖。此外,重楼皂苷Ⅰ还可以诱导胞质ROS升高,过量的ROS可以损伤线粒体,造成线粒体氧化还原状态失衡,引起线粒体凋亡通路活化,并导致细胞凋亡[14]。试验证实,重楼皂苷Ⅰ作用A375细胞后可使凋亡相关蛋白Bcl⁃2表达下调,Bax表达上调,caspase⁃3活化,说明重楼皂苷Ⅰ处理可以诱导A375细胞凋亡。同时,需要指出的是由于条件所限,本研究中缺少阳性对照药,以及与公认抗黑素瘤药物协同效应的测评,相关结果尚需进一步研究。
综上所述,我们证实重楼皂苷Ⅰ能够通过抑制PKM2蛋白,下调Cyclin D1表达,使细胞周期停留在G1期,并抑制A375细胞糖酵解途径;诱导胞质ROS升高,降低线粒体膜电位;调控凋亡相关蛋白的表达诱导细胞凋亡,为中药重楼治疗黑素瘤提供了一定的依据。
[1]Sheng H,Tang W.Glycolysis inhibitors for anticancer therapy:a review of recent patents[J].Recent Pat Anticancer Drug Discov,2016,11(3):297⁃308.
[2]Falkenius J,Lundeberg J,Johansson H,et al.High expression of glycolytic and pigment proteins is associated with worse clinical outcome in stage III melanoma[J].Melanoma Res,2013,23(6):452⁃460.DOI:10.1097/CMR.0000000000000027.
[3]苏菲菲,卢木娣,曾惠红,等.重楼皂苷Ⅰ对人视网膜色素上皮细胞系ARPE⁃19增殖的影响[J].眼科新进展,2016,36(6):528⁃531.DOI:10.13389/j.cnki.rao.2016.0140.
[4]龙剑文,皮先明,王玉英,等.重楼皂苷Ⅰ对HaCaT细胞增殖和VEGF表达的影响[J].中国皮肤性病学杂志,2014,28(2):128⁃130.DOI:10.13735/j.cjdv.1001⁃7089.201412123
[5]邓碧凡,廖敏,邱荣敏,等.重楼皂苷Ⅰ对低氧喉癌Hep⁃2细胞增殖和HIF⁃1α、VEGF表达的影响[J].安徽医科大学学报,2016,51(11):1613⁃1616,1617.DOI:10.19405/j.cnki.issn1000⁃1492.2016.11.013.
[6]章玲玲,许文,许爱娥.葛根素促进黑素细胞黑素合成及其机制的初步探讨[J].中华皮肤科杂志,2016,49(5):338⁃341.DOI:10.3760/cma.j.issn.0412⁃4030.2016.05.010.
[7]郭健敏,陈雨,周云,等.呋喃二烯对人胃腺癌MGC⁃803细胞凋亡的诱导作用[J].中国药理学与毒理学杂志,2016,30(3):215⁃220.DOI:10.3867/j.issn.1000⁃3002.2016.03.006.
[8]Kang LP,Yu K,Zhao Y,et al.Characterization of steroidal glycosides from the extract ofParis Polyphyllavar.Yunnanensisby UPLC/Q⁃TOF MSE[J].J Pharm Biomed Anal,2012,62:235⁃249.DOI:10.1016/j.jpba.2011.12.027.
[9]Ma DD,Lu HX,Xu LS,et al.Polyphyllin D exerts potent anti⁃tumour effects on Lewis cancer cells under hypoxic conditions[J].J Int Med Res,2009,37(3):631⁃640.
[10]Abdelalim EM.Molecular mechanisms controlling the cell cycle in embryonic stem cells[J].Stem Cell Rev,2013,9(6):764⁃773.DOI:10.1007/s12015⁃013⁃9469⁃9.
[11]Córdova⁃Alarcón E,Centeno F,Reyes⁃Esparza J,et al.Effects of HRAS oncogene on cell cycle progression in a cervical cancer⁃derived cell line[J].Arch Med Res,2005,36(4):311⁃316.DOI:10.1016/j.arcmed.2005.04.001.
[12]Yang W,Xia Y,Ji H,et al.Nuclear PKM2 regulates β ⁃catenin transactivation upon EGFR activation[J].Nature,2011,480(7375):118⁃122.DOI:10.1038/nature10598.
[13]Wong EY,Wong SC,Chan CM,et al.TP53⁃induced glycolysis and apoptosis regulator promotes proliferation and invasiveness of nasopharyngeal carcinoma cells[J].Oncol Lett,2015,9(2):569⁃574.DOI:10.3892/ol.2014.2797.
[14]Rajendran P,Nandakumar N,Rengarajan T,et al.Antioxidants and human diseases[J].Clin Chim Acta,2014,436:332 ⁃347.DOI:10.1016/j.cca.2014.06.004.
Effects of polyphyllinⅠon the proliferation and apoptosis of human melanoma cell line A375
Long Jianwen,Luo Jing,Yin Xuwen,Wei Jing,He Qi,Li Heng,Shi Quan,Pi Xianming
Department of Dermatology,The First Clinical Medical School of Hubei University of Chinese Medicine,Wuhan 430061,China(Long JW[current affiliation:Department of Dermatology,Hubei Provincial Hospital of Traditional Chinese Medicine,Wuhan 430061,China]);Department of Dermatology,Hubei Provincial Hospital of Traditional Chinese Medicine,Wuhan 430061,China(Luo J,Yin XW,Wei J,He Q,Li H,Shi Q,Pi XM)
Long Jianwen,Email:ljwhbzyy@qq.com
ObjectiveTo investigate effects of polyphylinⅠon the proliferation and apoptosis of human melanoma cell line A375,and to explore their mechanisms.MethodsNormal human melanocytes isolated from healthy human foreskin were divided into 6 groups to be treated with 0,1.5,3.0,6.0,9.0,12.0 mg/L polyphyllinⅠrespectively.A375 melanoma cells were divided into 4 groups,i.e.,control group,1.5⁃,3.0⁃,6.0⁃mg/L polyphyllinⅠ groups,to be treated with 0,1.5,3.0,6.0 mg/L polyphyllinⅠ,respectively.Cell counting kit⁃8(CCK8)assay was performed to evaluate the effect of polyphyllinⅠ on the proliferation of normal human melanocytes and A375 cells.Hoechst 33258 fluorescent staining was conducted to observe the morphology of apoptotic cells,flow cytometry to estimate cell cycle phase distribution and apoptosis rate,dichloro⁃dihydro⁃fluorescein diacetate(DCFH⁃DA)fluorescent probe assay to detect the level of reactive oxygen species(ROS),rhodamine ⁃123 staining to evaluate changes of mitochondrial membrane potential,spectrophotography to detect the level of ATP in A375 cells,as well as levels of lactic acid and glucose in the culture supernatant of A375 cells,and Western blot analysis to determine the protein expression of Bcl⁃2,Bcl⁃2⁃related X protein(Bax),cleaved⁃caspase⁃3,cyclin D1 and pyruvate kinase isozyme type M2(PKM2).Statistical analysis was carried out by using one⁃way analysis of variance(ANOVA)for comparisons among groups and Student⁃Newman⁃Keuls⁃q(SNK⁃q)test for multiple comparisons.ResultsCCK8 assay showed that the treatment with polyphyllinⅠat concentrations of 1.5,3.0,6.0 mg/L for 48 hours had no effects on the proliferation of normal human melanocytes,but significantly inhibited the proliferation of A375 cells.The survival rate of A375 cells was significantly lower in the 1.5⁃,3.0⁃,6.0⁃mg/L polyphyllinⅠgroups than in the control group(P< 0.01).After the treatment with polyphyllinⅠ,distinct apoptotic morphology of A375 cells was observed under fluorescence microscope.Additionally,along with the increase of polyphyllinⅠconcentrations(0,1.5,3.0,6.0 mg/L),there were gradual increasing trends in the apoptosis rate of A375 cells(4.25% ±1.27%,10.03% ±1.49%,36.62% ±1.97%,44.11%±2.47%respectively,F=665.7,P< 0.01),the percentage of A375 cells at G0/G1 phase(54.13% ± 2.57%,67.35%±3.79%,74.39%±3.29%,82.29%±3.99%respectively,F=71.81,P<0.01),the level of ROS in A375 cells(P< 0.01),the level of glucose in the culture supernatant(P< 0.01),and the protein expression of Bax and cleaved⁃caspase⁃3(bothP< 0.01),while gradual decreasing trends were found in the levels of mitochondrialmembranepotential and ATPinA375cells(bothP< 0.01),thelevel of lacticacidintheculture supernatant(P< 0.01),and the protein expression of Cyclin D1,Bcl⁃2 and PKM2(allP< 0.01).ConclusionPolyphyllinⅠcan effectively induce A375 cell apoptosis by promoting the production of ROS in A375 cells and decreasing the mitochondrial membrane potential,and arrest A375 cells at G0/G1 phase by inhibiting the expression of PKM2 and Cyclin D1.
Melanoma;Cell line,tumor;Apoptosis;Reactive oxygen species;Cell proliferation;PolyphyllinⅠ
Fund program:Integrated Traditional Chinese and Western Medicine Research Project of Health and Family Planning Commission of Hubei Province(2013Z⁃B05)
龙剑文,Email:ljwhbzyy@qq.com
10.3760/cma.j.issn.0412⁃4030.2017.12.006
湖北省卫生计生委中西医结合科研计划项目(2013Z⁃B05)
2016⁃11⁃04)
朱思维 颜艳)
