病毒侵染过程中肌动蛋白的作用研究进展
2022-10-20赵淑玲
李 杰, 赵淑玲
(扬州大学生物科学与技术学院, 扬州225100)
肌动蛋白作为细胞骨架和运动系统的重要成分普遍存在于真核细胞中[1]。肌动蛋白由375个氨基酸残基组成,其分子质量约为42 ku,在细胞中有两种基本形式:单体的球状肌动蛋白(G-actin)和多聚体的丝状肌动蛋白(F-actin)[2]。F-actin为双股螺旋,由G-actin聚合组装而成,是真核细胞骨架中微丝的主要组分。在细胞内,Actin纤维形成的微丝网络主要包括含有肌球蛋白的收缩应力纤维和位于质膜下和细胞器周围的皮质肌动蛋白网络。另外,actin纤维也可以形成片状的延伸结构(如板足)、膜皱褶和气泡、指状的突起(如微绒毛和丝足)或点状的足小体。Actin参与并调控细胞内多种生理过程,包括维持细胞形态、感知环境力量、参与膜泡的内化和细胞运动等[3]。病毒作为一种专性活细胞内寄生的微生物,在其识别、结合和进入宿主的过程中涉及的细胞信号转导、内吞摄取和细胞质转运等过程直接或间接依赖于细胞骨架[4]。主要介绍肌动蛋白在病毒侵入、复制、释放及细胞间扩散过程中功能的研究进展,以期为抗病毒研究提供理论依据。
1 肌动蛋白与病毒进入
病毒侵染细胞时首先与细胞表面结合,然后迁移到特定的位置,随后穿过细胞膜进入细胞中。在这个过程中,病毒通常会遇到肌动蛋白组装的各种结构,如丝足和微绒毛,并利用这些结构有效地迁移到细胞膜上进入宿主细胞。Lehmann等[5]发现病毒与丝足结合后,在进入细胞前会诱导快速且高度有序的侧向运动,向细胞体滑动(图1)。滑动由肌动蛋白细胞骨架介导,依赖于功能性的肌球蛋白Ⅱ。病毒感染通常会改变细胞的常规功能,以支持病毒复制和新病毒粒子的产生。因为细胞的形状、运动、吞噬、细胞间通信等都依赖于肌动蛋白细胞骨架的动态重组,因此病毒常利用肌动蛋白的结构重排来完成其感染和复制过程。细胞肌动蛋白结构的重排是一个动态的、快速的过程,由肌动蛋白丝的连续组装、拆卸和重新组装驱动[6]。Melamed等[7]发现肌动蛋白重排对EB病毒(epstein barr virus,EBV)感染 B 细胞是必不可少的。EBV感染B细胞时,会刺激G-actin向F-actin的转化,阻止G-actin向F-actin转化抑制了EBV的增殖。此外,囊泡病毒(Ascovirus)进入细胞时也会引起肌动蛋白细胞骨架的重排[8]。在静止的CD4 T淋巴细胞中,皮质肌动蛋白被认为是病毒进入和核迁移的独特物理屏障[9]。Yin等[10]发现人体免疫缺损病毒(human immunodeficiency virus,HIV)在与质膜融合后,可调节α-辅肌动蛋白介导的皮质肌动蛋白重排,为病毒进入打开一个“通道”,从而有助于病毒进入静息CD4 T淋巴细胞。Roberts等[11]表明疱疹病毒(Herpesvirus)在进入细胞时首先遇到宿主肌动蛋白。位于质膜胞质侧的皮质肌动蛋白是一个由F-actin组成的网状结构,通过表面受体连接到细胞表面。在病毒感染的情况下,病毒粒子包膜蛋白与特定的宿主细胞受体结合,最终导致包膜和质膜融合,从而进入细胞质中。
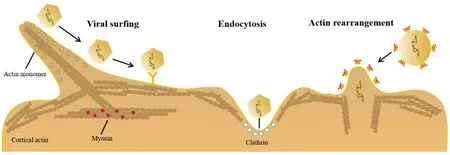
图1 肌动蛋白参与病毒侵染细胞(根据文献[4]修改)Figure 1 Involvement of actin in virus entry (modified according to reference [4])
Trejo-Cerro等[12]发现Rho家族的两个重要成员Cdc42和Rac1是轮状病毒感染所必需的。Rho GTP酶属于小G蛋白家族,广泛存在于所有真核生物中,是肌动蛋白细胞骨架的主要调节因子[13]。Rho GTP酶成员可将跨膜蛋白的分子信号传递到肌动蛋白,作为肌动蛋白细胞骨架调控的分子开关,其中RhoA、Cdc42和Rac1是3个关键成员。Rac1和Cdc42蛋白在细胞膜突起形成过程中控制肌动蛋白组织,Rac1促进细胞表面周边的肌动蛋白聚合,产生片状或层状突起,而Cdc42调节纤毛的形成。RhoA促进细胞内肌动蛋白应力纤维合成增加和与局部粘连相关的复合物的形成[14]。Xu等[15]发现乙型脑炎病毒(Japanese encephalitis virus,JEV)通过小窝蛋白1(Caveolin-1)介导的内吞作用进入人类神经元细胞。内吞作用依赖于RhoA和Rac1触发的肌动蛋白细胞骨架重塑。首先病毒诱导RhoA激活促进小窝蛋白-1的磷酸化,然后磷酸化小窝蛋白-1激活Rac1,导致病毒在小窝蛋白1相关小泡内的内吞作用。除此之外,埃博拉病毒(ebola virus,EBOV)能够与网格蛋白重链(CHC)共定位,通过网格蛋白介导的内吞作用进入细胞[16]。
2 肌动蛋白与病毒复制
在感染宿主细胞的过程中,病毒首先附着在宿主细胞膜上,进而进入细胞,然后病毒基因组转运到细胞质或核质中,进行病毒基因组的复制和病毒蛋白质的合成,最后病毒被转运到质膜处释放[17]。Ohkawa等[18]发现当杆状病毒(Baculovirus)进入细胞后,会诱导形成细长的活性纤维,并与之结合,然后沿着这些纤维运输到细胞核。Hirai等[19]发现抑制肌动蛋白的核质转运影响了博尔纳病毒(borna disease virus,BoDV)在细胞核内的复制。此外,抑制肌动蛋白的核输出促进了病毒基质蛋白在细胞质内的积累。研究发现,核肌动蛋白与几种在细胞核内复制的DNA病毒之间存在关联。Feierbach等[20]发现伪狂犬病病毒(pseudorabies virus,PRV)和1型单纯疱疹病毒(herpes simplex virus type 1,HSV-1)感染可诱导核肌动蛋白丝的形成。病毒衣壳蛋白VP26可与肌球蛋白Ⅴ共定位,表明病毒使用基于肌球蛋白的定向运输沿核肌动蛋白丝传播。研究也发现核肌动蛋白和肌球蛋白在腺病毒(Adenovirus)复制过程中起重要作用,腺病毒DNA在细胞核中复制时将肌动蛋白以及肌球蛋白Ⅰ、Ⅴ和Ⅵ招募到病毒DNA复制的位点,从而促进病毒的复制[21]。同时,病毒自身的蛋白也能随着肌动蛋白微丝进行移动,Cui等[22]发现烟草饲纹病毒(tobacco etch virus,TEV)的P3蛋白通过早期分泌途径形成可移动的包涵体,并沿肌动蛋白微丝运输,最后与能诱导复制的病毒6K蛋白共定位。Burke等[23]发现除病毒基因组复制和转录外,任何一种主要细胞骨架成分的改变都会显著影响呼吸道合胞病毒(respiratory syncytial virus,RSV)生命周期的每一步。病毒到达其复制部位后与肌动蛋白细胞骨架的结合,促进了子代病毒的复制和组装。RSV依赖肌动蛋白和肌动蛋白单体结合蛋白刺激RSV聚合酶的转录活性。另外,Kallewaard等[24]研究表明微管在产生RSV的过程中起主导作用,而肌动蛋白丝对病毒从细胞内释放的影响更大。De Bishnu等[25]发现肌动蛋白微丝在3型人副流感病毒(human parainfluenza virus type 3,HPIV3)生命周期中起着关键作用,特别是在病毒转录和复制的水平上。免疫荧光标记和共聚焦显微镜显示,病毒核衣壳与肌动蛋白微丝共定位,纯化的病毒核衣壳蛋白特异性地与重组肌动蛋白互作,激活mRNA合成。
3 肌动蛋白与病毒释放
病毒复制周期的最后阶段是从受感染的宿主细胞释放。Miranda-Saksena等[26]发现1型单纯疱疹病毒(herpes simplex virus type 1,HSV-1)利用肌动蛋白和微管进入细胞时,在质膜和轴突中进行逆行运输,组装和离开细胞时进行顺行运输。Charlton等[27]研究发现苜蓿银纹夜蛾核型多角体病毒(Autographacalifornicanuclear polyhedrosis virus,AcMNPV)出芽型病毒粒子BV进入细胞后立即诱导细胞质中的肌动蛋白形成缆索结构,介导病毒穿过核孔进入细胞核中进行复制。随着病毒早期基因的表达,病毒感染引起宿主细胞肌动蛋白构象的再次变化,肌动蛋白缆索结构解体,F-actin在细胞膜附近聚集。AcMNPV具有将宿主G-actin组装成F-actin的能力[28]。在病毒感染晚期,AcMNPV动员核内的肌动蛋白以促进病毒出核[29]。并且,肌动蛋白聚合对病毒在出核时破坏核膜的完整性是必需的。在细胞质内,病毒利用肌动蛋白移动系统到达质膜,进而出芽。Wilkie等[30]发现核F-肌动蛋白可促进人巨细胞病毒(human cytomegalovirus,HCMV)向核周边移动,并促进出核。
4 肌动蛋白与病毒细胞间传播
很多病毒利用宿主的肌动蛋白细胞骨架来促进它们在细胞间的传播。如痘苗病毒(vaccinia virus,VV)感染导致宿主肌动蛋白细胞骨架的重排,利用肌动蛋白聚合作为驱动力,在细胞内和细胞间运动[31]。Humphries等[32]研究发现新组装的痘苗病毒颗粒与质膜融合,并通过诱导Arp2/3依赖的肌动蛋白聚合来增强它们的传播。ARP2/3复合物在肌动蛋白的组装中不可或缺,最主要功能是促进肌动蛋白聚合[33]。痘苗病毒通过病毒蛋白F11抑制RhoA信号传导来调节皮质肌动蛋白细胞骨架形成的屏障,从而增强其释放[34]。
Mehedi等[35]研究发现,呼吸道合胞病毒感染诱导细胞形成丝状足,从而促进了RSV的细胞间传播。此外,El Najjar等[36]研究发现人偏肺病毒(human metapneumovirus,HMPV)可在感染细胞表面形成丝状结构,并刺激病毒结构蛋白在细胞间延伸,这些结构的形成依赖于肌动蛋白的聚合和肌动蛋白相关的信号转导。另外,一些植物呼肠孤病毒利用由病毒蛋白形成的小管介导病毒粒子在昆虫介体内进行病毒传播。Chen等[37]发现与actin相连的原肌球调节蛋白能够直接与水稻矮缩病毒(rice dwarf virus,RDV)Pns10小管相互作用参与病毒传播,最终促进病毒感染。RDV的非结构蛋白Pns10是管状结构的主要成分,含病毒粒子的小管与肌动蛋白丝结合,从感染细胞表面突出并穿透到邻近细胞中。因此,认为RDV利用Pns10形成的小管和肌动蛋白形成的丝足在宿主昆虫细胞间传播[38]。
5 总结与展望
肌动蛋白在真核细胞中起着至关重要的作用,细胞的形状、运动、分裂、细胞内物质运输和细胞内信号转导等都依赖于肌动蛋白。此外,肌动蛋白还参与许多病原微生物的侵染、复制等过程。病毒在侵染宿主细胞时,会破坏肌动蛋白形成的细胞骨架,以促进自身的生存、复制和传播(表1)。

近年来,大量的研究发现病毒都有一套调控宿主细胞骨架的策略,对病毒与细胞骨架之间的研究不但在病毒感染机制方面,而且在细胞骨架调节途径方面都取得了进展。通过研究病毒生命不同周期中与肌动蛋白的相互作用,了解病毒感染如何利用宿主细胞骨架有助于对病毒致病机理的理解,从而限制或消除病毒传播。重要的是,解析病毒与细胞骨架之间的分子相互作用机制,通过靶向与宿主细胞骨架相互作用或操纵宿主细胞骨架的病毒蛋白可能为抗病毒治疗的发展提供重要的新靶点。
