miRNA⁃29c⁃3p对体外慢性光损伤皮肤成纤维细胞COL1A1和COL3A1基因表达及Ⅰ、Ⅲ型胶原蛋白合成的影响
2018-01-09宋晓婧彭亚婷陈海燕郑跃许庆芳龚子鉴陆春赖维510630广州中山大学附属第三医院皮肤科
宋晓婧 彭亚婷 陈海燕 郑跃 许庆芳 龚子鉴 陆春 赖维510630广州,中山大学附属第三医院皮肤科
·论著·
miRNA⁃29c⁃3p对体外慢性光损伤皮肤成纤维细胞COL1A1和COL3A1基因表达及Ⅰ、Ⅲ型胶原蛋白合成的影响
宋晓婧 彭亚婷 陈海燕 郑跃 许庆芳 龚子鉴 陆春 赖维510630广州,中山大学附属第三医院皮肤科
目的研究miRNA⁃29(miR⁃29)家族对人慢性光损伤(光老化)皮肤Ⅰ、Ⅲ型胶原蛋白的影响。方法将人皮肤成纤维细胞分为未照射组和慢性光损伤组,后者给予长波紫外线(UVA)连续照射以构建慢性光损伤细胞模型,并用流式细胞仪及β半乳糖苷酶染色法验证模型。Western印迹检测两组Ⅰ型和Ⅲ型胶原蛋白的表达,实时荧光定量PCR(qRT⁃PCR)检测miR⁃29家族3个成员(miR⁃29a⁃3p、miR⁃29b⁃3p和miR⁃29c⁃3p)在两组细胞中的表达,选择表达具有显著差异的miR⁃29c⁃3p进行功能试验。将人皮肤成纤维细胞分为4组,分别采用荧光标记的miRNA⁃29c⁃3p模拟物(过表达组)、抑制物(抑制组)及二者各自的对照RNA寡核苷酸(阴性对照组和抑制对照组)转染各组细胞,观察各组荧光细胞比例,qRT⁃PCR法检测各组miR⁃29c⁃3p的相对表达量,判定干扰效率。采用qRT⁃PCR法检测转染后4组COL1A1和COL3A1 mRNA水平,Western印迹法检测转染后Ⅰ和Ⅲ型胶原蛋白表达水平。结果与未照射组相比,慢性光损伤组衰老染色细胞阳性率显著升高(36.47%±3.20%比12.56%±1.46%,P<0.01),G1期细胞比例明显升高,S期细胞比例明显降低(均P<0.01),慢性光损伤模型成功建立。慢性光损伤组Ⅰ和Ⅲ型胶原蛋白表达(0.40±0.19和0.52±0.10)明显低于未照射组(1.00±0.12和1.00±0.10,均P<0.01),而miR⁃29c⁃3p(4.42±2.05)明显高于未照射组(0.89±0.10,P< 0.05),两组间miR⁃29a⁃3p和miR⁃29b⁃3p表达水平差异无统计学意义(均P> 0.05)。转染后24 h,过表达组和抑制组的转染效率均大于90%,达到干预要求。过表达组miR⁃29c⁃3p的表达(224.17±2.00)明显高于阴性对照组(2.45±0.34),而抑制组(0.20±0.08)明显低于抑制对照组(2.24±0.14),干扰模型构建成功。评价转染效率显示,过表达组COL1A1和COL3A1 mRNA和Ⅰ、Ⅲ型胶原蛋白表达水平均明显低于阴性对照组和抑制组(均P<0.05),而抑制组明显高于抑制对照组(均P<0.01)。结论miR⁃29c⁃3p在慢性光损伤皮肤成纤维细胞中表达上调,可能通过调控COL1A1、COL3A1的表达影响Ⅰ、Ⅲ型胶原蛋白合成。
紫外线;成纤维细胞;微RNAs;胶原Ⅰ型;胶原Ⅲ型;光老化;miR⁃29
皮肤光老化是紫外线[主要是长波紫外线(UVA)]照射引起的皮肤外源性老化,真皮胶原减少是其最重要的病理学特征之一[1⁃2]。皮肤Ⅰ、Ⅲ型胶原蛋白是构成皮肤真皮细胞外基质最主要的蛋白成分,具有保持皮肤水分、支撑皮肤正常结构及维持皮肤韧性的功能,主要分布于真皮层,仅由成纤维细胞合成和分泌。miRNA⁃29家族(miR⁃29)是主要调控人体内胶原表达的一类miRNA分子,在多种以胶原改变为主的疾病中呈非正常表达,通过负性调节胶原形成参与疾病发展[3⁃5]。最近研究发现,在自然衰老皮肤的真皮组织中miR⁃29表达上调[6],但胶原含量下调,提示miR⁃29上调可能与真皮胶原合成减少有关。我们通过研究miR⁃29(miR⁃29a⁃3p、miR⁃29b⁃3p和miR⁃29c⁃3p)在慢性光损伤人皮肤成纤维细胞(HDF)中的表达及其对Ⅰ、Ⅲ型胶原蛋白合成的影响,进一步揭示光老化的机制。
材料与方法
一、材料
1.细胞来源:HDF来源于中山大学附属第三医院泌尿外科3~9岁健康儿童包皮环切术后包皮组织,儿童监护人已被告知组织用途并签署知情同意书。本研究通过中山大学附属第三医院医学伦理委员会批准(中大附三医伦[2016]2⁃63号)。
2.主要试剂和仪器:Hairpin⁃itTMmiRNA实时定量PCR(qRT⁃PCR)定量检测试剂盒、miR⁃29特异性引物和U6内参引物(上海吉玛制药技术有限公司),PrimerScript RT⁃PCR试剂盒和SYBR Green实时PCR预混液(美国Clontech公司)。按照文献[7]设计胶原基因(COL1A1及COL3A1)mRNA引物及内参3-磷酸甘油醛脱氢酶(GAPDH)基因引物序列,并由美国life公司合成。一抗鼠抗人Ⅰ型胶原蛋白IgG抗体、兔抗人Ⅲ型胶原蛋白多克隆抗体、鼠抗人β肌动蛋白抗体(美国Abcam公司),二抗辣根过氧化物酶标记的羊抗兔IgG及羊抗鼠IgG(美国Cell Signaling Technology公司),BCA蛋白定量试剂盒(美国Pierce公司),蛋白提取试剂盒、细胞周期检测试剂盒(南京凯基生物科技发展有限公司),总RNA提取试剂Trizol及Opti⁃MEM无血清培养基(美国Invitrogen公司),β半乳糖苷酶染色试剂盒(上海碧云天生物技术有限公司),ECL显色试剂盒(美国Millpore公司)。
PCR仪(美国Applied Biosystems公司),酶联免疫检测仪(美国BioTek公司),UVA紫外线辐射仪和UVA照射计(上海希格玛高技术有限公司),流式细胞仪(美国BD Biosciences公司)。
二、慢性光损伤细胞模型的建立与验证
1.建立模型:取小儿包皮组织,参照文献[8]方法分离、培养HDF,6代以内的细胞用于后续试验。按照文献[9⁃10]方法照射HDF(慢性光损伤组):HDF距离光源15 cm,平均照射功率12.7 mW/cm2,单次照射时间780 s,剂量9.9 J/cm2,每日照射1次,连续照射7 d;以同等条件下未照射的HDF为对照。两组细胞处理完成后均置于95%湿度、含5%CO2、37℃培养箱继续培养。
2.验证:采用β半乳糖苷酶染色法检测老化比率,即末次UVA照射后48 h去除培养基,根据试剂盒说明书固定细胞和染色,置于37℃干燥、无CO2的培养箱避光孵育过夜。光镜下观察,每皿至少计数500个细胞及其中胞质被染成蓝色的老化细胞数量,计算老化细胞比率。参照文献[6]收集和固定细胞,按照细胞周期检测试剂盒说明书进行细胞染色,4℃避光孵育30 min后流式细胞仪检测细胞周期,记录激发波长488 nm处红色荧光强度。
三、检测慢性光损伤HDF中miR⁃29及Ⅰ、Ⅲ型胶原蛋白的表达
1.qRT⁃PCR法检测慢性光损伤HDF中miR⁃29的表达:按Trizol试剂说明书从样品中提取总RNA,并用超微量核酸分析仪测定其浓度及纯度。取2 μg总RNA,严格按照Hairpin⁃itTMmiRNA RT⁃PCR定量检测试剂盒说明书操作,用茎环法反转录成cDNA,反应体系为20 μl,3个miR⁃29和U6的特异性反转录引物浓度均为60 nmol/L。按照说明书取2 μl cDNA在Applied Biosystems 7500 Fast PCR仪中扩增,扩增体系20 μl,包括2倍实时定量PCR缓冲液 10 μl,PCR 引物 0.32 μl,cDNA 2 μl,浓度均为80 nmol/L,Taq DNA聚合酶0.2 μl以及双蒸水。扩增条件:95℃预变性3 min,95℃变性12 s,62℃退火40 s,40个循环。以U6为内参基因,采用2⁃ΔΔCt方法计算miR⁃29a⁃3p、miR⁃29b⁃3p和miR⁃29c⁃3p的相对表达量。
2.Western印迹法检测慢性光损伤HDF中Ⅰ、Ⅲ型胶原蛋白的表达:按照蛋白提取试剂盒说明书提取总蛋白,用BCA法测量蛋白浓度。用8%分离胶电泳分离蛋白50 min,再将蛋白转移至聚偏二氟乙烯(PVDF)膜上,用5%牛血清白蛋白(BSA)封闭。1 000倍稀释的抗Ⅰ型胶原蛋白抗体、10 000倍稀释的抗Ⅲ型胶原蛋白抗体及5 000倍稀释的抗β肌动蛋白抗体为一抗,10 000倍稀释的辣根过氧化物酶标记的羊抗兔或羊抗鼠抗体为二抗。采用ECL化学发光显色,电子成像系统成像。以β肌动蛋白为内参,使用Image J软件分析图像。
四、miR⁃29c⁃3p的功能验证
对上述发现的差异表达miR⁃29c⁃3p进行功能验证,研究其对HDF胶原合成的影响。
1.HDF转染RNA寡核苷酸后miR⁃29c⁃3p水平:HDF培养24 h后,接种在6孔板上,培养24 h并融合至70%后分为4组。按照试剂说明书用Lipofectamine3000将miR⁃29c⁃3p模拟物(过表达组)、抑制物(含羟基荧光素绿色荧光标记,抑制组)及各自的对照(阴性对照组和抑制对照组)分别转染入各组HDF。其中模拟物(双链RNA)序列为5′⁃UAGCACCAUUUGAAAUCGGUUA⁃3′、5′⁃ACCGAUU UCAAAUGGUGCUAUU⁃3′,抑制物(单链RNA)序列为5′⁃UAACCGAUUUCAAAUGGUGCUA⁃3′,阴性对照组(双链RNA)序列为5′⁃UUCUCCGAACGUGUCA CGUTT⁃3′、5′⁃ACGUGACACGUUCGGAGAATT⁃3′,抑制对照组(单链RNA)序列为5′⁃CAGUACUUUUG UGUAGUACAA⁃3′。利用倒置荧光显微镜观察绿色荧光细胞比例,评价转染效率(荧光细胞比例超过80%认为达到转染要求),采用qRT⁃PCR法检测过表达组相对阴性对照组及抑制组相对抑制对照组miR⁃29c⁃3p表达量,以判定过表达和抑制的干扰效率。
2.qRT⁃PCR法检测转染后24 h HDF中COL1A1、COL3A1 mRNA水平:取2 μg总RNA,按照PrimerScript RT⁃PCR试剂盒说明书反转录合成cDNA,稀释100倍后取2 μl按照SYBR Green实时PCR预混液说明书进行PCR扩增。以GAPDH为内参 基 因 ,采 用 2⁃ΔΔCt方法计算 HDF 中 COL1A1、COL3A1 mRNA相对表达量。
3.Western印迹法检测转染后HDF中Ⅰ、Ⅲ型胶原蛋白的表达:同上述慢性光损伤HDF中Ⅰ、Ⅲ型胶原蛋白表达的检测方法。
五、统计学分析
采用SPSS 19.0软件进行统计分析,实验结果以±s表示,两组间比较采用独立样本t检验,多组间比较首先采用单因素方差分析,再采用LSD⁃t检验进行两两间的多重比较,P<0.05为差异有统计学意义。
结 果
一、慢性光损伤HDF模型的建立和验证
1.UVA照射后HDF形态及β半乳糖苷酶染色结果:多次UVA照射后,细胞生长缓慢,形状宽大扁平,胞质透明,胞核内颗粒增多,呈衰老表现。β半乳糖苷酶染色可见典型衰老细胞核周蓝染。未照射组老化细胞比率为(12.56±1.46)%,慢性光损伤组为(36.47±3.20)%,两组差异有统计学意义(n=3,t=6.80,P< 0.01)。见图1。
2.UVA照射对HDF细胞周期的影响:慢性光损伤组G1期细胞比例(71.70%±2.43%)高于未照射组(41.89% ±1.86%),S期细胞比例(10.63% ±0.36%)及G2期细胞比例(12.00%±0.48%)均低于未照射组(分别为36.48%±1.31%、21.56%±0.51%),差异均有统计学意义(n=3,t值分别为9.75、19.02、13.67,均P< 0.01)。
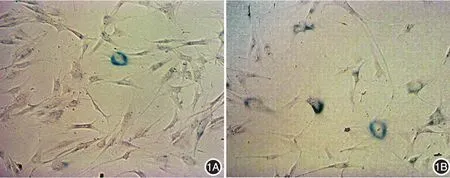
图1 β半乳糖苷酶染色法检测连续UVA照射后人皮肤成纤维细胞(HDF)形态(×100) 1A:未照射组,仅见少量HDF核周蓝染;1B:慢性光损伤组,可见多个HDF核周蓝染
二、慢性光损伤HDF中miR⁃29的表达及Ⅰ、Ⅲ型胶原蛋白表达水平
经UVA处理后,慢性光损伤组HDF的miR⁃29c⁃3p明显高于未照射组(n=3,t=2.98,P< 0.05),而miR⁃29a⁃3p和miR⁃29b⁃3p与未照射组相比,差异均无统计学意义(n=3,t分别为0.12、0.82,均P>0.05)。见图2。慢性光损伤组HDFⅠ型(0.40±0.19)、Ⅲ型胶原蛋白(0.52±0.10)表达均明显低于未照射组(分别为1.00±0.12、1.00±0.10,t值分别为4.75和5.90,均P< 0.01),见图3。
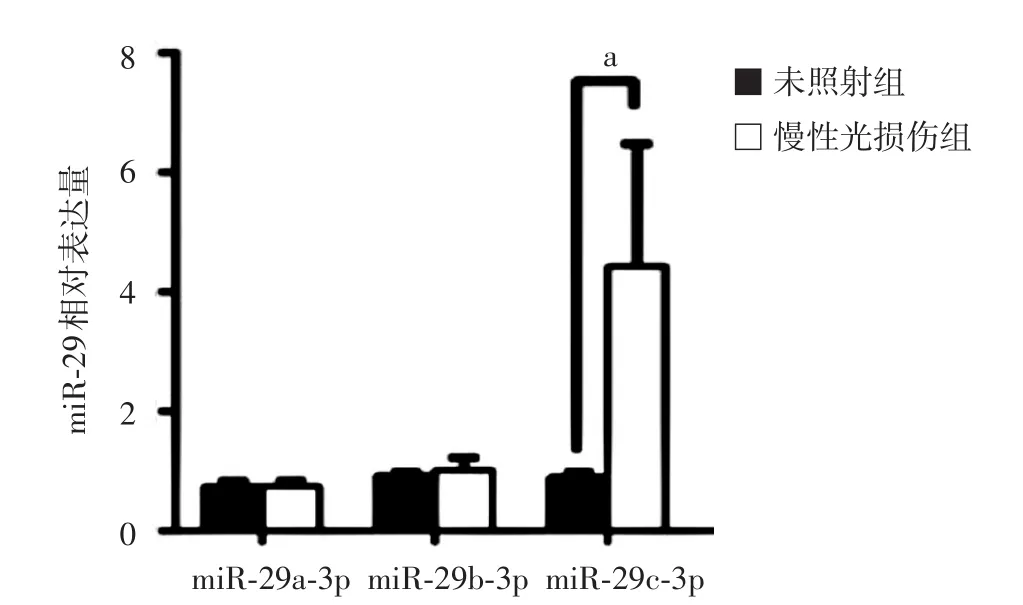
图2 慢性光损伤人皮肤成纤维细胞中miR⁃29家族的表达差异 n=3;a:P<0.05。慢性光损伤组miR⁃29c⁃3p表达显著高于未照射组
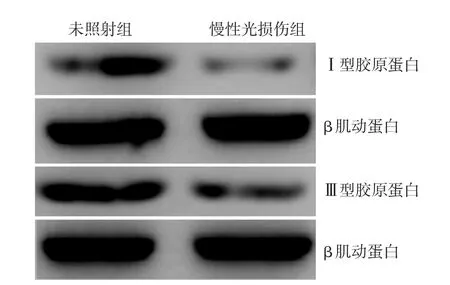
图3 Western印迹检测慢性光损伤与未照射人皮肤成纤维细胞中Ⅰ、Ⅲ型胶原蛋白的表达 与未照射组相比,慢性光损伤组Ⅰ、Ⅲ型胶原蛋白的表达均明显下调
三、miR⁃29c⁃3p对HDF胶原表达的影响
1.RNA寡核苷酸转染效率和干扰效率:转染后24 h,miR⁃29c⁃3p过表达组(94 ± 1.3)%和miR⁃29c⁃3p抑制组转染效率(93±1.6)%均>90%,达到转染要求(图4)。转染后24 h,各组miR⁃29c⁃3p水平差异有统计学意义(F=36141.04,P<0.01),过表达组(224.17±2.00)明显高于阴性对照组(2.45±0.34,LSD⁃t=267.85,P< 0.01),抑制组(0.20 ± 0.08)明显低于抑制对照组(2.24±0.14,LSD⁃t=2.46,P<0.05),干扰模型构建成功。
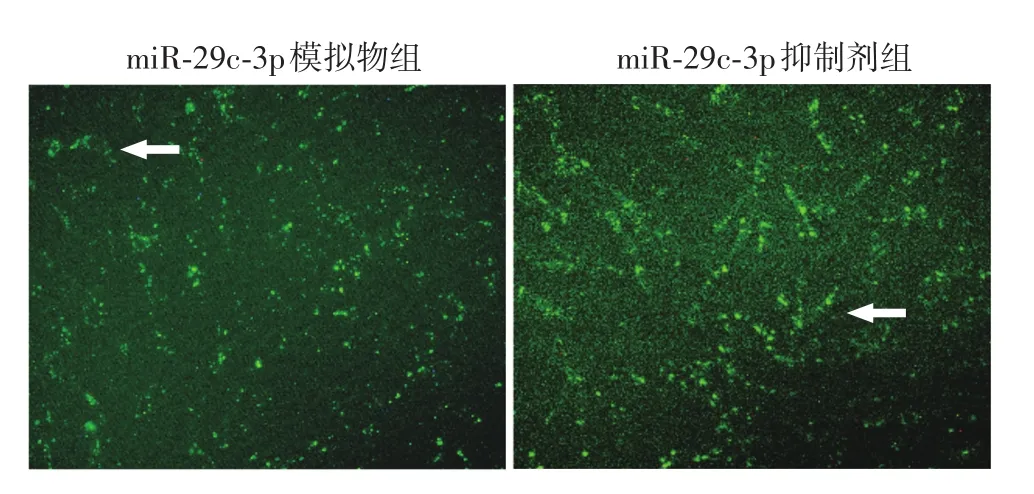
图4 RNA寡核苷酸转染人皮肤成纤维细胞效率(×100) 两组绿色荧光细胞比例均占该视野下细胞总数的90%以上,箭头所指为转染成功的成纤维细胞
2.miR⁃29c⁃3p对HDF胶原表达的影响:转染后各组COL1A1和COL3A1 mRNA水平和Ⅰ、Ⅲ型胶原蛋白水平组间差异均有统计学意义(F=18.73、20.87、69.51、55.49,均P< 0.01)。过表达组COL1A1和COL3A1 mRNA水平和Ⅰ、Ⅲ型胶原蛋白表达均明显低于阴性对照组(LSD⁃t=2.56、3.11、7.23、5.36,均P< 0.05)和抑制组(LSD⁃t=7.00、7.58、14.44、12.72,均P<0.01),而抑制组均明显高于抑制对照组(LSD⁃t=5.48、5.28、7.08、8.19,均P< 0.01)。见图5、6。

图5 人皮肤成纤维细胞转染miR⁃29c⁃3p后各组COL1A1和COL3A1 mRNA相对表达量 n=3。a:P <0.05;b:P <0.01。1:阴性对照组;2:miR⁃29c⁃3p过表达组;3:抑制对照组;4:miR⁃29c⁃3p抑制组。过表达组COL1A1和COL3A1 mRNA水平均明显低于阴性对照组,而抑制组均明显高于抑制对照组
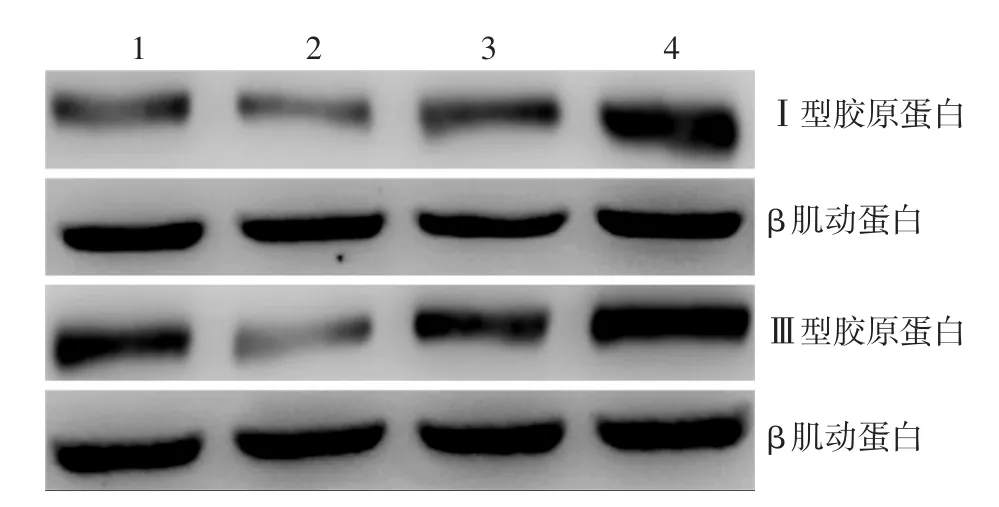
图6 人皮肤成纤维细胞转染miR⁃29c⁃3p后各组Ⅰ型和Ⅲ型胶原蛋白表达 n=3。1:阴性对照组;2:miR⁃29c⁃3p过表达组;3:抑制对照组;4:miR⁃29c⁃3p抑制组。过表达组Ⅰ、Ⅲ型胶原蛋白表达均明显低于阴性对照组,而抑制组均明显高于抑制对照组
讨 论
有研究发现,miR⁃29家族参与人体内多个器官、多种疾病中胶原蛋白的调控[11⁃12]。然而,同一miRNA家族的不同成员,甚至同一miRNA,对不同组织和器官中的同一靶分子的影响不同,有明显的组织或器官倾向性。van Rooij等[13]发现,miR⁃29b在心肌梗死组织周围的表达明显高于miR⁃29a和miR⁃29c。Roderburg等[11]和Sekiya等[5]则发现,miR⁃29b除了可以通过直接靶向结合胶原基因的方式下调肝脏的胶原合成,还可以通过细胞阻滞机制抑制肝星状细胞的活化,起到抗肝纤维化的作用。我们在体外光老化HDF中发现,miR⁃29家族的3个成员中仅miR⁃29c⁃3p表达显著上调,说明miR⁃29c⁃3p与光老化相关,相比于其他两个miR⁃29成员更可能参与调控光老化过程,这为下一步发现调控光老化成纤维细胞胶原合成的特异miRNA奠定了基础。本研究还通过体外构建过表达和抑制表达模型证明,miR⁃29c⁃3p能负性调节成纤维细胞的胶原蛋白表达。Plaisier等[14]和Sengupta等[15]也利用荧光素酶报告系统验证了COL1A1和COL3A1是miR⁃29c⁃3p的靶基因。因此,miR⁃29c⁃3p很可能通过调控胶原基因的表达参与光老化胶原蛋白合成。这一特异性上调的miRNA对研究光老化发病机制和干预手段新工具的开发都有重要的意义。
尽管我们的结果已证实miR⁃29c⁃3p在皮肤胶原合成中起重要作用,但miR⁃29c⁃3p和胶原表达水平之间并没有直接对等的化学剂量关系。例如,UVA连续照射后miR⁃29c⁃3p表达升高了5倍左右,伴随着胶原蛋白降低2倍左右,而miR⁃29c⁃3p模拟物转染(miR⁃29c⁃3p上调200倍以上)导致的胶原下调也仅2倍左右,表明miRNA靶基因结合位点不是miR⁃29调控靶基因mRNA的唯一决定因素,光老化中还可能存在另外的调控机制影响miR⁃29的作用和胶原合成减少的控制。我们推测,UVA可能会增加miR⁃29的作用,同样的现象也见于心肌梗死,心肌梗死后miR⁃29表达降低数倍,伴随着胶原mRNA表达增加20倍,而miR⁃29抑制物诱导的胶原合成仅略微增加[13],表明应激可能会增加miR⁃29的作用。
另外,也有研究报道,miR⁃29家族与自然衰老和病理性衰老有关[6]。研究发现,miR⁃29能够通过影响RNA稳定性、激活p53信号通路,导致DNA损伤,抑制B⁃Myb等途径抑制细胞增殖,促进细胞衰老[16⁃17]。这也解释了miR⁃29在自然衰老的皮肤组织中也存在上调现象[6]。特别的是,Suh 等[12]发现,miR⁃29特异性调控静止期细胞的细胞外基质,提示miR⁃29对细胞外基质的调控与其对细胞增殖和衰老的影响是分不开的。至于光老化皮肤中miR⁃29对光老化细胞的增殖和衰老的作用及对光老化胶原合成的影响,仍需要进一步研究。
本研究虽然发现miR⁃29c⁃3p与HDF胶原合成的调控有关,但具体的胶原调控机制、在光老化形成中的具体作用、UVA如何导致miR⁃29c⁃3p上调以及后者在活体的光老化皮肤中表达的情况等仍需进一步研究。
[1]Gilchrest BA.Photoaging[J].J Invest Dermatol,2013,133(E1):E2⁃6.DOI:10.1038/skinbio.2013.176.
[2]Griffiths CE,Russman AN,Majmudar G,et al.Restoration of collagen formation in photodamaged human skin by tretinoin(retinoic acid)[J].N Engl J Med,1993,329(8):530⁃535.DOI:10.1056/NEJM199308193290803.
[3]Li J,Zhang Y,Kuruba R,et al.Roles of microRNA⁃29a in the antifibrotic effect of farnesoid X receptor in hepatic stellate cells[J].Mol Pharmacol,2011,80(1):191⁃200.DOI:10.1124/mol.110.068247.
[4]Luna C,Li G,Qiu J,et al.Role of miR⁃29b on the regulation of the extracellular matrix in human trabecular meshwork cells under chronic oxidative stress[J].Mol Vis,2009,15:2488⁃2497.
[5]Sekiya Y,Ogawa T,Yoshizato K,et al.Suppression of hepatic stellate cell activation by microRNA⁃29b[J].Biochem Biophys Res Commun,2011,412(1):74⁃79.DOI:10.1016/j.bbrc.2011.07.041.
[6]Li T,Yan X,Jiang M,et al.The comparison of microRNA profile of the dermis between the young and elderly[J].J Dermatol Sci,2016,82(2):75⁃83.DOI:10.1016/j.jdermsci.2016.01.005.
[7]Deng W,Yuan P,Lai W,et al.A novel KRT5 mutation,p.Lys199Asn,is associated with three subtypes of epidermolysis bullosa simplex phenotypes in a single Chinese family[J].J Dermatol Sci,2011,64(3):241 ⁃243.DOI:10.1016/j.jdermsci.2011.09.003.
[8]Fisher GJ,Shao Y,He T,et al.Reduction of fibroblast size/mechanical force down⁃regulates TGF⁃β type II receptor:implications for human skin aging[J].Aging Cell,2016,15(1):67⁃76.DOI:10.1111/acel.12410.
[9]刘晨,赖维,许庆芳,等.连续长波紫外线照射对人皮肤成纤维细胞胞吞、降解弹性蛋白的影响[J].中华皮肤科杂志,2015,48(5):338⁃342.DOI:10.3760/cma.j.issn.0412⁃4030.2015.05.010.
[10]Lamore SD,Wondrak GT.UVA causes dual inactivation of cathepsin B and L underlying lysosomal dysfunction in human dermal fibroblasts[J].J Photochem Photobiol B,2013,123:1⁃12.DOI:10.1016/j.jphotobiol.2013.03.007.
[11]Roderburg C,Urban GW,Bettermann K,et al.Micro⁃RNA profiling reveals a role for miR⁃29 in human and murine liver fibrosis[J].Hepatology,2011,53(1):209 ⁃218.DOI:10.1002/hep.23922.
[12]Suh EJ,Remillard MY,Legesse⁃Miller A,et al.A microRNA network regulates proliferative timing and extracellular matrix synthesis during cellular quiescence in fibroblasts[J].Genome Biol,2012,13(12):R121.DOI:10.1186/gb⁃2012⁃13⁃12⁃r121.
[13]van Rooij E,Sutherland LB,Thatcher JE,et al.Dysregulation of microRNAs after myocardial infarction reveals a role of miR⁃29 in cardiac fibrosis[J].Proc Natl Acad Sci U S A,2008,105(35):13027⁃13032.DOI:10.1073/pnas.0805038105.
[14]Plaisier CL,Pan M,Baliga NS.A miRNA⁃regulatory network explains how dysregulated miRNAs perturb oncogenic processes across diverse cancers[J].Genome Res,2012,22(11):2302 ⁃2314.DOI:10.1101/gr.133991.111.
[15]Sengupta S,den Boon JA,Chen IH,et al.MicroRNA 29c is down⁃regulated in nasopharyngeal carcinomas,up⁃regulating mRNAs encoding extracellular matrix proteins[J].Proc Natl Acad Sci U S A,2008,105(15):5874⁃5878.DOI:10.1073/pnas.0801130105.
[16]Ugalde AP,Español Y,López⁃Otín C.Micromanaging aging with miRNAs:new messages from the nuclear envelope[J].Nucleus,2011,2(6):549⁃555.DOI:10.4161/nucl.2.6.17986.
[17]Ugalde AP,Ramsay AJ,de la Rosa J,et al.Aging and chronic DNA damage response activate a regulatory pathway involving miR⁃29 and p53[J].EMBO J,2011,30(11):2219⁃2232.DOI:10.1038/emboj.2011.124.
Effects of miRNA⁃29c⁃3p on the expression of collagen typeⅠα1 and collagen type Ⅲ α1 genes and the synthesis of collagenⅠandⅢ in chronically photodamaged human dermal fibroblastsin vitro
Song Xiaojing,Peng Yating,Chen Haiyan,Zheng Yue,Xu Qingfang,Gong Zijian,Lu Chun,Lai Wei
Department of Dermatology,The Third Affiliated Hospital,Sun Yat⁃sen University,Guangzhou 510630,China
Lai Wei,Email:drlaiwei@163.com
ObjectiveTo evaluate the effect of miRNA⁃29(miR⁃29)family on the synthesis of collagenⅠandⅢ in chronically photodamaged(photoaged)skin.MethodsSome cultured human dermal fibroblasts(HDFs)were divided into 2 groups:non⁃irradiated group receiving no treatment,and chronic photodamage group treated with repetitive ultraviolet A(UVA)radiation,which served as a chronically photodamaged cell model and was verified by flow cytometry and β ⁃galactosidase staining.Western blot analysis was performed to determine the protein expression of collagenⅠand Ⅲ,and real⁃time fluorescence⁃based quantitative PCR(qRT⁃PCR)to measure expression of 3 members of the miR⁃29 family(miR⁃29a⁃3p,miR⁃29b⁃3p and miR⁃29c⁃3p)in the above 2 groups.The differentially expressed miR⁃29c⁃3p between the above 2 groups was chosen for further functional tests.Some HDFs were divided into 4 groups to be transfected with fluorescein⁃labelled miR⁃29c⁃3p mimics(overexpression group),inhibitors(inhibition group),and their control RNA oligonucleotides(negative control group and inhibitor control group)respectively.The transfection efficiency was evaluated by the proportion of fluorescent cells,and the relative expression of miR⁃29c⁃3p in the above 4 groups was measured by qRT⁃PCR for evaluating the RNA interference efficiency.qRT⁃PCR was conducted to determine the mRNA expression of collagen typeⅠα1(COL1A1)and collagen type Ⅲ α1(COL3A1)genes,and Western blot analysis to measure the protein expression of collagenⅠandⅢ.ResultsCompared with the non⁃irradiated group,the chronic photodamage group showed significantly increased proportion of senescent cells(36.47% ±3.20%vs.12.56% ±1.46%,P<0.01)and G1⁃phase cells(71.70% ±2.43%vs.41.89% ±1.86%,P<0.01),but significantly decreased proportion of S⁃phase cells(10.63% ± 0.36%vs.36.48% ± 1.31%,P< 0.01),which indicated that the chronically photodamaged cell model was established successfully.The protein expression of collagenⅠandⅢwas significantly lower in the chronic photodamage group(0.40±0.19 and 0.52±0.10)than in the non⁃irradiated group(1.00±0.12 and 1.00±0.10,respectively,bothP< 0.01).The expression of miR⁃29c⁃3p was significantly higher in the chronic photodamage group than in the non⁃irradiated group(4.42±2.05vs.0.89±0.10,P<0.05),while there were no significant differences in the expression of miR⁃29a⁃3p or miR⁃29b⁃3p between the 2 groups(bothP> 0.05).Twenty⁃four hours after transfection,the overexpression group and inhibition group both showed more than 90%transfection efficiency which met the interference requirements.The expression of miR⁃29c⁃3p was significantly higher in the overexpression group than in the negative control group(224.17±2.00vs.2.45±0.34,P<0.01),but significantly lower in the inhibition group than in the inhibitor control group(0.20±0.08vs.2.24±0.14,P< 0.01),suggesting that a RNA interference model was successfully established.The mRNA expression of COL1A1 and COL3A1 and the protein expression of collagenⅠandⅢ were significantly lower in the overexpression group than in the negative control group and inhibition group(allP< 0.05),and significantly higher in the inhibition group than in the inhibitor control group(allP< 0.01).ConclusionThe expression of miR⁃29c⁃3p is up⁃regulated in chronically photodamaged HDFs,likely by regulating the mRNA expression of COL1A1 and COL3A1 and the protein expression of collagenⅠandⅢ.
Ultraviolet rays;Fibroblasts;MicroRNAs;Collagen type I;Collagen type III;Photoaging;miR⁃29
Fund program:National Natural Science Foundation of China(81673047)
赖维,Email:drlaiwei@163.com
10.3760/cma.j.issn.0412⁃4030.2017.12.003
国家自然科学基金(81673047)
2017⁃03⁃06)
周良佳 颜艳)
