四川慈竹生理生化指标对SO2胁迫的响应
2018-01-05王丽华
王丽华,高 景,刘 尉 ,李 西
(1.阿坝师范学院,四川汶川 623002;2.中国科学院成都生物研究所,成都 610041;3.成都市农林科学院,成都 611130;4.四川农业大学风景园林学院,成都 611130)
四川慈竹生理生化指标对SO2胁迫的响应
王丽华1,2,高 景2,刘 尉3,李 西4*
(1.阿坝师范学院,四川汶川 623002;2.中国科学院成都生物研究所,成都 610041;3.成都市农林科学院,成都 611130;4.四川农业大学风景园林学院,成都 611130)
【目的】研究SO2胁迫下四川慈竹(Neosinocalamus affinis)的抗性及净化能力。【方法】通过人工模拟熏气法研究SO2胁迫下慈竹叶片形态和生理生化指标变化,SO2处理设置为CK(自然状态,低于3 mg/m3SO2)、S1(30 mg/m3SO2)、S2(60 mg/m3SO2)。【结果】①慈竹叶片的叶脉在初期表现为点状伤斑而在后期为条状伤斑,受害程度表现为S2>S1>CK,且SO2浓度越高受害症状出现越早,受害程度越大;②SO2胁迫在时间上的持续和浓度上的增加,导致了慈竹叶绿素总量的增加;③SO2胁迫30 d后导致了慈竹净光合速率、气孔导度、蒸腾速率升高,且在S1时达到峰值,但在S2处下降;慈竹胞间CO2浓度随SO2浓度升高而降低;④慈竹叶的丙二醛、可溶性糖、脯氨酸(0~20 d)、可溶性蛋白、超氧化物歧化酶、过氧化物酶、过氧化氢酶、叶片硫含量均随SO2胁迫持续和浓度升高而升高,其中在30 d时,SO2处理下慈竹脯氨酸含量明显低于初始值和CK。【结论】慈竹能通过调节自身保护机制来应对低浓度SO2的逆境胁迫并维持正常生长,该结果可为城市SO2污染(雾霾、汽车尾气等)治理和城市园林绿化提供基础数据与理论依据。
慈竹;SO2;胁迫;生理生化指标
从工业革命至今,SO2污染问题一直伴随着人类社会发展,其来源方式较多,并且危害影响较大、历时较长、涉及范围较广[1-3]。20世纪对酸雨问题(SO2湿沉降)的治理,虽有效减缓了SO2污染带来的影响[4-5],但近年来随着雾霾、汽车尾气等城市污染问题(SO2干沉降)的日益加剧[6-7],SO2污染再次成为大气环境治理的热点之一。因此,深入了解SO2胁迫对植物的影响机理,同时利用植物净化作用来缓解SO2造成的大气污染,都将会成为解决当前SO2污染问题的重要课题和研究方向。
目前,国内外关于SO2污染对植物影响的研究较多,诸如不同植物在SO2污染胁迫下的生物学反应、渗透调节物质、保护酶抗氧化系统以及吸收净化等方面[2,3,8],但基于竹类对 SO2胁迫的研究并不多见。竹类是森林生态系统的重要组成部分之一,全球现有超过3.150×107hm2的竹林面积,并拥有1200多个竹种,而我国更是全球竹子起源和分布中心。竹类在城市园林绿化中占有不可替代的价值地位。慈竹(Neosinocalamus affinis)广泛分布于我国西南地区,尤其在四川地区其资源十分丰富[9]。同时,慈竹不仅是四川地区重要的经济竹种之一,也是城市园林绿化的常见植物[10]。随着SO2污染问题的日益严重,势必会对四川慈竹生长及其种植产业造成影响,并且目前关于这方面的基础研究相对较少[5]。因此,开展慈竹对SO2胁迫的响应研究,不仅在竹类的保护及资源利用上可提供更多有效的参考数据,同时对进一步完善SO2污染研究具有重要意义。
综上所述,本研究以四川慈竹为研究对象,采用人工模拟熏气法,以30 d为周期,通过研究不同SO2浓度熏气处理下慈竹叶片形态和生理生化指标的变化,探讨了四川慈竹对SO2胁迫的反应特征和响应机制,以期为城市SO2污染治理提供基础数据,也为城市园林绿化植物筛选提供理论基础。
1 材料和方法
1.1 试验地与试验材料
试验地位于雅安市雨城区四川农业大学科研园区。雅安多年平均气温16.2℃,≥10℃的积温5231℃,月平均最高温和最低温分别为29.9℃(7月)和3.7℃(1月),年均日照时数1039.6 h,无霜期298 d,多年平均降雨量1774.3 mm,空气平均湿度79%,属于亚热带湿润气候,受季风和地形的影响,冬无严寒,夏无酷热,气候温和,昼夜温差小,阴雨较多,光照不足,四季分明,立体气候明显。经多年观测,该区域空气SO2含量低于高等植物不受SO2伤害的临界浓度 3 mg/m3SO2[5,11]。
本研究以慈竹(Neosinocalamus affinis)为试验材料。于2015年3月盆栽慈竹15盆,随后适应性栽培1年。2016年4月选出9盆长势均匀且健康的慈竹以供试验。
试验熏香为自制加硫熏香,自制熏香释放SO2浓度均在若干次预试验测定后确定,确保每支自制熏香在燃放时释放的SO2浓度为4~6 mg/m3,熏香基质为粉末状的碎木屑等,并添加相应量的硫黄。
试验熏气室为密闭可开顶式塑料透光静态环境控制室(3 m×3 m×3 m),共设3室。试验测硫仪为现场大气 SO2测定仪(GDYK-402S,USA)。
1.2 试验设计
将9盆待试验的盆栽慈竹分别置于3个熏气室,每室3盆,3次重复。以高等植物不受SO2伤害的临界浓度3 mg/m3SO2为依据,设置3个SO2浓度水平,分别为自然状态(CK)、SO2浓度30 mg/m3(S1)、SO2浓度60 mg/m3(S2)。
试验周期为30 d(2016年5月1日—30日),每日上午6:00—9:00进行熏气,各熏气室依照所需SO2浓度,点燃熏香进行3 h的密闭熏气处理,过程中使用测硫仪监测SO2浓度,增减熏香控制所需SO2浓度水平(波动范围±5 mg/m3)。结束后将盆栽慈竹搬至室外,避免中午室内高温对试验造成干扰,同时打开熏气室换气系统释放SO2。待18:00以后对盆栽慈竹进行浇水,目的在于避免早上浇水影响SO2浓度。处理过程中注意以下两点:①熏气开始前和过程保证熏气室内的空气湿度和温度与室外尽量一致;②熏气周期内,不添加肥料,防止肥料中少量的硫元素干扰硫含量的测定。
1.3 测定指标与方法
处理开始后,每天观测并记录叶片受害状况。分别在5月10日、5月20日、5月30日对慈竹叶片进行采集,采样前先对每个处理的叶片光合指标进行测定,随后由上至下采集受害且成熟的叶片若干,带回试验室进行各项生理生化指标测定。
形态指标:每天处理前对慈竹叶片受害状况(症状时间和程度)进行观测与记录。
光合指标:采用便携式光合测定系统(LI-6400,USA)测定[12]。测定时在每个处理水平下慈竹的中部选取成熟完全展开叶片进行测定,从中选取10个连续稳定值并求其平均值,测定指标包括净光合速率(net photosynthesis rate,Pn)和相关气体交换参数,即气孔导度(stomatal conductance,Gs),蒸腾速率(transpiration rate,Tr),胞间 CO2浓度(intercellular CO2concentration,Ci)。叶绿素总量(Total Chl)采用丙酮乙醇等量混合法[12]。3次采样当天,选择取样之前,即当天上午10:00前后,对各处理进行光合指标测定。尽量保证环境温度在25~30℃,同时避开中午高温干扰。
生理生化指标:丙二醛(malondialdehyde,MDA)和可溶性糖(soluble sugar,SS)采用硫代芭比妥酸(TBA)比色法[12]。游离脯氨酸(proline,Pro)酸性茚三酮比色法[12]。可溶性蛋白质(soluble protein,SP)采用紫外吸收法[12]。3种主要保护酶活性[13],即超氧化物歧化酶(superoxide dismutase,SOD)采用氮蓝四唑(NBT)光化还原法(以0.5为一个活力单位,U)、过氧化物酶(peroxidase,POD)采用愈创木酚法(以 0.01为一个活力单位,U);过氧化氢酶(catalase,CAT)紫外分光光度法(以0.01为一个活力单位,U)。以上指标均为鲜重下测定。
叶片硫含量指标:采用硫酸钡比浊法[14]。该指标为干重下测定。
1.4 数据处理
采用Microsoft Office Excel 2010软件整理数据和绘制图表,并利用SPSS 19.0软件进行统计分析,对各项生理生化指标进行重复测量方差分析,采用最小显著差数法(LSD法)进行多重比较。
2 结果与分析
2.1 SO2胁迫对叶形态的影响
30 d观测记录显示,CK处理的慈竹叶片始终未出现SO2受害症状;S1处理在第20 d出现轻微SO2受害症状,即叶脉间出现点状伤斑,随后10 d症状略有加重,处理结束后叶片有明显的小条状伤斑,受害面积小于10%;S2处理在14d出现轻微SO2受害症状,随后症状逐渐扩散,处理结束后叶片出现明显的条状和块状伤斑,受害面积约30%。各处理受害程度为S2>S1>CK。同时观测还发现,叶片健康部分绿色程度呈现S1>S2>CK。可见,SO2浓度越高慈竹叶片受害时间越早,受害程度越大。
2.2 SO2胁迫对叶绿素的影响
从时间上看(图1),CK处理的慈竹叶绿素总量无明显变化(P>0.05),S1和S2处理整体呈现升高趋势(P<0.05),具体表现为 20 d>30 d>10 d>0 d,均在20 d达到最大值,且较0 d分别增加了33.25%(S1)和27.31%(S2)。所以,SO2胁迫会导致慈竹叶绿素总量增加。
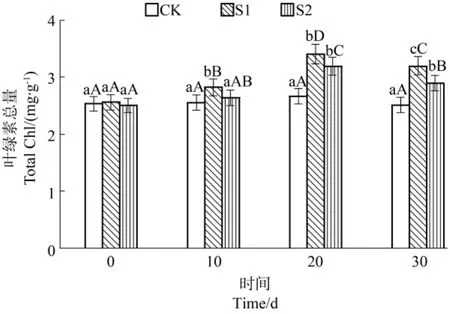
图1 SO2胁迫对不同处理水平下叶绿素总量的影响Figure1 Effects of SO2stress on total Chl in each treatment
从处理间看,随着时间持续,慈竹各处理间的叶绿素总量差异逐渐明显,在处理30 d后呈现S1>S2>CK(P<0.05)的趋势,S1较 CK 增加了 27.23%,S2则增加了15.14%。可见,随SO2浓度增加慈竹叶绿素总量同样增加,但不表现为线性增加。
2.3 SO2胁迫对净光合速率和相关气体交换参数的影响
光合测定显示在0~20 d内,慈竹光合指标在时间梯度和各处理间均无显著差异(P>0.05),仅在30 d测定时有所变化。从表1可看出,S1和S2的净光合速率、气孔导度、蒸腾速率较CK显著升高(P<0.05),但两个处理间差异不显著(P>0.05),其中S1增量最大,分别较CK增加了4.78%、25.00%、85.59%;而各处理的胞间CO2浓度大小呈现CK>S1>S2,且处理间差异显著(P<0.05),S1和S2较CK分别下降了43.01%和71.87%。可见,SO2胁迫对慈竹光合指标在0~20 d无明显影响,而在30 d后,SO2胁迫会导致净光合速率、气孔导度、蒸腾速率的升高,同时S1处理下达到最大,而胞间CO2浓度随SO2浓度升高而明显降低。

表1 SO2胁迫对不同处理水平下净光合速率和相关气体交换参数的影响(平均值±标准误,n=5)Table1Effects of SO2stress on Pn,Gs,Trand Ciin each treatment(means±SE,n=5)
2.4 SO2胁迫对丙二醛及渗透调节物质的影响
由图2(a)可知,在处理周期内,CK处理的慈竹叶MDA含量无明显变化(P>0.05),S1和S2处理则随时间持续呈明显升高趋势(P<0.05),均在30 d达到最大值,分别较初始值增加了84.24%和132.29%。而各处理间的MDA含量在10 d、20 d、30 d均呈现S2>S1>CK(P<0.05);在 30 d 时 S1 和S2 较 CK 增加了74.87%和125.33%。可见,持续的SO2胁迫会导致慈竹叶MDA含量明显升高;同时MDA含量随SO2浓度升高而升高。
由图2(b)可知,除CK外,S1和S2处理的慈竹叶SS含量均在20d后呈升高趋势(P<0.05),30d时达到最大值,分别较初始值分别增加了28.78%和48.88%。从处理间看,10 d时各处理间的SS含量无显著差异(P>0.05),20 d时S1和S2较CK明显升高(P<0.05),30 d 时 3 个处理间呈现 S2>S1>CK(P<0.05),S1和S2较CK增加了26.36%和48.97%。这说明,持续的SO2胁迫会导致慈竹叶SS含量明显升高;而且SS含量随SO2浓度升高而升高。
图2 (c)显示,在30 d处理时间内,CK处理的慈竹叶Pro含量无显著变化(P>0.05),而S1和S2处理则随时间持续呈先升高后降低的变化趋势(P<0.05),两者含量均在20 d达到最大,分别较初始值增加了69.29%和148.55%,最低含量出现在30 d,分别较初始值降低了27.14%和42.06%。在各处理下,10 d和20d时3个处理间均呈现S2>S1>CK(P<0.05),而30 d时三者呈现CK>S1>S2(P<0.05),S1和S2较CK降低了28.57%和42.85%。故而,持续的SO2处理会导致慈竹叶Pro含量先升高后降低;在0~20 d时Pro含量随SO2浓度升高而升高,而20~30 d时含量随SO2浓度升高而降低。
最后由图2(d)可得,CK处理的慈竹叶SP含量在时间上无明显变化(P>0.05),S1和S2处理则随时间持续呈升高趋势,其中S2处理各时间段差异性显著(P<0.05),但两个SO2处理均在30 d达到最大值,分别较初始值增加了12.26%(S1)和22.10%(S2)。处理间对比分析后,10 d和20 d时仅S2较CK有明显升高(P<0.05),而30 d时3 个处理间呈现S2>S1>CK(P<0.05),S1和S2较CK增加了12.36%和24.57%。可见,持续的SO2胁迫会导致慈竹叶SP含量缓慢升高;处理后期3个处理的SP含量呈现出明显的随SO2浓度升高而升高。
2.5 SO2胁迫对3种保护酶活性的影响
由图3(a)可知,除CK无变化外,S1和S2处理的慈竹叶SOD活性随时间持续呈逐渐升高趋势(P<0.05),均在30 d时达到最大,分别较初始值增加了73.52%(S1)和 144.73%(S2)。处理间分析表明,10 d、20 d、30 d时 3个处理间均呈现 S2>S1>CK(P<0.05),在30 d时S1和S2较CK增加了71.95%和133.89%。
由图3(b)可知,3个处理的慈竹叶POD活性在时间上的变化与SOD活性变化一致,也在30 d时达到最大,S1和S2处理分别较初始值增加了23.64%和35.94%。而处理间分析表明,10 d和20 d时两个SO2胁迫处理均明显高于CK(P<0.05),但两者之间差异性不显著(P>0.05),但30 d 3个处理间呈现S2>S1>CK(P<0.05),S1和S2较 CK 增加了 21.32%和34.50%。
由图3(c)可知,3个处理的慈竹叶CAT活性在时间上和不同时间段处理间的变化均与SOD活性变化一致。
从上述分析可知,持续的SO2胁迫会导致慈竹叶3种酶活性逐渐升高;同时3种酶活性均随SO2浓度升高而升高。
2.6 SO2胁迫对叶片硫含量的影响
由图4可知,随处理时间CK处理的慈竹叶片硫含量无明显变化(P>0.05),S1和S2处理整体呈现逐渐升高趋势(P<0.05),均在30 d达到最大值,且较0 d分别增加了 175.18%(S1)和 431.57%(S2)。各处理间的对比分析显示,慈竹各处理间的叶片硫含量差异随时间逐渐变大,处理结束后呈现S2>S1>CK(P<0.05)的趋势,S1较CK增加了175.75%,S2则增加了405.35%。可见,随SO2胁迫时间持续和浓度增加均会使得慈竹叶片硫含量增加。
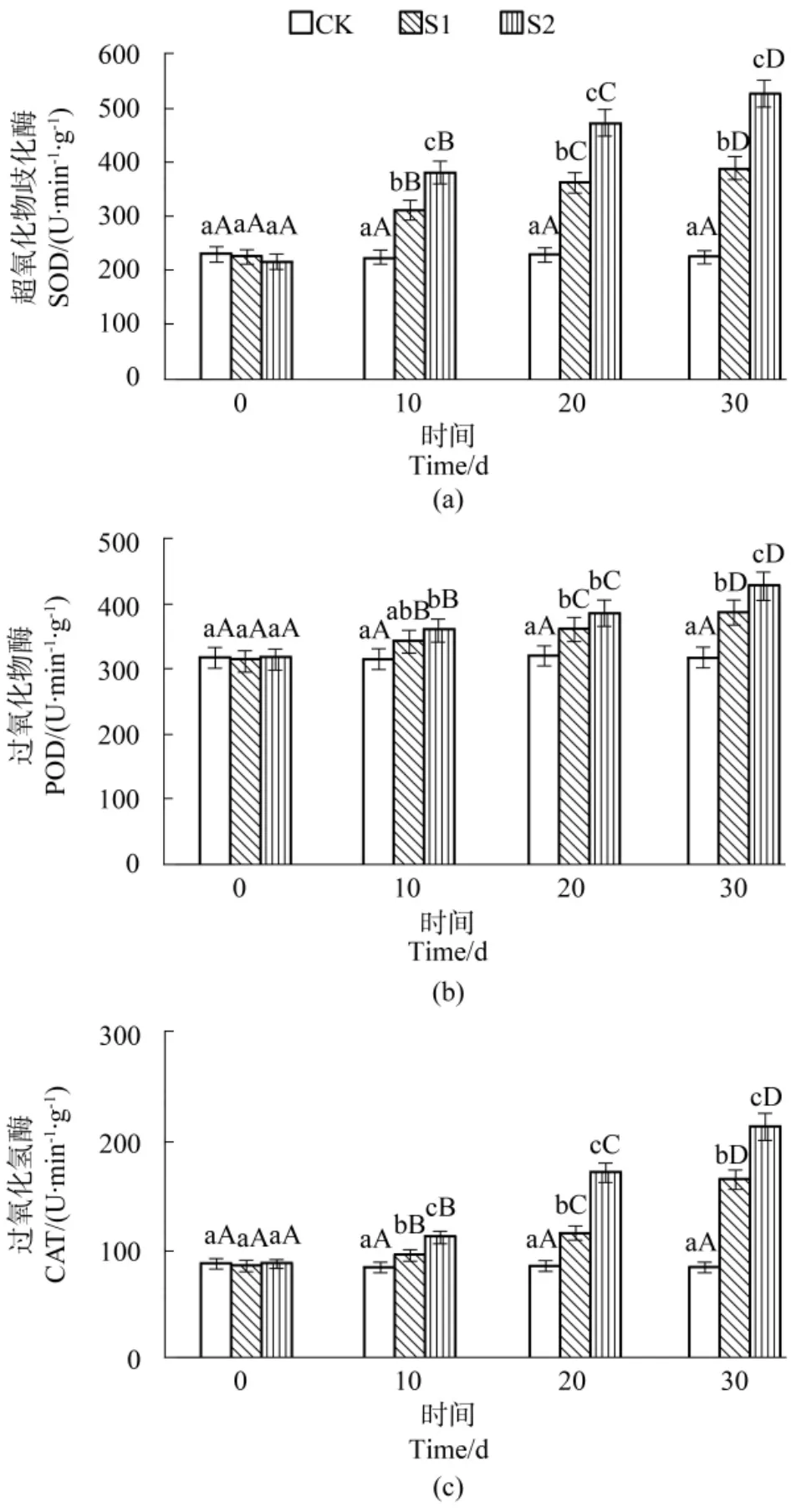
图3 SO2胁迫对不同处理水平下SOD(a)、POD(b)、CAT(c)的影响Figure3 Effects of SO2stress on SOD(a)、POD(b)and CAT(c)in each treatment
3 讨论
3.1 慈竹叶形态及其光合指标对SO2胁迫的响应
叶片作为植物最快和最明显的反应器官[15-16],同时其受害症状是植物对SO2胁迫最直接的表观反应。本研究结果表明,当SO2浓度大于高等植物受害临界浓度3 mg/m3时,慈竹叶出现受害症状与其他树种受害规律相似[5],具体表现为SO2浓度越高叶片出现受害症状越早,受害程度越大。多数研究[17-18]认为,在SO2胁迫下,最初叶脉间出现伤斑,由漂白引起失绿,逐渐呈棕色坏死,伤斑形状呈不规则的点状、条状或小块状,且伤斑区和健康区之间界限明显;随着胁迫的加剧,伤斑面积扩大,直至叶片萎蔫下垂或失水干枯。然而本试验中,慈竹在SO2胁迫下表现出较强的抗性,即在30 d最高浓度下,叶片受害面积仅约30%,这可能与慈竹叶片为C4结构有关,即不同叶片结构是导致树种抗SO2能力差异的主要原因之一[5,16]。
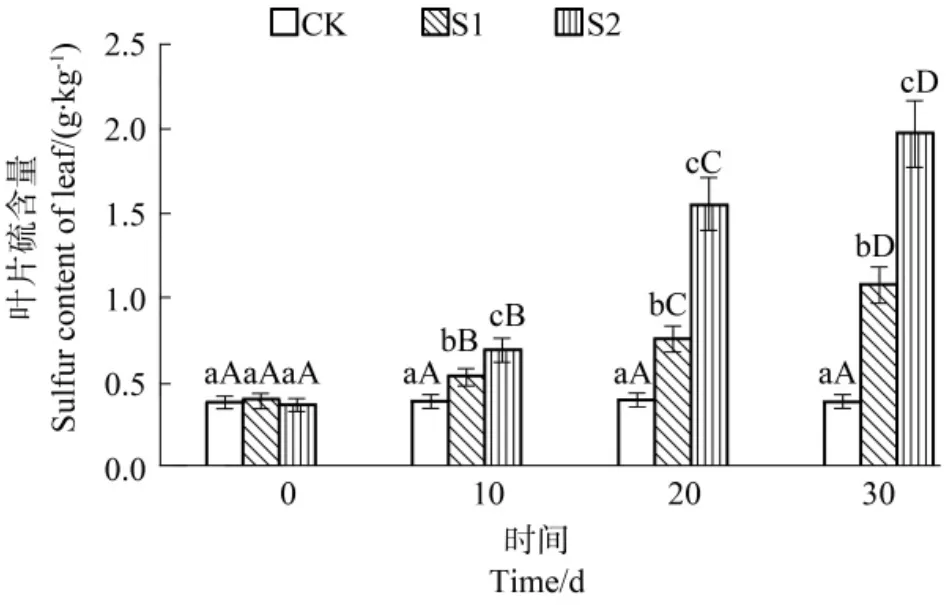
图4 SO2胁迫对不同处理水平下叶片硫含量的影响Figure4 Effects of SO2stress on sulfur content of leaf in each treatment
叶绿素在植物光合作用过程中扮演着重要的作用,其含量变化不仅直接影响光合作用的强弱,同时也决定了叶片的生理活动和植物对SO2胁迫的适应性和抗逆性[19-20]。我国较早时期关于SO2胁迫对植物叶绿素影响的机制研究有两种观点:①SO2胁迫加速了氧自由基的形成[11],进而导致叶绿素分解;②SO2胁迫促使亚硫酸离子氧化过程中产生大量自由基(多种自由基),叶绿素在这些自由基的漂白作用下被分解[24]。而在本研究中,SO2胁迫在时间的持续和浓度的增加上,导致了慈竹叶绿素总量的增加,除与慈竹[5]和水稻[21]的相关研究结果一致外,与其他多数研究均相反(叶绿素含量与SO2浓度呈负相关关系)[20,22-23]。因此,本研究推测原因为:植物在生长发育过程中需要硫元素,慈竹作为C4植物本身对硫元素的需求较大,当在一定SO2浓度内,SO2浓度的升高恰好为慈竹提供了大量硫元素,促进叶绿素合成过程(硫脂和生物酶等),进而导致叶绿素含量上升。此外,有研究认为较高叶绿素含量的植物对SO2胁迫的抗性一般较强,这可能是植物的一种自我保护机制[25-26]。
植物叶片的净光合速率是衡量光合作用强弱最直观的指标,相关气体交换参数则与净光合速率之间有着密切关系[27]。研究认为,影响植物光合速率的原因主要是气孔因素和非气孔因素[28-29]。本研究中慈竹净光合速率及其相关气体交换参数出现明显变化是在试验后期(30 d后),即SO2胁迫会导致净光合速率、气孔导度(气孔因素)、蒸腾速率(非气孔因素)的升高,同时S1处理下达到最大,而胞间CO2浓度(非气孔因素)则随SO2浓度升高而明显降低,然而这与竹类的胁迫研究结果并不一致[5,29]。同时这一结果很难解释慈竹净光合速率升高的原因。但结合相关慈竹叶片的光合研究和叶绿素升高的结果,本研究推断可能因慈竹是C4植物,其本身对CO2浓度的变化并不敏感[30],所以胞间CO2浓度的降低不会导致净光合速率下降,而慈竹叶绿素含量的升高可能才是净光合速率升高的主要原因[31]。
3.2 慈竹叶丙二醛及渗透调节物质对SO2胁迫的响应
植物体内的MDA是超氧化自由基作用于细胞膜中脂质发生过氧化反应的产物,其含量高低代表着植物受害程度和对胁迫逆境条件反应的强弱[8,32]。本研究结果表明,持续的SO2胁迫和浓度的增加会导致慈竹叶MDA含量明显升高。多数植物胁迫逆境的研究认为,MDA含量随胁迫持续或浓度升高而增加[33-35]。所以MDA含量增加表明植物在受到胁迫后,发生了一系列过氧化反应,进而堆积了大量的MDA,而植物只有通过渗透调节物质、保护酶等自身保护机制来应对MDA的升高。
渗透调节机制是植物对抗胁迫逆境重要的自我保护机制,渗透调节物质(SS、Pro、SP等)则是该机制的核心部分,通常情况下,渗透调节物质积累量越大表示植物抗性越强,一旦超过其承受范围则会破坏该机制导致渗透调节物质含量的下降[36-37]。本研究表明,SS、Pro(0~20 d)、SP 含量均随 SO2胁迫持续和浓度升高而升高,这与大多胁迫研究结果一致[5,14,19]。在逆境条件下,植物体的内压由于过多自由基的产生逐渐失去平衡,因此植物只有通过这些渗透调节物质来增强吸水和持水能力,维持自身膨压平衡,进而保持机体的正常生理过程[5,38-39]。而在30 d时,SO2处理下慈竹Pro含量低于初始值和CK,这说明胁迫可能超过了植株的耐受范围。
3.3 慈竹叶保护酶对SO2胁迫的响应
保护酶抗氧化系统是植物降低或消除过多活性氧对膜脂攻击能力的一套自身防御系统,是决定植物对SO2胁迫抗性的关键因素,同时在稳定植物体内自由基动态平衡、维持正常生理活动等方面具有十分重要的作用[5,14]。本研究中持续的SO2胁迫会导致慈竹叶3种酶活性逐渐升高;同时均随SO2浓度升高而升高,这与R.Mitfler等[40]研究结果一致。相关研究解释为,在SO2胁迫下植株产生大量活性氧,作为抗氧化系统中酶促子系统中最重要的3种保护酶,通过提高自身活性来清除这些活性氧,进而让植物维持体内活性氧产生与猝灭的动态平衡,从而阻止膜脂过氧化,减少MDA的积累,最终减轻SO2带来的伤害[41-42]。
3.4 慈竹叶硫含量对SO2胁迫的响应
在SO2污染环境下,植物通常会采用两种方式来适应:①通过叶片表皮毛等将SO2吸附于叶表面;②将吸收于植株内的SO2,通过降解或转化的方式将其加以同化利用[17,37]。而多数研究均表明,植物对于吸收SO2能力强弱主要与植物种类、叶片结构和成熟度、植株生长季节、外界环境因素有关[26],在一定SO2浓度范围内,植物吸收SO2的能力随浓度的增加而增强[16,37]。本研究中慈竹叶片硫含量同样随SO2胁迫时间持续和浓度增加而增加,同时试验中叶片硫含量均在30 d时达到最大值,这说明慈竹对SO2具有一定的吸收和净化能力。
综上所述,慈竹从叶形态和生理生化方面做出的反馈表明了对不同SO2浓度胁迫的适应性特征,同时也表明慈竹能够通过调节自身保护机制来应对低浓度SO2的逆境胁迫并维持正常的生长;根据不同浓度胁迫下慈竹的反应规律,表明其受害程度为S2>S1>CK;SO2胁迫下慈竹叶片中的硫含量增加同样说明了其对硫污染具有一定吸收和净化能力,但慈竹能否在城市大气SO2污染的净化植物方面具有开发潜力,甚至能否在雾霾、汽车尾气等治理工作上加以利用,仍需要进一步研究。
[1]AGRAWAL M,DEEPAK S S.Physiological and biochemical responses of two cultivars of two wheat to elevated levels of CO2and SO2,singlyandincombination[J].Environmental Pollution,2003,121:189-197.
[2]SHA C,WANG T,LU J.Relative sensitivity of wet land plants to SO2pollution[J].Wetlands,2010,30:1023-1030.
[3]UNSWORTH MH,ORMROD DP.Effects of gaseous air pollution in agriculture and horticulture[M].Oxford:Butterworth-Heinemann,2013:1326-1331.
[4]MANSFIELD T A.Stomata and plant water relations:does air pollution create problems[J].Environmental Pollution,1998,101:1-11.
[5]刘尉.SO2胁迫对四种主要造林树种的影响[D].温江:四川农业大学,2012.
[6]SU B,ZHAN M,ZHAI J,et al.Spation-temporal variation of haze days and atmospheric circulation pattern in China(1961—2013)[J].Journal of Statistical Computation and Simulation,2014,15(15):81-84.
[7]周峤.雾霾天气的成因[J].中国人口资源与环境,2015,(s1):211-212.
[8]李西,王丽华,刘尉,等.三种暖季型草坪草对二氧化硫抗性的比较[J].生态学报,2014,34(5):1189-1197.
[9]黄术,张新明.慈竹的基本特性及园林栽植技术[J].绿色科技,2016,(19):23-24.
[10]陈其兵,蒋瑶,卢学琴,等.四川不同地区慈竹的遗传多样性研究[J].西北农林科技大学学报(自然科学版),2009,37(6):187-193.
[11]曹洪法,刘厚田,舒俭民,等.植物对二氧化硫污染的反应[J].环境科学,1985,6(6):59-66.
[12]章家恩.生态学常用实验研究方法与技术[M].北京:化学工业出版社,2006:23-29.
[13]涂利华,胡红玲,胡庭兴,等.模拟氮沉降对华西雨屏区光皮桦林土壤酶活性的影响[J].应用生态学报,2012,23(8):2129-2134.
[14]王丽华,李西,刘尉,等.四种暖季型草坪草对SO2的抗性及净化能力的比较[J].草业学报,2013,22(1):225-233.
[15]李利红,仪慧兰,王磊,等.二氧化硫暴露对拟南芥叶片形态和生理生化指标的影响[J].农业环境科学学报,2008,27(2):525-529.
[16]宋彬,王得祥,张义,等.13种园林树种叶片解剖结构与其二氧化硫吸收能力的关系[J].西北植物学报,2015,35(6):1206-1214.
[17]赵晓丽.SO2胁迫对15种园林绿化树种生理生化指标的影响[D].兰州:甘肃农业大学,2008.
[18]CHUNG C Y,CHUNG P L,LIAO S E.Carbon fixation efficiency of plants influenced by sulfur dioxide[J].Environmental Nonitoring and Assessment,2011,173:701-707.
[19]王玲.两种彩叶女贞对SO2胁迫的生理响应研究[D].温江:四川农业大学,2015.
[20]孙凌霞,孙萍,蔡仕珍,等.四种冷季型草坪草对SO2胁迫的生理响应研究[J].草业学报,2014,23(4):237-244.
[21]韩超,张金恒.SO2毒害水稻叶片吸收光谱植被指数研究[J].农业环境科学学报,2009,28(11):2224-2231.
[22]BALSBERG-PAEHLSSONA M.Effects of heavy-metal and SO2pollution on the concentrations of carbohydrates and nitrogen in tree leave[sJ].Canadian Journal of Botany,1998,67:2106-2113.
[23]DELTORO V I,GIMENO C,CALATAYUD E.An effect of SO2fumigation on photosynthetic CO2gas exchange,chlorophyll a fluorescence emission and antioxidant enzymes in the lichens Everniaprunastri and Ramalinafarinacea[J].Plant Physiology,1999,105:648-654.
[24]刘荣坤.二氧化硫对植物光合色素伤害的机理[J].生态学进展,1989,6(2):102-109.
[25]KUDDUS M,KUMARI R,RAMTEKE P W.Studies on air pollu-tion tolerance of selected plants in Allahabad city India[J].Journal of Environmental Research and Management,2011,2:42-46.
[26]任广炼,石佳,郑文娟,等.黄连木抗二氧化硫能力研究[J].西南师范大学学报(自然科学版),2012,37(2):97-101.
[27]王建华,任士福.连翘光合作用特性及其影响因子分析[J].西北林学院学报,2010,25(6):41-45.
[28]FARQUHAR G D,SHARKEY T D.Stomatal conductance and photosynthesis[J].Annual Review of Plant Physiology,1982,33:317-345.
[29]谢寅峰,杨万红,陆美蓉,等.模拟酸雨胁迫下硅对鬓毛箬竹光合特性的影响[J].应用生态学报,2008,19(6):1179-1184.
[30]王健林,于贵瑞,王伯伦,等.北方粳稻光合速率、气孔导度对光强和CO2浓度的响应[J].植物生态学报,2005,29(1):16-25.
[31]应小芳,刘鹏.吕胁迫对大豆叶片光合特性的影响[J].应用生态学报,2005,16(1):166-170.
[32]RANIERI A,NALL C,LORENZINI G,et al.Ozone stimulates apoplastic antioxidant system in pumpkin leaves[J].Physiologia Plantarum,1996,97:381-389.
[33]刘爽,吴永波.土壤压实对树木脯氨酸及丙二醛含量的影响[J].武汉生物工程学院学报,2010,6(1):23-26.
[34]郭剑,李彩凤,陈明,等.碳酸钠胁迫对甜菜幼苗生长及保护酶的影响[J].植物生理学报,2015,51(6):840-846.
[35]闫忠业,吕天星,王冬梅,等.低温下六个苹果新品种抗性生理指标的比较[J].植物生理学报,2015,51(1):93-96.
[36]AKBAR A,SOLOKLUI G,ERSHADI A.Evaluation of cold hardinessin seven Iranian commercial pomegranate(Punicagranatum L.)cultivar[sJ].HortScience,2012,47(12):1821-1825.
[37]刘丹,陈保军,杨永贵,等.4种幼树对二氧化硫胁迫的抗性生理响应[J].西北植物学报,2013,33(12):2441-2450.
[38]MORGAN J M.Osmoregulation and water stress in higher plants[J].Annual Review of Plant Physiology,1984,(1):299-319.
[39]IMLAY J,LINN S.DNA damage and oxygen radical toxicity[J].Science,1998,240(4857):1302-1309.
[40]MITFLER R,VANDERAYWERA S,GOLLERY M,et al.Reactive oxygen gene network of plants[J].Trends in Plant Science,2004,9(10):490-498.
[41]窦宏伟,周菲,谢清忠,等.SO2胁迫对桑树部分生理生化特性的影响[J].蚕业科学,2010,36(1):126-131.
[42]MUMEER S,KIM T H,CHOI B C,et al.Effect of CO2,NOxand SO2on ROS production,photosynthesis and ascorbate-glutathione pathwayto induce Fragaria×annasa as a hyperaccumulator[J].Redox Biology,2014,(2):91-98.
Physio-Biochemical Responses of Neosinocalamus affinis to SO2Stress
WANG Li-hua1,2,GAO Jing2,LIU Wei3,LI Xi4*
(1.ABA Teachers University,Wenchuan 623002,Sichuan,China;2.Chengdu Institute of Biology,Chinese Academy of Sciences,Chengdu 610041,China;3.Chengdu Agriculture and Forestry Sciences,Chengdu 611130,China;4.College of Landscape Architecture,Sichuan Agricultural University,Chengdu 611130,China)
【Objective】The aim of the study was to investigate the resistance mechanism and purifying capacity of N.affinis to sulfur dioxide(SO2)pollution.【Method】An artificial fumigation manipulation was used to study the leaf morphology and physio-biochemical indicators of N.affinis in response to SO2stress.The levels of SO2were CK(control,under 3 mg/m3SO2),S1(30 mg/m3SO2)and S2(60 mg/m3SO2).【Results】①Lear vein of N.affinis exhibited punctiform injury in the early stage and striped injury in the late stage.Moreover,the damage degree was shown as S2>S1>CK.The injury symptoms appeared earlier and deeper under higher SO2concentrations.②The total content of leaf chlorophyll increased with increasing SO2concentration and treatment duration.③Leaf net photosynthesis rate(Pn),stomatal conductance(Gs)and transpiration rate(Tr)increased during the 30 days and peaked at the S1.Intercellular CO2concentration(Ci)decreased with increasing SO2concentration.④The malondialdehyde(MDA),soluble sugar(SS),protein content(Pro,0~20 d),activities of superoxide dismutase(SOD),peroxidase(POD),catalase(CAT)and leaf sulphur content of the were increased with an increase in both SO2concentra-tion and treatment duration.At the 30-day,Pro content was significantly lower than the initial value and CK.【Conclusion】N.affinis may adjust its stress protection system to adapt SO2stress and maintain normal growth.Such results provide basic data and theoretical basis for SO2pollution treatment(haze,automobile exhaust,etc.)and urban landscape.
Neosinocalamus affinis;SO2;stress;physiological and biochemical index
S718.4
A
1000-2650(2017)04-0547-08
10.16036/j.issn.1000-2650.2017.04.014
2017-07-17
四川省教育厅重点项目(17ZA0001);四川省科技厅应用基础项目(15JY0085)。
王丽华,讲师,博士。*责任作者:李西,教授,博士,主要从事园林生态方面的研究,Email:781221015@qq.com。
(本文审稿:阮少宁;责任编辑:巩艳红;英文编辑:徐振锋)
