生物组织光学透明技术研究进展
2017-12-19李亚敏薛成志李贵叶胡章立阮双琛陈玲玲
李亚敏, 薛成志, 李贵叶, 胡章立, 阮双琛, 陈玲玲
(1. 深圳市激光工程重点实验室; 2. 深圳大学 先进光学精密制造技术广东普通高校重点实验室; 3. 深圳大学 光电工程学院 电子科学与技术学院 生命与海洋科学学院, 深圳 518060;4. 深圳大学 电子科学与技术学院, 深圳 518060; 5. 深圳大学 生命与海洋科学学院, 深圳 518060)
生物组织光学透明技术研究进展
李亚敏1, 2, 5, 薛成志1, 2, 4, 李贵叶1, 2, 3, 胡章立5, 阮双琛1, 2, 3, 陈玲玲1, 2, 3
(1. 深圳市激光工程重点实验室; 2. 深圳大学 先进光学精密制造技术广东普通高校重点实验室; 3. 深圳大学 光电工程学院 电子科学与技术学院 生命与海洋科学学院, 深圳 518060;4. 深圳大学 电子科学与技术学院, 深圳 518060; 5. 深圳大学 生命与海洋科学学院, 深圳 518060)
生物组织光学透明技术是一种将完整的不透明的生物组织器官经过光学透明处理后实现高透明且完整的新技术,可进一步结合光学成像技术实现完整组织器官的荧光/吸收三维立体成像,具有传统切片技术无法替代的性能,是生物医学光子学领域的研究热点。综述了组织光学透明技术的概念、原理及具体的实现方法和步骤,介绍了其在生物医学尤其是脑科学领域的研究现状和部分成果,比较了各方法不同参数的优劣,并就未来的挑战和发展应用研究进行了讨论。
生物组织光学透明;组织透明;生物系统样本成像;生物医学光子学
现代生命科学和生物医学的研究愈加倚重于对样本的精确观测,根据此需求发展起来的生物医学光子学技术涉及生物系统以光子形式释放的能量,以及光子所携带的有关生物系统的结构与功能信息等方面,受到了重视并得到快速发展。其中,高精度的三维光学(荧光/吸收)成像技术因其特异性好、灵敏度高、分辨率高,以及非入侵式等优点在生物医学的研究中获得广泛应用,是重要和常用的研究方法。但是生物组织内存在的光散射和光吸收[1-3]等问题限制了组织内部的深度成像,使得光学技术只能作用于浅表组织。
近年来随着生物医学迅速发展,生命科学医学研究从人工痕迹较重的细胞研究过渡到了更具生理含义的组织、器官甚至模式动物的研究。为了获得这些组织器官的三维光学成像,常见的技术是进行组织切片再分层成像。但传统的组织切片技术费时费力而且其切片过程破坏器官的完整性和某些细胞亚细胞结构的连续性,易导致获得的细胞生理信息部分丢失。因此,随着生物医学光子学的发展,迫切需求发展能保持组织完整性且能够高透明的方法,生物组织光学透明技术便应运而生。它将组织内部的光散射和吸收降低,从而显著提高光在组织内的穿透深度,形成高透明性,进一步结合光学成像技术在完整的组织器官内实现高分辨的荧光/吸收光学成像。
国际上在早期一直使用最简单的BABB(benzylbenzoate,benzylalcohol)光学透明技术,但随着脑科学研究的发展,从2011年开始光学透明技术大力兴起并快速发展。文章综述了光学透明的原理和主要技术方法,介绍了其在生物医学的发展现状和部分成果在生物医学研究领域的应用,并比较了不同技术间的各参数优劣,就进一步的发展进行讨论。
1 生物组织光学透明主要技术方法
生物组织的不透明因素是组织对传播光的吸收以及组织内不同物质的不同折射率引起的光散射。生物组织光学透明技术(Tissue optical clearing technique)是将完整的不透明的生物组织经生化试剂混合溶液进行灌注、浸泡、电泳等处理后,获得高透明生物组织样本的方法。其原理主要是通过物化方法降低组织内部由于折射率(refractive index, RI)的不均一性(水RI=1.33、脂类RI>1.45、蛋白RI>1.44)所引起的光散射,从而使得组织透明。此外也可降低组织内部的内源性色素(如血红素、核黄素、黑色素、脂褐素[4])等对光产生的强吸收的影响因素,增加光穿透深度。
早在1914年,Spalteholz[5]首次采用苯甲醇和水杨酸甲酯作透明剂进行组织透明用于解剖学和生物医学方面的研究,极大地推动了解剖学和生物医学的发展。近年发展起来的生物组织光学透明技术根据它们采取的透明机制主要形成了被动型和主动型的两大类方法(如图1)。被动型透明技术在对组织透明的过程中仅依靠生化溶剂在组织中的被动扩散来完成。主动型透明技术是在透明过程中引入较强的外力(如电场力)去除折射率高的皮脂类物质等从而减小折射率差达到透明。
1.1 被动型光学透明技术
被动型方法因为其原理清晰,设备要求低等突出优点而成为光学透明技术发展到现在的主要研究领域和热点。其中依据其采用的生化试剂种类不同主要分为:1)有机溶剂型;2)亲水溶剂型。
1.1.1 有机溶剂型光学透明方法
有机溶剂型透明方法是先用脱水剂渐进地完全脱去生物组织样本中的水分,然后用高折射率的疏水性有机溶剂进行折射率匹配,部分方法在脱水后增加去脂步骤(使得样本更加透明)。属于有机溶剂型透明方法主要有BABB(苯甲醇和苯甲酸卞酯体积比为1∶2)[6],DBE(Benzyl ether,二苄醚)[7],3DISCO (3D imaging of solvent-cleared organs)[8-10],iDISCO(immunolabeling-enabled three-dimensional imaging of solvent-cleared organs)[11]和uDISCO(ultimate DISCO)[12]等。
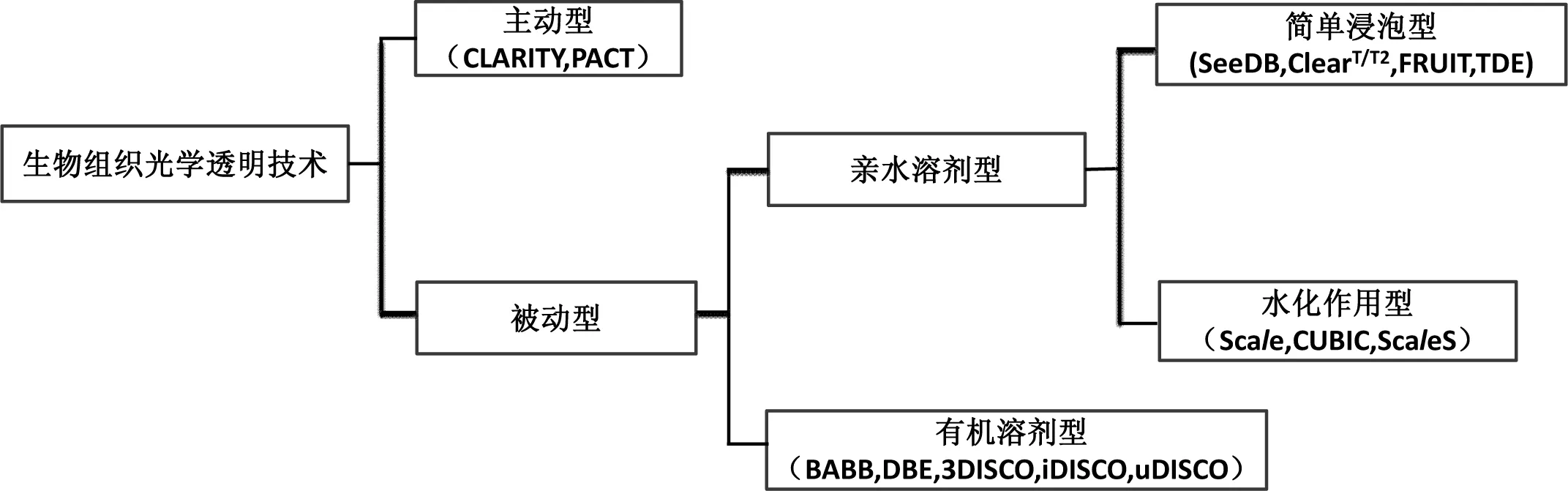
图1 生物组织光学透明技术分类

方法Methods脱水(渐进过程)Dehydration去脂Degreasing折射率匹配阶段RImatchingBABB甲醇/乙醇[30%,50%,70%,80%,96%,100%,100%,(V/V)]/BABBDBE四氢呋喃[50%,70%,80%,96%,100%,100%,(V/V)]/二苄醚3DISCO四氢呋喃[50%,70%,80%,96%,100%,100%,(V/V)]二氯甲烷二苄醚iDISCO四氢呋喃[50%,70%,80%,96%,100%,100%,(V/V)]二氯甲烷二苄醚uDISCO叔丁醇[30%,50%,70%,80%,96%,100%,100%,(V/V)]二氯甲烷BABB、二苯醚、维生素E混合液
传统的BABB透明方法(也称为Murray透明方法)是采用梯度浓度的乙醇或甲醇[30%,50%,70%,80%,96%,100%,100%,(V/V)]对样本进行脱水,接着用BABB试剂(RI=1.55)进行匹配。为了改进BABB对荧光蛋白信号的淬灭问题,DBE透明方法(Becker,2012)采用了四氢呋喃(Tetrahydrofuran,THF)进行脱水,之后用二苄醚(RI=1.56)进行匹配,可以部分保留绿色荧光蛋白信号。3DISCO方法(Erturk,2012)为了提高BABB方法的透明效率,则在用THF的脱水和DBE的匹配过程中引入一个二氯甲烷溶液的脱脂步骤。iDISCO(Renier,2014)则是在3DISCO技术透明样品前进行多种免疫标记(神经营养因子受体TrkA,TrkB,TrkC,Ret等),证实了此方法的光学透明和免疫标记的良好兼容性。uDISCO透明方法(Pan,2016)是对3DISCO的进一步改进,采用叔丁醇脱水以及BABB、二苯醚 (diphenyl ether, DPE)和0.4%(V/V)维生素E(Vitamin E)的混合液[例如:BABB-D4,BABB和DPE体积比为4∶1再加上0.4%(V/V) Vitamin E,BABB-D15, BABB和DPE体积比为15∶1再加上0.4%(V/V) Vitamin E]来进行最后的折射率匹配,部分解决了BABB和3DISCO极易淬灭荧光蛋白信号的问题。
上述有机溶剂型透明方法总体而言清洗效率和透明度高,荧光蛋白信号保存度低,其中荧光蛋白保存能力(uDISCO>3DISCO/iDISCO/DBE>BABB),组织形态维持能力(BABB>3DISCO/iDISCO/DBE>uDISCO)。在对器官的适用性上,仅BABB法不能透明成年小鼠的中枢神经系统[8]。
1.1.2 亲水溶剂型光学透明方法
亲水溶剂型与有机溶剂型透明方法的最大区别在于选择的生化试剂是否有强亲水性。由于荧光蛋白分子上带有亲水基团,亲水型溶剂相比较有机溶剂更利于荧光蛋白的保存,更适用于用来透明化表达荧光蛋白的组织样本(如Thy1-YFP转基因的小鼠大脑,可直接透明后通过光学成像技术观测神经元[13])。此方法根据具体的透明机制细分为:1)简单浸泡型;2)水化作用型。
1)简单浸泡型光学透明方法
简单浸泡型透明方法是将样品浸泡在梯度浓度的高渗透性亲水性溶液中,利用相应梯度浓度溶液将低折射率的组织液和胞液(基质)逐步替换出来,从而在组织内部形成一个折射率匹配的环境,使样本变得透明。属于简单浸泡型透明方法有:SeeDB(See Deep Brain)[13],ClearT/T2[14-15],FRUIT(fructose and urea induced transparency)[16],TDE(2,2′-Thiodiethanol,硫二甘醇)[17-18]。

表2 简单浸泡型透明方法
SeeDB(Ke,2013)是一种以果糖溶液作为主要透明试剂的温和透明方法,其过程是采用梯度浓度的果糖溶液[20%,40%,60%,80%,100%,115%(室温)/130%(37℃),(W/V)]逐渐清洗样本[为防止组织褐化每种浓度的果糖溶液都需加入0.5%(V/V) 1-硫代甘油]。ClearT方法(Kuwajima,2013)采用梯度浓度的甲酰胺溶液[20%,40%,80%,95%,95%,(V/V)],而ClearT2则是为了更好保存荧光蛋白信号在梯度甲酰胺中引入了不同比例的聚乙二醇[25%(V/V)/10%(W/V)逐渐清洗样本,50%(V/V)/20%(W/V),50%(V/V)/20%(W/V)]。FRUIT方法(Hou,2014)是SeeDB一个改进,采用梯度的尿素和果糖混合液[20%/48%,40%/48%,60%/37%,80%/28%,100%/11%,115%/2%,(W/V)]对样本逐渐清洗[同理每种溶液都需加入0.5%(W/V) 1-硫代甘油]。TDE方法(Aoyagi,2015)采用的是梯度浓度的硫二甘醇溶液[30%,60%,97%,(V/V)]透明样本。值得注意的是,最后匹配折射率的硫二甘醇溶液浓度越高,其折射率高样本越透明,但荧光蛋白信号极易淬灭。
上述简单浸型泡法总体而言是温和简单,但透明效率较低。其中保存荧光蛋白信号能力(SeeDB/FRUIT>ClearT2>ClearT>TDE),透明效率(TDE>ClearT2>ClearT> FRUIT/SeeDB)。只有TDE和FRUIT能用于成年小鼠脑透明;ClearT2,ClearT, SeeDB仅限于新生鼠或者胚胎透明。

表3 水化作用型透明方法
2)水化作用型光学透明方法
水化作用型透明方法主要是基于尿素介导的水化作用下细胞膜的流动性增加,进出膜上的分子通量增多,从而使得其他试剂能较好渗透进入细胞内逐步除去样本中高折射率的脂类从而使得样本透明。属于水化作用型透明方法有:Scale,[19]CUBIC(clear unobstructed brain imaging cocktails and computational analysis)[20-22], ScaleS[23]。
Scale方法(Hama,2011)是将样本简单浸泡在ScaleA2[4 mol/L尿素+10%(W/V)甘油]或者ScaleU2[4 mol/L尿素+30%(W/V)甘油+0.1%(V/V)TritonX-100)]溶液中逐渐透明,清洗时间长达数周甚至数月,样本膨胀较大。CUBIC(Susaki,2014)方法则改进成三个阶段,首先将样本放入CUBIC1[25%(W/W)尿素+25%(W/W)依地醇+15%(W/W)TritonX-100)]中处理去脂,然后用磷酸缓冲盐溶液(phosphate buffer saline,PBS)清洗,最后放入CUBIC2[25%(W/W)尿素+50%(W/W)蔗糖+10%(W/W)三乙醇胺,RI~1.49]中进行折射率匹配。因为第一阶段的水化过程会导致组织的膨胀,从而加入过渡的PBS清洗阶段使得样本体积回缩。ScaleS方法(Hama,2015)是将样本放入S0[20%(W/V)山梨醇+5%(W/V)甘油+1 mmol/L γ环糊精+1 mmol/L甲基β环糊精+1%(W/V)奥沙西罗+3%(V/V)二甲基亚砜进行通透(提升细胞膜的通透性,便于透明试剂较快进入组织)],随后依次放入S1[20%(W/V)山梨醇+10%(W/V)甘油+4 mol/L尿素+0.2%(W/V)TritonX-100],S2[27%(W/V)山梨醇+2.7 mol/L尿素+0.1%(W/V) TritonX-100+8.3%(V/V)二甲基亚砜],S3[36.3%(W/V)山梨醇+2.7 mol/L尿素+9.1%(V/V)二甲基亚砜]溶液中渐进水化,再用PBS溶液清洗回缩组织,最后转入S4[40%(W/V)山梨醇+10%(W/V)甘油+4 mol/L尿素+0.2%(W/V)TritonX-100+15-20%(V/V)二甲基亚砜]溶液中进行折射率匹配。
水化作用型透明方法相对简单,浸泡型清洗速率较快,透明度较高。其保存荧光蛋白能力Scale>ScaleS>CUBIC,透明效果和透明效率从大到小排序为CUBIC>ScaleS>Scale。值得注意的是由于CUBIC方法引入了高浓度的去污剂[15%(W/W) Triton X-100],会一定程度地破坏细胞膜结构,所以不能和DiI(1,1′-dioctadecyl-3,3,3′,3′-tetramethylindocarbocyanine perchlorate,细胞膜红色荧光探针)染色相兼容。

表4 主动型透明方法
1.2 主动型光学透明技术
主动型透明方法主要是指透明过程中引入较强的外力去除折射率高的皮脂类物质,相对于被动型方法步骤更为复杂且对设备要求更高。其主要包含以下三个步骤:1)水凝胶包埋步骤:利用水凝胶包埋固定组织;2)脂类去除步骤:采用外力(如电场力)强制去除脂类物质;3)折射率匹配步骤:脂类去除后的组织浸泡在高折射率溶液中如FocusClear[24],80%甘油,RIMS(refractive index matching solution)溶液中产生高透明的样本。主动型透明方法主要有CLARITY(clear lipid-exchanged acrylamide-hybridized rigid imaging/immunostaining /in situ hybridization-compatible tissue-hydrogel)[25-28]和PACT(passive clarity technique)[29-30]。
CLARITY方法(Chung,2013)采用心脏灌注水凝胶溶液[40%(W/V)丙烯酰胺+2%(W/V)双丙烯酰胺+10%(W/V)VA-044initiator+16%(W/V)PFA]产生水凝胶,之后将组织取出放入干燥箱中用氮气取代氧气,37℃孵育组织3 h直到所有溶液发生聚合(包埋固定步骤完成)。之后用特定设备通过电泳的方法强制性去除样品中的脂质,最后将样本放入FocusClear或80%甘油溶液匹配获得高透明的样本。尽管其透明能力强,但CLARITY中存在电泳法的难以操控性和组织褐化等问题。为了解决上述问题,PACT透明方法(Bin,2014)在CLARITY基础上结合了被动型透明方法,具体过程是在水凝胶包埋组织后其采用8%SDS(十二烷基硫酸钠)来替代电泳法去除脂类,最后转入RIMS[88%(W/V)碘海醇+0.1(V/V)tween-20]溶液中匹配透明。虽然PACT克服了CLARITY因电泳导致组织褐化和降解以及重复性差的问题,但是其透明速率相较于CLARITY更低,并且会出现很大的组织膨胀[12]。
2 不同生物组织光学透明技术的比较
对光学透明技术的能力比较,主要从其透明能力,清洗效率,荧光蛋白保存度,与脂类染料的匹配性,操作流程复杂性,成本等方面展开。综合上述介绍的光学透明技术,有机溶剂型方法得到的透明度最高、透明速率最快、能适应于多种组织和器官。其缺点是所采用的试剂大多是毒性较强,并且容易淬灭内源性荧光蛋白的信号,不能和细胞膜上亲脂性追踪分子染料如DiI相兼容,清洗后组织体积会有明显收缩,组织或器官内部精确三维结构部分丢失。主动型透明方法部分解决了有机溶剂型透明方法的中荧光蛋白容易淬灭问题,但是其清洗速率和样本透明度会有一定程度降低,此外其操作过程最为复杂,可重复性低。与前面两种技术相比较水化作用型透明技术样本透明度和透明速率出现进一步下降,但是可更好保存内源性荧光蛋白信号。而对于简单浸泡型透明技术而言该技术对成年的样本透明速率低下,透明度最低,但能够同脂质追踪染料相搭配,组织形态结构保存较为完好,同时也能很好保存内源性荧光蛋白的信号。具体技术指标的比较见表5。
3 生物组织光学透明技术的应用
由于组织光学透明技术可以将完整的不透明的生物组织器官实现高透明,它进一步结合各种光学成像技术实现完整组织器官的荧光/吸收三维立体成像及标记目标的定量测量,在生物医学研究领域有巨大的应用前景。到目前为止,主要集中在以下方面。
1)重要生物样本的形态结构的直观观察。Dodt等[6]用BABB完成对新生鼠脑、鼠胚胎、果蝇等模式动物的透明和三维立体成像。Ertürk等[31-32]用3DISCO完成对大脑、脊髓、肺、脾、免疫器官和肿瘤等组织器官的透明成像工作。还可与多种标记方法搭配,如荧光蛋白、合成的荧光染料、抗体标记等。Pan等[12]用uDISCO透明方法成功完成了对小鼠全身脊髓干细胞的定位和追踪。张云翔等[33]运用基于被动扩散原理建立的CLARITY,在尽可能保存脑组织精细结构的前提下,完成了大鼠脑组织海马的透明工作。段红梅等[34]比较了iDISCO和CUBIC两种透明技术在脊髓细胞骨架蛋白(NF)免疫荧光中的染色效果,结果表明iDISCO透明技术效果更好,同时应用iDISCO透明技术和免疫荧光染色相结合的方法可以完整观察脊髓轴突。

表5 不同组织光学透明技术比较
2)临床生理疾病的研究。CLARITY技术已用于对一位七岁大的自闭症男孩的脑组织进行了透明然后分析。结果发现,在这名患儿大脑皮质部分里的神经元细胞像梯子一样地聚集在一起,与正常情况下的分支状结构区别明显;Hama等[23]用ScaleS处理患阿尔兹海默症病人脑后发现核心的Aβ斑块通常远离小胶质细胞,同时与小胶质细胞几乎没有联系;在糖尿病研究中,Eriksson等[35]将BABB透明法和免疫荧光及光学投影层析技术结合起来研究β细胞在胰腺中的分布情况。
4 生物组织光学透明技术存在的问题和展望
虽然近10年来生物组织透明处理技术获得了快速的发展但是仍然存在一些问题:1)BABB,3DISCO等透明方法存在内源的荧光蛋白淬灭问题和亲脂性神经追踪分子不兼容的问题[6-12];2)3DISCO,PACT,CUBIC透明方法透明后组织块中的细胞结构和亚细胞结构的保护问题[23];3)SeeDB,ScaleS等透明方法样本仍然集中在介观(mm~cm)量级,主要是一些组织、器官和小型模式动物[12-23];4)如何实现清洗能力高、效率快,又能良好保存内源性荧光蛋白以及组织形态结构等因素的平衡调节[21,23];5)几乎所有透明方法都无法清洗富含黑色素组织如眼珠,毛发等组织;6)如何开发与生物组织光透明技术相匹配的更高性能的显微成像设备(目前无论是双光子显微镜其观察的深度都难以超过8 mm[19],难以完全显示透明后大的组织器官的研究优势)。
生物组织光学透明技术使得人们得以从系统生物学水平更深入了解了不同组织器官中的生命活动,未来的重大挑战是完成啮齿动物整个身体和灵长类动物大组织器官的透明工作[4]。该项技术能应用于基础生命科学领域,通过对透明后全身组织器官进行高通量的三维成像可以找出与药物发生相互作用的靶器官或者靶细胞,这使得该项技术未来有望用于药物开发领域[36]。通过对透明后的大量临床样本进行三维分析将有助于发现更多疾病的相关细胞,这能提高临床诊断的敏感性和准确性,为治疗提供更好的帮助, 这使得该项技术未来有望用于临床研究领域[37]。
[1]VARERY T. Tissue optics: light scattering methods and instruments for medical diagnosis, second edition[M]. New Delhi:Spie Publications, 2000.
[2]GRATTON E. Deeper tissue imaging with total detection[J]. Science, 2011, 331(6020): 1016-1017.
[3]TUCHIN V V, MAKSIMOVA I L, ZIMNYAKOV D A, et al. Light propagation in tissues with controlled optical properties[J]. Journal of Biomedical Optics, 1997, 2(4): 401-417.
[4]TAINAKA K, KUNO A, KUBOTA S I, et al. Chemical principles in tissue clearing and staining protocols for whole-body cell profiling[J].Annual Review of Cell & Developmental Biology, 2016, 32(1): 713-741.
[5]SPALTEHOLZ W. ÜBER das Durchsichtigmachen von menschlichen und tierischen Präparaten und seine theoretischen Bedingungen, nebst Anhang[J]. Agris, 1914,22.
[6]DODT H U, LEISCHNER U, SCHIERLOH A, et al. Ultramicroscopy: three-dimensional visualization of neuronal networks in the whole mouse brain[J]. Nature Methods, 2007, 4(4): 331-336.
[7]BECHER K, JAHRLING N, SAGHAFI S, et al. Chemical clearing and dehydration of GFP expressing mouse brains[J]. PLoS One, 2012, 7(3): e33916.
[8]ERTÜRK A, BECKER K, JHRLING N, et al. Three-dimensional imaging of solvent-cleared organs using 3DISCO[J]. Nat Protoc, 2012, 7(11): 1983-1995.
[9]ERTÜRK A, BRADKE F. High-resolution imaging of entire organs by 3-dimensional imaging of solvent cleared organs (3DISCO)[J]. Experimental Neurology, 2012, 242:57-64.
[10]ERTÜRK A, LAFKAS D, CHALOUNI C. Imaging cleared intact biological systems at a cellular level by 3DISCO[J]. Journal of Visualized Experiments Jove, 2014(89):e51382.
[11]RENIER N, WU Z, SIMON D J, et al. iDISCO: a simple, rapid method to immunolabel large tissue samples for volume imaging[J]. Cell, 2014,159(4): 896-910.
[12]PAN C, CAI R, QUACQUARELLI F P, et al. Shrinkage-mediated imaging of entire organs and organisms using uDISCO[J]. Nature Methods, 2016, 13(10):859-867.
[13]KEe M T, FUJIMOTO S, IMAI T. SeeDB: a simple and morphology-preserving optical clearing agent for neuronal circuit reconstruction[J]. Nat Neurosci, 2013,16(8): 1154-1161.
[14]KUWAJIMA T, SITKO A A, BHANSALI P, et al. Clear T: a detergent-and solvent-free clearing method for neuronal and non-neuronal tissue[J]. Development, 2013,140(6): 1364-1368.
[15]WANG J, YU T, QI Y, et al. A simple optical clearing method for tissue block[C]// Opto-Electronics and Communications Conference, 2015:1-3.
[16]HOU B, ZHANG D, ZHAO S, et al. Scalable and DiI-compatible optical clearance of the mammalian brain[J]. Frontiers in NeuroAnatomy, 2015, 9:19.
[17]AOYAGI Y, KAWAKAMI R, OSANAI H, et al. A Rapid optical clearing protocol using 2, 2′-thiodiethanol for microscopic observation of fixed mouse brain[J]. PloS One, 2015, 10(1): e0116280.
[18]COSTANTINI I, GHOBRIL J P, Giovanna A P D, et al. A versatile clearing agent for multi-modal brain imaging[J]. Scientific Reports, 2015, 5: 9808.
[19]HAMA H, KUROKAWA H, KAWANO H, et al. Scale: a chemical approach for fluorescence imaging and reconstruction of transparent mouse brain[J]. Nat Neurosci, 2011,14(11): 1481-1488.
[20]SUSAKI E A, TAINAKA K, PERRIN D, et al. Whole-brain imaging with single-cell resolution using chemical cocktails and computational analysis[J]. Cell, 2014,157(3): 726-739.
[21]SUSAKI E A, TAINAKA K, PERRIN D, et al. Advanced CUBIC protocols for whole-brain and whole-body clearing and imaging[J]. Nature Protocols, 2015, 10(11): 1709-1727.
[22]TAINAKA K, KUBOTA S I, SUYAMA T Q, et al. Whole-body imaging with single-cell resolution by tissue decolorization[J]. Cell, 2014, 159(4): 911-924.
[23]HAMA H, HIOKI H, NAMIKI K, et al. Scale S: an optical clearing palette for biological imaging [J]. Nature Neuroscience, 2015, 18(10): 1518-1529.
[24]CHIANG A S, LIN W Y, LIU H P, et al. Insect NMDA receptors mediate juvenile hormone biosynthesis[J].Proceedings of the National Academy of Sciences, 2002, 99(1):37-42.
[25]CHUNG K, WALLACE J, KIM S Y, et al. Structural and molecular interrogation of intact biological systems[J]. Nature, 2013, 497(7449): 332-337.
[26]TOMER R, Ye L, HSUEH B, et al. Advanced clarity for rapid and high-resolution imaging of intact tissues[J]. Nature Protocols, 2014, 9(7): 1682-1697.
[27]EPP J R, NIIBORI Y, HSIANG H L, et al. Optimization of clarity for clearing whole-brain and other intact organs(1,2,3)[J]. Eneuro, 2015, 2(3): e0022-15.
[28]CHUNG K, DEISSEROTH K. CLARITY for mapping the nervous system[J]. Nature Methods, 2013, 10(6):508-513.
[29]YANG B, TREWEEK J B, KULKARNI R P, et al. Single-cell phenotyping within transparent intact tissue through whole-body clearing[J]. Cell, 2014,158(4): 945-958.
[30]TREWEEK J B, CHAN K Y, FLYTZANIS N C, et al. Whole-body tissue stabilization and selective extractions via tissue-hydrogel hybrids for high-resolution intact circuit mapping and phenotyping[J]. Nature protocols, 2015, 10(11): 1860-1896.
[31]ERTÜRK A, MAUCH C P, HELLAL F, et al. Three-dimensional imaging of the unsectioned adult spinal cord to assess axon regeneration and glial responses after injury[J]. Nature Medicine, 2012, 18(1): 166-171.
[32]YOKOMIZOT,YAMADA-INAGAWA T,YZAGUIRRE A D,et al. Whole-mount three-dimensional imaging of internally localized immunostained cells within mouse embryos[J]. Nat Protoc, 2012, 7(3): 421-431.
[33]张云翔, 吴清勤, 冯 娟,等. 基于被动扩散原理的CLARITY大鼠海马透明技术[C]// 第十二次全国中西医结合实验医学专业委员会暨第七次湖南省中西医结合神经科专业委员会学术年会论文集, 2015:10-11.
[34]段红梅, 尚俊奎, 郝 鹏,等. 两种组织透明技术在免疫荧光染色观察脊髓3D结构中的应用[J]. 中国康复理论与实践, 2016, 22(4):417-421.
[35]ERIKSSON A U, SVENSSON C, HORNBLAD A, et al. Near infrared optical projection tomography for assessments of β-cell mass distribution in diabetes research[J].Journal of Visualized Experiments Jove, 2013, 71(71):e50238.
[36]MARTINEZ N J, TITUS S A, WAGNER A K, et al. High-throughput fluorescence imaging approaches for drug discovery using in vitro and in vivo three-dimensional models[J]. Expert Opinion on Drug Discovery, 2015, 10(12): 1347-1361.
[37]SUSAKI E A, UEDA H R. Whole-body and whole-organ clearing and imaging techniques with single-cell resolution: toward organism-level systems biology in mammals[J]. Cell Chem Biol, 2016, 23(1):137-157.
Theresearchprogressoftissueopticalclearingtechniques
LI Ya-min1, 2, 5, XUE Cheng-zhi1, 2, 4, LI Gui-ye1, 2, 3, HU Zhang-li5, RUAN Shuang-chen1, 2, 3, CHEN Ling-ling1, 2, 3
(1. Shenzhen Key Laboratory of Laser Engineering; 2. Key Laboratory of Advanced Optical Precision Manufacturing Technology of Guangdong Higher Education Institutes, Shenzhen University; 3. Shenzhen University, College of Optoelectronic Engineering, Shenzhen 518060; 4. College of Electronic Science and Technology, Shenzhen University, Shenzhen 518060; 5. College of Life Sciences and Oceanography, Shenzhen University, Shenzhen 518060, China)
Tissue optical clearing methods, which transform intact opaque tissue into an optically transparent construct by reducing light scattering and then can be further combined with optical imaging technology to facilitate intact tissue organ deep optical (fluorescence/absorption) three-dimensional imaging, have been attracted increasing interest in biomedical photonics area due to their advantages compared to conventional mechanical-sectioning-based methods. This paper summarized optical clearing principles, main approaches and their current research situation and achievements in biomedicine, especially in the field of brain science. The comparison of their performance parameters and the further development challenge were also presented.
tissue optical clearing technology; transparent organization; imaging of mesoscopic biological systems; biomedical photonics
2017-02-27;
2017-03-23
国家自然科学基金(No. 61505112);中央高校基本科研业务费专项资金资助;深圳市战略新兴产业发展专项资金资助(No. JCYJ20150525092941015);深圳市高端人才启动(827-0000086)
李亚敏,硕士研究生,主要从事生物医疗光子学研究,E-mail:1054257761@qq.com
陈玲玲, 副教授, 博士, 主要研究方向为荧光多维度成像、光学透明技术,E-mail: l.chen10@szu.edu.cn
10.3969/j.issn.2095-1736.2017.06.083
Q593
A
2095-1736(2017)06-0083-06
