鳞头犬牙南极鱼卵壳蛋白的功能初步研究
2017-12-19付艳霞陈良标
付艳霞, 黄 巧, 陈良标
(1. 上海海洋大学 水产与生命学院, 上海 201306;2. 上海海洋大学 省部共建水产种质资源发掘与利用省部共建教育部重点实验室, 上海 201306)
鳞头犬牙南极鱼卵壳蛋白的功能初步研究
付艳霞1,2, 黄 巧1,2, 陈良标1,2
(1. 上海海洋大学 水产与生命学院, 上海 201306;2. 上海海洋大学 省部共建水产种质资源发掘与利用省部共建教育部重点实验室, 上海 201306)
已有研究表明卵壳蛋白ZPC5(Dissostichusmawsonizona pellucida c5,DmZPC5)在南极鱼卵巢中大量表达,但是其具体功能尚不清楚。为了明确ZPC5是否参与鱼类抗寒过程,研究在中国仓鼠卵巢细胞(Chinese hamster ovary ,CHO)中过表达南极鱼ZPC5,随之给予CHO细胞一定程度的低温处理,通过统计CHO细胞的存活率,来探讨zpc5在鱼类抗寒过程中的作用。存活率检测结果发现,过表达ZPC5的CHO细胞在0℃处理16 h后,其存活率较对照组显著上升(P<0.001),证明zpc5在低温下可以促进细胞的存活。Western Blot检测结果显示,zpc5能在CHO细胞中高效表达,0℃处理后,CHO细胞内的ZPC5表达量显著上调,证明了低温可以诱导ZPC5的表达。研究结果表明,ZPC5有可能参与南极鱼鱼卵抗寒过程。
卵壳蛋白;CHO细胞;南极鱼
南极海水温度常年维持在-1.9℃左右,过去三千万年间,南极鱼亚目鱼类适应了南大洋极端低温的环境,成为南极海域的主要物种。目前已经知道南极鱼适应这种极端环境的一个机制是这些鱼类进化出了抗冻糖蛋白(antifreeze glycoproteins,AFGPs),AFGPs存在于成鱼的体液中,保护成鱼可以在持续寒冷的水体中生存[1]。新孵出的鱼卵主要靠从母体携带的AFGPs来保护,而鱼卵在孵化的过程中AFGPs的数量会逐渐减少[2],那么南极鱼卵是如何在这种极端环境下存活的,是进化生物学上非常重要的一个科学问题。
卵壳蛋白(zona pellucida,ZP)在哺乳动物中被称为透明带蛋白,是绒毛膜的组成成分之一,是动物卵细胞卵外围的一层保护基质。这些蛋白质都含有一个保守的ZP结构域,约260个氨基酸,包含8个高度保守的半胱氨酸残基[3],通过二硫键将4条多肽链结合形成糖蛋白[4],主要功能是精卵识别和保护卵细胞[5]。在哺乳动物中,ZP主要参与受精过程中的精卵识别,从而造成物种之间的生殖隔离[6]。在鱼类中,精子通过专门的卵孔穿透浆膜,受精后鱼类绒毛膜硬化,阻止其他精子入卵[7],硬化的卵壳作为一个物理屏障保护发育中的胚胎。
鱼类的zp经历了基因扩增、分化、消亡等过程,使zp具有多态性[8]。有关许多鱼类的zp已经发表,如斑马鱼Daniorerio[9]、青鳉Oryziaslatipes[10]、虹鳟鱼Oncorhynchusmykiss[11]等。Chen等[12]对南极圈内鱼(D.mawsoni和C.aceratus)和南极圈外鱼(如E.maclovnus)的基因组经进化分析发现,南极圈内鱼基因组内zp的扩增较圈外鱼显著上升,尤其是D.mawsoni的zpc5,表明zpc5可能与南极鱼适应南极极端寒冷环境有关。对于在寒冷环境下进化的zpc5,是否具有抗寒功能,是本文研究的主要内容。
1 材料和方法
1.1 材料
实验用的真核表达载体pIRES2-EGFP购自Invitrogen公司;胰酶(不含EDTA)购自life technology公司;一抗FLAG(F3165)与荧光染料PI(P4170)均购自Sigma-Aldrich公司;一抗EGFP购自Santa Cruz Biotechnology公司;二抗羊抗小鼠IgG-HRP购自杭州华安生物技术有限公司;细胞培养箱(Galaxy170R)购自 Eppendorf公司;低温培养箱购自北京五洲东方科技发展有限公司;Accuri C6流式细胞仪购自美国BD公司;细胞荧光倒置显微镜购自Carl Zeiss Jena公司;聚丙烯酰胺凝胶电泳装置购自Bio-Rad公司;其他常规试剂由省部共建水产种质资源发掘与利用教育部重点实验室提供。
1.2 方法
1.2.1zpc5重组质粒的测序鉴定
将pIRES2-EGFP空载体和包含FLAG标签蛋白的pIRES2-flag-zpc5-EGFP重组质粒分别进行测序,根据已知zpc5(KM030018.1)目的基因序列利用vector软件设计测序引物(表1),引物合成与序列测序由上海生物工程有限公司完成。
1.2.2 CHO细胞的培养
将冻存的CHO细胞(ATCCCCL-61TM)从液氮中用镊子取出,于37℃水浴中迅速化冻,然后以800 r/min在室温下离心5 min,移除冻存液(含10% FBS,10% DMSO),向冻存管中加入1 mL完全培养基(含10% FBS,1% PS),将细胞吹成单细胞悬液后转移至直径60 mm培养皿中,并向培养皿内补加6 mL完全培养基,放于细胞培养箱(37℃,5% CO2)培养,每隔2~3 d传代1次。
1.2.3 CHO细胞的转染及转染后蛋白水平成功表达的鉴定
提前一天传代CHO细胞,贴壁细胞汇合度约40%~60% 时,采用脂质体的方法进行转染,分别转染pIRES2-flag-zpc5-EGFP重组质粒和pIRES2-EGFP空载体。继续培养2 d,移除培养基,用DPBS清洗细胞2次,然后加入500 μL细胞裂解液(sigma,使用前加入1% Cocktail),4℃裂解15 min,以 20 000 r/min离心细胞颗粒碎片20 min,转移包含蛋白的上清至冷冻过的EP管中,使用BCA法测定蛋白总浓度,将蛋白样品放置在-80℃冰箱中保存。分别取野生、转空载和转zpc5的CHO细胞总蛋白各30 μg,加入蛋白电泳缓冲液(Takara),沸水中煮10 min,蛋白充分变性后,使用10% SDS-PAGE胶进行Western Blot,转膜后用FLAG和EGFP抗体分别检测ZPC5和EGFP的表达情况。1.2.4 低温处理策略及细胞存活率实验
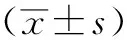
2 结果与分析
2.1 zpc5的编码区序列分析
本实验室从鳞头犬牙南极鱼的卵巢中克隆得到zpc5,测序结果表明,该基因编码区全长为1629 bp。通过ExPASy(http://web.expasy.org/protparam/)在线软件对zpc5序列分析发现,该基因共编码543个氨基酸,分子质量约为60.43 ku,等电点为5.44。SMART(http://smart.embl-heidelberg.de/smart/set_mode.cgi? GENO-MIC=1)在线软件预测表明,该ZPC5信号肽(signal peptide,SP)对应1~21氨基酸,ZP结构域对应67~324氨基酸,低复杂性区域(low complexity region)对应351~363氨基酸,预测ZP结构域E值为1.02e-47(图1,表2)。

图1 zpc5编码区序列
注:其中方框区域为信号肽序列;深灰色区域为ZP结构域序列;浅灰色区域为低复杂性区域;*为终止密码子
Note: The box area denotes the signal peptide sequence; Dark grey area represents the ZP structure domain sequence; Light grey area shows low complexity region; *, stop codon

表2 ZPC5预测结构域E值
2.2 zpc5重组真核表达载体的结构分析
pIRES2-flag-zpc5-EGFP真核表达载体质粒图谱如图2所示,zpc5启动子为cmv,双酶切位点为EcoR I和SmaI,并在sp与zpc5之间添加了flag标签(方便检测ZPC5的蛋白表达)。

图2 pIRES2-flag-zpc5-EGFP 示意图
2.3 CHO细胞的转染及转染后蛋白水平成功表达的鉴定
为了检测ZPC5在CHO细胞中能否进行表达,将pIRES2-flag-zpc5-EGFP重组质粒和pIRES2-EGFP空载体转染至CHO细胞中,通过荧光显微镜观察到细胞中有绿色荧光(图3-A),说明载体成功转染至细胞中。为了验证ZPC5在CHO细胞中的表达,对野生型及转染质粒的细胞进行Western Blot检测。结果发现,转染空载体的细胞只有1条28 ku左右的EGFP条带;转染重组质粒的细胞有2条带,一个条带为ZPC5约75 ku,另外一个条带为EGFP;野生型CHO细胞没有条带出现,表明ZPC5在CHO细胞中成功进行表达(图3-B)。

图3 ZPC5真核表达检测
注:A为质粒在CHO细胞中转染成功,Phase表示白光图,EGFP表示绿色荧光图;B为Western Blot检测CHO细胞中ZPC5及EGFP的表达
Note: A,the expression absence of plasmids in CHO cells, Phase, white light ;EGFP, green light; B, the Western Blot detection of ZPC5 and EGFP
2.4 ZPC5表达量及存活率检测
为了探讨低温下ZPC5是否参与细胞抗寒,我们使用了瞬间表达zpc5的CHO细胞。Western Blot结果显示,CHO细胞表达的外源性ZPC5在低温处理后表达量较37℃明显上调,EGFP未对低温做出应答(图4-A、图4-B)。上述结果说明,低温可以诱导ZPC5的表达。
通过PI染色的方法检测了低温下细胞的存活状况。转染空载体的CHO细胞作为对照组,过表达zpc5的CHO细胞作为试验组,经流式细胞仪检测,结果发现,对照组细胞存活率为(27.99±2.44)%,试验组存活率为(41.06±3.09)%,试验组显著高于对照组(P<0.001,图4-C)。这些结果提示,低温下ZPC5对细胞具有一定的保护作用,可能参与细胞抗寒过程。

图4 低温下ZPC5的表达与细胞存活率
注:A、B分别为外源性蛋白ZPC5、EGFP 的Western Blot检测及相应的灰度分析,***P<0.001,P>0.05,与37℃对照组比较;C为0℃处理后过表达ZPC5(ZPC5-M)及缺乏ZPC5(EGFP-M)的CHO细胞存活率,***P<0.001,与转染空载CHO细胞相比
Note: A,Western Blot detection and the gray intensity of ZPC5 in CHO cells,**P<0.001vs37℃ control group; B,Western Blot detection and the gray intensity of EGFP in CHO cells,P>0.05; C,The survival rate of CHO cells in the presence (ZPC5-M) or absence (EGFP-M) of ZPC5 in 0℃, ***P<0.001vsEGFP-M (vector-M)
3 讨论
Cao等[13]最近研究发现,ZPC5具有冰晶融解促进活性(ice melting-promoting,IMP activity),在中等浓度下可以降低溶液的冰点0.26℃~0.65℃,zpc5转基因斑马鱼卵壳蛋白溶液的冰点明显降低。以往有研究表明,鳞头犬牙南极鱼的atp6v0c在低温下可以提高HeLa 细胞的存活率[14],南极鱼LycodichthysDearborni的ld4在低温胁迫下可以显著降低应激颗粒的形成[15],本研究也发现,低温诱导ZPC5表达量上调,且zpc5在低温下可以提高CHO细胞的存活率,这和Cao等[13]的研究结果一致。同时我们也发现,检测CHO细胞存活率时,细胞的低温处理时间不能超过24 h,否则会对细胞造成不可修复的损伤,说明zpc5抗寒能力相对较弱。
蛋白表达量及存活率结果表明,低温处理后,zpc5提高了CHO细胞的抗寒能力。抗冻蛋白(antifreeze proteins,AFPs)主要是依靠AFPs降低溶液的冰点来调节抗冻[16]。有研究表明,南极鱼ZPC5的ZP结构域和酸性残基是IMP活性所必需的,阐明了ZPC5等一类蛋白是通过独特的ZP-冰晶结合机制抗冻的,这是一种不同于已知AFPs的抗冻机制[13]。本研究中,CHO细胞低温处理后,ZPC5表达量上调,笔者推测,有可能是因为ZPC5与冰晶结合,导致冰晶对细胞膜的损害降低,从而提高了细胞的存活率。也有可能是低温诱导ZPC5的表达,维持了胞内与胞外渗透压平衡,最终达到维持细胞膜系统稳定性,从而增强CHO细胞在低温下的耐受性。
ZP作为重要的生物屏障,在保护卵细胞、受精卵以及发育中的胚胎时发挥着多种作用[17]。结合本实验结果说明,低温下卵中zp的扩增,可以保护受精卵免受冰冻的损伤。在本实验中,为避免因转染效率过低导致蛋白表达量存在差异的情况,我们使用了瞬时表达ZPC5的CHO细胞,荧光观察及Western Blot结果发现,转染效率达到90%以上。同时也发现,当低温温度为0℃(尽量模拟南极海水-1.9℃的温度)时,CHO细胞的存活率差异显著。笔者推测,南极鱼作为一种高级模式生物,有可能因为南极极端寒冷的环境,导致了南极鱼的部分潜在基因具有了抗寒的功能。另有研究发现,青藏高原齐口裂腹鱼(Schizothoraxprenanti)的ZP3也具有一定的冰晶结合活性[18],表明南极鱼的ZP功能多元化并不是单一的。
综上所述,转zpc5的CHO细胞在低温下的存活率有明显上升,说明南极鱼卵壳蛋白ZPC5参与细胞抗寒过程,为更好地研究南极极端环境下生物的进化提供了新思路,有助于我们进一步了解低温适应性机制,为改善其他动植物的抗寒性提供了更多可供选择的抗寒基因。
[1]SWANSON W J, VACQUIER V D. The rapid evolution of reproductive proteins [J]. Nature Reviews Genetics, 2002, 3(2): 137-144.
[2]SWANSON W J, YANG Z, WOLFNER M F, et al. Positive Darwinian selection drives the evolution of several female reproductive proteins in mammals [J]. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(5): 2509-2514.
[3]BORK P, SANDER C. A large domain common to sperm receptors (Zp2 and Zp3) and TGF-βtype III receptor [J]. FEBS Letters, 1992, 300(3): 237-240.
[4]CONNER S J, HUGHES D C. Analysis of fish ZP1/ZPB homologous genes-evidence for both genome duplication and species-specific amplification models of evolution [J]. Reproduction (Cambridge, England), 2003, 126(3): 347-352.
[5]WASSARMAN P M, LITSCHER E S. The multifunctional zona pellucida and mammalian fertilization [J]. Journal of Reproductive Immunology, 2009, 83(1-2): 45-49.
[6]HAN L, MONNÉ M, OKUMURA H, et al. Insights into egg coat assembly and egg-sperm interaction from the X-ray structure of full-length ZP3 [J]. Cell, 2010, 143(3): 404-415.
[7]IWAMATSU T, YOSHIZAKI N, SHIBATA Y. Changes in the chorion and sperm entry into the micropyle during fertilization in the teleostean fish,Oryziaslatipes[J]. Development, Growth & Differentiation, 1997, 39(1): 33-41.
[8]HUGHES D C. ZP genes in avian species illustrate the dynamic evolution of the vertebrate egg envelope [J]. Cytogenetic and Genome Research, 2007, 117(1-4): 86-91.
[9]DEL GIACCO L, DIANI S, COTELLI F. Identification and spatial distribution of the mRNA encoding an egg envelope component of the Cyprinid zebrafish,Daniorerio, homologous to the mammalian ZP3 (ZPC) [J]. Development Genes and Evolution, 2000, 210(1): 41-46.
[10]KANAMORI A, NARUSE K, MITANI H, et al. Genomic organization of ZP domain containing egg envelope genes in medaka (Oryziaslatipes) [J]. Gene, 2003, 305(1): 35-45.
[11]HYLLNER S J, WESTERLUND L, OLSSON P E, et al. Cloning of rainbow trout egg envelope proteins: members of a unique group of structural proteins [J]. Biology of Reproduction, 2001, 64(3): 805-811.
[12]CHEN Z, CHENG C H, ZHANG J, et al. Transcriptomic and genomic evolution under constant cold in Antarctic notothenioid fish [J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(35): 12944-12949.
[13]CAO L, HUANG Q, WU Z, et al. Neofunctionalization of zona pellucida proteins enhances freeze-prevention in the eggs of Antarctic notothenioids [J]. Nature Communications, 2016, 7: 12987.
[14]刘明丽, 王金凤, 张 东, 等. 鳞头犬牙南极鱼atp6v0c基因在HeLa细胞中抗寒功能的研究 [J]. 大连海洋大学学报, 2016, 31(1): 7-12.
[15]尹秀娟, 俞梦超, 陈良标. 低温胁迫下极地鱼抗冻基因ld4对细胞应激颗粒形成的影响 [J]. 大连海洋大学学报, 2016, 31(5): 522-527.
[16]CHENG J, HANADA Y, MIURA A, et al. Hydrophobic ice-binding sites confer hyperactivity of an antifreeze protein from a snow mold fungus [J]. The Biochemical Journal, 2016, 473(21): 4011-4026.
[17]许强华, 吴智超, 陈良标. 南极鱼类多样性和适应性进化研究进展 [J]. 生物多样性, 2014, 22(1): 80-87.
[18]马战领, 胡瑞芹, 黄 巧, 等. 齐口裂腹鱼zonapellucida3的克隆表达及其蛋白活性研究 [J]. 大连海洋大学学报, 2015, 30(6): 592-597.
PrimaryanalysisofthefunctionofzonapellucidainDissostichusmawsoni
FU Yan-xia1,2, HUANG Qiao1,2, CHEN Liang-biao1,2
(1. College of Aquaculture and Life, Shanghai Ocean University, Shanghai 201306;2. Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources, Ministry of Education, Shanghai Ocean University, Shanghai 201306, China)
The previous studies have shown that ZPC5 expressed in the ovary of the Antarctic notothenioid fishes, however, the specific function of ZPC5 is unclear until now. In order to clarify whether ZPC5 has an ability to avoid fish-freezing at the low temperature, here, we attempted the overexpression of ZPC5 in Chinese Hamster Ovary (CHO) cells, and then treated CHO cells in the low temperature, by monitoring the survival rate of CHO cells, thus we revealed about the function ofzpc5 in fishes. The survival rate of CHO cells treated at 0℃ for 16 h was significantly higher than that of the mock (P<0.001), which proved thatzpc5 improved the cold resistance of the cells. The Western Blot analysis showed that thezpc5 was highly expressed in CHO cells and the expression of ZPC5 was significantly increased at 0℃, which proved that the low temperature guided the expression of ZPC5. Our data suggested that ZPC5 may be involved in the resistance process of the Antarctic notothenioid fishes to the cold environment.
zona pellucida; CHO cells; Antarctic notothenioid fishes
2016-11-15;
2016-11-21
国家自然科学基金(31572611);上海市教委水产高峰学科项目
付艳霞,硕士,主要从事分子生物学研究, E-mail:yanxia009@163.com
陈良标,教授,博士生导师,主要从事发育、分子生物学研究, E-mail: lbchen@shou.edu.cn
10.3969/j.issn.2095-1736.2017.06.028
Q51
A
2095-1736(2017)06-0028-04
