洋葱槲皮素对脂多糖诱导的小鼠腹腔巨噬细胞炎症反应抑制作用
2017-12-18,,
,,
(锦州医科大学食品科学与工程学院,辽宁锦州 121001)
洋葱槲皮素对脂多糖诱导的小鼠腹腔巨噬细胞炎症反应抑制作用
倪湾,李敬双,于洋*
(锦州医科大学食品科学与工程学院,辽宁锦州 121001)
为探讨洋葱槲皮素的抗炎作用,本研究以小鼠腹腔巨噬细胞为模型,采用MTT法检测洋葱槲皮素单药组、洋葱槲皮素与LPS复合药组对巨噬细胞吞噬功能的影响;采用ELISA法检测洋葱槲皮素单药组、洋葱槲皮素与LPS复合药组对小鼠腹腔巨噬细胞分泌细胞因子和炎症介质的影响。结果显示,洋葱槲皮素能够提高巨噬细胞的吞噬功能;洋葱槲皮素单药、洋葱槲皮素与LPS复合药组刺激巨噬细胞,均能够抑制巨噬细胞IL-1β和 COX-2的产生。结论:洋葱槲皮素可能通过提高巨噬细胞的吞噬功能、影响细胞因子和炎症介质的分泌,而发挥抗炎作用。
洋葱槲皮素,巨噬细胞,细胞因子,炎症介质,抗炎
洋葱(AlliumcepaL.),又名葱头,圆葱,玉葱,属百合科葱属二年生草本植物。根据联合国粮食与农业组织(Food and Agriculture Organization,FAO)的统计,截止到2015年12月年全球洋葱的种植面积达到600多万公顷,洋葱的干产量达到11000多万吨,我国的洋葱种植面积达到200多万公顷,洋葱的干产量达到3500多万吨,我国已成为洋葱生产大国[1]。洋葱槲皮素(Onion quercetin)是洋葱中提取的一种多羟基黄酮类化合物,研究表明,洋葱槲皮素具有抗氧化、清除自由基[2]、抗肥胖[3]、抗癌[4]、抗炎[5]、抗菌[7]、抗病毒[7]、降糖降压[7]、免疫调节及心血管保护等作用[8]。
近年来,槲皮素的抗炎作用逐渐受到重视,特别是槲皮素调节细胞因子及炎性介质释放发挥抗炎作用已成为研究热点。王保健等[9]研究了槲皮素对海水诱发性急性肺损伤(SW-ALI)的保护作用,并探索该作用与M1型巨噬细胞极化及其介导的炎症的相关性,结果表明槲皮素可通过抑制M1型巨噬细胞极化及其介导的免疫反应显著改善SW-ALI后气体交换功能、减轻肺组织病变。王敏等[10]研究了以人脐静脉内皮细胞为试材,用棕榈酸(PA)建立氧化应激与炎症模型,考察槲皮素和其代谢物槲皮素-3-O-葡萄糖醛酸对内皮细胞氧化应激与炎症的抑制作用,结果表明PA刺激诱发了内皮细胞内的氧化应激反应,导致胞内ROS的增加和线粒体膜电位的下降。刘明玥等[11]研究了槲皮素抑制RAW264.7巨噬细胞胆固醇累积、胆固醇流入及促进胆固醇流出作用及其机制,结果表明槲皮素可能是一种新型的胆固醇累积抑制剂,其作用可能是通过激活PPARγ-LXRα-ABCA1/ABCG1通路和抑制SR-A1和SR-A2的表达实现的。然而关于洋葱槲皮素抗炎作用的研究目前还鲜有报道。因此,加大、加深洋葱槲皮素抗炎活性的研究具有更高经济效益和社会效益,为洋葱槲皮素的临床应用和药物开发提供依据,对发展特色农业,推进农业产业化进程,提高农业总体竞争力,促进农产品转化增值,支撑国民经济发展,增加农民经济收入,都具有十分重要的意义。
为探讨洋葱槲皮素的抗炎作用,本研究建立了以小鼠腹腔巨噬细胞为靶细胞的模型,体外研究洋葱槲皮素抗炎活性,为洋葱槲皮素的进一步开发和利用提供实验依据。
1 材料与方法
1.1 材料与仪器
洋葱槲皮素 西安天瑞生物技术有限公司,批号(MUST-12062610),纯度≥98%;新生牛血清 浙江天杭生物科技有限公司;脂多糖(LPS)、甲基噻唑蓝(MTT)、台盼蓝、RPMI-1640培养基、二甲基亚砜(DMSO)、IL-1β、COX-2试剂盒 北京索莱宝科技有限公司;健康SPF级Balb/c小鼠 体重(20±2) g,6~8周龄,锦州医科大学实验动物中心提供;CO2培养箱 日本SHELLAB;CKX41SF倒置显微镜 Olympus Corporation Tokyo,Japan Madein Philippiness;TD5A低速离心机 湖南赫西;TDL80-2B 96孔板或24孔板台式离心机 上海安亭;FA2004N电子天平 上海精密;SUNRISE-BASJC TECAN酶标仪 TeCan Austria GmbH 5082 Grodly,Austria;SW-CJ-1F型超净工作台 苏州净化设备。
1.2 实验方法
1.2.1 制备巨噬细胞悬液 小鼠饲养于环境温度(20±2) ℃,湿度50%±10%,按照12 h光照/12 h黑暗,自由摄食、饮水的饲养条件喂养,实验前适应性饲养1周。颈椎脱臼法处死小鼠,75%乙醇浸泡3 min,将4 mL RPMI-1640培养基注入腹腔,轻按摩腹部约3 min,抽取腹腔液,1800 r/min离心5 min,弃上清,重复上述操作3次。细胞沉淀用RPMI-1640完全培养基悬起,过滤后台盼蓝染色计数,活细胞数达到95%以上,将细胞密度调整为5×106个/mL,制成巨噬细胞悬液。96孔细胞培养板中,每孔加入100 μL细胞悬液,置于37 ℃、5% CO2培养箱中,培养 12 h 后换液,以去掉少数未贴壁的杂细胞[12],用于下列实验。
1.2.2 MTT法检测巨噬细胞吞噬功能 96孔细胞培养板中,每孔加入100 μL巨噬细胞悬液,设空白组、LPS组、洋葱槲皮素单药组、洋葱槲皮素与LPS(1 μg/mL LPS)复合药组,各组均设3个重复。空白组每孔加入100 μL RPMI-1640完全培养基,LPS组每孔加入100 μL LPS(终浓度为1 μg/mL)溶液;其它各浓度组每孔各加100 μL含不同浓度的洋葱槲皮素(终浓度为20,40,80,120和160 μg/mL)溶液;37 ℃,5% CO2培养24 h 后取出,每孔加入50 μL金黄色葡萄球菌悬液,继续培养9 h,每孔加入20 μL MTT(5 mg/mL),置于37 ℃、5% CO2培养箱中培养4 h,1800 r/min离心10 min,弃上清。每孔再加入150 μL DMSO振荡溶解,用酶标仪检测570 nm处的OD值[12]。
1.2.3 ELISA法检测巨噬细胞因子及炎症介质
1.2.3.1 洋葱槲皮素对巨噬细胞分泌IL-1β、COX-2功能的影响 24孔细胞培养板中,每孔加入l mL巨噬细胞悬液,设空白组、LPS组、洋葱槲皮素单药组,各组均设3个重复。空白组每孔加入l mL RPMI-1640完全培养基,LPS组每孔加入1 mL LPS(终浓度为1 μg/mL)溶液;洋葱槲皮素单药组每孔分别加入1 mL不同浓度的洋葱槲皮素(终浓度为20、40、80、120和160 μg/mL)溶液。37 ℃,5% CO2培养箱中培养24 h,离心取细胞上清液,采用ELISA 法检测IL-1β、COX-2的分泌量,按照试剂盒说明书进行操作。
1.2.3.2 洋葱槲皮素对LPS诱导的巨噬细胞分泌IL-1β、COX-2功能的影响 24孔细胞培养板中,每孔加入l mL巨噬细胞悬液,设空白组、LPS组、洋葱槲皮素与LPS(1 μg/mL LPS)复合药组,各组均设3个重复。空白组每孔加入l mL RPMI-1640完全培养基;LPS组每孔加入1 mL LPS(终浓度为1 μg/mL)溶液;洋葱槲皮素与LPS复合药组每孔分别加入l mL不同浓度的洋葱槲皮素(终浓度为20、40、80、120和160 μg/mL)溶液。37 ℃,5% CO2培养箱中培养24 h,离心取细胞上清液,采用ELISA 法检测IL-1β、COX-2的分泌量,按照试剂盒说明书进行操作。
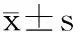
2 结果与分析
2.1 洋葱槲皮素对巨噬细胞吞噬功能的影响
2.1.1 洋葱槲皮素单药组对巨噬细胞吞噬功能的影响 洋葱槲皮素单药各浓度组与空白组比较:洋葱槲皮素单药各浓度组巨噬细胞的OD570值均极显著(p<0.01)高于空白组;洋葱槲皮素单药各浓度组与LPS组比较:洋葱槲皮素单药各浓度组巨噬细胞的OD570值均极显著(p<0.01)高于LPS组;洋葱槲皮素单药各浓度组之间比较:洋葱槲皮素为120 μg/mL浓度组巨噬细胞的OD570值极显著(p<0.01)高于洋葱槲皮素为20、40、80和160 μg/mL浓度组;洋葱槲皮素为160 μg/mL浓度组巨噬细胞的OD570值低于洋葱槲皮素为40 μg/mL浓度组,无统计学意义(p>0.05)。表明洋葱槲皮素单药组能够提高巨噬细胞的吞噬功能,洋葱槲皮素为120 μg/mL浓度组对提高巨噬细胞的吞噬功能效果优于其它浓度组,呈双向调节作用。结果见图1。
2.1.2 洋葱槲皮素与LPS复合药组对巨噬细胞吞噬功能的影响 洋葱槲皮素与LPS复合药各浓度组与空白组比较:洋葱槲皮素与LPS复合药各浓度组巨噬细胞的OD570值均极显著(p<0.01)高于空白组;洋葱槲皮素与LPS复合药各浓度组与LPS组比较:洋葱槲皮素与LPS复合药各浓度组巨噬细胞的OD570值均极显著(p<0.01)高于LPS组;洋葱槲皮素与LPS复合药各浓度组之间比较:洋葱槲皮素为120 μg/mL浓度组巨噬细胞的OD570值极显著(p<0.01)高于洋葱槲皮素为20、40、80、160 μg/mL浓度组;洋葱槲皮素为160 μg/mL浓度组巨噬细胞的OD570值高于洋葱槲皮素为40 μg/mL浓度组,无统计学意义(p>0.05)。洋葱槲皮素单药组与复合药组比较:复合药组巨噬细胞的OD570值高于单药组。表明洋葱槲皮素与LPS复合药组能够提高巨噬细胞吞噬能力,洋葱槲皮素为120 μg/mL浓度复合药组对巨噬细胞吞噬功能优于其它浓度复合药组。结果见图1。

图1 洋葱槲皮素对巨噬细胞吞噬功能的影响(n=3)Fig.1 The influnence of onion quercetinon phagocytosis of macrophages(n=3)
2.2 洋葱槲皮素单药组对巨噬细胞分泌IL-1β、COX-2的影响
2.2.1 洋葱槲皮素单药组对巨噬细胞分泌IL-1β的影响 LPS 组与空白组比较:LPS 组巨噬细胞IL-1β的分泌量极显著(p<0.01)高于空白组,说明LPS刺激可以造成巨噬细胞IL-1β的转录水平显著上升。洋葱槲皮素单药各浓度组与空白组比较:洋葱槲皮素单药各浓度组巨噬细胞IL-1β的分泌量均极显著(p<0.01)低于空白组;洋葱槲皮素单药各浓度组与LPS组比较:洋葱槲皮素单药各浓度组巨噬细胞IL-1β的分泌量均极显著(p<0.01)低于LPS组;洋葱槲皮素单药各浓度组之间比较:洋葱槲皮素单药各浓度组巨噬细胞IL-1β的分泌量差异均极显著(p<0.01),且呈一定的剂量依赖关系依次递减。表明洋葱槲皮素单药组能抑制巨噬细胞IL-1β的分泌,洋葱槲皮素为160 μg/mL浓度组对抑制巨噬细胞IL-1β的分泌效果优于其它浓度组。结果见图2。
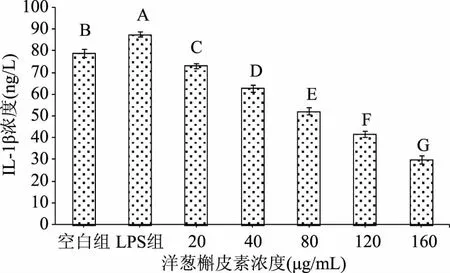
图2 洋葱槲皮素对巨噬细胞分泌IL-1β的影响(n=3)Fig.2 The influence of onion quercetin on macrophages secretion of IL-1β(n=3)
2.2.2 洋葱槲皮素单药组对巨噬细胞分泌COX-2的影响 LPS组与空白组比较:LPS组巨噬细胞COX-2的分泌量极显著(p<0.01)高于空白组,说明LPS刺激可以造成巨噬细胞COX-2的转录水平显著上升。洋葱槲皮素单药各浓度组与空白组比较:洋葱槲皮素单药各浓度组巨噬细胞COX-2的分泌量均极显著(p<0.01)低于空白组;洋葱槲皮素单药各浓度组与LPS组比较:洋葱槲皮素单药各浓度组巨噬细胞COX-2的分泌量均极显著(p<0.01)低于LPS组;洋葱槲皮素单药各浓度组之间比较:洋葱槲皮素单药各浓度组巨噬细胞COX-2的分泌量差异均极显著(p<0.01),且呈一定的剂量依赖关系依次递减。表明洋葱槲皮素单药组能抑制巨噬细胞COX-2的分泌,洋葱槲皮素为160 μg/mL浓度组对抑制巨噬细胞COX-2的分泌效果优于其它浓度组。结果见图3。
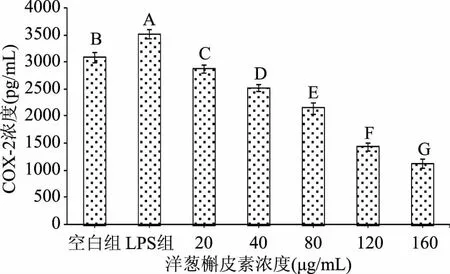
图3 洋葱槲皮素对巨噬细胞分泌COX-2的影响(n=3)Fig.3 The influence of onion quercetin on macrophages secretion of COX-2(n=3)
2.3 洋葱槲皮素对LPS诱导的巨噬细胞分泌IL-1β、COX-2的影响
2.3.1 洋葱槲皮素对LPS诱导的巨噬细胞分泌IL-1β的影响 洋葱槲皮素与LPS复合药各浓度组与空白组比较:洋葱槲皮素浓度为40、80、120、160 μg/mL复合药组巨噬细胞IL-1β的分泌量均极显著(p<0.01)低于空白组;洋葱槲皮素浓度为20 μg/mL复合药组巨噬细胞IL-1β的分泌量低于空白组,无统计学意义(p>0.05);洋葱槲皮素与LPS复合药各浓度组与LPS组比较:洋葱槲皮素与LPS复合药各浓度组巨噬细胞IL-1β的分泌量均极显著(p<0.01)低于LPS组;洋葱槲皮素与LPS复合药各浓度组之间比较:洋葱槲皮素与LPS复合药各浓度组巨噬细胞IL-1β的分泌量差异均极显著(p<0.01),且呈一定的剂量依赖关系依次递减。表明洋葱槲皮素与LPS复合药组能抑制LPS诱导的巨噬细胞IL-1β的分泌,洋葱槲皮素为160 μg/mL浓度的复合药组对抑制LPS诱导的巨噬细胞IL-1β的分泌效果优于其它浓度复合药组。结果见图4。
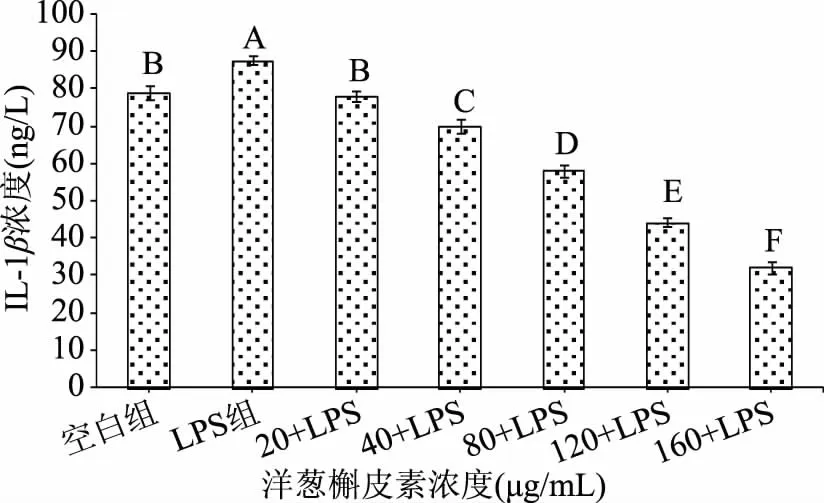
图4 洋葱槲皮素对LPS诱导的巨噬细胞分泌IL-1β的影响(n=3)Fig.4 The influence of onion quercetin on lps-induced macrophages secretion of IL-1β(n=3)
2.3.2 洋葱槲皮素对LPS诱导的巨噬细胞分泌COX-2的影响 结果见图5。洋葱槲皮素浓度为40、80、120、160 μg/mL复合药组巨噬细胞COX-2的分泌量均极显著(p<0.01)低于空白组;洋葱槲皮素浓度为20 μg/mL复合药组巨噬细胞COX-2的分泌量低于空白组,无统计学意义(p>0.05);洋葱槲皮素与LPS复合药各浓度组与LPS组比较:洋葱槲皮素与LPS复合药各浓度组巨噬细胞COX-2的分泌量均极显著(p<0.01)低于LPS组;洋葱槲皮素与LPS复合药各浓度组之间比较:洋葱槲皮素与LPS复合药各浓度巨噬细胞COX-2的分泌量差异均极显著(p<0.01),且呈一定的剂量依赖关系依次递减。表明洋葱槲皮素与LPS复合药组能抑制LPS诱导的巨噬细胞COX-2的分泌,洋葱槲皮素为160 μg/mL浓度的复合药组对抑制LPS诱导的巨噬细胞COX-2的分泌效果优于其它浓度复合药组。
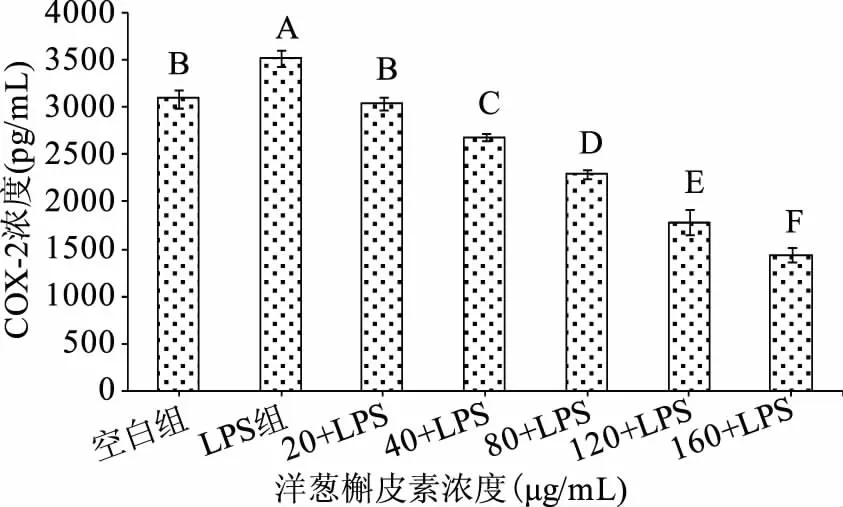
图5 洋葱槲皮素对LPS诱导的巨噬细胞分泌COX-2的影响(n=3)Fig.5 The influence of onion quercetin on lps-induced macrophages secretion of COX-2(n=3)
3 讨论
3.1 槲皮素对细胞活性的影响
槲皮素可以增加腹腔毛细血管和肠粘膜的通透性,减少肠道水分的渗出,电解质分泌减少,从而最终达到减轻肠道炎症,发挥止泻的效果。作为一种天然的免疫抑制剂,槲皮素能够通过与IgE高亲和力受体(FCεRI)交联,抑制肥大细胞系HMC-1细胞分泌内胰蛋白酶及IL-6的释放,同时下调HMC-1细胞组氨酸脱梭酶(HDC)mRNA的转录水平,使得组胺的释放减少,减轻过敏反应[13]。有学者发现在OVA诱导的哮喘小鼠模型的动物实验中发现,槲皮素可以通过调节T-bet和GATA-3基因的表达及比值,影响Thl/Th2淋巴细胞平衡,导致Th2型细胞因子IL-4、IL-5等炎症介质水平下降,Thl型细胞因子IFN-α的水平升高[14],从而减轻哮喘的变态反应炎症中具有重要的调节作用。汤海波[15]等通过检测氧分压(PaO2),二氧化碳分压(PaCO2),呼吸频率(RR)、酸碱度(pH)、IL-6、IL-1β、TNF-α、JAK2、STAT3、p-JAK2、p-STAT3 表达以及肺组织病理变化和干/湿比(D/W)方法,探讨槲皮素对内毒素(LPS)诱导的急性肺损伤作用及机制,发现槲皮素组预处理可通过抑制 JAK2/STAT3信号通路激活而改善气体交换功能,抑制炎性介质的释放,从而减轻 LPS 诱导的急性肺损伤。
3.2 洋葱槲皮素对巨噬细胞吞噬功能的调节作用
当巨噬细胞受到活化信号的刺激时,即可发挥免疫功效。活化的巨噬细胞不仅可以杀灭病原微生物、分泌特定的细胞因子参与机体的炎症反应,还能够吞噬机体衰老的细胞,在先天性免疫和获得性免疫应答中发挥不可替代的作用,吞噬能力是检测巨噬细胞功能的重要指标。刺激剂LPS可使细胞增殖转化,其机制主要是通过与淋巴细胞膜上的受体结合,进而诱导胞内信号传导[16]。LPS是一种革兰氏阴性细菌内毒素,是革兰氏阴性细菌的细胞壁组成成分,在炎症的发生发展中起着重要作用。LPS主要作用于巨噬细胞、内皮细胞的膜受体,通过细胞内信号传递级联,最终激活一些转录因子如NN-κB,诱导炎症前细胞因子、趋化因子、炎症介质等的合成和释放,引起炎症反应[17-19]。
本实验采用MTT法测定洋葱槲皮素对体外小鼠腹腔巨噬细胞吞噬金黄色葡萄球菌功能的影响,结果提示,洋葱槲皮素单药组、洋葱槲皮素与LPS复合药组均能够提高巨噬细胞的吞噬功能,呈双向调节作用。洋葱槲皮素能刺激巨噬细胞进一步分化成熟,成为活化巨噬细胞,使吞噬功能增强,与之功能相适应的结构是富含溶酶体,溶酶体的酶消化其吞噬物,酸性磷酸酶活性增强是与其吞噬功能增强相适应的结构特点[20]。
3.3 洋葱槲皮素对巨噬细胞分泌IL-1β、COX-2的影响
许银凤[21]等采用不同浓度的槲皮素处理细菌LPS诱导过的BV2小胶质细胞,观察不同浓度的槲皮素对炎症因子:一氧化氮(NO)、肿瘤坏死因子(TNF-α)以及白介素-1β(IL-1β)的抑制效果。发现槲皮素对LPS刺激的小胶质细胞炎症因子有一定的下调作用,其抗炎机制可能与下调NO、TNF-α绿以及IL-1β的产生有关。
IL-1是巨噬细胞分泌的主要细胞因子,过量分泌可刺激各种免疫细胞及炎性细胞产生TNF-α、IL-6及IL-8等多种细胞因子,从而介导炎性反应和细胞损伤。IL-1β为一种致炎细胞因子,广泛参与了机体组织破坏、水肿形成等多种病理损伤过程。本研究采用ELISA 法检测洋葱槲皮素对巨噬细胞分泌IL-1β的影响,结果提示,洋葱槲皮素单药组、洋葱槲皮素与LPS复合药组均能抑制巨噬细胞IL-1β的分泌,IL-1β的分泌呈一定的剂量依赖关系依次递减,表明洋葱槲皮素能剂量依赖性地抑制LPS诱导的巨噬细胞因子IL-1β的产生。一定浓度的洋葱槲皮素能抑制LPS刺激活化的小鼠原代培养腹腔巨噬细胞分泌IL-1β,这可能与抑制IL-1βmRNA表达有关。因此,我们认为洋葱槲皮素对IL-1β的抑制作用是在基因转录水平上进行调节。
COX-2与炎症性疾病的关系非常密切,各种炎症疾病和动物炎症模型的炎性渗出液中均发现 COX-2 mRNA和蛋白表达的增强,同时伴随 PGE2、PGI2代谢物和 TXA2水平的提高[22]。本研究采用ELISA 法检测洋葱槲皮素对巨噬细胞分泌COX-2的影响,结果提示,洋葱槲皮素单药组、洋葱槲皮素与LPS复合药组均能抑制巨噬细胞COX-2的分泌,COX-2的分泌呈一定的剂量依赖关系依次递减,表明洋葱槲皮素剂量依赖性地抑制LPS诱导的巨噬细胞炎症介质COX-2的产生。洋葱槲皮素其抗炎作用机制与选择性抑制 COX-2有关,体现在对COX-2活性的直接抑制作用,或下调COX-2蛋白及mRNA 的表达从而干扰其功能,并且避免了由抑制COX-1而引起的胃肠道等一系列副作用。
4 结论
洋葱槲皮素可能通过提高巨噬细胞的吞噬功能、影响细胞因子和炎症介质的分泌,从而发挥抗炎作用。洋葱为我国主要农产品之一,资源十分丰富,利用其产品洋葱槲皮素来开发抗炎活性成分或功能食品能大大增加洋葱的附加值,具有较高的实用价值和广阔的应用前景。
[1]刘通. 近5年大蒜、洋葱、大葱、生姜、大白菜、番茄、马铃薯价格走势分析[J]. 中国蔬菜,2017(2):81-84.
[2]Shivraj H N,Arti S N,Young S K,et al. Utilization of quercetin and quercetin glycosides from onion(Allium cepa L.)solid waste as an antioxidant,urease and xanthine oxidase inhibitors[J]. Food Chemistry,2017,235:119-126.
[3]Moon J,Do H,Kim O Y,et al. Antiobesity effects of quercetin-rich onion peel extract on the differentiation of 3T3-L1 preadipocytes and the adipogenesis in high fat-fed rats[J]. Food and Chemical Toxicology,2013,58:347-354.
[4]Mousumi P,Riya M,Milon B,et al. Calcium phosphate-quercetin nanocomposite(CPQN):Amulti-functional nanoparticle having pH indicating,highlyfluorescent and anti-oxidant properties[J]. Colloids and Surfaces B:Biointerfaces,2017,154:63-73.
[5]Wang Y,Zhao L,Wang C T,et al. Protective effect of quercetin and chlorogenic acid,two polyphenols widely present in edible plant varieties,on visible light-induced retinal degenerationinvivo[J]. Journal of Functional Foods,2017,33:103-111.
[6]Akihiko S,Zhang T,Lina Y,et al. Antiallergic activities of eleven onions(Alliumcepa)were attributed to quercetin 4-glucosideusing QuEChERS method and Pearson’s correlation coefficient[J]. journal of functional foods,2015,14:581-589.
[7]Lee S M,Moon J,Chung J H,et al. Effect of quercetin-rich onion peel extracts on arterial thrombosis in rats[J]. Food and Chemical Toxicology,2013,57:99-105.
[8]陈爱洋,万端极,汪淑廉,等. 洋葱中总黄酮含量测定方法的比较研究[J]. 食品科技,2016(8):276-279.
[9]王保健,毛旭. 槲皮素通过抑制肺巨噬细胞的M1极化减轻海水吸入诱导的小鼠急性肺损伤[J]. 细胞与分子免疫学杂志,2017(6):751-755.
[10]刘明玥,吴崇明,王帅,等. 槲皮素对巨噬细胞胆固醇流入和流出的调节作用[J]. 国际药学研究杂志,2015(1):44-48.
[11]王敏,刘保林,国旭丹. 槲皮素及其代谢物抑制氧化应激与炎症[J]. 食品科学,2013,(15):256-260.
[12]戴艺,徐明生,上官新晨,等. 松针多糖对小鼠腹腔巨噬细胞免疫调节作用的研究[J]. 动物营养学报,2017(2):670-677.
[13]Azevedo MI,Pereira AF,Nogueira RB,et al. The antioxidant effects of the flavonoids rutin and quercetin inhibit oxaliplatin-induced chronic painful peripheral neuropathy[J]. Mol Pain. 2013,23(9):53-61.
[14]Park HJ,Lee CM,Jung ID,et al. Quercetin regulates Thl/Th2 balance in a marine model of asthma[J]. Int Immunopharmacol,2009,9(3):261-267.
[15]汤海波,杨萍. 槲皮素对内毒素诱导急性肺损伤大鼠的作用机制[J]. 实用医学杂志,2016(4):531-534.
[16]尹乐乐,曾耀英,黄秀艳,等.连翘提取物对小鼠 T 淋巴细胞体外活化与增殖的影响[J].细胞与分子免疫学杂志,2008,24(1):10-12.
[17]刘中原,李延平.细菌脂多糖的生物活性及作用机制[J].医学综述,2010,16(2):166-169.

[19]D’Andrea A,Aste-Amezaga M,Valiante N M,et al. Interleukin 10(IL-10)inhibits human lymphocyte interferon gamma-production by suppressing natural killer cell stimulatory factor/IL-12 synthesis in accessory cells[J].The Journal of experimental medicine,1993,178(3):1041-1048.
[20]李云峰,郭长江,韦京豫,等. 槲皮素对小鼠腹腔巨噬细胞氧化应激反应与功能的影响[J]. 解放军预防医学杂志,2007,(03):160-163.
[21]许银凤,叶云,孙琴,等. 槲皮素对LPS刺激的小胶质细胞炎症因子的下调作用[J].基因组学与应用生物学,2017(3):1173-1179.
[22]靳丽媛,邓子辉,张金英,等. 间充质干细胞通过环氧化酶2影响慢性炎症损伤的巨噬细胞表型极化[J]. 中华老年心脑血管病杂志,2017(5):524-528.
Inhibitingeffectofonionquercetinonlipopolysaccharide-inducedmice’senterocoeliamacrophageinflammatoryresponse
NIWan,LIJing-shuang,YUYang*
(College of Food Science and Engineering Jinzhou Medical University,Jinzhou 121001,China)
To discuss the inhibiting effect of onion quercetin on inflammatory response,this paper took mice’s enterocoelia macrophage as sample and used MTT to investigate the impact of onion quercetin single drug group,combination drug of onion quercetin and LPS group on macrophage’s phagocytosis,used ELISA to investigate the impact of onion quercetin single drug group,combination drug of onion quercetin and LPS group on cytokines and inflammatory mediator secretion from mice’s enterocoelia macrophage. The result showed that onion quercetin can improve phagocytosis of macrophage;onion quercetin single drug and combination drug of onion quercetin and LPS can stimulate macrophage of IL-1βand COX-2 which induces secretion of macrophage. In summary,onion quercetin may inhibit inflammation via improving macrophage’s phagocytosis and affecting secretion of cytokines and inflammatory mediator.
onion quercetin;macrophages;cytokines;inflammatory mediator;anti-inflammatory
2017-06-13
倪湾(1994-),女,在读研究生,研究方向:功能因子与健康的相关性,E-mail:15350907088@163.com。
*通讯作者:于洋(1962-),男,博士,教授,研究方向:功能因子与健康的相关性,E-mail:spyuyang@163.com。
辽宁省科技厅-锦州医科大学联合基金项目(20170540357);辽宁省大学生创新创业训练计划项目(201610160000055,201610160000011)。
TS201.4
A
1002-0306(2017)23-0284-05
10.13386/j.issn1002-0306.2017.23.052
