血水比例对羊血豆腐凝胶特性和品质的影响
2017-12-18,,,,,,,,
,, ,, , ,,,
(江苏省农业科学院农产品加工研究所,江苏南京 210014)
血水比例对羊血豆腐凝胶特性和品质的影响
陈琳,张新笑,卞欢,吴海虹,孙冲,邹烨,诸永志*,王道营,徐为民
(江苏省农业科学院农产品加工研究所,江苏南京 210014)
血水比例是调控血豆腐口感品质的关键。本实验以湖羊血液为原料,按照血水比(v/v)1∶0、1∶1、1∶2、1∶3、1∶4、1∶5、1∶6稀释后制作血豆腐凝胶,从血浆纤维蛋白原浓度、动态流变特性、微观结构、质构、保水性等指标的角度,研究血水比例对血豆腐凝胶特性和品质的影响。结果表明:随着血浓度降低,血豆腐储能模量、损能模量弱化,凝胶强度呈下降趋势,同时血豆腐凝胶蒸煮损失和离心损失增大,不易流动水比例下降,水分向慢弛豫方向移动。当血水比<1∶3时,凝胶网状结构稳定性下降,水分易渗出,且不具有动态流变特性,凝胶强度极弱;除弹性外,血豆腐硬度、咀嚼性、内聚性以及黏性均显著降低。血水比≥1∶3时能较好地保持羊血豆腐凝胶的质构特性和持水力,是制作血豆腐的适宜比例范围。
羊血,血水比例,血豆腐,凝胶特性
羊血营养丰富,蛋白含量高达17%~22%,富含谷物类食品的第一限制性氨基酸-赖氨酸,且铁元素含量高[1-2],是一种天然补血剂。另外,羊血还含有多种无机盐和微量元素[2-3]。现代医学证明,羊血具有止血、祛瘀、排毒等功效[2]。通常情况下,羊血制成羊血凝胶(又称血豆腐)食用,因地域和饮食习惯的差异,消费者对血豆腐品质的需求有所不同,例如:北方偏爱厚实且有韧性的口感,常用芥末、胡椒等调味炒制血豆腐[4];而南方更喜爽嫩细滑,多在汤煲、火锅中食用[5],而血水比例是制作血豆腐嫩度、口感的关键[6-7]。但是目前血豆腐规模化加工企业较少,诸多核心工艺参数基本依赖经验,制作过程中血豆腐常出现碎血、产品不成形等质量问题,限制了血豆腐企业的稳定发展。
目前仅有少量关于血豆腐加工工艺对凝胶质构特性和营养价值影响的研究[8-11],且多集中于鸭血豆腐和猪血豆腐等,有关羊血豆腐凝胶特性及品质的研究较少。本研究从血浆纤维蛋白原浓度、动态流变特性、微观结构、质构、保水性等指标变化的角度,探讨血水比例对羊血豆腐凝胶特性和品质的影响,以期利于对不同口感的血豆腐凝胶产品进行研发和质量控制,满足消费者的多元需求,同时为血豆腐加工企业的标准化生产提供理论参考。
1 材料与方法
1.1 材料与仪器
选取6头6月龄、活体重为(45±5) kg健康商品湖羊(Ovis aries) 湖羊均为公羊并在同一条件下饲养,于太仓市金仓湖食品有限公司宰杀并收集血液;凝血酶冻干品(2000 U) 上海蓝季科技发展有限公司;柠檬酸钠、硫酸钙、氯化钠、磷酸氢二钠、磷酸二氢钾、尿素等 均为分析纯,国药集团化学试剂有限公司。
TVT 300XP质构仪 瑞典泰沃公司;PQ001低场核磁分析仪 上海纽曼电子科技有限公司;数显恒温水浴锅HH-8 国华电器有限公司;MCR301流变仪 奥地利安东帕公司;TG16-WS台式高速离心机 长沙湘仪离心机有限公司;UV 6100紫外可见分光光度计 上海美谱达仪器有限公司;EVO-LS10扫描电子显微镜 德国蔡司公司。
1.2 实验方法
1.2.1 羊血豆腐凝胶的制备 新鲜血液迅速加入0.5%柠檬酸钠,搅拌均匀后,部分新鲜血液以3000×g离心5 min,分离红细胞后留存上层血浆,剩余血液4 ℃冷藏用于制作羊血豆腐凝胶。取4 ℃冷藏的抗凝羊血,以纱布过滤后定量置于成型容器中,将0.90% NaCl溶液(用去离子水配制)按血水比(v/v)1∶0、1∶1、1∶2、1∶3、1∶4、1∶5、1∶6添加到羊血中搅拌均匀。0.20%硫酸钙凝固剂与稀释血液混合(w/v)进行凝血交联,凝胶经80 ℃水浴20 min,熟化为羊血豆腐。
1.2.2 血浆纤维蛋白原浓度含量测定 纤维蛋白原浓度测定参考Jocobsson法并稍作修改[12]。除钙的抗凝血浆1.00 mL加入2.00 mL生理盐水应用缓冲液(1.50 mmol/L Na2HPO4·2H2O,6.50 mmol/L KH2PO4,pH6.35),与100 μL凝血酶(500 IU/mL)混合均匀后37 ℃温育2 h。收集纤维蛋白凝块,生理盐水反复洗涤后用碱性尿素(400 g/L)溶解,于280 nm和315 nm波长处读取吸光度。
1.2.3 动态流变特性测定 测定方法参考Westphalen等[13]并做一定修改。羊血凝血激活后立即均匀涂布于测试平台,平台外蛋白与空气接触处用液态石蜡密封,测定频率0.10 Hz,应变2%,上下板狭缝1.00 mm,环境温度25 ℃。升温与保温过程:10 ℃/min线性升温至37 ℃,保温20 min。继续升温至75 ℃,保温20 min完成流变测定,每个实验组测定6个重复,3个平行。测定指标为流变储能模量G′,损能模量G″,相位角δ。
1.2.4 微观结构观察 通过扫描电镜(scanning electron microscope,SEM)的方法观察羊血生凝胶的微观结构,方法参考徐舶[14]等将样品切成约0.50 cm×0.50 cm×0.50 cm的薄块,薄块浸泡在2.5%戊二醛中(20.00 mmol/L磷酸缓冲液溶解,pH7.20)固定,经磷酸缓冲液反复冲洗,梯度乙醇脱水,100%丙酮置换,超临界CO2干燥仪干燥后附着于金箔,EVO-LS10扫描电子显微镜观察。
1.2.5 保水性测定
1.2.5.1 蒸煮损失的测定 参照陈振林等人[15]的方法,稍作修改。稀释羊血与0.20%硫酸钙凝固剂(w/v)混合后凝血交联,记录羊血生凝胶重量M1。 凝胶块中心插入温度记录仪,羊血凝胶经80 ℃水浴熟化至中心温度72 ℃,流水冷切后吸干凝块表面水分,记录血豆腐重量M2,蒸煮损失(%)=(M1-M2)/M2×100。
1.2.5.2 离心损失的测定 参考Trout等[16]方法,称取10.00 g左右血豆腐凝胶装填于离心管中,记录离心前样品重量M1,4 ℃下10000 g离心10 min。离心结束后,倒去上层水分后称重,并记录离心后重量M2,离心损失(%)=(M1-M2)/M2×100。
1.2.5.3 低场核磁共振弛豫时间T2测定 低场核磁共振(Low-Field Nuclear Magnetic Resonance,LF-NMR)测定参数参考Han[17]和Wang[18]的设定并作一定修改。准确称取2.00 g血豆腐,25 ℃稳定30 min,每个处理测定6个重复,每个样品取5个平行。测定参数为:核磁共振主频率22.6 MHz,回波时间τ值为250 s,重复扫描16次,重复采样等待时间7.50 s得到12000个回波个数。利用Carr-Purcell-Meiboom-Gill序列[19-20]测定自旋-自旋弛豫时间T2,测定结果采取多元模型软件MultiExp Inv Analysis反演分析。
1.2.6 质构特性测定 质构测定方法参考Shiranita等[21]并针对血豆腐产品的特点稍加修改。将血豆腐切成直径20.00 mm,高10.00 mm的圆柱体,每个处理组测定6个重复,每个样品取三个平行。测定时环境温度为25 ℃,测试前速度为2.00 mm/s,测试速度1.00 mm/s,测试后速度1.00 mm/s,试样变形压缩比50%,两次压缩中间间歇5 s,测定结果经TVT-300XP数据软件分析得出硬度、咀嚼性、内聚性、弹性、黏性等5个主要指标。
1.3 数据处理
采用SAS 8.1软件对实验数据进行单因素方差分析,处理组间采用Duncan’s方差检验,每个处理组测定6个重复,差异显著水平为p<0.05,数据以均值±标准差表示。
2 结果与分析
2.1 血水比例对血浆纤维蛋白原浓度的影响
纤维蛋白原是形成羊血凝胶网状结构的主要蛋白之一。随着血水比例降低,羊血浆纤维蛋白原浓度线性下降(图1),血水比与血浆纤维蛋白原浓度呈正相关。当血水比<1∶3时,血浆纤维蛋白原浓度<0.8 g/L,形成的纤维蛋白凝块水分极易渗出,较为稀软、弹性弱。而纤维蛋白原浓度高的羊血浆由于加热交联形成的网络结构更加紧密,束缚水分能力更强,形成的凝胶更加稳定。

图1 血水比例对羊血浆纤维蛋白原浓度的影响Fig.1 Effect of ratios of blood to water on fibrinogen content of sheep blood
2.2 血水比例对热诱导凝胶动态流变特性的影响
动态流变测定中贮能模量(G′)和损能模量(G″)分别是蛋白胶体的弹性和粘性响应。由图2 可知,随着加热时间增加,37 ℃保温期G′和G″逐渐增大且G′增加速率较快,体系以弹性响应为主向凝胶转化。血水比1∶0时G′和G″最大,血水比例下降能不断弱化G′和G″,相对粘弹性tanδ呈上升趋势。75 ℃升温期,羊血流体结构随着温度升高逐渐破坏,纯粹的弹性不被维持,黏性性质得以表现,凝胶向着稳定方向转化。不同血水比例G′和G″在75 ℃保温后趋于稳定,血水比1∶0时血豆腐凝胶强度大,具有最大黏性。随着血水比例下降,血豆腐凝胶强度依次下降,而不同血水比例血液由流动态向凝胶态转变的幅度变化不大,相位角(δ)最终值都小于10,血水比例对75 ℃保温期δ无影响。当血水比<1∶3时,凝胶体系不具有特征动态流体变化,所体现的凝胶强度极弱,因此图2显示血水比≥1∶3时的动态流变结果。

图2 血水比例对羊血热诱导凝胶流变特性的影响Fig.2 Effect of ratios of blood to water on the rheology property of sheep blood gel注:图A~C分别对应羊血凝胶储能模量、损能模量以及相位角的变化。
2.3 血水比例对凝胶微观结构的影响
随着血水比例下降,血凝胶出现白色蛋白溶出物,且视野下除红细胞外白色蛋白溶出物逐渐增多。羊血红细胞形变加剧,由细胞膜表面光滑的圆盘状向类似于神经-棘状红细胞转变,其特征为红细胞膜表面有数量不等的钝圆形棘状突起或细胞边缘出现钝齿状隆起,细胞学形态逐渐模糊。同时束缚于纤维蛋白凝胶网状结构中血细胞数量减少,经热诱导后蛋白变性,结构展开并发生分子间交联形成凝胶。血水比例下降使得凝胶内细胞结构致密性下降,由紧致结构表现为疏松结构(图3)。

图3 血水比例对羊血凝胶微观结构的影响(5000×)Fig.3 Effect of ratios of blood to water on the ultrastructure of sheep blood gel(5000×)注:A~G分别对应血水比1∶0、1∶1、1∶2、1∶3、1∶4、1∶5、1∶6时微观细胞学形态变化;标尺表示2 μm。

表1 血水比例对羊血豆腐低场核磁共振特性的影响Table 1 Effect of ratios of blood to water on the water relaxation time and population of sheep blood tofu gel
注:同行平均值数据上标有不同小写字母表示差异显著(p<0.05);T2b,T21对应结合水、不易流动水横向弛豫时间;P2b、P21对应结合水、不易流动水相对含量。
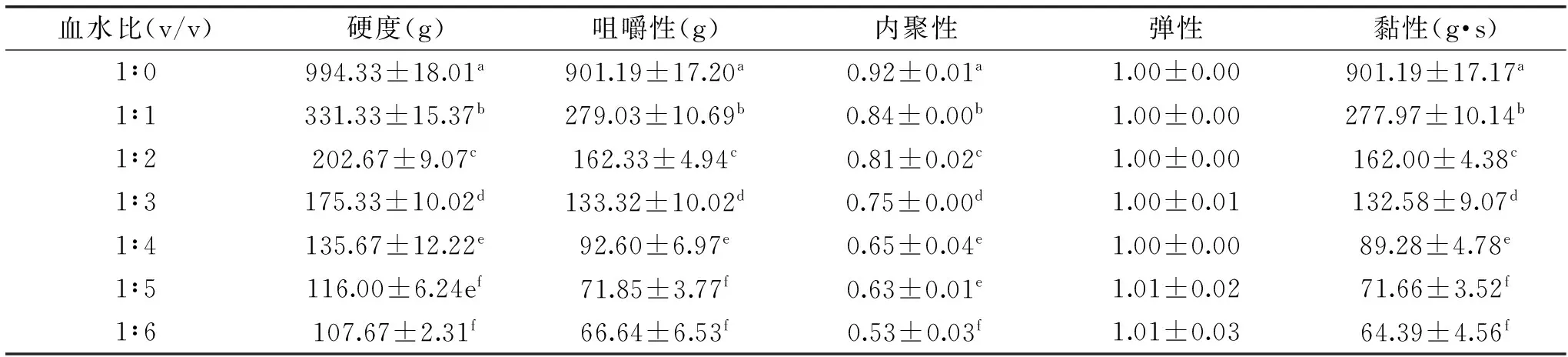
表2 血水比例对羊血豆腐质构特性的影响Table 2 Effect of ratios of blood to water on texture characteristics of sheep blood tofu gel
注:同列中不同小写字母表示差异显著(p<0.05)。2.4血水比例对羊血豆腐凝胶持水力的影响
2.4.1 血水比例对羊血豆腐凝胶蒸煮损失的影响 由图4可知,随着血水比例下降,血豆腐蒸煮损失显著增加(p<0.05),至血水比1∶6时血豆腐蒸煮损失高达43.51%,相较于血水比1∶0血豆腐,蒸煮损失增加了4.70倍。
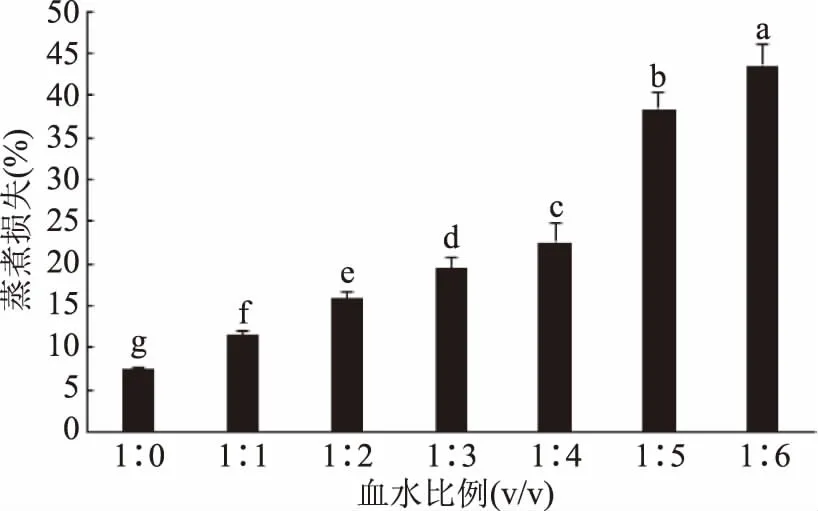
图4 血水比例对羊血豆腐凝胶蒸煮损失的影响Fig.4 Effect of ratios of blood to water on cooking loss of sheep blood tofu gel
2.4.2 血水比例对羊血豆腐凝胶离心损失的影响 分析图5可知,随着血水比例下降,血豆腐离心损失不断增加。血水比1∶6时血豆腐离心损失高达87.12%,相较于血水比1∶0羊血豆腐凝胶,离心损失增加了1.22倍。
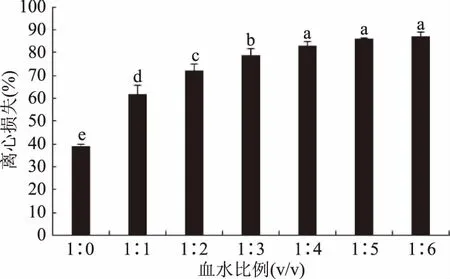
图5 血水比例对羊血豆腐凝胶离心损失的影响Fig.5 Effect of ratios of blood to water on centrifuging loss of sheep blood tofu gel
2.4.3 血水比例对羊血豆腐凝胶低场核磁共振性质的影响 表1显示,T2拟合后血豆腐呈现不易流动水和结合水两个峰,自由水低弛豫时间的峰不能被检出。随着血水比下降,血豆腐P21含量呈下降趋势,T21和T2b显著增加(p<0.05),水分逐渐朝慢弛豫方向移动,保水性呈下降趋势。
2.5 血水比例对羊血豆腐凝胶质构特性的影响
由表2可知,纯血加入等比例水后,血豆腐硬度、咀嚼性以及黏性大幅下降,随着水的继续加入,使得血豆腐硬度、咀嚼性、内聚性以及黏性进一步显著下降(p<0.05),而弹性不受血水比影响(p>0.05)。相对于血水比1∶0血豆腐,血水比1∶6血豆腐硬度值下降89%,咀嚼性下降93%,内聚性下降42%。血水比<1∶3时血豆腐会出现起孔、碎血、产品不成形等问题,不适于血豆腐产品制备。
3 讨论
动物血浆蛋白中,可溶性纤维蛋白原在凝血酶催化下变为不溶性蛋白,纤维蛋白单体之间以共价键形成胶体骨架,网罗血细胞和水分形成胶冻状的血块[22],对血凝胶形成起主要作用[23-25]。血块的强度和持水力不仅反映纤维蛋白的凝固状态,也是体现血豆腐产品品质的重要指标。Ockerman认为[26]血浆蛋白凝胶的蛋白质最少浓度约4%~5%,本实验中随着血水比例下降,纤维蛋白浓度降低,当血水比<1∶3时,血浆纤维蛋白原浓度<0.8 g/L,是胶凝能力较弱的低浓度纤维蛋白原[27],形成的纤维蛋白凝块水分极易渗出,较为稀软、弹性弱。结合SEM图推测,血液不断稀释使得血凝胶网络中致密性下降,内部胶凝能力逐渐弱化,粘附性不断减小。当血水比<1∶3时,纤维蛋白凝胶网络极易被破裂,此时凝胶已不具流体动态特性,水分在凝胶网络中流动性变大,在遭受离心力时,离心损失显著增加。
本实验中随着血水比例降低,不易流动水含量下降,不易流动水和结合水横向弛豫时间增加。一方面,血浓度下降使得弛豫时间对应的质子密度降低,自由水向不易流动水转化的比例下降;另一方面,凝胶结构能够阻碍水的空间移动,对应水组分的弛豫时间延长[28-29]。凝胶水分状态的变化与羊血豆腐保水性密切相关,血水比例降低使得羊血豆腐保水性降低。此外,血豆腐的质构直接影响产品嫩度、口感以及出品率等[30-31]。血水比例变化引起血豆腐结构变化,羊血豆腐质构特性不同。随着血水比例下降,由离心损失、蒸煮损失以及LF-NMR反映的血豆腐保水性降低,表现在质构上即血豆腐硬度、咀嚼性、内聚性以及黏性下降。张佳敏等人[7]研究发现,凝胶的硬度、咀嚼性和持水力随着猪血浓度降低显著下降,与本实验结果相一致。杨芳[32]发现大豆豆腐凝胶网格含水处于饱和状态时其硬度和弹性较低,含水较多的大豆豆腐并未处于最佳品质状态。结合本实验中质构和保水性结果可推测,在评价羊血豆腐品质时也存在类似情况,即适当血水比例可改善血豆腐品质状态。此外,水分过量添加会有效促进红细胞破裂溶出血红蛋白。本实验表明血浆纤维蛋白原确有参与胶凝过程,且随着血水比例下降胶凝能力逐渐弱化,而血红蛋白参与血豆腐凝胶生成的途径以及对品质的影响仍有待进一步研究。
4 结论
血水比例下降能够降低参与凝胶形成的纤维蛋白原浓度,弱化羊血豆腐凝胶强度,羊血豆腐保水性变差;同时羊血豆腐凝胶结构变化其质构特性不同,血水比例过低时形成的羊血豆腐较为稀软,易碎。因此,合理的血水比例是决定羊血豆腐凝胶质构和保水性的关键。血水比≥1∶3时羊血豆腐具有较好的凝胶特性,对此范围内的血水比进行调控可制作出不同嫩度、口感丰富的羊血豆腐产品,有利于满足消费者的多元需求。
[1]张红梅. 羊血肠配方优化研究[J]. 肉类工业,2015(7):7-9.
[2]陈雪寒. 动物血的营养及食疗功效[J]. 山东食品科技,2003,5(12):19.
[3]高巍. 羊血超氧化物歧化酶(SOD)的分离纯化及化学修饰研究[D]. 呼和浩特:内蒙古农业大学,2010.
[4]于仁文. 从红白豆腐说补血和补钙[J]. 饮食科学,2016(1):7.
[5]牛国强. 大江南北品 “血” 食[J]. 烹调知识,2009(12):17-18.
[6]Aree Innun. Effects of salt,blood concentration and cooking temperature on the quality of edible blood gel[J]. International Journal of Food Engineering,2015,1(1):8-12.
[7]张佳敏,王卫,白婷,等. 工艺条件对猪血凝胶质构特性和持水力的影响[J]. 肉类研究,2016,30(7):16-20.
[8]李森. 盒装猪血豆腐加工关键技术的研究[J]. 肉类工业,2009(11):17-19.
[9]李翔,许彦. 猪血豆腐质构特性的影响因素[J]. 肉类研究,2016(5):15-19.
[10]陈尚卫,徐为民,陈菲,等. 超声波破壁工艺对鸭血豆腐营养品质的影响[J]. 江苏农业科学,2012,40(7):238-239.
[11]陈菲. 鸭血豆腐加工工艺优化及品质改善技术研究[D]. 南京:南京农业大学,2012.
[12]Gaffney P J,Wong M Y. Collaborative study of a proposed international standard for plasma fibrinogen measurement[J]. Thrombosis and Haemostasis,1992,68(4):428-432.
[13]Westphalen A D,Briggs J L,Lonergan S M. Influence of pH on rheological properties of porcine myofibrillar protein during heat induced gelation[J]. Meat Science,2005,70(2):293-299.
[14]徐舶,周光宏,徐幸莲,等. 不同部位鹿肉在宰后成熟过程中超微结构的变化[J].南京农业大学学报,2008,31(1):107-111.
[15]陈振林,石忠志,肖华党,等. 影响猪血豆腐品质的主要因素探讨[J]. 肉类工业,2010(5):21-25.
[16]Trout G R. Techniques for measuring water-binding capacity in muscle foods—A review of methodology[J]. Meat Science,1988,23(4):235-252.
[17]Han M,Zhang Y,Fei Y,et al. Effect of microbial transglutaminase on NMR relaxometry and microstructure of pork myofibrillar protein gel[J]. European Food Research and Technology,2009,228(4):665-670.
[18]Wang P,Xu X,Huang M,et al. Effect of pH on heat-induced gelation of duck blood plasma protein[J]. Food Hydrocolloids,2014,35:324-331.
[19]Carr H Y,Purcell E M. Effects of diffusion on free precession in nuclear magnetic resonance experiments[J]. Physical Review,1954,94(3):630.
[20]Meiboom S,Gill D. Modified spin-echo method for measuring nuclear relaxation times[J]. Review of Scientific Instruments,1958,29(8):688-691.
[21]Shiranita K,Miyajima T,Takiyama R. Determination of meat quality by texture analysis[J]. Pattern Recognition Letters,1998,19(14):1319-1324.
[22]张庆茹.动物生理学[M].北京:中国农业科学技术出版社,2007.
[23]Wang F S,Lin C W. Molecular forces involved in heat-induced porcine blood curd[J]. Journal of Agricultural & Food Chemistry,1994,42(5):1085-1088.
[24]Heinz S,Braspenning J. Measurement of Blood Coagulation Factor Synthesis in Cultures of Human Hepatocytes[J]. Methods in Molecular Biology,2015,1250:309-316.
[25]吕茂民,王方,赵雄,等. 凝血因子与创伤止血[J]. 军事医学,2015,39(3):211-215.
[26]Ockerman H W,Hansen C L. Animal by-product processing & utilization[M]. CRC Press,1999.
[27]秦红,李忠信. 纤维蛋白原的检测方法及进展[J]. 实验与检验医学,2003,21(1):33-35.
[28]王鹏. 血液蛋白的凝胶性质及其对肌原纤维蛋白凝胶的影响[D]. 南京:南京农业大学,2010.
[29]Yasui T,Ishioroshi M,Nakano H,et al. Changes in shear modulus,ultrastructure and spin-spin relaxation times of water associated with heat-induced gelation of myosin[J]. Journal of Food Science,2010,44(4):1201-1204.
[30]Alonso V,Campo M M,Roncalés P,et al. Effect of two levels of intramuscular fat on meat quality and instrumental texture and sensory quality in pork[J]. Transformation in Business & Economics,2009,7(3):31-46.
[31]Cierach M,Majewska D I K. Comparison of instrumental and sensory evaluation of texture of cured and cooked beef meat[J]. Molecular Nutrition & Food Research,2010,41(6):366-369.
[32]杨芳. 豆腐凝胶形成机理及水分状态与品质关系研究[D]. 武汉:华中农业大学,2009.
Effectofratiosofbloodtowaterongelpropertiesandqualityofsheepbloodtofugel
CHENLin,ZHANGXin-xiao,BIANHuan,WUHai-hong,SUNChong,ZOUYe,ZHUYong-zhi*,WANGDao-ying,XUWei-min
(Institute of Agricultural Products Processing,Jiangsu Academy of Agricultural Sciences,Nanjing 210014,China)
Ratios of blood to water is the key factor influencing the texture quality of blood tofu gel. Hu sheep blood was mixed with saline to make blood tofu gel in ratios of 1∶0,1∶1,1∶2,1∶3,1∶4,1∶5 and 1∶6. Then plasma fibrinogen levels,dynamic rheological properties,ultrastructural changes were measured to reveal the ratios of blood to water on gel properties and quality changes of sheep blood tofu gel. The results showed that with the fall of blood concentration,the storage moduli and loss moduli of blood tofu gel decreased and its strength tend to be weak,meanwhile the cooking loss,centrifuging loss and relaxation time increased and immobilized water decreased. When the ratio of blood to water was great than or equal to 1∶3,fibrin gel showed fragile and soft structure and blood tofu gel was not with typical dynamic fluid characteristics leading to more water exudate,the texture characteristics of blood tofu gel showed a remarkable falling of hardness,chewiness,cohesiveness,but elasticity was not affected. When the ratio of blood to water was more than 1∶3,it was conducive for maintaining the texture characteristics and water holding capacity,which was more suitable to make sheep blood tofu gel.
sheep blood;ratios of blood to water;blood tofu gel;gel properties
2017-07-06
陈琳(1992-),女,硕士,研究方向:畜禽产品加工,E-mail:njauchenlin@163.com。
*通讯作者:诸永志(1975-),男,硕士,研究员,研究方向:畜禽产品加工,E-mail:yongzhizhu@163.com。
江苏省农业科技自主创新资金(CX(15)1007);国家自然科学基金青年科学基金(31601405)。
TS251
A
1002-0306(2017)23-0005-05
10.13386/j.issn1002-0306.2017.23.002
