超声辅助提取金针菇中麦角甾醇及其HPLC测定方法
2017-12-18,,,,,
,,, ,,
(陕西理工大学,维生素D生理与应用研究所,陕西汉中 723000)
超声辅助提取金针菇中麦角甾醇及其HPLC测定方法
胡代花,张嘉昕,李翠丽,陈旺,赵浩名,王文博
(陕西理工大学,维生素D生理与应用研究所,陕西汉中 723000)
采用超声辅助提取方法,通过单因素实验和正交实验,对影响麦角甾醇提取效果的主要因素提取溶剂、提取时间、料液比和提取温度进行研究,并建立金针菇中麦角甾醇HPLC测定方法。结果表明,各因素对金针菇中麦角甾醇得率的影响程度依次为提取次数、料液比、提取温度和提取时间。最佳提取条件为无水乙醇超声提取2次,每次20 min,料液比1∶50,提取温度50 ℃,在该提取条件下,麦角甾醇得率高达2.28 mg·g-1。麦角甾醇的线性范围为10.00~100.00 μg·mL-1,相关系数为0.9998,平均回收率(n=9)为100.31%,RSD(n=9)为2.69%,分析周期11 min。该法与传统皂化回流提取相比,提取效率及重现性均较好。
金针菇,麦角甾醇,超声辅助提取,高效液相色谱法
超声波是一种高频机械振荡波,其空化效应可以强化萃取效果,其产生的热效应、乳化、扩散、击碎、化学效应、生物效应、凝聚效应等次级效应也能加速有效成分在溶剂中的扩散释放,因此超声提取法具有缩短提取时间,减少溶剂用量,提高提取率等诸多优势而得到较广泛应用[21-23]。
本论文拟采用超声波辅助提取法,应用单因素和正交实验,通过考察提取溶剂、提取次数、料液比、提取时间、提取温度等5个方面对金针菇粉中麦角甾醇的提取效果的影响,对其提取工艺进行优化,并建立金针菇中麦角甾醇的HPLC含量检测方法,旨在为其深加工和高值化开发利用提供理论参考和技术依据。
1 材料与方法
1.1 材料与仪器
金针菇粉 鲜金针菇(购自汉中市蔬菜市场)剪去根部约2 cm,置于电热鼓风干燥箱中烘干后研磨成粉,过200目筛,冷却至室温,装袋密封4 ℃保存备用;麦角甾醇标准品(美仑生物技术有限公司,纯度98%,20 mg);丙酮、乙醚、氯仿、乙醇 均为分析纯,天津市富宇精细化工有限公司;乙醇、乙腈、甲酸 均为色谱级,购自Sigma-Aldrich公司;KOH-EtOH溶液 25 g KOH用40 mL去离子水溶解,乙醇定容至100 mL。
1260高效液相色谱仪 美国Agilent公司;BSA224S-CW万分之一电子天平 北京赛多利斯仪器有限公司;5810 R低速离心机 德国Eppendorf公司;KQ-500E超声波清洗仪(固定功率500 W,频率40 kHz) 昆山舒美公司;FW177中草药粉碎机、101-3A电热鼓风干燥箱 天津市泰斯特仪器有限公司;BCD-278TAJ冰箱 青岛海尔有限公司。
1.2 实验方法
1.2.1 金针菇粉麦角甾醇的提取和得率测定 取一定量金针菇粉,按一定料液比加入提取溶剂,于一定温度下超声提取(功率500 W,频率40 kHz)一定时间和一定次数后,3500 r·min-1离心10 min,上清液定容至一定体积,0. 22 μm微孔滤膜滤过,直接进色谱系统分析。参照线性回归方程、溶液总体积和称样量计算麦角甾醇得率。每个处理进行3次重复。麦角甾醇得率(mg/g)=待测液浓度×待测液总体积/称样量。
1.2.2 单因素实验
1.2.2.1 不同提取溶剂对麦角甾醇得率的影响 固定反应条件为提取温度40 ℃,提取时间15 min,提取次数2次,提取料液比1∶50 (g/mL),考察不同提取溶剂(乙醇、乙醚、丙酮和氯仿)对麦角甾醇得率的影响。
1.2.2.2 不同提取次数对麦角甾醇得率的影响 固定反应条件为提取溶剂无水乙醇,提取温度40 ℃,提取时间15 min,提取料液比1∶50 (g/mL),考察不同提取次数(1、2、3次)对麦角甾醇得率的影响。
1.2.2.3 不同提取时间对麦角甾醇得率的影响 固定反应条件为提取溶剂无水乙醇,提取温度40 ℃,提取次数2次,提取料液比1∶50 (g/mL),考察不同提取时间(10、15、20、30、40 min)对麦角甾醇得率的影响。
1.2.2.4 不同提取料液比对麦角甾醇得率的影响 固定反应条件为提取溶剂无水乙醇,提取温度40 ℃,提取时间15 min,提取次数2次,考察不同提取料液比(1∶5、1∶10、1∶20、1∶40、1∶50 g/mL)对麦角甾醇得率的影响。
1.2.2.5 不同提取温度对麦角甾醇得率的影响 固定反应条件为提取溶剂无水乙醇,提取料液比1∶40 (g/mL),提取时间15 min,提取次数2次,考察不同提取温度(20、30、40、50、60、70 ℃)对麦角甾醇得率的影响。
1.2.3 正交实验 根据单因素实验结果,以无水乙醇为提取溶剂,超声功率500 W,选取提取次数、提取时间、料液比、提取温度作为影响麦角甾醇得率因素,以四因素三水平进行正交实验对提取条件进行优化,实验设计见表1。

表1 正交实验因素与水平表Table 1 The factors and levels table of the orthogonal test
1.2.4 含量测定方法学考察
1.2.4.1 色谱条件的选择 柱温30 ℃,进样量10 μL,检测波长282 nm。比较了不同比例的乙腈-0.1%甲酸流动相(80∶20、95∶5、96∶4、97∶3、98∶2),4.6×100 mm(3.5 μm)和4.6×250 mm(5 μm)两种Agilent RP C18色谱柱,以及0.6、0.8、1.0、1.2 mL/min四种流速对分离效果的影响。
1.2.4.2 溶液的制备 对照品溶液:精密称取麦角甾醇对照品100 mg,置于50 mL棕色容量瓶中,乙醇溶解后定容至刻度,配制成对照品母液。经逐步定量稀释,制成10、20、40、60、80、100 μg·mL-1的系列对照品溶液;供试品溶液参照1.2.1方法制备。
1.2.4.3 系统适用性实验 对照品溶液、供试品溶液各进样10 μL,利用液相色谱仪测定,记录色谱图。
1.2.4.4 线性关系考察 系列对照品溶液分别进样10 μL,以282 nm处的吸收峰面积对浓度作曲线,进行拟合。
1.2.4.5 精密度实验 对照品溶液进样10 μL,连续进样5 次,测定麦角甾醇峰面积。
1.2.4.6 稳定性实验 取同一供试品溶液,分别在0、2、4、8、12和24 h各进样10 μL,测定麦角甾醇峰面积。
1.2.4.7 重复性实验 取不同批次金针菇粉末样品,按“1.2.1”项下方法制备供试品溶液,分别进样,测定峰面积,计算含量。
1.2.4.8 加样回收率实验 取已知麦角甾醇含量的金针菇粉3 份,分别加入0.330、0.416、0.500 mg麦角甾醇标准品,按“1.2.1”项下方法制备供试品溶液,依法测定,计算回收率,每处理3个重复。
1.2.5 传统皂化回流提取 精确称取1.0 g金针菇粉,混悬于32 mL KOH-EtOH溶液中,85~90 ℃回流提取3 h,待提取液冷却后,倒入分液漏斗中,正庚烷提取三次(3×10 mL),蒸除溶剂,无水乙醇溶解定容至10 mL,0.22 μm微孔滤膜滤过,直接进色谱系统分析。每个处理进行3次重复[12,24]。
1.2.6 超声辅助提取(EtOH-KOH为提取液) 精确称取200 mg金针菇粉,混悬于10 mL KOH-EtOH溶液中,60 ℃超声提取2次,每次40 min,合并提取液,倒入分液漏斗中,正庚烷提取三次(3×10 mL),蒸除溶剂,无水乙醇溶解定容至10 mL,0.22 μm微孔滤膜滤过,直接进色谱系统分析。每处理3个重复[12,24]。
1.3 数据处理
采用SPSS 21.0软件进行统计分析,采用Tukey’s HSD进行方差分析(p<0.05)。
2 结果与分析
2.1 单因素实验
2.1.1 提取溶剂对麦角甾醇得率的影响 由图1可知,不同提取溶剂对金针菇中麦角甾醇提取效率影响较大,其中无水乙醇为溶剂的得率最高,分别是丙酮、氯仿及乙醚为溶剂时提取得率的1.44、1.46和2.57倍,并与丙酮和乙醚为溶剂时提取得率差异显著(p<0.05),但与氯仿为溶剂时提取得率相比无显著差异(p>0.05)。当以氯仿为提取溶剂时,由于混悬液分层不明显,给实际操作带来了一定影响。综合考虑提取效率、提取溶剂安全性和经济性,确定麦角甾醇提取溶剂为无水乙醇。
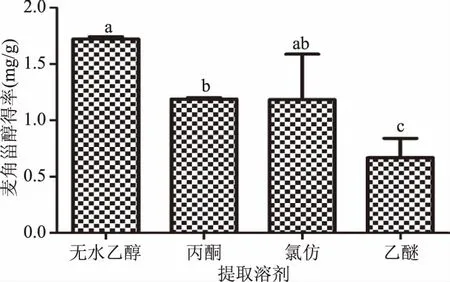
图1 提取溶剂对麦角甾醇得率的影响Fig.1 Effect of solvent on extraction yield of ergosterol 注:不同小写字母表示差异显著,p<0.05;图2~图5同。
2.1.2 提取次数对麦角甾醇得率的影响 由图2可知,不同提取次数对麦角甾醇提取得率影响较大,随着提取次数增加,提取得率逐渐升高,提取一次、两次、三次的麦角甾醇得率依次为(1.40±0.21)、(1.82±0.01)和(1.91±0.06) mg·g-1,其中两次与三次提取得率之间在5%水平无显著性差异,而提取一次与提取两次、三次的得率间均有显著性差异。综合考虑提取得率及经济性,确定麦角甾醇提取次数为两次。
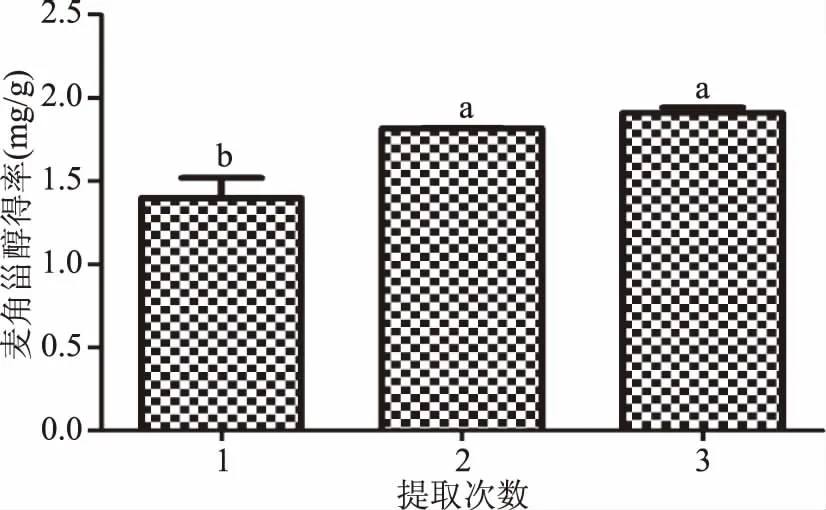
图2 提取次数对麦角甾醇得率的影响Fig.2 Effect of extraction on extraction yield of ergosterol
2.1.3 提取时间对麦角甾醇得率的影响 由图3可知,不同提取时间对麦角甾醇提取得率影响较大,在10~40 min提取时间范围内,随着提取时间的延长,提取得率先升高后趋于稳定。提取10、15、20、30、40 min的麦角甾醇提取得率分别为(1.24±0.22)、(1.96±0.06)、(1.95±0.07)、(1.96±0.04)和(2.06±0.10) mg·g-1。其中提取10 min与提取15、20、30、40 min的得率均有显著性差异(p<0.05),而提取15、20、30、40 min的得率差异无显著(p>0.05)。综合考虑提取得率及经济性,确定麦角甾醇提取时间为15 min。
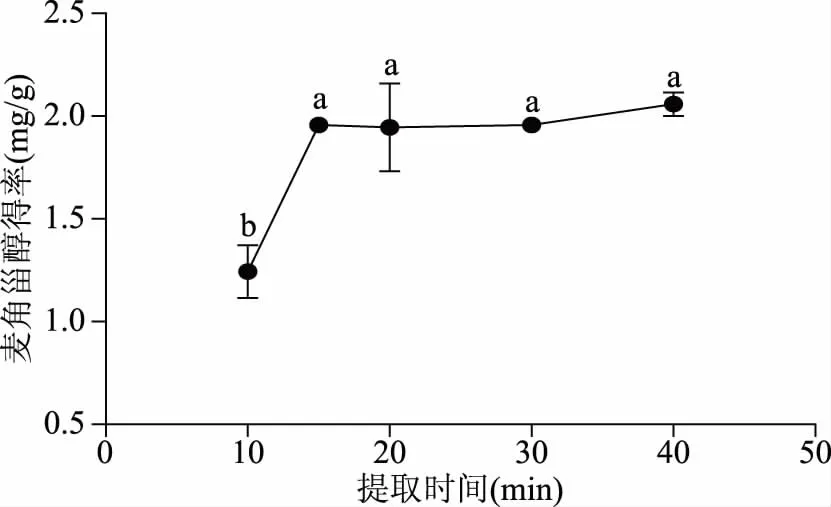
图3 提取时间对麦角甾醇得率的影响Fig.3 Effect of time on extraction yield of ergosterol
2.1.4 料液比对麦角甾醇得率的影响 由图4可知,不同料液比对麦角甾醇提取得率影响极大,在1∶5~1∶50料液比范围内,提取得率随着料液比增加先升高后趋于平缓,料液比(g/mL)为1∶5、1∶10、1∶20、1∶40、1∶50时麦角甾醇提取得率分别为(0.32±0.07)、(0.62±0.02)、(1.42±0.35)、(1.68±0.08)和(1.99±0.01) mg·g-1,其中料液比为1∶40的提取得率与1∶20和1∶50间均无显著性差异,而与料液比为1∶5和1∶10间的提取得率差异显著。综合考虑提取得率且减少不必要浪费,确定麦角甾醇提取料液比为1∶40。
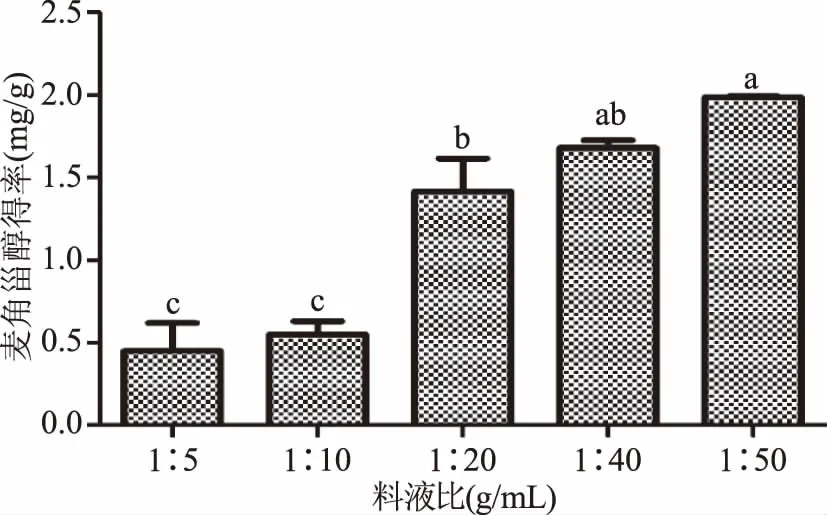
图4 料液比对麦角甾醇得率的影响Fig.4 Effect of ratios of solvent to material on extraction yield of ergosterol
2.1.5 提取温度对麦角甾醇得率的影响 由图5可知,不同提取温度对麦角甾醇提取得率有较大影响,20、30、40、50、60、70 ℃时麦角甾醇提取得率依次为(1.55±0.03)、(1.70±0.04)、(1.68±0.08)、(1.83±0.09)、(1.96±0.05)和(1.75±0.23) mg·g-1。其中60 ℃与20 ℃提取得率间有显著性差异,与其余温度提取得率间均无显著性差异;20 ℃与其余温度提取得率间均无显著性差异。综合考虑提取得率、能耗及可操作性,确定麦角甾醇提取温度为40 ℃。
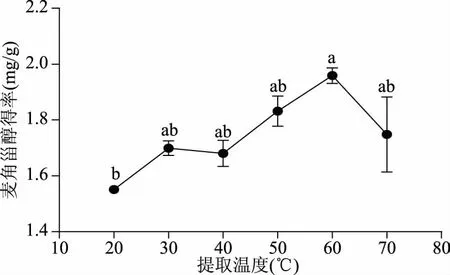
图5 提取温度对麦角甾醇得率的影响Fig.5 Effect of temperature on extraction yield of ergosterol

表4 麦角甾醇测定的回归方程、线性范围、回收率、精密度、稳定性和重复性Table 4 The linear equation,linear range,recovery,precision,stability and repeatability of ergosterol determination
2.2 正交实验
根据单因素实验结果,以无水乙醇为提取溶剂,超声功率500 W,选取提取次数、提取时间、料液比、提取温度作为影响金针菇中麦角甾醇得率因素,以四因素三水平进行正交实验对提取条件进行优化,正交实验结果见表2,方差分析结果见表3。
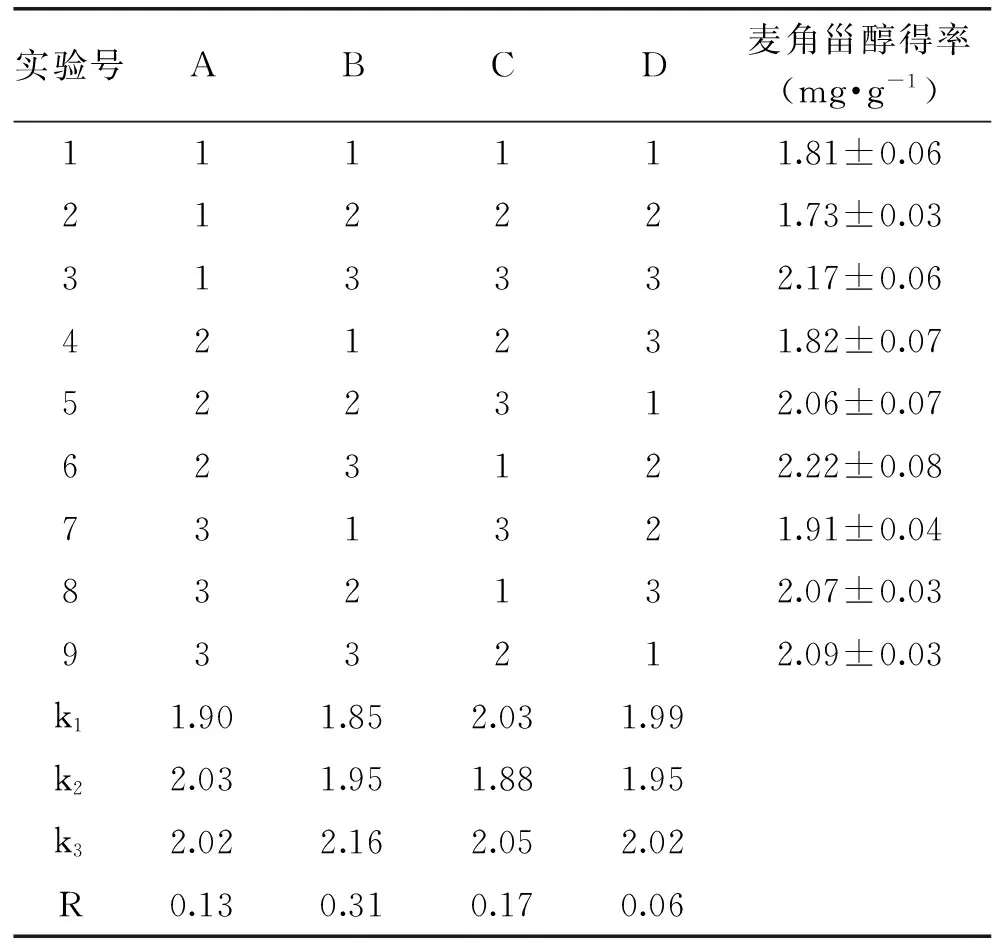
表2 正交实验设计与结果分析(n=3)Table 2 Trials and results of orthogonal experiment(n=3)
由表2中R值可知,影响金针菇中麦角甾醇得率的先后顺序依次为:提取时间(B)>料液比(C)>提取次数(A)>提取温度(D)。由表3方差分析结果可知,提取时间、料液比、提取次数对麦角甾醇得率的影响极为显著,提取温度对麦角甾醇得率的影响不显著。正交实验优化得出的条件为A2B3C3D3,即无水乙醇超声提取2次,每次20 min,料液比1∶50 (g/mL),提取温度50 ℃。对优化条件进行验证实验,麦角甾醇得率高达(2.28±0.03) mg·g-1(n=3)。
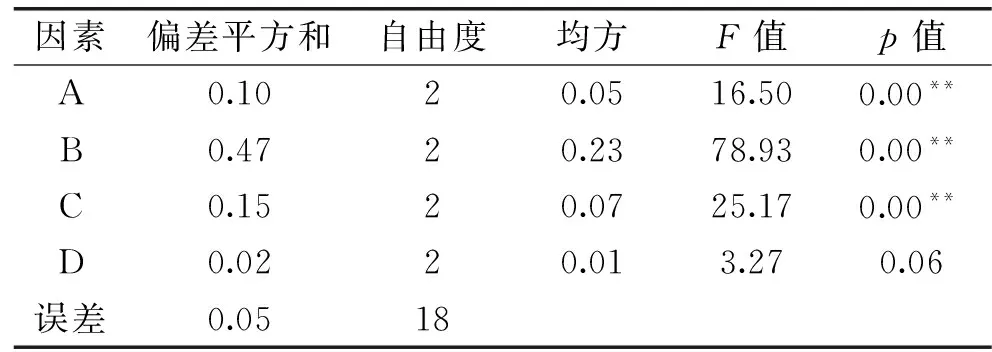
表3 方差分析表Table 3 Analysis results of variance
注:**表示p<0.01,极显著。
2.3 含量测定方法学考察
2.3.1 色谱条件的选择 比较了不同比例的乙腈-0.1%甲酸流动相(80∶20、95∶5、96∶4、97∶3、98∶2),结果表明在80∶20比例下麦角甾醇色谱峰的分离效果不佳,在95∶5比例时,麦角甾醇与其相邻组分分离效果较好,当继续增加乙腈比例时,麦角甾醇色谱峰出现拖尾现象,且保留时间增长;比较了4.6 mm×100 mm(3.5 μm)和4.6 mm×250 mm(5 μm)两种C18柱色谱柱,结果表明前者麦角甾醇保留时间为7.7 min,而后者麦角甾醇保留时间超过30 min;比较了0.6、0.8、1.0、1.2 mL/min四种流速,结果表明0.6、0.8、1.0 mL/min下麦角甾醇保留时间分别为13.86、10.18、7.7 min,而1.2 mL/min流速的保留时间为6.91 min,但峰形较宽。综合以上因素,最终确定色谱条件为:Agilent RP C18色谱柱(4.6 mm×100 mm,3.5 μm),流速1.0 mL·min-1,流动相为乙腈-0.1%甲酸水溶液(95∶5)。麦角甾醇测定的回归方程、线性范围、回收率、精密度、稳定性和重复性结果见表4。
2.3.2 系统适用性实验 由图6可知,该色谱条件下,麦角甾醇与相邻色谱峰能达到较好的分离,且出峰时间合适,峰形较好,干扰少。
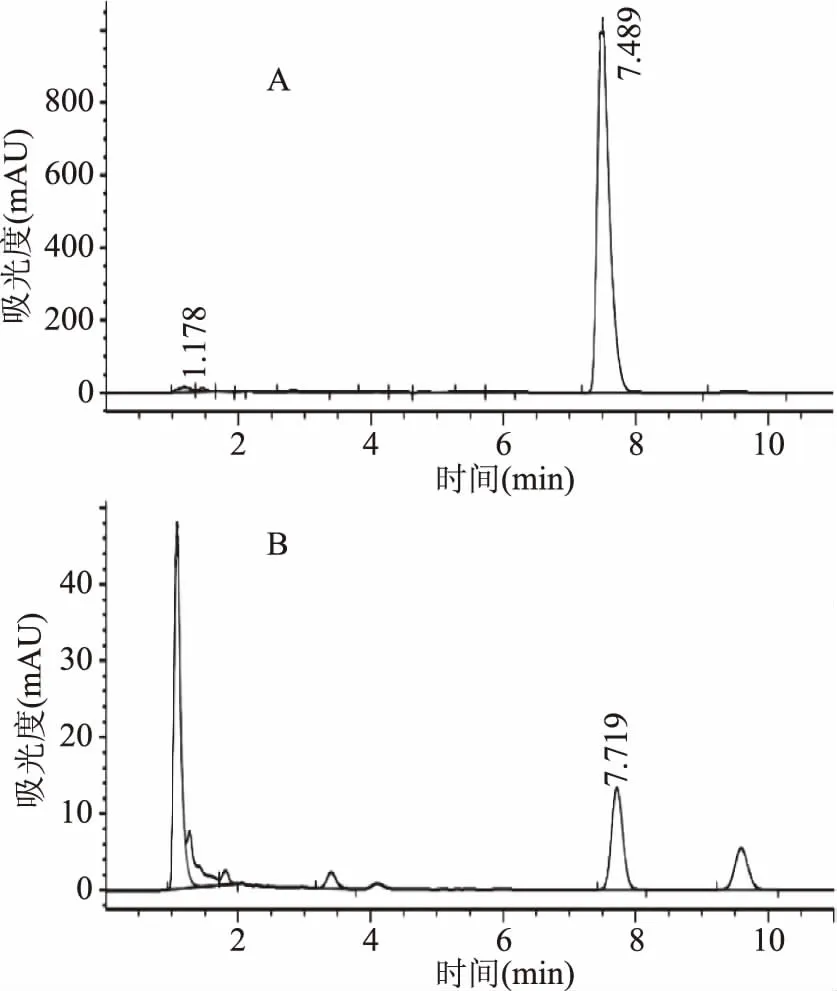
图6 麦角甾醇对照品溶液(A)及样品溶液(B)HPLC色谱图Fig.6 Ergosterol HPLC chromatogram of standard solution(A)and sample solution(B)
2.4 三种提取方法比较
由表5可知,乙醇超声辅助(EtOH-UAE)比EtOH-KOH超声辅助提取(EtOH-KOH-UAE)和传统回流提取(RE)对金针菇麦角甾醇的提取更完全,具有提取时间短、得率高、操作简便、重现性佳、样品用量少等优势,适用于快速高效准确提取麦角甾醇;EtOH-KOH-UAE相比EtOH-UAE提取率较低,RSD值较高,且后处理还需多次萃取、减压蒸除溶剂和定容等步骤,进一步增加了提取成本及样品处理时间;而传统皂化回流提取相比提取率最低,耗时最长且重现性较差。
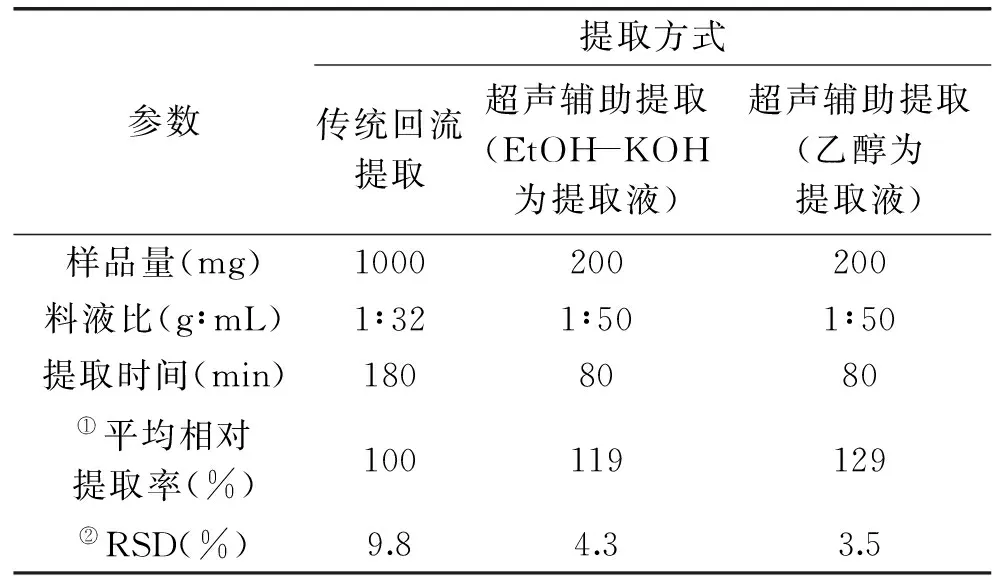
表5 传统回流提取、皂化液超声辅助提取和乙醇超声辅助提取比较Table 5 Comparison of conventional extraction and EtOH-KOH ultrasonic-assisted extraction with EtOH microwave assisted extraction
注:①以传统回流提取方法的提取率为100%计算;②3次实验的相对标准偏差。
3 结论
采用超声辅助提取方法,通过单因素实验和正交实验,对影响麦角甾醇提取效果的主要因素进行研究,并建立金针菇中麦角甾醇HPLC测定方法。结果表明,各因素对金针菇中麦角甾醇得率的影响程度依次为提取时间,料液比,提取次数和提取温度。最佳提取条件为无水乙醇超声提取2次,每次20 min,料液比1∶50,提取温度50 ℃,在该提取条件下,麦角甾醇得率高达2.28 mg·g-1。麦角甾醇的线性范围为10.00~100.00 μg·mL-1,相关系数为0.9998,平均回收率(n=9)为100.31%,RSD(n=9)2.69%,且分析周期在11 min以内。该法与EtOH-KOH-UAE法和RE法两种方法同比,结果表明EtOH-UAE法比EtOH-KOH-UAE法和RE法对金针菇麦角甾醇的提取更完全,具有提取时间短、得率高、操作简便、重现性佳、样品用量少等优势,适用于金针菇生产及对生物量的间接测定,也可以被借鉴于其他真菌的相关研究和应用中。
[1]刘骏,陈相艳,王文亮,等. 金针菇的研究现状及产业化应用[J]. 中国食物与营养,2014,20(10):25-28.
[2]Smiderle F R,Carbonero E R,Sassaki G L,et al. Characterization of a heterogalactan:Some nutritional values of the edible mushroomFlammulinavelutipes[J]. Food Chemistry,2008,108(1):329-333.
[3]Shin K S,Yu K W,Lee H K,et al. Production of anti-complementary exopolysaccharides from submerged culture offlammulinavelutipes[J]. Food Technology & Biotechnology,2007,45(3):319-326.
[4]Takaku T,Kimura Y,Okuda H. Isolation of an antitumor compound fromAgaricusblazeiMurill and its mechanism of action[J]. The Journal of Nutrition,2001,131(5):1409-1413.
[5]Zhao Y,Xie R,Chao X,et al. Bioactivity-directed isolation,identification of diuretic compounds fromPolyporusumbellatus[J]. Journal of Ethnopharmacology,2009,126(1):184-187.
[6]张萍,肖新月,黄玮,等. RP-HPLC-UV法测定5种发酵虫草制剂中麦角甾醇的含量[J].药物分析杂志,2011,31(2):258-260.
[7]赵英永,赵晔,林瑞超,等. RP-HPLC法测定猪苓中麦角甾醇的含量[J]. 药物分析杂志,2009,29(6):898-900.
[8]Simon R R,Phillips K M,Horst R L,et al. Vitamin D mushrooms:comparison of the composition of button mushrooms(Agaricusbisporus)treated postharvest with UVB light or sunlight[J]. Journal of Agricultural and Food Chemistry,2011,59(16):8724-8732.
[9]Mau J L,Chen P R,Yang J H. Ultraviolet irradiation increased vitamin D2content in edible mushrooms[J]. Journal of Agricultural and Food Chemistry,1998,46(12):5269-5272.
[10]Jasinghe V J,Perera C O. Ultraviolet irradiation:the generator of vitamin D2in edible mushrooms[J]. Food Chemistry,2006,95(4):638-643.
[11]朱效刚,陶冠军,陈蕴.高效液相色谱法测定功能性红曲中的麦角甾醇[J].食品与发酵工业,2005,26(2):104-107.
[12]高虹,谷文英,丁霄霖. 利用微波辅助提取测定姬松茸中麦角甾醇的含量[J].浙江大学学报:农业与生命科学版,2007,33(1):113-118.
[13]宋师花,贾晓斌,陈彦,等. 超临界CO2萃取灵芝中麦角甾醇的实验研究[J].中国中药杂志,2009(14):1783-1785.
[14]史德芳,高虹,程薇,等. 闪式提取香菇柄中麦角甾醇工艺研究[J].食品工业科技,2014,5(9):208-210,215.
[15]谢翎,陈红梅,陈安徽,等. 超声波破碎法提取球孢白僵菌麦角甾醇的条件优化研究[J].徐州工程学院学报,2007,22(2):10-13.
[16]高虹,谷文英. 三波长光度法测定姬松茸中麦角甾醇含量[J].分析化学,2007,35(4):586-588.
[17]Larsen T,Axelsen J,Ravn H W. Simplified and rapid method for extraction of ergosterol from natural samples and detection with quantitative and semi-quantitative methods using thin-layer chromatography[J]. Journal of Chromatography A,2004,1026(1):301-304.
[18]Barreira J C M,Oliveira M B P P,Ferreira I C F R. Development of a novel methodology for the analysis of ergosterol in mushrooms[J]. Food Analytical Methods,2014,7(1):217-223.
[19]Phillips K M,Ruggio D M,Horst R L,et al. Vitamin D and sterol composition of 10 types of mushrooms from retail suppliers in the United States[J]. Journal of Agricultural and Food Chemistry,2011,59(14):7841-7853.
[20]Jasinghe V J,Perera C O. Distribution of ergosterol in different tissues of mushrooms and its effect on the conversion of ergosterol to vitamin D2by UV irradiation[J]. Food Chemistry,2005,92(3):541-546.
[22]邓梦琴,林晓瑛,张明,等. 超声辅助提取菠萝蜜果皮黄酮工艺优化及体外抗氧化活性研究[J]. 食品工业科技,2016,37(24):288-296.
[23]张苗,刘晓娟,刘欣. 超声辅助提取雨生红球藻渣多糖工艺优化[J]. 食品工业科技,2016,37(20):254-257,262.
[24]Lamacka M,Sajbidor J. Ergosterol determination inSaccharomycescerevisiae. Comparison of different methods[J]. Biotechnology Techniques,1997,11(10):723-725.
Optimizationofultrasonic-assistedextractionprocessofergosterolfromFlammulinavelutipesanditsdeterminationbyHPLC
HUDai-hua,ZHANGJia-xin,LICui-li,CHENWang,ZHAOHao-ming,WANGWen-bo
(Vitamin D Research Institute,Shaanxi University of Technology,Hanzhong 723000,China)
The main factors affecting the ultrasonic-assisted extraction efficiency of solvent types,times,ratios of solvent to material,duration and temperature on the yield of ergosterol inFlammulinavelutipeswere researched respectively by single-factor experiments,and the extraction process were optimized by orthogonal tests. The results showed that the factors affecting the extraction rate of ergosterol were in the order of extraction duration,extraction ratios of solvent to material,extraction times and extraction temperature. The optimum extraction conditions were as follows:the extraction time 20 min and number of extraction 2 times,the ratio of material to ethanol was 1∶50 (g/mL),extraction temperature 50 ℃. Under these conditions,the average extraction yield of ergosterol was 2.28 mg·g-1. The linear range of ergosterol was 10.00~100.00 μg·mL-1(R2=0.9998),the average recoveries(n=9)was 100.31% with RSD 2.69%,and the analysis cycle was within 11 minutes. This method showed significantly higher extraction yield and reproducibility compared with conventional reflux.
Flammulinavelutipes;ergosterol;ultrasonic-assisted extraction;HPLC
2017-06-16
胡代花(1983-),女,博士,讲师,主要从事维生素D类保健食品研发方面的工作,E-mail:hudaihua007@163.com。
陕西理工大学博士后项目(SLGBH16-04);陕西省重点科技创新团队项目(2012KCT-29);陕西省2011协同中心项目(QBXT-Z(P)-15-15);陕西理工大学校级科研项目(SLGQD16-10);汉中市科技局项目(2013FZ24)。
TS209
A
1002-0306(2017)23-0192-06
10.13386/j.issn1002-0306.2017.23.036
