人疱疹病毒感染及抗疱疹病毒感染药物研究进展
2017-12-02徐慧玲陈军刚何灿辉
徐慧玲, 陈军刚, 何灿辉
人疱疹病毒感染及抗疱疹病毒感染药物研究进展
徐慧玲1, 陈军刚2, 何灿辉1
人疱疹病毒感染; 抗疱疹病毒药物; 治疗应用
疱疹病毒(herpes viruses)是一类有包膜、基因组为双链DNA的病毒。目前发现的能感染人的疱疹病毒有8种,包括:单纯疱疹病毒1型(herpes simplex virus-1,HSV-1),单纯疱疹病毒2型(herpes simplex virus-2,HSV-2),水痘-带状疱疹病毒(varicella zoster virus,VZV),EB病毒(Epstein-Barr virus,EBV),人类巨细胞病毒(human cytomegalovirus,HCMV),人类疱疹病毒6型(HHV-6),人类疱疹病毒7型(HHV-7)和卡波济肉瘤相关病毒(Kaposi's sarcoma-associated herpesvirus,KSHV)[1]。疱疹病毒的生活周期分为典型的潜伏期复制和裂解期复制。疱疹病毒感染能够引起多种疾病,如疱疹、神经系统感染及肿瘤等重大疾病[2]。疱疹病毒具有人群高携带性、易致病性及病症反复发作性等特点,严重影响人们的生命健康。目前,依然缺乏预防及治疗疱疹病毒感染的有效疫苗。临床治疗疱疹病毒相关疾病的药物主要为核苷类似物类抗病毒药物、免疫调节剂及抗病毒化疗药物。这些药物在一定程度上可以缓解相关疾病的病症,减轻患者的痛苦。然而,临床应用数据显示这些药物不能完全清除感染的病毒,并且存在极大的不良反应,对机体造成很大的伤害。因此,了解疱疹病毒感染的特点及抗疱疹病毒药物的现状对于疱疹病毒相关疾病的临床治疗及药物研发具有重要的意义。
1 疱疹病毒感染及相关疾病
1.1 疱疹病毒感染及复制
人类疱疹病毒感染为多发病和常见病,人群中疱疹病毒感染血清抗体阳性率高。流行病学调查显示90%成人携带一种或多种疱疹病毒,大多数以潜伏形式终生存在[3-4]。人群中较高的疱疹病毒携带率及疱疹病毒感染周期发病率与病毒本身的复制特点密切相关。
疱疹病毒感染的生活周期分为典型的潜伏期复制和裂解期复制。在潜伏期复制过程中,病毒基因组随细胞基因组复制而复制,只有少量的病毒基因被表达,不产生成熟的病毒粒子。研究数据显示潜伏复制和潜伏基因的表达在病毒基因组的维持、免疫逃逸及相应疾病的发生中起到重要作用。处于潜伏期的疱疹病毒可在机体中终生潜伏,而不表现出任何疾病症状,因此,疱疹病毒潜伏复制的特点是其人群高阳性率的原因,同时也是限制抗疱疹病毒研发的难点之一[5-6]。目前,临床上依然没有针对疱疹病毒潜伏复制的抗病毒药物。
病毒进入到裂解期复制过程中时,大多数的病毒基因表达,病毒基因组DNA大量复制,产生大量成熟的病毒粒子[7]。并诱导多种疾病的发生且具有高的传播性。研究表明裂解期复制在病毒的致病过程中起到重要作用。临床数据显示应用抑制病毒裂解期复制的药物或抑制剂,能有效地缓解病毒造成的疾病症状[8-9]。目前,治疗疱疹病毒感染的抗病毒药物的作用靶标大多是针对其裂解期复制阶段。因此,开发针对病毒裂解期复制的药物对于防治疱疹病毒造成的疾病至关重要。
1.2 疱疹病毒感染性疾病
根据基因组序列和结构及理化性质的不同,又可将人类疱疹病毒分为3个亚科:α疱疹病毒亚科,β疱疹病毒亚科和γ疱疹病毒亚科。疱疹病毒感染引起的疾病,根据病源种类的不同及感染的部位不同,产生的疾病症状也有所差异,如表1所示。
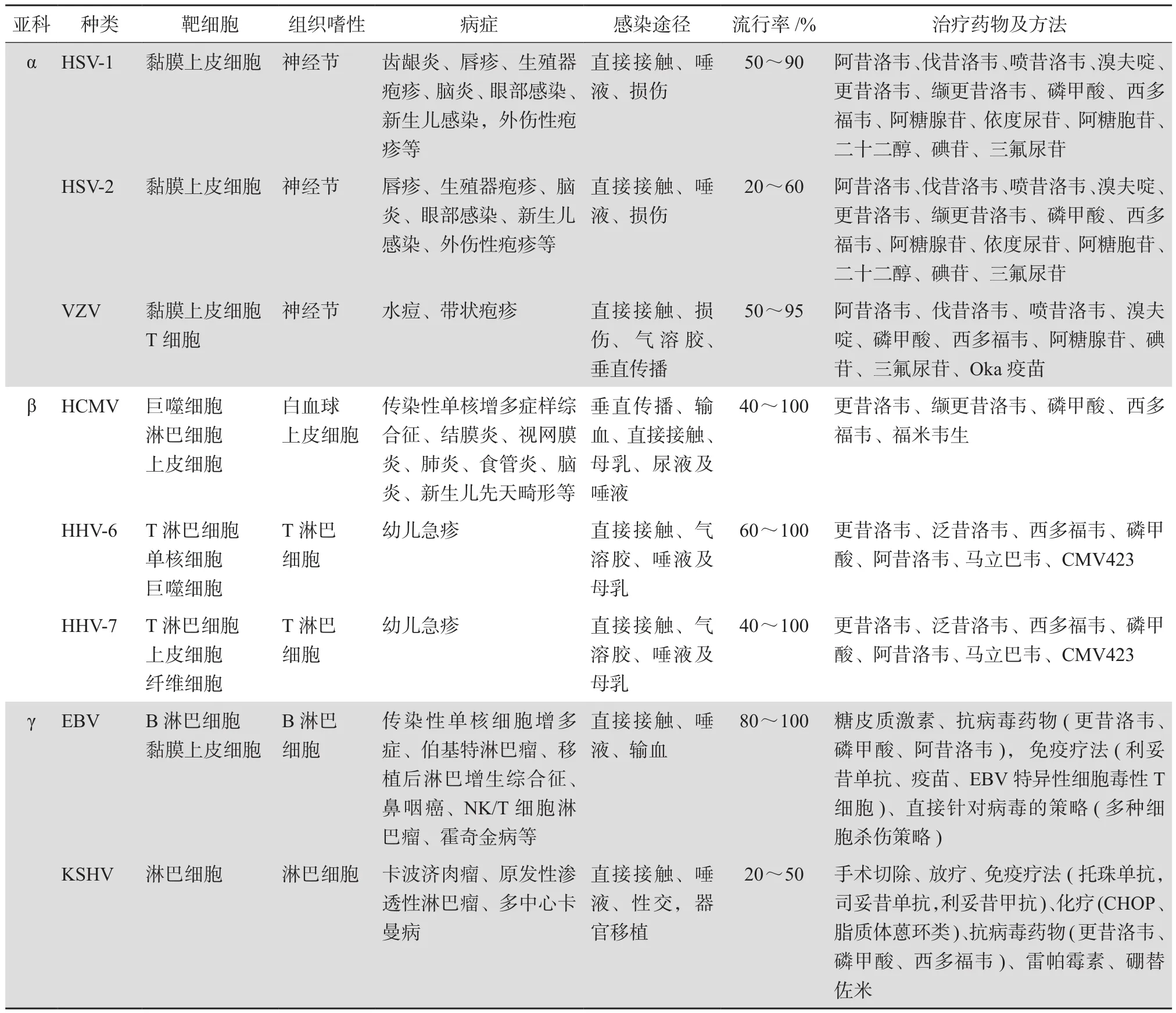
表1 人疱疹病毒成员及抗疱疹病毒感染治疗[5-6,8-14]
α疱疹病毒亚科包括HSV-1、HSV-2和VZV。流行病学调查显示人群中携带单纯疱疹病毒阳性率较高,2012年全世界感染HSV-1的人数达到4亿,感染HSV-2的达到1亿[15-16]。单纯疱疹病毒感染引起口、唇或生殖器的皮肤或黏膜上出现水泡等症状[4]。临床病症主要包括:龈口炎(gingivostomatitis)、角膜结膜炎(keratoconjunctivitis)、脑炎(encephalitis)以及生殖系统感染和新生儿的感染。在病发时,会产生非常轻微或异常症状。首次在口腔内发作时可诱导无菌性脑膜炎(aseptic meningitis)的发生[17]。单纯疱疹病毒感染途径包括直接接触、唾液及皮肤损伤。VZV同样是一种具有高度传染性的疱疹病毒,可引发水痘(chickenpox)和带状疱疹(shingles)。感染儿童时通常引起水痘症状,而感染成人通常引起带状疱疹[10]。带状疱疹临床症状表现可以为非典型及典型的带状疱疹。病毒感染引起的并发症通常有脑脊髓炎和眼结膜炎。VZV的感染途径包括直接接触、飞沫传播等[18]。若无水痘疫苗接种规划,大多数人都会在中年期感染该病毒,严重影响人类的生命健康。
β疱疹病毒亚科包括HCMV、HHV-6和HHV-7。HCMV在我国人群中的感染率高达86%~96%[19]。HCMV先天性感染可导致胎儿畸形、智力障碍和感觉神经性耳聋等严重后遗症。HCMV感染免疫抑制个体,如器官移植、骨髓移植(BMT)、造血干细胞移植(HSCT)、AIDS等患者,则可引起肺炎、肝炎、视网膜脉络膜炎等疾病,严重时危及生命[20-21]。HHV-6及HHV-7在人群中的携带率同样非常高,严重影响人们的健康[22-23]。两者感染引起的症状有一定的类似,值得人们重视[24]。病毒感染婴幼儿时,表现为玫瑰疹(roseola),并伴有咽部充血和颈淋巴结肿大、高热、惊厥、恶心、呕吐、嗜睡等全身症状;感染成人时,症状多为发热、双侧颈淋巴结肿大、无触痛、斑疹等;感染AIDS患者及器官移植受者时,临床可见发热、白细胞减少、皮疹等症状,甚至发生肺炎、肝炎及脑炎[25]。
γ疱疹病毒亚科成员包括EBV和KSHV。目前报道显示多种肿瘤疾病的发生与该亚科病毒的感染相关。研究表明在非霍奇金和霍奇金淋巴瘤、淋巴组织增生等疾病中能发现EBV的存在。同时,EBV感染也可以引起非淋巴瘤的发生,如鼻咽癌(nasopharyngeal carcinoma,NPC)[26]。其传播途径包括直接接触、唾液及输血方式传播。KSHV被证明是卡波济肉瘤(KS)、原发性渗透性淋巴瘤(PEL)和多中心卡曼病(MCD)的致病因子[27]。KSHV感染主要通过直接接触、唾液、器官移植及性交的方式进行传播。EBV和KSHV在AIDS患者、器官移植受者或免疫抑制患者身上有极高的致淋巴瘤发生率。流行病学调查数据显示,在2012年,世界范围内估计EBV造成的NPC新增病例86 691例,死亡50 828例[28];KSHV相关肿瘤新增44 247例,死亡26 974例[29]。
疱疹病毒感染的普遍性和病症多样性,严重影响人们的日常生活和生命健康,引起世界各卫生机构及研究机构广泛的关注和研究。目前,疱疹病毒感染已经成为全球重要的公共卫生问题。因此,研发有效的、安全的治疗疱疹病毒感染的方法及药物对于保证人们的生命健康极其重要。
2 疱疹病毒感染的治疗
目前,治疗疱疹病毒感染的方法主要是抗病毒药物治疗。然而,肿瘤相关疱疹病毒EBV及KSHV能引起肿瘤及增生疾病的发生,因此在其病症治疗过程中通常还需要放疗、抗病毒化疗、免疫调节治疗、病毒依赖性杀伤细胞,甚至联合用药等治疗手段。
2.1 抗疱疹病毒药物
临床上治疗疱疹病毒感染疾病的抗病毒药物主要是病毒聚合酶抑制剂类药物,如阿昔洛韦(acyclovir)、更昔洛韦(ganciclovir)、泛昔洛韦(famciclovir)、伐昔洛韦(valaciclovir)、西多福韦(cidofovir)、喷昔洛韦(penciclovir)、缬更昔洛韦(valgancyclovir)、磷甲酸(foscarnet)、溴呋啶(brivudin)、碘苷(idoxuridine)、三氟尿苷(trifluridine)、阿糖腺苷(vidarabine)、阿糖胞苷(cytarabine)、依度尿苷(edoxudine)及二十二醇(docosanol)等[9,11]。这些药物多为核苷或核苷酸类似物。值得注意的是,这些药物对病毒感染的裂解期复制有抑制作用,对于潜伏阶段的病毒复制没有明显的抑制作用。其抗病毒的机制主要为抑制或干扰裂解期病毒DNA的合成[9]。
2.2 α疱疹病毒的治疗药物
单纯疱疹病毒包括HSV-1及HSV-2,基因学分析显示两种病毒紧密相关。临床上两者诱发的病症相似且治疗药物基本通用。不同的是,HSV-1倾向于引起复发性的口腔损伤(recurrent oral lesions),而HSV-2更容易引起生殖器损伤(recurrent genital lesions)。早期,单纯疱疹病毒的治疗主要依赖于抗病毒化疗药物碘苷(IDU)及三氟胸苷(TFT)[5]。尽管这2种药物在单纯疱疹病毒感染治疗过程中起到一定积极的作用,然而,其不良反应及有效性限制了其临床应用的范围。目前,治疗单纯疱疹病毒感染的药物主要为核苷类似物,即阿昔洛韦及其相关化合物,如喷昔洛韦、伐昔洛韦及泛昔洛韦[12]。二线推荐药物为磷甲酸及西多福韦。这类化合物的临床应用极大地造福了单纯疱疹病毒感染患者,但是,这类药物的不良反应及长期应用造成的耐药性同样给患者带来一定的负影响。类似的是,这些抗病毒化合物同样适合VZV感染患者的临床治疗,但同样有一定的不良反应及造成耐药性。相比于其他疱疹病毒,令人欣慰的是,在VZV临床预防过程中,其预防疫苗(Oka vaccine)的临床应用是成功的,该疫苗的预防接种能极大地降低VZV感染的致病率。早在1995年,该疫苗就被美国FDA批准并推广用于新生儿的预防接种[5]。然而,类似于单纯疱疹病毒感染的治疗,对于VZV后天感染或VZV再激活引起的相应疾病的治疗,临床上依然将核苷类似物作为其治疗的主要推荐用药。迄今为止,尽管核苷类似物应用于临床治疗将近40年,然而依然没有开发出更为合适的药物。目前,一些新的药物及疗法正在开发过程中,如聚合酶抑制剂CMX001、伐马洛韦(valomaciclovir)及N-Methanocarbathymidine(N-MCT);解旋酶引发酶复合物抑制剂AIC316及ASP2151等。
2.3 β 疱疹病毒的治疗药物
目前,治疗HCMV感染比较常规的药物有更昔洛韦、西多福韦及磷甲酸[30]。更昔洛韦是第1个被批准用于治疗HCMV疾病的抗病毒药物,也是治疗器官移植患者HCMV感染及HCMV疾病的一线用药。其不良反应常为中性粒细胞减少症、贫血症及血小板减少症。而更昔洛韦的L-缬氨酰酯类化合物(L-valyl ester of ganciclovir)缬更昔洛韦临床应用具有更好的生物利用度及更低的不良反应,其口服生物利用度接近为60%,10倍高于更昔洛韦口服药片的利用度(6%~9%)[31],因此,其被开发作为口服药物用于HCMV感染的临床治疗,目前缬更昔洛韦的应用更为广泛。HCMV感染治疗过程中,更昔洛韦的短期使用很少造成耐药突变株的出现,但是在治疗免疫缺陷患者HCMV感染时,由于需要长期用药,因此,较容易造成更昔洛韦耐药突变株的出现[13]。对HCMV感染的器官移植患者调查显示,更昔洛韦用药造成的耐药性突变的比例为12.1%左右[32]。同时,临床调查数据显示,在治疗AIDS患者因HCMV感染引起的视网膜炎时,有19%患者因药物不良反应而终止使用该药。磷甲酸被推荐作为HCMV感染疾病的二线用药,在出现更昔洛韦耐药性的患者及更昔洛韦不良反应明显的患者身上,磷甲酸可以考虑作为首选用药治疗HCMV感染。CDV在1996年被批准用于AIDS患者因CMV感染引起的视网膜炎疾病的治疗用药。然而,其较低的生物利用度(口服的生物利用度<5%)及对机体的不良反应极大地限制了其临床应用[14]。临床调查数据显示,西多福韦在治疗HCMV相关疾病过程中,有39%患者因为不良反应终止用药。除此之外,在欧洲一些国家,阿昔洛韦被用于器官移植患者的HCMV预防,但是临床结果显示其对激活的HCMV相关感染的疗效并不理想;RNA药物福米韦生 (fomivirsen)也被用于HCMV引起的视网膜炎的治疗。同时,还有一些应用前景较好的药物正处于临床研究阶段,如pUL97 激酶抑制剂maribavir、病毒末端酶抑制剂BAY 38-4766和GW275175Xs、及DNA聚合酶抑制剂西多福韦酯(cidofovir ester)等[33-34]。目前,依然没有化合物被批准用于HHV-6及HHV-7感染的临床治疗。通常按照治疗HCMV感染的推荐药物用于HHV-6及HHV-7感染的治疗,主要为更昔洛韦、西多福韦及磷甲酸。由于这些药物的毒性限制,仅更昔洛韦可以用于口服。因此,急迫需要有效的治疗HHV-6及HHV-7药物。目前,一些新的抗HHV-6及HHV-7药物正在被开发,比如病毒DNA合成抑制剂brincidofovir (CMX001)、中药提取物青蒿酯(artesunate)或UL97抑制剂马立巴韦(cyclopropavir),期望在不久的将来能开发出有效的临床治疗药物。
2.4 γ 疱疹病毒的治疗药物
临床上治疗EBV及KSHV感染的抗病毒药物主要推荐更昔洛韦、西多福韦及磷甲酸。尽管抗病毒药物的单独使用可以一定程度上降低病毒载量,但是,对于相关肿瘤疾病的治疗具有很大的局限性。因此,病毒感染相关病症的治疗还需要其他的治疗方法。针对EBV感染的患者,除了使用抗病毒药物外,相关抗体及免疫杀伤细胞的使用在治疗EBV相关的肿瘤及增生疾病过程中也起到重要的作用。临床上,利妥昔单抗(riruximab,anti-CD20抗体)、CD45抗体及重组病毒糖蛋白gp350或CTL抗原肽(CTL epitopebased peptide)疫苗等免疫疗法的应用一定程度上可以缓解相应的病症。在EBV感染的增生细胞中,细胞的表面抗原CD20及CD45高水平表达,因此,针对这些抗原的抗体可以有效地杀伤病毒感染的细胞。以病毒的糖蛋白gp350及CTL作为抗原制备的疫苗,可以诱导机体产生杀伤EBV感染细胞机制的发生,从而治疗EBV感染诱导的相关疾病。EBV原发感染(primary infection)时宿主的CD4+及CD8+杀伤性T细胞(cytotoxic T cells)和自然杀伤细胞(natural killer cells)能有效地杀灭EBV感染的细胞。临床上,应用这些细胞可以极大地缩短相关疾病的病程。除此之外,EBV裂解复制诱导剂药物联合抗病毒或杀细胞药物同样有一定的治疗效果[35]。KSHV感染主要引起KS、PEL及MCD。对于KSHV引起的KS实体瘤通常选择手术切除,同时配合放射疗法进行治疗;对于AIDS相关的KS(AIDS-KS)的治疗通常选择鸡尾酒疗法(HAART)。临床上用化疗的方法进行PEL的治疗,如紫杉醇、CHOP法等。CHOP法中配合使用的药物主要包括抗肿瘤药物长春新碱、环磷酰胺、阿霉素及激素类药物泼尼松。在MCD患者中,通常使用抗体类药物进行免疫疗法治疗,主要包括托珠单抗(tocilizumab,IL-6受体抗体)、司妥昔单抗(siltuximab,IL-6 嵌合的单克隆抗体)及利妥昔单抗[36]。
尽管抗病毒药物及其他疗法在一定程度上能缓解相关疾病的病症。但是,这些疗法不完善且有一定的不良反应。同时,临床上这类药的长期使用致使病毒产生了许多耐药突变株,增加了治疗的困难。例如,阿昔洛韦会引起牙龈疼痛、口腔溃疡、注射部位发炎、静脉炎、皮肤瘙痒或荨麻疹;高剂量突击用药可造成急性肾小管坏死及引发神经系统障碍,如头痛、眩晕等。同时,ACY在治疗HSV-1感染过程中的长期应用,造成HSV-1的TK或聚合酶发生突变产生抗阿昔洛韦病毒株[37]。因此,开发新的、安全的、有效的针对病毒复制不同阶段靶标或细胞靶标的广谱抗病毒药物具有重要的意义。
3 结语
目前,尽管疱疹病毒感染已成为全球重要的公共卫生问题,然而治疗疱疹病毒感染的手段依然十分有限。究其原因可能与疱疹病毒感染及致病机制理论研究相关。疱疹病毒复制机制的复杂性及致病机制研究的滞后性限制了抗病毒药物研发的进程;疱疹病毒感染的普遍性、潜伏性及致病的多样性,更增加了疱疹病毒感染治疗的难度。因此,了解疱疹病毒感染的特点及抗疱疹病毒药物的现状对于疱疹病毒相关疾病的临床治疗及药物研发具有重要的指导意义。
[1]ADAMS MJ, CARSTENS EB. Ratification vote on taxonomic proposals to the International Committee on Taxonomy of Viruses (2012)[J]. Arch Virol, 2012, 157(7): 1411-1422.
[2] FLINT J. Molecular biology of animal viruses[J]. Cell, 1976, 8(1): 151-162.
[3]STARAS SA, DOLLARD SC, RADFORD KW, et al.Seroprevalence of cytomegalovirus infection in the United States, 1988–1994[J]. Clin Infect Dis, 2006, 43(9): 1143-1151.
[4]CHAYAVICHITSILP P, BUCKWALTER JV, KRAKOWSKI AC, et al. Herpes simplex[J]. Pediatr Rev, 2009, 30 (4):119-129.
[5]FIELD HJ, VERE HODGE RA. Recent developments in antiherpesvirus drugs[J]. Bri Medical Bulletin, 2013, 106(1):213-249.
[6]PIRES DE MELLOCP, BLOOM DC, PAIXÃO IC. Herpes simplex virus type-1 : replication, latency, reactivation and its antiviral targets[J]. Antivir ther, 2016, 21(4): 277-286.
[7]PRASAD A, REMICK J, ZEICHNER SL, et al. Activation of human herpesvirus replication by apoptosis[J]. J Virol, 2013, 87(19): 10641-10650.
[8] EIZURU Y. Development of new antivirals for herpesviruses[J].Antivir Chem Chemother, 2003, 14(6): 299-308.
[9]SKORENSKI M, SIENCZYK M. Anti-herpesvirus agents: a patent and literature review (2003 to present)[J]. Expert Opin Ther Pat, 2014, 24(8): 925-941.
[10]BIALAS KM, SWAMY GK, PERMAR SR, et al. Perinatal cytomegalovirus and varicella zoster virus infections:epidemiology, prevention, and treatment[J]. Clin Perinatol,2015, 42(1): 61-75.
[11]EVANS CM, KUDESIA G, MCKENDRICK M. Management of herpesvirus infections[J]. Int J Antimicrob Agents, 2013, 42(2): 119-128.
[12]JAMES SH, PRICHARD MN. Current and future therapies for herpes simplex virus infections: mechanism of action and drug resistance[J]. Curr Opin Virol, 2014, 8 : 54-61.
[13]POSTHUMA CC, VAN DER BEEK MT, VAN DER BLIJDE CS, et al. Mass spectrometry-based comparative sequencing to detect ganciclovir resistance in the UL97 gene of human cytomegalovirus[J]. J Clin Virol, 2011, 51(1): 25-30.
[14]TOLAN RW. Editorial:cytomegalovirus infection in the fetus,infant, child, and adolescent: an overview of virus genetics and pathogenesis, disease burden, prevention, diagnosis,treatment, antiviral resistance, and drug targets[J]. Infect Dis Drug Targets, 2011, 11(5): 424-425.
[15]Centers for Disease Control and Prevention(CDC).Seroprevalence of herpes simplex virus type 2 among persons aged 14-49 years-United States, 2005-2008[J]. MMWR Morb Mortal Wkly Rep, 2010, 59(15): 456-459.
[16]HALFORD WP, PÜSCHEL R, RAKOWSKI B. Herpes simplex virus 2 ICP0− mutant viruses are avirulent and immunogenic:implications for a genital herpes vaccine[J]. PLoS One, 2010, 5(8): e12251.
[17]BENJAMIN LA, KELLY M, COHEN D, et al. Detection of herpes viruses in the cerebrospinal fluid of adults with suspected viral meningitis in Malawi[J]. Infection, 2013, 41(1): 27-31.
[18]NAGEL MA, GILDEN D. The relationship between herpes zoster and stroke[J]. Curr Neurol Neurosci Rep, 2015, 15(4):16.
[19]FANG FQ, FAN QS, YANG ZJ, et al. Incidence of cytomegalovirus infection in Shanghai, China[J]. Clin Vaccine Immunol, 2009, 16(11): 1700-1703.
[20]REVELLO MG, GERNA G. Diagnosis and management of human cytomegalovirus infection in the mother, fetus, and newborn Infant[J]. Clin Microbiol Rev, 2002, 15(4): 680-715.
[21]LANDOLFO S, GARIGLIO M, GRIBAUDO G, et al. The human cytomegalovirus[J]. Pharmacol Ther, 2003, 98(3):269-297.
[22]OKUNO T, TAKAHASHI K, BALACHANDRA K, et al.Seroepidemiology of human herpesvirus 6 infection in normal children and adults[J]. J Clin Microbiol, 1989, 27(4): 651-653.
[23]WYATT LS, RODRIGUEZ WJ, BALACHANDRAN N, et al.Human herpesvirus 7: antigenic properties and prevalence in children and adults[J]. J Virol, 1991, 65(11): 6260-6265.
[24]CASELLI E, DI LUCA D. Molecular biology and clinical associations of Roseoloviruses human herpesvirus 6 and human herpesvirus 7[J]. New Microbiol, 2007, 30(3): 173-188.
[25]AGUT H, BONNAFOUS P, GAUTHERET-DEJEAN A,et al. Laboratory and clinical aspects of human herpesvirus 6 infections[J]. Clin Microbiol Rev, 2015, 28(2): 313-335.
[26]YOUNG LS, RICKINSON AB. Epstein-Barr virus: 40 years on[J]. Nat Rev Cancer, 2004, 4(10): 757-768.
[27]DUPIN N, FISHER C, KELLAM P, et al. Distribution of human herpesvirus-8 latently infected cells in Kaposi's sarcoma,multicentric Castleman’s disease, and primary effusion lymphoma[J]. Proc Nat Acad Sci USA, 1999, 96(8): 4546-4551.
[28]DA COSTA VG, MARQUES-SILVA AC, MORELI ML, et al. The Epstein-Barr virus latent membrane protein-1 (LMP1)30-bp deletion and XhoI-polymorphism in nasopharyngeal carcinoma: a meta-analysis of observational studies[J]. Syst Rev, 2015, 4(1): 46.
[29]OH JK, WEIDERPASS E. Infection and cancer: global distribution and burden of diseases[J]. Ann Glob Health, 2014,80(5): 384-392.
[30]ANDREI G, DE CLERCQ E, SNOECK R. Drug targets in cytomegalovirus infection[J]. Infect Disord Drug Targets, 2009,9(2): 201-222.
[31]KOMATSU TE, PIKIS A, NAEGER LK, et al. Resistance of human cytomegalovirus to ganciclovir/valganciclovir:a comprehensive review of putative resistance pathways[J].Antiviral Res, 2014, 101 : 12-25.
[32]YOUNG PG, RUBIN J, ANGARONE M, et al. Ganciclovirresistant cytomegalovirus infection in solid organ transplant recipients: a single-center retrospective cohort study[J]. Transpl Infect Dis, 2016, 18(3): 390-395.
[33]BIRON KK. Antiviral drugs for cytomegalovirus diseases[J].Antiviral Res, 2006, 71(2-3): 154-163.
[34]TROFE J, POTE L, WADE E, et al. Maribavir: a novel antiviral agent with activity against cytomegalovirus[J]. Ann Pharmacother, 2008, 42(10): 1447-1457.
[35]GHOSH SK, PERRINE SP, FALLER DV. Advances in virusdirected therapeutics against Epstein-Barr virus-associated malignancies[J]. Adv Virol, 2012,509296
[36]COEN N, DURAFFOUR S, SNOECK R, et al. KSHV targeted therapy: an update on inhibitors of viral lytic replication[J].Viruses, 2014, 6(11): 4731-4759.
[37]PIRET J, BOIVIN G. Resistance of herpes simplex viruses to nucleoside analogues: mechanisms, prevalence, and management[J]. Antimicrob Agents Chemother, 2011, 55(2):459-472.
Human herpesvirus infections and recent development in anti-herpesvirus drugs
XU Huiling, CHEN Jungang, HE Canhui.
(Supply Center, Donghu Hospital, Wuhan430073, China)
R511;R978.7
A
1009-7708 ( 2017 ) 06-0719-06
10.16718/j.1009-7708.2017.06.021
1. 武汉市东湖医院供应室,武汉 430073;2. 中国科学院武汉病毒研究所,病毒学国家重点实验室。
徐慧玲(1963—),女,专科学历,副主任护师,主要从事护理专业工作。
何灿辉,E-mail:xuhl19630211@126.com。
2017-03-30 修回日期:2017-07-31
