1株血标本分离的碳青霉烯类、磷霉素耐药大肠埃希菌耐药机制研究
2017-12-02田月如马逸珉蒋晓飞
田月如, 马逸珉, 王 蓓, 刘 红, 蒋晓飞
1株血标本分离的碳青霉烯类、磷霉素耐药大肠埃希菌耐药机制研究
田月如, 马逸珉, 王 蓓, 刘 红, 蒋晓飞
目的探究复旦大学附属华山医院2010年12月血标本分离的1株碳青霉烯类、磷霉素耐药大肠埃希菌的耐药机制及耐药基因可能的传播方式。方法对该株大肠埃希菌进行药敏试验、多位点序列分型(MLST)、耐药基因筛选、质粒分型、PCR mapping基因环境分析。结果该菌株对碳青霉烯类、磷霉素耐药,超广谱β内酰胺酶(ESBL)阳性。MLST属ST46型。碳青霉烯类耐药基因blaKPC-2和磷霉素耐药基因fosA3存在~70 kb接合型质粒上,分别介导碳青霉烯类、磷霉素耐药。β内酰胺酶耐药基因blaTEM、blaCTX-M存在~150 kb接合型质粒上,介导菌株对β内酰胺类药物耐药。PCR mapping结果显示blaKPC-2位于Tn1721-blaKPC-2-Tn3样结构内,fosA3位于IS26-fosA3-IS26移动元件。结论此株来源于血标本菌株携带blaKPC-2、fosA3、blaTEM、blaCTX-M等多种临床常见耐药基因,其耐药机制及耐药基因可能的传播方式,应引起医院感控高度重视。
大肠埃希菌; 碳青霉烯类; 磷霉素; 耐药基因; 基因环境
碳青霉烯类抗生素抗菌谱广,具有高效抗菌特点,现已成为临床治疗严重细菌感染最主要的抗菌药物之一。然而,随着该类药物的广泛使用以及耐药基因的快速传播,碳青霉烯类耐药的肠杆菌科细菌(CRE)已呈全球蔓延,成为医院获得性感染重要致病原[1]。目前,磷霉素是对抗CRE少数几种有效的抗菌药物之一。然而,磷霉素在治疗中会快速出现耐药现象。染色体介导磷霉素低水平耐药通常发生在glpT、murA等[2]位点上,质粒介导的磷霉素耐药基因已在肠杆菌科细菌中陆续报道,包括fosA3、fosA5、fosA6、fosC2等[3-5]。此外,超广谱β内酰胺酶(ESBL)是肠杆菌科细菌对β内酰胺类抗生素产生耐药的重要机制。多重耐药菌的广泛出现,给临床带来极大困扰,现已成为临床抗感染治疗的主要难题。
本研究对分离自血流感染患者1株碳青霉烯类及磷霉素耐药、ESBL阳性的大肠埃希菌,进行耐药机制及耐药基因可能的传播方式探究。
1 材料与方法
1.1 菌株来源
本研究1株大肠埃希菌分离自2010年12月上海华山医院住院患者。菌株使用法国生物梅里埃公司VITEK 2-Compact全自动细菌鉴定药敏系统鉴定。质控菌株:大肠埃希菌ATCC25922为阴性对照株,肺炎克雷伯菌ATCC700603(产SHV型)为阳性对照株,购自卫生部临床检验中心。大肠埃希菌TOP10感受态细菌,大肠埃希菌C600受体菌购自天根生化科技有限公司。
1.2 药敏试验
按照美国临床和实验室标准化协会(CLSI)推荐的纸片扩散法进行药敏试验,根据CLSI 2016年版的标准判断结果[6],替加环素参照欧州药敏试验委员会(EUCAST)2012版的标准判断结果[7]。药敏纸片均购自英国 OXOID公司。ESBL检测使用VITEK 2-Compact全自动细菌鉴定药敏系统确认。碳青霉烯酶活性采用Carba NP试验检测评估[8]。
1.3 多位点序列分型(MLST)
扩增大肠埃希菌基因组上的8个管家基因:dinB、icdA、pabB、polB、putP、trpA、trpB、uidA,将PCR产物送上海迈浦生物科技有限公司纯化后测序。参照大肠埃希菌MLST分型网站(http://bigsdb.pasteur.fr/ecoli/ecoli.html)提供的步骤进行分型[9]。
1.4 耐药基因筛选
提取细菌DNA为模板。采用引物碳青霉烯酶耐药基因blaIMP、blaOXA、blaNDM、blaKPC[10-11],质粒编码的磷霉素耐药基因fosA、fosA3、fosC2[3,12],其他fosA、fosC家族耐药基因fosAd、fosCd见表1,ESBL耐药基因进行PCR基因筛选。Taq DNA聚合酶购自美国Promega公司。将PCR产物送上海迈浦生物科技有限公司纯化后双向测序。

表1 引物列表Table 1 Primers used in this study
1.5 质粒的抽提与可移动性
运用Qiagen Plasmid Midi kit (Qiagen,德国)抽提野生株质粒,电转至大肠埃希菌TOP10感受态细菌,分别采用含磷霉素(64 mg/L)、葡萄糖-6-磷酸(25 mg/L) LB平皿和含氨苄西林(100 mg/L) LB平皿筛选阳性转化子。
接合试验采用液相接合法,链霉素耐药的大肠埃希菌C600作为受体菌[14]。分别采用含链霉素(2 000 mg/L)、磷霉素(64 mg/L)、葡萄糖-6-磷酸(25 mg/L) LB平皿和含氨苄西林(100 mg/ L) LB平皿筛选阳性接合子[15]。
阳性转化子、接合子运用碳青霉烯酶耐药基因引物KPC[16]和磷霉素耐药基因fosA3引物进行PCR验证确认。
转化子头孢噻肟、亚胺培南、厄他培南、美罗培南抗菌药敏试验采用微量肉汤稀释法,磷霉素采用琼脂稀释法确认[17]。
1.6 质粒分型
依赖PCR的复制子分型及Degenerate Primer MOB 分型(DPMT)[18-20],鉴别主要质粒的兼容性。
1.7 耐药基因环境分析
PCR mapping分析确定携带fosA3基因质粒是否存在IS26-fosA3-IS26结构。引物IS26F-fosA3F和IS26R-fosA3R(见表1)用来覆盖整个 IS26-fosA3-IS26区域[21]。
2 结果
2.1 菌株情况与药敏结果
肠杆菌科细菌中,检测到1株大肠埃希菌HS225,来源于血流感染患者。该菌株对亚胺培南、美罗培南中介,厄他培南耐药(Carba NP试验阳性),磷霉素耐药;头孢唑林、头孢呋辛、头孢噻肟耐药,头孢他啶中介,ESBL阳性。其他药敏结果见表2。
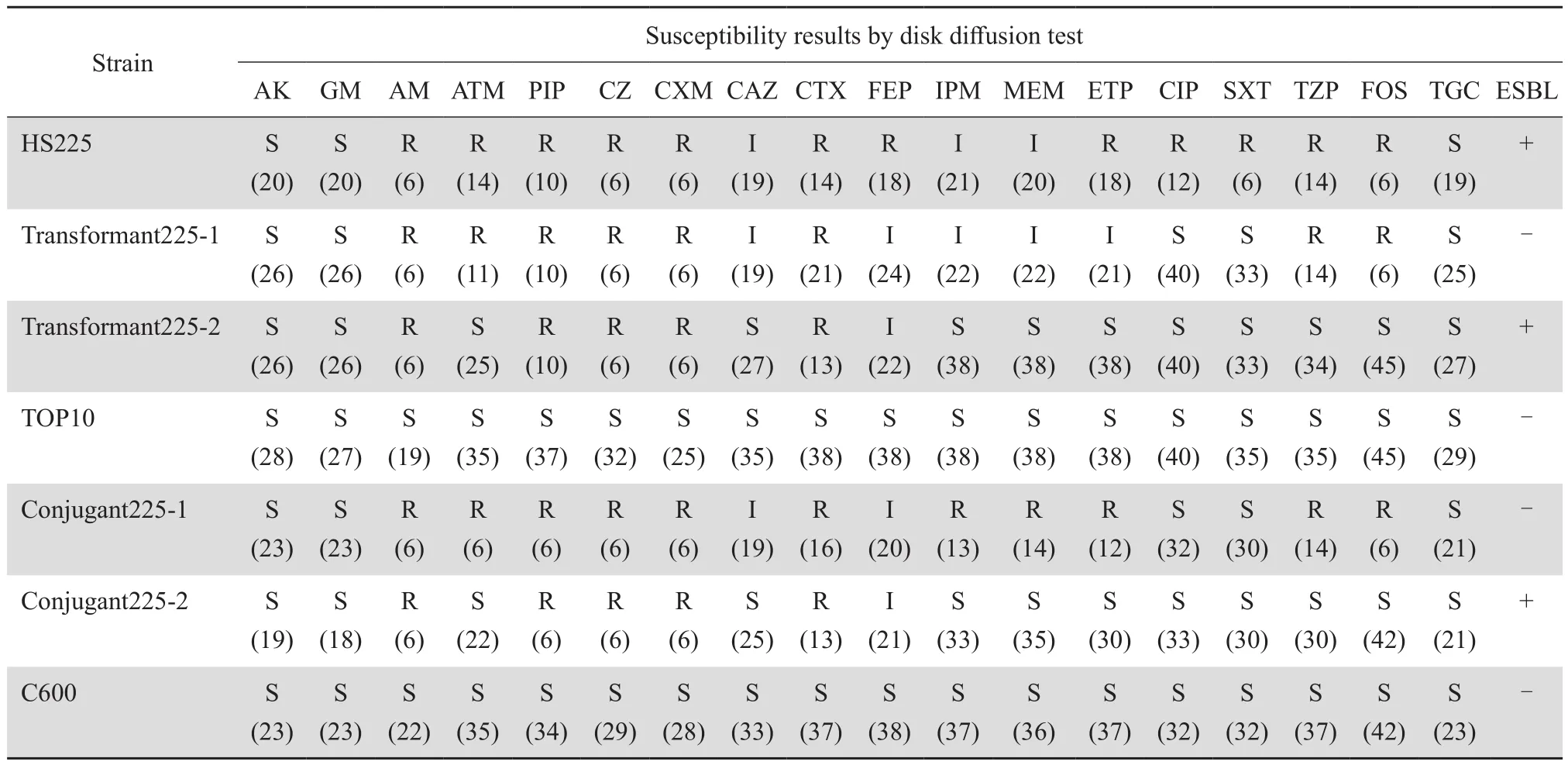
表2 本研究原始菌HS225、转化子、TOP10、接合子、C600药敏结果Table 2 Susceptibility of original strain HS225,transformants,TOP10,conjugants and C600 isolate to antimicrobial agents(mm)
2.2 耐药基因筛选与MLST分型
运用耐药基因特异性引物对大肠埃希菌HS225进行PCR及测序,结果显示菌株携带碳青霉烯酶耐药基因blaKPC-2,质粒编码的磷霉素耐药基因fosA3,β内酰胺酶耐药基因blaTEM、blaCTX-M。MLST属于ST46型。
2.3 携带耐药基因质粒分析
电转大肠埃希菌TOP10试验筛选到2个阳性转化子:含磷霉素LB平皿筛选到转化子225-1(质粒~70kb),含氨苄西林LB平皿筛选到转化子225-2(质粒~150 kb)。经PCR测序证实,转化子225-1携带碳青霉烯酶耐药基因blaKPC-2和磷霉素耐药基因fosA3;转化子225-2携带β内酰胺酶耐药基因blaTEM、blaCTX-M。
药敏结果显示,转化子225-1、接合子225-1对碳青霉烯类药物中介(Carba NP试验阳性),头孢他啶中介、头孢噻肟耐药,ESBL阴性,为KPC表型特征。转化子225-2、接合子225-2对碳青霉烯类药物敏感、头孢他啶敏感、头孢噻肟耐药,ESBL阳性,为CTX型ESBL表型特征。转化子、接合子、空白对照TOP10、C600其他药敏结果见表2。
2.4 质粒分型与可移动性
原始菌株HS225复制子质粒分型共有4种,分别为Inc HI1、FIIs、F、R型。转化子225-1、225-2复制子质粒分型均未分出。DPMT质粒释放显示原始菌株为P11型,转化子225-1为P11型,转化子225-2未分出。
接合试验证实2个质粒均可以发生接合转移。
2.5 携带耐药基因质粒环境分析
PCR mapping显示blaKPC-2位于Tn1721-blaKPC-2-Tn3样结构内,fosA3位于IS26-fosA3-IS26移动元件内。
3 讨论
本研究分离到的大肠埃希菌,对碳青霉烯类、磷霉素耐药,ESBL阳性,MLST为46型,属多重耐药大肠埃希菌。转化子PCR测序证实:碳青霉烯酶耐药基因blaKPC-2和磷霉素耐药基因fosA3存在于约70 kb大小质粒上,而β内酰胺酶耐药基因blaTEM、blaCTX-M存在于另一约150 kb大小质粒。转化子药敏试验显示,包含blaKPC-2和fosA3耐药基因的转化子225-1对亚胺培南、美罗培南、厄他培南中介,磷霉素耐药,而包含blaTEM、blaCTX-M基因的转化子225-2对亚胺培南、美罗培南、厄他培南、磷霉素高度敏感,提示blaKPC-2和fosA3是介导该株大肠埃希菌对碳青霉烯类抗生素低水平耐药、磷霉素高水平耐药的主要机制。虽然,转化子225-1对头孢噻肟耐药,但其抑菌圈直径与原菌株相比相差稍大(7 mm),同时头孢他啶药敏程度与原菌株一致,提示blaKPC-2基因促进大肠埃希菌对第三代头孢菌素低水平抵抗。此外,转化子225-2对头孢他啶敏感,对头孢噻肟耐药程度与原菌株一致,提示blaTEM、blaCTX-M是介导大肠埃希菌对头孢噻肟高水平耐药的主要原因。
此株大肠埃希菌原始菌复制子质粒分型共有4种,分别为Inc HI1、FIIs、F、R型,2个转化子复制子质粒分型未能分出,可能由于原始菌含多个质粒,除转化子225-1、225-22种质粒外,还富含其他Inc HI1、FIIs、F、R型质粒或者更多未能复制子分型的质粒。DPMT质粒释放显示原始菌为P11型,转化子225-1为P11型,转化子225-2未分出。接合试验证实2个质粒均为接合性质粒。同时,PCR mapping结果显示blaKPC-2位于Tn1721-blaKPC-2-Tn3样结构内,fosA3位于IS26-fosA3-IS26移动元件,该结构在碳青霉烯酶耐药的肺炎克雷伯菌中已有发现,提示耐药基因具有种属间水平传播能力[22]。该菌携带blaKPC-2、fosA3、blaTEM、blaCTX-M等多种临床常见耐药基因,可作为耐药基因的储蓄库,同时接合型质粒可作为传播载体,使耐药基因广泛传播,应引起医院感控部门高度重视。
[1]MUNOZPRICE LS,POIREL L,BONOMO RA,et al.Clinical epidemiology of the global expansion ofKlebsiella pneumoniaecarbapenemases[J]. Lancet Infect Dis,2013,13(9):785-796.
[2]MORRILL HJ,POGUE JM,KAYE KS,et al. Treatment options for carbapenem-resistantEnterobacteriaceaeinfections[J]. Open Forum Infect Dis,2015,2(2):ofv050.
[3]WACHINO J,YAMANE K,SUZUKI S,et al. Prevalence of fosfomycin resistance among CTX-M-producingEscherichia coliclinical isolates in Japan and identification of novel plasmidmediated fosfomycin-modifying enzymes[J]. Antimicrob Agents Chemother,2010,54(7):3061-3064.
[4]MA Y,XU X,GUO Q,et al. Characterization offosA5,a new plasmid-mediated fosfomycin resistance gene inEscherichiacoli[J]. Lett Appl Microbiol,2015,60(3):259-264.
[5]GUO Q,TOMICH AD,MCELHENY CL,et al. Glutathione-S-transferaseFosA6ofKlebsiella pneumoniaeorigin conferring fosfomycin resistance in ESBL-producingEscherichia coli[J]. J Antimicrob Chemother,2016,71(9):2460-2465.
[6] Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing[S]. Twenty-sixth informational supplement,2016,M100-S26.
[7]EUCAST T,MIC H,MIC E,et al. European Committee on Antimicrobial Susceptibility Testing Breakpoint tables for interpretation of MICs and zone diameters[S]. Version 2. 0,valid from 2012-01-01.
[8]POIREL L,NORDMANN P. Rapidec Carba NP test for rapid detection of carbapenemase producers[J]. J Clin Microbiol,2015,53(9):3003-3008.
[9]DIANCOURT L,PASSET V,VERHOEF J,et al. Multilocus sequence typing ofKlebsiella pneumoniaenosocomial isolates[J].J Clin Microbiol,2005,43(8):4178-4182.
[10]POIREL L,DORTET L,BERNABEU S,et al. Genetic features of blaNDM-1-positiveEnterobacteriaceae[J]. Antimicrob Agents Chemother,2011,55(11):5403-5407.
[11]NORDMANN P,NAAS T,POIREL L. Global spread of carbapenemase-producingEnterobacteriaceae[J]. Emerg Infect Dis,2011,17(10):1791-1798.
[12]GRAY KJ,GASCOYNE-BINZI DM,NICHOLSON P,et al.Transmissible fosfomycin resistance markers in urinary isolates and imported foodstuffs in the UK during 1994 and 1995[J]. J Antimicrob Chemother,2001,48(5):744-745.
[13]陈慧红,韩立中,余素飞,等. 大肠埃希菌与肺炎克雷伯菌超广谱β-内酰胺酶基因型研究[J]. 中华医院感染学杂志,2008,18(2):160-162.
[14]KIEFFER N,NORDMANN P,AIRES-DE-SOUSA M,et al.High Prevalence of carbapenemase-producingEnterobacteriaceaeamong hospitalized children in Luanda,Angola[J]. Antimicrob Agents Chemother,2016,60(10):6189-6192.
[15]HOU J,YANG X,ZENG Z,et al. Detection of the plasmidencoded fosfomycin resistance genefosA3inEscherichia coliof food-animal origin[J]. J Antimicrob Chemother,2013,68(4):766-770.
[16]WOODFORD N,TIERNO PJ,YOUNG K,et al. Outbreak ofKlebsiella pneumoniaeproducing a new carbapenemhydrolyzing class A beta-lactamase,KPC-3,in a New York Medical Center[J]. Antimicrob Agents Chemother,2004,48(12):4793-4799.
[17]JORGENSEN J H. Antimicrobial susceptibility testing of bacteria that grow aerobically[J]. Infect Dis Clin North Am,1993,7(2):393-409.
[18]SCHLUTER A,NORDMANN P,BONNIN RA,et al. IncH-type plasmid harboring bla CTX-M-15,bla DHA-1,and qnrB4 genes recovered from animal isolates[J]. Antimicrob Agents Chemother,2014,58(7):3768-3773.
[19]ALVARADO A,GARCILLAN-BARCIA MP,DE LA CRUZ F. A degenerate primer MOB typing (DPMT) method to classify gamma-proteobacterial plasmids in clinical and environmental settings[J]. PLoS One,2012,7(7):e40438.
[20]SHEN P,ZHANG Y,LI G,et al. Characterization of the genetic environment of theblaKPC-2gene amongKlebsiella pneumoniaeisolates from a Chinese Hospital[J]. Braz J Infect Dis,2016,20(4):384-388.
[21]JIANG Y,SHEN P,WEI Z,et al. Dissemination of a clone carrying afosA3-harbouring plasmid mediates high fosfomycin resistance rate of KPC-producingKlebsiella pneumoniaein China[J]. Int J Antimicrob Agents,2015,45(1):66-70.
[22]LI G,ZHANG Y,BI D,et al. First report of a clinical,multidrug-resistantEnterobacteriaceaeisolate coharboring fosfomycin resistance genefosA3and carbapenemase geneblaKPC-2on the same transposon,Tn1721[J]. Antimicrob Agents Chemother,2015,59(1):338-343.
Mechanisms of carbapenem and fosfomycin resistance in an Escherichia coli strain isolated from bloodstream infection
TIAN Yueru, MA Yimin, WANG Bei, LIU Hong, JIANG Xiaofei.
(Department of Laboratory Medicine, Huashan Hospital, Fudan University, Shanghai200040, China)
ObjectiveThis study was designed to determine the mechanisms of carbapenem and fosfomycin resistance in anEscherichia colistrain isolated from bloodstream infection in Huashan Hospital, Shanghai in 2010 and the mode of transmission of resistance genes.MethodsTheEscherichia coliisolate was characterized by antibiotic susceptibility testing, multilocus sequence typing (MLST), molecular identification of resistance genes, plasmid typing and the resistant genetic environment analysis.ResultsIt was found that the isolate was resistant to carbapenem, fosfomycin and produced extended-spectrum β-lactamases. MLST genotyping showed it belonged to ST46. The carbapenem-resistant geneblaKPC-2and fosfomycin resistant genefosA3co-located on the same conjugative plasmid (~70 kb). The β-lactamases geneblaTEMandblaCTX-Mlocated on another conjugative plasmid (~150 kb). PCR mapping showed thatblaKPC-2gene located in the structure Tn1721-blaKPC-2-Tn3 andfosA3gene located between two IS26 elements. Conclusions ThisEscherichia colistrain isolated from bloodstream infection carried multiple antibiotic resistant genes, includingblaKPC-2,fosA3,blaTEM, andblaCTX-M. More attention should be paid to the mechanisms of antibiotic resistance and transmission of resistance genes inEscherichia coliisolates for better control of hospital infections.
Escherichia coli; carbapenem; fosfomycin; resistant genes; resistant genetic environment
R378.2
A
1009-7708 ( 2017 ) 06-0648-05
10.16718/j.1009-7708.2017.06.007
国家自然科学基金项目(81572031);上海青年临床医技人才计划(沪医卫基[2016]04号)。
复旦大学附属华山医院检验医学科,上海 200040。
田月如(1982—),女,硕士研究生,主管技师,主要从事细菌耐药机制研究、无菌体液快速诊断。
蒋晓飞,E-mail:jiangxi2154@aliyun.com。
2017-04-17 修回日期:2017-06-07
