生物浮岛与漂浮植物对开放池塘水质净化效果
2017-11-29刘旻慧闻学政张志勇刘海琴张迎颖严少华秦红杰
刘旻慧 闻学政 张志勇 王 岩 刘海琴 张迎颖 宋 伟 严少华 秦红杰
(江苏省农业科学院农业资源与环境研究所, 南京 210014)
生物浮岛与漂浮植物对开放池塘水质净化效果
刘旻慧 闻学政 张志勇 王 岩 刘海琴 张迎颖 宋 伟 严少华 秦红杰
(江苏省农业科学院农业资源与环境研究所, 南京 210014)
采用自主研发流量可控的密闭漂浮性水槽开展河道原位模拟实验, 研究了挺水植物菖蒲(种植于浮岛上)与漂浮植物凤眼莲对受到城市污水污染的开放池塘水质净化效果以及系统中氮磷等污染物的归趋。结果表明, 菖蒲和凤眼莲对水体藻类密度和叶绿素a削减率达到90%以上, 对CODMn浓度削减率达到45%以上。经过10 m长水槽后, 种植了凤眼莲的水槽水体其TN和TP浓度分别由3.71和0.24 mg/L降低至1.71和0.09 mg/L, 而设置有菖蒲浮岛的水槽其水体TN和TP浓度则分别降低至2.69和0.16 mg/L。在水体N、P的总削减量中, 凤眼莲吸收作用分别占84.31%和77.52%, 而在菖蒲浮岛系统中, 菖蒲的吸收作用仅分别占7.72%和8.55%, 菖蒲净化系统中氮、磷的物理沉淀量显著高于凤眼莲组, 分别达到35.26%和51.58%, 但仍有57%和39%以上的氮和磷去向未知, 推测可能与浮岛上生长的生物膜有关。研究结果可为选用凤眼莲和浮岛植物修复技术进行污染水体生态修复理论研究与实践运用提供借签和参考。
菖蒲; 凤眼莲; 水质净化; 植物修复
近年来, 随着城市发展以及人口的急剧增长,导致大量富含氮、磷等营养物质的城市生活污水流入自然水域, 加快了水体的富营养化进程。污水问题不仅威胁着城市生态环境, 降低水体美学价值, 增加水处理难度和成本, 而且影响水体经济价值, 危害人体健康[1]。目前, 城市污水处理面临很多挑战, 已成为我国面临的主要环境难题之一。在诸多的污水治理与修复技术中, 采用水生植物进行水体净化和水生态修复因其具有成本低、投资少、处理效果好、操作简便等优点被国内外广泛应用[2—4]。
菖蒲(Acorus calamusL.)是天南星科多年生挺水植物, 常见于浅水池塘、水沟等处, 除具有较好的观赏和药用价值外[5], 也作为人工浮岛植物被广泛应用于富营养化治理[6,7]。凤眼莲(Eichhornia crassipes), 俗称水葫芦, 为雨久花科凤眼莲属, 属多年生漂浮性草本植物, 因其具有根系发达、生长繁殖快、耐污能力强的特点, 在污染水体生态修复的应用已逐渐成为广受关注的举措[8]。此外, 选用漂浮植物可降低人工浮床建设成本, 无需反复移栽等优点[9], 且凤眼莲资源化利用如发酵、堆肥等技术也已日臻成熟[10]。目前, 凤眼莲已被广泛应用于富营养化湖泊[11,12]、河道[13]、工业废水[14]等方面的治理。
然而, 以往研究多局限于单一的人工浮岛或漂浮植物对污水的治理效果, 且多在实验室模拟或大水面开阔水域环境展开的, 很难准确地、真实地反映水生植物在实际应用中的氮磷去除效果, 而对浮岛挺水植物与漂浮植物在生活污水净化差异方面的研究并不多见。基于此, 本研究采用自主研发流量可控的密闭漂浮性水槽, 开展为期24d的24h不间断动态模拟实验, 比较菖蒲和凤眼莲对受城市污水污染的开放性池塘的水质净化效果, 为合理选用水生植物进行污染水体修复实践提供参考。
1 材料与方法
1.1 实验材料与地点
实验地点实验地点设在江苏省农业科学院中1#蓄水塘中(31°17′28.0″ N, 119°02′29.3″ E), 该水塘平均水深2.5 m, 面积10500 m2, 塘内水体主要来源于居民生活污水和上游紫金山汇流的雨水, 常年呈中度富营养化状态(TN: 2.4—5.9 mg/L; TP:0.1—0.8 mg/L)。实验期间, 水塘水温在25.8—28.6℃内波动。
实验装置本实验在6个不锈钢水槽(长10.0 m×宽1.0 m×深0.5 m)中进行(图1), 水槽为5面的长方体(无顶面), 通过不锈钢板无缝焊接而成, 水槽两侧固定有泡沫浮球, 整个装置可自主地漂浮于水面之上, 并可随水位变化而上下浮动。该水槽包括进水口、出水口、流量调节泵、流水槽。水槽一端安装有计量泵, 通过调节计量泵的功率来控制水槽内水流速与水力停留时间。进水口距离槽底0.4 m, 槽内水深维持在0.40 m。出水端连接计量泵, 工作效率5 m3/d, 保持水力停留时间为0.8d, 该装置安置于蓄水塘中。
水生植物来源实验前, 将凤眼莲与菖蒲暂养于蓄水塘实验装置附近, 选取生长健壮、长势一致的植株用自来水清洗干净, 然后将凤眼莲投放于1#、3#、5#水槽, 菖蒲移栽至2#、4#、6#水槽内的浮岛中(图1b、图2)。
1.2 实验设计
本研究于2015年8月17日至9月10日在蓄水塘内完成, 实验设置2个处理(菖蒲组和凤眼莲组), 每个处理设3个平行, 两种植物初始投放量依照其100%覆盖水面为标准。水体指标每天监测, 植物指标每周监测, 沉积物指标实验结束后监测, 样品采集与分析见后续方法描述。
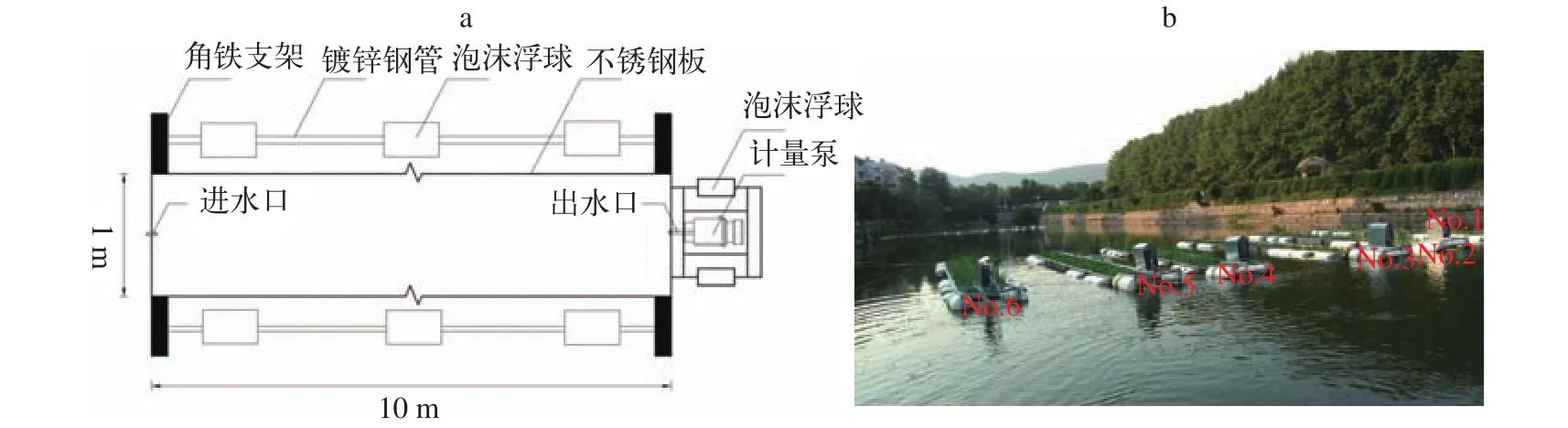
图1 水槽结构示意图(a)和实景图(b)Fig. 1 The structural diagram (a) and the photo (b) of the experimental tanks

图2 实验布置与样品采集Fig. 2 Experimental arrangement and sample collection
1.3 分析方法
水质指标测定水体理化指标的监测频率为1次/d, 其中水温、pH、溶解氧(DO)通过水质分析仪(哈希, HQ40D, 美国)现场测定; 分别采取各水槽进水口和出水口水样, 带回实验室后采用流动分析仪(Auto-Analyzer 3 Application)测定水体氨氮(-N)、硝氮(-N)、可溶性正磷酸盐()、可溶性总氮(TDN)、可溶性总磷(TDP)、总氮(TN)及总磷(TP)等。高锰酸盐指数(CODMn)参照《水和废水监测分析方法》方法测定[15], 水体藻类生物量使用流式细胞仪(BD公司, FACSJazz型)测定, 水体叶绿素a浓度依照Wintermans和de Mots方法, 使用乙醇提取后测定[16]。
水生植物指标测定水生植物生物量测定:采用重量法, 将1 m2水生植物从水中捞起放在筛网上, 直至无滴水时称重而得, 单位为kg/m2。
水生植物氮磷含量的测定: 将植物在105℃下杀青30min后, 于65℃烘干至恒重。粉粹后的植物干物质过60目网筛, 用于植物总氮和总磷含量测定,其中氮含量用凯氏滴定法测定, 磷含量用钼锑抗比色法[17]。
沉积物的收集与测定在实验结束后, 清除实验水槽剩余的凤眼莲和菖蒲, 用计量泵抽去水槽净化系统中的全部水样。采用毛细尼龙刷收集6个水槽底部全部沉积物至水桶中, 混合均匀后称重获其鲜重。分别取6个水槽沉积物500 g, 均匀的平铺于培养皿中, 放于阴凉透风处自然风干至恒重, 称其干重, 根据取样量(500 g)换算水槽全部沉积物干物质。干燥后沉积物用研磨磨碎后过100目网筛,用于沉积物氮磷测定。沉积物中全氮采用凯氏定氮法测定, 全磷采用酸溶-钼锑抗比色法测定[18]。
数据处理文中数据均以均值±标准差表示, 数据的统计处理采用Excel 2010、origin 7.5和统计软件SPSS 16.0, 凤眼莲实验组与菖蒲实验组间差异性选用单因素方差比较(LSD检验), 其中显著性水平设置为P<0.05。
2 结果
2.1 水温、DO与pH
在实验期间, 水温、DO及pH变化如图3所示。水温变化区间为25.6—28.9℃, 各实验组进水口和出水口的水温无显著性差异(P>0.05)(图3a)。如图3b所示, 菖蒲出水口DO在第5天达到最低(0.67 mg/L), 实验第18天凤眼莲处理组出水口DO最低(0.64 mg/L)。各水槽出水口DO均显著低于进水口DO值(P<0.05), 而菖蒲出水口处DO在实验开始后的8—18 d显著高于凤眼莲出水口(P<0.05)。
实验初期水体pH在9.0左右, 两者pH最小值分别出现在实验第18天和第19天, pH为6.24和6.42。实验3d后, 各实验水槽进水口pH显著高于出水口(P<0.05)。此外, 菖蒲出水口的pH显著高于凤眼莲出水口(P<0.05)(图3c)。
各处理组对叶绿素a、藻类密度及CODMn的削减率如表1所示。除实验第20天(降雨), 处理组对叶绿素a及CODMn削减率有所降低外, 凤眼莲与菖蒲对两者的去除率分别到达70%、34%和10%、3%。两处理组的藻类密度削减率在60%和30%以上。如表1所示, 凤眼莲对叶绿素a、藻类密度及CODMn的削减效果优于菖蒲。
2.2 水体不同形态氮素浓度变化
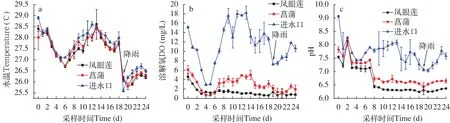
图3 水体水温(a)、DO(b)与pH(c)变化Fig. 3 Values of water temperature (a), dissolved oxygen (b), and pH (c) of water samples harvested from different sites
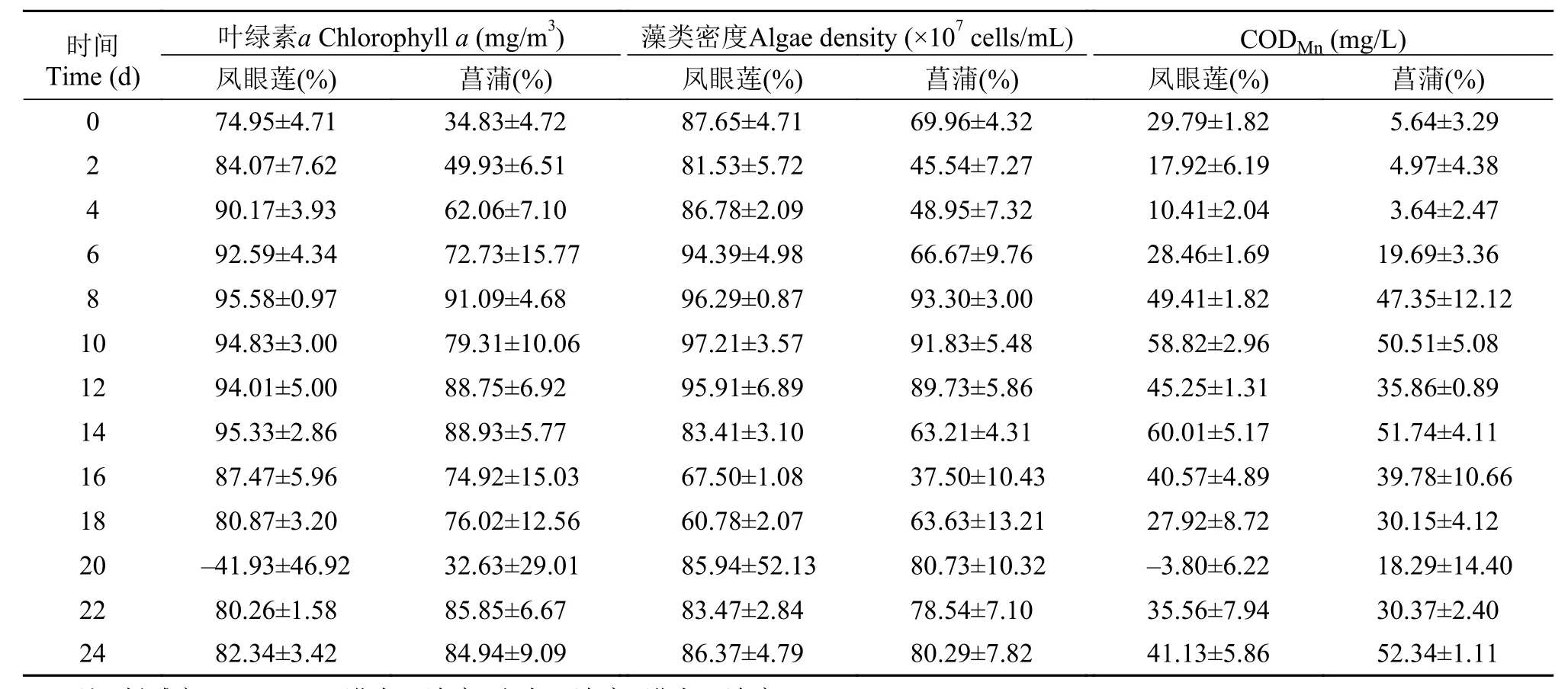
表1 凤眼莲与菖蒲水槽净化系统水体叶绿素a、藻类密度及CODMn的削减率Tab. 1 The removal rate of chlorophyll a, algae density, and the CODMn of purification system with E. crassipes and A. calamus

图4 实验水体中TN, TDN, -N,-N浓度变化Fig. 4 Values of total nitrogen (TN), dissolved total nitrogen (TDN), nitrate (-N), and ammonium (-N) in the water during the experiments
TDN浓度变化趋势与TN相似, 菖蒲出水口与凤眼莲出水口TDN浓度分别在实验第15和第10天达到最低值1.72和0.74 mg/L。实验前15天, 菖蒲出水口TDN浓度显著高于进水口浓度(P<0.05), 15d后其TDN与进水口无显著差异(P>0.05)。在整个实验过程中, 凤眼莲出水口TDN则显著低于进水口和菖蒲出水口(P<0.05)。
2.3 水体不同形态磷素变化
实验水体不同形态磷素包括总磷(TP)、可溶性总磷(TDP)、正磷酸盐()的变化如图5所示。实验期间进水口TP平均浓度为0.24 mg/L, 而凤眼莲和菖蒲出水口TP平均浓度分别为0.09 mg/L和0.16 mg/L(图5a)。实验8d后, 菖蒲处理组出水口TP浓度显著低于进水口浓度, 而凤眼莲处理组在整个实验过程中其出水口浓度显著低于进水口(第19天除外)(P<0.05)。
在为期24d的实验中, 菖蒲处理组出水口TDP浓度显著高于进水口浓度, 尤其是在实验前18天(P<0.05)。凤眼莲处理组出水口TDP浓度略低于进水口处水体TDP浓度, 在18d后较进水口有显著降低(P<0.05)(图5b)。
2.4 菖蒲和凤眼莲植株氮磷含量及其对水体氮磷去除贡献分析
实验结束时, 菖蒲生物量增长了0.27 kg/m2, 凤眼莲生物量增长了3倍以上(增长量13.25 kg/m2)。凤眼莲氮含量在2.36%—2.37%间波动, 显著高于菖蒲1.21%—1.55%。此外, 凤眼莲磷含量也显著高于菖蒲(P<0.05)。菖蒲含水率为(82.56%—83.63%)显著低于凤眼莲(93.63%—94.81%)(P<0.05, 表2)。
两种植物水槽底部沉积物含水率无显著差异,均在90%左右(P>0.05)(表3)。种养菖蒲的水槽中沉积物鲜重达到14.93 kg, 显著高于凤眼莲水槽底部沉积物12.60 kg (P<0.05)。而且, 菖蒲水槽沉积物氮磷含量分别为3.18%干重和0.38%干重, 显著高于凤眼莲水槽中沉积物氮磷含量2.49%干重和0.33%干重(P<0.05)。
如表4所示, 凤眼莲净化系统氮磷削减量达250.77和21.04 g, 显著高于菖蒲净化系统氮磷削减量127.38和10.41 g (P<0.05)。凤眼莲通过自身吸收作用对水体氮磷去除量达到211.43和16.31 g, 分别占水槽净化系统总削减量的84.31%和77.52%, 而物理沉淀作用对系统氮磷的削减贡献较弱。但菖蒲净化系统中物理沉淀作用分别占总削减量的35.26%和51.58%, 而菖蒲自身的吸收量仅占总削减量的7.72%和8.55%, 仍有57%和39%以上的氮磷通过其他途径从净化系统中去除。
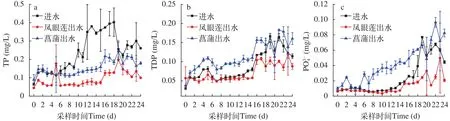
图5 实验过程中水体磷TP、TDP和变化Fig. 5 Values of total phosphorus (TP), dissolved total phosphorus (TDP), and orthophosphate () in the water during the experiments
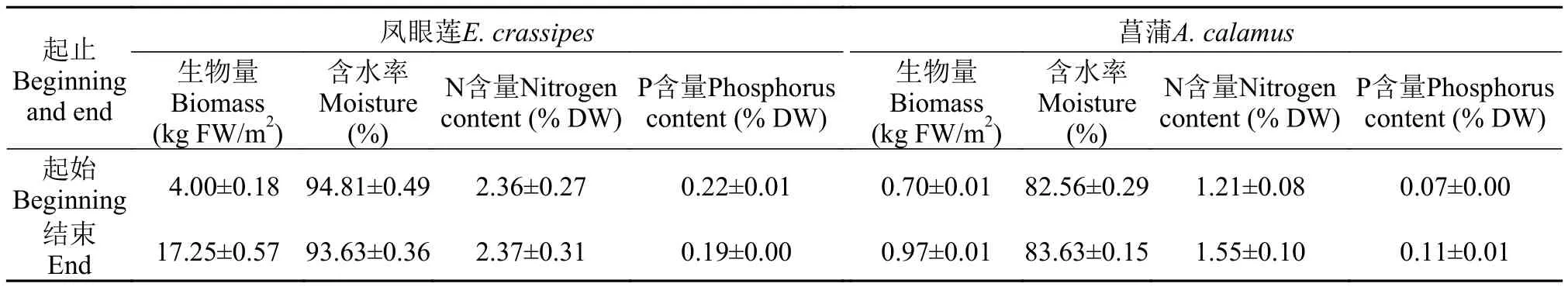
表2 实验植物生物量及其氮磷含量Tab. 2 Biomass of the test plants and their nitrogen and phosphorus contents

表3 水槽沉积物收集量及其氮磷含量Tab. 3 Sediment collection in sinks and their nitrogen and phosphorus content

表4 水体净化系统中氮磷归趋Tab. 4 The fate of nitrogen and phosphorus in water purification systems
3 讨论
凤眼莲原产于南美洲, 主要以无性繁殖, 被称为生长最快的水生植物之一[19], 除物种本身特性外,环境因子也是影响水生植物生长的重要因素, 其中温度是影响水生植物生长的关键因子[20]。有研究表明, 凤眼莲在水温27—30℃时生长最旺盛[8], 而菖蒲的最适水温在20—25℃。在本研究中, 水温在25—29℃内波动, 更适合凤眼莲生长, 故水温在本研究中也是造成凤眼莲扩繁更快的因素之一, 最快生长速度达到每周0.94 kg/m2, 而菖蒲最大生长速率仅为每周0.16 kg/m2。
菖蒲与凤眼莲均使实验水体的DO和pH显著降低, 这与前人的研究相一致, 王智等[21]通过对滇池湖湾凤眼莲种养区连续3个月的监测表明, 凤眼莲种养区水体DO与pH较无凤眼莲水域显著降低。其原因有: 一方面, 凤眼莲生长紧密, 覆盖面积大, 阻碍了大气向水体富氧[22]; 另一方面, 凤眼莲根系脱落物的分解腐烂消耗水体中的氧气, 导致种植水域DO低于进水口。有研究表明, 水生植物在淹水状态下, 其根系能分泌氧气, 但随着时间的延长, 植物根际区域的氧浓度逐渐下降, 这也是种植区水体DO小于进水口的原因之一[23]。而菖蒲出水口的DO高于凤眼莲, 分许其主要原因可能是, 菖蒲细而长的叶片对大气富氧的阻碍作用较叶片大而繁茂的凤眼莲弱。此外, 尽管浮岛也有很强的遮光效果,影响大气富氧, 然而菖蒲根系与凤眼莲相比并不发达, 根系对藻类等有机物拦截效率低, 拦截的有机污染物在根部分解时也会消耗水体溶氧, 这也是菖蒲处理组出水口DO较凤眼莲组高的原因之一。
pH也是影响菖蒲和凤眼莲生长的因素之一。在本研究中, 进水口的pH在7—9内波动, 而菖蒲出水口与凤眼莲出水口的pH则分别稳定在6.6和6.3左右。可见植物根系能降低并稳定水体的pH。加上根系周围的微生物分解水体有机物, 其呼吸作用产生CO2均会降低水体的pH[24]。
在一定浓度范围内, 叶绿素a在与藻类密度呈现一定的相关性, 可直接说明水体中藻类的多少和水华暴发的强度[25]。有研究表明, 叶绿素a浓度为40 mg/m3时是水华暴发的临界值[26]。在本研究中,进水口叶绿素a浓度在100 mg/m3左右, 已达到水华阈值。不管种养漂浮植物凤眼莲, 还是浮岛植物菖蒲以, 水体叶绿素a和藻类密度均有显著降低。分析其原因主要有: (1)菖蒲和凤眼莲均能分泌感化物质对藻类产生竞争抑制[27—29], 从而降低了水体叶绿素a的浓度与藻类密度; (2)水生植物发达的根系能够拦截污水中的部分有机物包括水体藻类[30]; (3)依附在植物根系上小型水生生物和微生物通过分解或摄取藻类等有机物来维持其正常的生理活动, 进而成为水体藻类和叶绿素a削减的原因之一, 从这个角度看, 采用浮岛植物或漂浮植物一定程度上有抑制水华暴发的作用。同时, 这也是水体种养凤眼莲和菖蒲后CODMn浓度显著下降的主要原因之一。
植物快速吸收是通过种养水生植物吸收水体氮磷等污染物, 达到水质净化效果的主要原因之一。凤眼莲也早以其对水体营养物质(氮磷)的高效吸收与富集特征被广泛用于多种水体净化与修复[31]。本研究结果表明, 凤眼莲在24天的实验周期中生物量增加3倍以上, 通过植物吸收带走的氮素占总系统氮去除量的80%以上。此外, 从水体主要氮形态-N的削减效果看, 经过10 m长的控养水槽后凤眼莲可将-N浓度降低至1 mg/L以下, 而菖蒲出水口-N浓度平均在2.5 mg/L左右。
已有研究表明植物吸收和物理沉淀是水体磷素的主要归趋[32], 本研究结果显示凤眼莲的植物吸收与富集作用对净化系统中TP的削减占有率在77%以上, 而菖蒲对水体中TP的吸收作用仅8%左右。从水生植物对水体不同形态磷素的影响效果可以看出, 菖蒲对水体TDP的削减效果也远不及凤眼莲。在本研究中菖蒲组水槽出水口TDP和均高于其进水口浓度, 分析其原因有: (1)浮岛菖蒲对水体藻类等颗粒态磷素拦截后, 在缺氧环境下颗粒态物释放大量磷素; (2)从菖蒲生物量与其植物体氮磷含量可以看出, 菖蒲生长相对缓慢, 对水体磷素的削减效率低, 在水利滞留时间0.8d的条件下对水体TDP和的去除是有限的。
此外, 对于菖蒲水槽净化系统, 仍有57%和39%以上的氮磷是通过植物吸收和物理沉淀作用以外的途径从系统中移除。除上述所剖析的原因外, 作者推测浮岛自身复杂的结构也可能会对水体氮磷的去处有影响。菖蒲通过海绵条包裹后放入带孔的盆钵, 最后固定于漂浮性材料, 具体结构见材料与方法。实验期间也有发现在浮岛上生长有良好的生物膜结构, 尽管实验期间我们未对生物膜的结构功能等做相关监测, 但已有大量文献报道表明,生物膜对水体氮磷有较好的去除效果[33,34], 生物膜上广泛存在着异养硝化细菌等多种与水体氮磷代谢有关的微生物[35,36]。此外浮岛中菖蒲选用海绵包裹, 其多孔结构也可以增大微生物的附着空间,为微生物的扩繁提供生存介质, 进而也增加了其水体氮磷去除力度。
本研究基于自主研发的漂浮性水槽, 开展了漂浮植物和浮岛植物对受城市污水污染的开放池塘水质净化效果研究, 凤眼莲凭其快速的繁殖能力和高效的氮磷富集能力, 达到了良好的水质净化效果。此外, 笔者研究团队已打通了凤眼莲的控养、打捞、处置、及资源化利用等方便的技术关隘, 凤眼莲用于池塘和河道等污染水体的生物修复技术已日臻成熟。而浮岛植物菖蒲对水体氮磷的去除效率最高为42.04%和52.89%, 同时对水体悬浮颗粒物(包括藻类)有很好的拦截效果。凤眼莲和菖蒲的最适生长温度有互补, 在季节衔接上可以考虑交错使用这两种植物, 早春和晚秋凤眼莲生长缓慢, 而此时温度最适合菖蒲, 炎热夏季凤眼莲爆炸式生长,而菖蒲成长迟缓。鉴于此, 笔者提出漂浮植物凤眼莲和浮岛菖蒲组合模式用于水体修复, 在达到理想水质净化效果的同时, 提高水域美学效果。
4 结论
本文通过自主研发流量可控的漂浮性水槽, 对人工浮岛和漂浮植物对受城市污水污染的开放性水体净化效果的比较研究, 主要结论如下: 浮岛植物菖蒲和漂浮植物凤眼莲的种养均能降低水体的DO和pH, 显著削减水体藻类生物量和CODMn浓度,但凤眼莲作用效果更显著; 凤眼莲对水体氮、磷的削减效果显著, 而浮岛菖蒲尽管对氮、磷也有一定的去除作用, 然而其效果远不及凤眼莲, 且经其处理过的水体溶解态的磷(TDP和)还有所升高。凤眼莲的生长速度和氮、磷吸收能力均强于菖蒲, 对水体总氮和总磷的去除率最高分别为66.11%和73.20%, 比菖蒲分别高出24.07%和20.31%, 同时鉴于浮岛菖蒲对水体溶解性磷素的移除限制, 并结合凤眼莲对溶解性磷素高效吸收富集能力, 作者建议今后的水体修复工程实践中可考虑凤眼莲与菖蒲的组合模式, 在达到一定景观效果的同时, 提高其水质净化效果。
致谢:
感谢江苏省农业科学院农业资源与环境研究所的范如芹副研究员对英文摘要的修改及润色。
[1]Wang S F. Water eutrophication and its prevention control and treatment [J].Environmental Science and Management, 2005, 30(6): 63—65 [王淑芳. 水体富营养化及其防治. 环境科学与管理, 2005, 30(6): 63—65]
[2]Sun L, Liu Y, Jin H. Nitrogen removal from polluted river by enhanced floating bed grown canna [J].Ecological Engineering, 2009, 35(1): 135—140
[3]Cao D D, Wang D, Yang X,et al. Decomposition of two submerged macrophytes and their mixture: effect of sediment burial [J].Acta Hydrobiologica Sinica, 2016, 40(2):327—336 [曹丹丹, 王东, 杨雪, 等. 泥沙埋深对苦草和微齿眼子菜及两物种混合分解的影响. 水生生物学报,2016, 40(2): 327—336]
[4]Zhou X P, Xu X F, Wang J G,et al. Nitrogen and phosphorus removal performance by three planted floats in eutrophic water bodies in winter [J].Chinese Journal of Eco-Agriculture, 2007, 15(4): 102—104 [周小平, 徐晓峰, 王建国, 等. 3种植物浮床对冬季富营养化水体氮磷的去除效果研究. 中国生态农业学报, 2007, 15(4):102—104]
[5]Yang M, Wu X G, Zhou L F,et al. Study on the capacity of purification ofAcorus calamusL. in eutrophic water of different degree [J].Environmental Science and Management, 2007, 32(10): 77—80 [杨旻, 吴小刚, 周连凤, 等.菖蒲对不同程度富营养化水体的净化作用研究. 环境科学与管理, 2007, 32(10): 77—80]
[6]Yang J H, Zhou S B, Xie C J,et al. Comparative studies on growth character ofAcorus calamusandA.tatarinowiiand their purification function in sewage[J].Acta Laser Biology Sinica, 2008, 17(3): 417—422 [杨集辉, 周守标, 谢传俊, 等. 菖蒲和石菖蒲的生长特性及其对生活污水净化功能的比较研究. 激光生物学报,2008, 17(3): 417—422]
[7]Zhang L. Artificial floating islands for insitu bioremediation of reclaimed landscape water [D]. Hebei University of Engineering. 2014 [张蕾. 人工浮岛原位修复再生水景观河道研究. 河北工程大学. 2014]
[8]Malik A. Environmental challenge vis a vis opportunity:The case of water hyacinth [J].Environment international, 2007, 33(1): 122—138
[9]Wang Z, Zhang Z Y, Zhang J Q,et al. The fauna structure of benthic macro-invertebrates for environmental restoration in a eutrophic lake using water hyacinths [J].China Environmental Science, 2012, 32(1): 142—149 [王智, 张志勇, 张君倩, 等. 水葫芦修复富营养化湖泊水体区域内外底栖动物群落特征. 中国环境科学, 2012,32(1): 142—149]
[10]Gao Y Q. Purification effect on eutrophic water bodies and its energy utilization by water hyacinth [D]. Anhui Agricultural University. 2008 [高运强. 水葫芦净化富营养化水体及其能源化利用. 安徽农业大学. 2008]
[11]Zhang Z Y, Zhang Y Y, Liu H Q,et al. Population propagation characteristics and water improving effect of large-scale cultivated water hyacinth (Eichhornia crassipes) in Dianchi Lake [J].Jiangsu Journal of Agricultural Sciences, 2014, 30(2): 310—318 [张志勇, 张迎颖, 刘海琴, 等. 滇池水域凤眼莲规模化种养种群扩繁特征与水质改善效果. 江苏农业学报, 2014, 30(2): 310—318]
[12]Zhang Z Y, Qin H J, Liu H Q,et al. Effect of large-scale confined growth of water hyacinth improving water quality of relatively enclosed eutrophicated waters in Caohai of lake Dianchi [J].Rural Eco-Environment, 2014, 30(3):306—310 [张志勇, 秦红杰, 刘海琴, 等. 规模化控养水葫芦改善滇池草海相对封闭水域水质的研究. 生态与农村环境学报, 2014, 30(3): 306—310]
[13]Hu C W, Sun Z D, Li J L,et al. Application of water hyacinth in restoration of heavily polluted urban rivers [J].Chinese Journa1 of Environmenta1 Engineering, 2007,1(12): 51—56 [胡长伟, 孙占东, 李建龙, 等. 凤眼莲在城市重污染河道修复中的应用. 环境工程学报, 2007,1(12): 51—56]
[14]Verma V K, Gupta R K, Rai J P N. Biosorption of Pb and Zn from pulp and paper industry effluent by water hyacinth (Eichhornia crassipes) [J].Journal of Scientific and Industrial Research, 2005, 64(10): 778—781
[15]Wei S F. Monitoring and Analysis Methods for Water and Wastewater [M]. Beijing: China Environmental Science Press. 2002, 223—259 [魏复盛. 水和废水监测分析方法. 北京: 中国环境科学出版社. 2002, 223—259]
[16]Wintermans J F G M, DE Mots A. Spectropho-tometric characteristics of chlorophylls a and b and their pheophytins in ethanol [J].Biochimica et Biophysica Acta, 1965,109(2): 448—453
[17]Bao S D. Soil and Agricultural Chemistry Analysis (3rd)[M]. Beijing: China Agriculture Press. 2008, 39—76 [鲍士旦. 土壤农化分析(第三版). 北京: 中国农业出版社.2008, 39—76]
[18]Lu R K. Soil and Agricultural Chemistry Analysis Methods[M]. Beijing: China Agricultural Science and Technology Press. 2000, 147—168 [鲁如坤. 土壤农业化学分析方法. 北京: 中国农业科技出版社. 2000, 147—168]
[19]Priya E S, Selvan P S. Water hyacinth (Eichhornia crassipes)-An efficient and economic adsorbent for textile effluent treatment - A review [J].Arabian Journal of Chemistry, 2014, 5: 1—11
[20]Ansari A A, Gill S S, Gill R,et al. Phytoremediation:Management of Environmental Contaminants Volume 4[M]. In: Ansari A A, Trivedi S, Khan F A,et al(Eds.),Phytoremediation of Eutrophic Waters. 2014, 41—50
[21]Wang Z, Zhang Z Y, Han Y P,et al. Effects of large-area planting water hyacinth (Eichhornia crassipes) on water quality in the bay of Lake Dianchi [J].Techniques and Equipment for Environmental Pollution Control, 2012,6(11): 3827—3832 [王智, 张志勇, 韩亚平, 等. 滇池湖湾大水域种养水葫芦对水质的影响分析. 环境工程学报,2012, 6(11): 3827—3832]
[22]Hunt R J, Christiansen I H. Understanding Dissolved Oxygen in Streams [M]. Information Kit. Townsville:CRC Sugar Technical Publication (CRC for Sustainable Sugar Production). 2000, 15—40
[23]Wang W L, Han R M, Wang G X,et al. Impacts of rhizosphere oxygen environment at seedling and adult plant stages ofAcorus calamusin response to flooding stress[J].Research of Environmental Sciences, 2015, 28(2):318—325 [王文林, 韩睿明, 王国祥, 等. 淹水对菖蒲(Acorus calamus)根际氧环境的影响. 环境科学研究,2015, 28(2): 318—325]
[24]Rommens W, Maes J, Dekeza N,et al. The impact of water hyacinth (Eichhornia crassipes) in a eutrophic subtropical impoundment (Lake Chivero, Zimbabwe). I. Water quality [J].Archiv für Hydrobiologie, 2003, 158(3):373—388
[25]Yu H Y, Zhou B, Hu Z Y,et al. Study on correlation between chlorophyllaand algal density of biological monitoring [J].Environmental Monitoring in China,2009, 25(6): 40—43 [于海燕, 周斌, 胡尊英, 等. 生物监测中叶绿素a浓度与藻类密度的关联性研究. 中国环境监测, 2009, 25(6): 40—43]
[26]Liu B, Cui L F, Liu Z W,et al. Correlation between chlorophyllawater in urban and algal density of surface of Beijing [J].Environmental Science and Technology,2008, 31(8): 29—33 [刘波, 崔莉凤, 刘载文. 北京市城区地表水体叶绿素a与藻密度相关性研究. 环境科学与技术, 2008, 31(8): 29—33]
[27]Ding H J, Zhang W Y, Wang C,et al. Study on allelopathic effect ofAcorus calamuson several common algae [J].Environmental Science and Technology, 2007,30(6): 20—22 [丁惠君, 张维昊, 王超, 等. 菖蒲对几种常见藻类的化感作用研究. 环境科学与技术, 2007, 30(6):20—22]
[28]Zhou Q, Han S Q, Yan S H,et al. Impacts ofEichhornia crassipes(Mart.) Solms stress on the growth characteristics, microcystins and nutrients release ofMicrocystis aeruginosa[J].Environmental Science, 2014, 35(2):597—604 [周庆, 韩士群, 严少华, 等. 凤眼莲对铜绿微囊藻生长及藻毒素与营养盐释放的影响. 环境科学,2014, 35(2): 597—604]
[29]Shanab S M M, Shalaby E A, Lightfoot D A,et al. Allelopathic effects of water hyacinth (Eichhornia crassipes)[J].PLoS One, 2010, 5(10): e13200
[30]Kim Y, Kim W. Roles of water hyacinths and their roots for reducing algal concentration in the effluent from waste stabilization ponds [J].Water Research, 2000,34(13): 3285—3294
[31]Fox L, Struik P, Appleton B,et al. Nitrogen phytoremediation by water hyacinth (Eichhornia crassipes(Mart.)Solms) [J].Water,Air,and Soil Pollution, 2008, 194:199—207
[32]Al-nozaily F, Alaerts G, Veenstra S. Performance of duckweed-covered sewage lagoons-II. Nitrogen and phosphorus balance and plant productivity [J].Water Research, 2000, 34(10): 2734—2741
[33]Lu H Y, Chen J Z, Li Y D,et al. Migration and transformation of phosphorus among the three-phase system sediments-periphyton biofilm-overlying water [J].Journal of Lake Sciences, 2014, 26(4): 497—504 [陆海鹰, 陈建贞, 李运东, 等. 磷在“沉积物-自然生物膜-上覆水”三相体系中的迁移转化. 湖泊科学, 2014, 26(4): 497—504]
[34]Wu Y H, Fang T, Qiu C Q,et al. Method of algae-bacterium biofilm to improve the water quality in eutrophic waters [J].Environmental Science, 2005, 16(1): 84—89[吴永红, 方涛, 丘昌强, 等. 藻-菌生物膜法改善富营养化水体水质的效果. 环境科学, 2005, 16(1): 84—89]
[35]Feng M Y, Fang T, Wu J,et al. Technology of algae-bacterium biofilm with different carries for improvement of water quality [J].Technology of Water Treatment, 2007,33(3): 59—75 [丰民义, 方涛, 吴娟, 等. 不同载体的藻-菌生物膜应用于水体净化. 水处理技术, 2007, 33(3):59—75]
[36]Münch E V, Lant P, Keller J. Simultaneous nitrification and denitrification in bench-scale sequencing batch reactors [J].Water Research, 1996, 2(30): 277—284
PURIFICATION EFFECT OF BIOLOGICAL FLOATING ISLAND AND FLOATING PLANTS ON AN OPEN CONTAMINATED POND
LIU Min-Hui, WEN Xue-Zheng, ZHANG Zhi-Yong, WANG Yan, LIU Hai-Qin, ZHANG Ying-Ying, SONG Wei,YAN Shao-Hua and QIN Hong-Jie
(Institute of Agricultural Resources and Environment, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China)
The self-developed experimental device of a cuboid sink welded with stainless steel (10.0 m × 1.0 m ×0.5 m)without the top cover was used to investigate water purification of open pond contaminated with domestic sewage using biological floating island growing withAcorus calamusL. andEichhornia crassipes, and the fates of nitrogen (N)and phosphorus (P) in the water purification system. The results revealed that the removal rates of algal density and chlorophyllawere over 90%, and the removal rate of CODMnconcentration was over 45%. Total nitrogen (TN) and total phosphorus (TP) concentrations of the polluted water by running through the 10 m sinks decreased from 3.71 and 0.24 mg/L to 1.71 and 0.09 mg/L byE. crassipes, and to 2.69 and 0.16 mg/L byA. calamus, respectively. The main fate for N and P in the purification system withE. crassipeswas absorbed by the plants, which accounted for 84.31% and 77.52% decrease of the TN and TP, respectively; while the N and P absorbed by plants in the system withA. calamus
only accounted for 7.72% and 8.55% reduction, respectively. A large proportion TN (35.26%) and TP (51.58%) existed in the sediments in the sinks withA. calamus, while location of over 57% and 39% of the TN and TP were unclear in the system, which may relate to the biofilm growing on the floating island. This study provides practical and theoretical references for ecological restoration of open pond contaminated with domestic sewage using phytoremediation technology with floating island andE. crassipes.
Acorus calamusL.;Eichornia crassipes; Water purification; Phytoremediation
X52
A
1000-3207(2017)06-1318-09
2016-10-08;
2017-02-14
国家自然科学基金(41501545); 江苏省自然科学基金(BK20150549); 江苏省农业科学院基本科研业务专项(ZX(16)2035)资助[Supported by the National Natural Science Foundation of China (41501545); Natural Science Foundation of Jiangsu Province,China (BK20150549); Special Fund on Basic Research of Jiangsu Academy of Agricultural Sciences (Grant No. ZX(16)2035)]
刘旻慧(1991—), 女, 浙江台州人; 硕士; 主要从事水生态系统修复理论与技术方面的研究。E-mail: 540972937@qq.com
秦红杰(1984—), 男, 河南内黄人; 副研究员; 主要从事水生态系统修复理论与技术与水体氮素循环研究。E-mail: hongjieqin111@126.com
10.7541/2017.163
