水飞蓟素抑制草鱼肝细胞脂质蓄积的作用及其机制研究
2017-11-29萧培珍张宝彤叶元土李雪贤田晶晶
萧培珍 吉 红 张宝彤 叶元土 孙 健 杨 洲 李雪贤 田晶晶
(1. 西北农林科技大学动物科技学院, 杨陵 712100; 2. 北京市营养源研究所水产动物系统营养研究开放实验室, 北京 100069;3. 苏州大学基础医学与生命科学学院, 苏州 215123)
水飞蓟素抑制草鱼肝细胞脂质蓄积的作用及其机制研究
萧培珍1吉 红1张宝彤2叶元土3孙 健1杨 洲1李雪贤1田晶晶1
(1. 西北农林科技大学动物科技学院, 杨陵 712100; 2. 北京市营养源研究所水产动物系统营养研究开放实验室, 北京 100069;3. 苏州大学基础医学与生命科学学院, 苏州 215123)
为探究水飞蓟素(Silymarin)对草鱼肝细胞脂质蓄积的作用及其机理, 体外培养草鱼肝细胞, 在用400 μmol/L油酸对其进行蓄脂诱导的同时, 采用不同质量浓度的水飞蓟素处理24h, 检测了肝细胞活力、脂质蓄积状况、抗氧化指标和脂质代谢相关基因表达状况。结果显示, 水飞蓟素质量浓度在75—125 μg/mL对草鱼肝细胞活力无影响(P>0.05); 与单独采用油酸进行蓄脂诱导的油酸组比较, 水飞蓟素和油酸共同处理的水飞蓟素组中, 随着水飞蓟素质量浓度的增加, 肝细胞内的脂质含量逐渐降低, 且水飞蓟素质量浓度在100—150 μg/mL时的肝细胞脂质蓄积水平显著降低(P<0.05); 与油酸组相比, 100 μg/mL水飞蓟素处理组的脂质含量以时间依赖性的模式显著降低(P<0.05), 还原型谷胱甘肽含量显著升高(P<0.05), 脂肪酸合成酶和硬脂酰辅酶A去饱和酶1的mRNA表达量显著下调(P<0.05)。研究表明, 水飞蓟素能够抑制草鱼肝细胞脂质蓄积, 其作用可能与其抑制脂质合成基因的表达有关; 同时, 水飞蓟素可能通过提高肝细胞的抗氧化能力发挥保护肝细胞的作用。
水飞蓟素; 脂质蓄积; 肝细胞; 草鱼; 油酸
饲料油脂不仅能够为鱼体提供能量, 而且是养殖鱼类必需脂肪酸的重要来源[1]。研究表明, 提高饲料中脂肪水平能够节约蛋白质, 提高鱼体生长性能, 这已成为当前水产饲料配方技术发展的主要方向之一[2,3]。然而, 过量的脂肪摄入, 会抑制养殖对象生长, 引发脂质在鱼体组织如肝胰脏和腹腔脂肪组织中的过度蓄积, 进而引起鱼类出现高脂血症、脂肪肝和脂质过氧化反应等症状[4—8]。由于饲料能量摄入过多或营养素不平衡导致肝细胞内脂质过度蓄积, 引起肝细胞脂肪变, 称为鱼类营养性脂肪肝[9]。当前几乎所有的主要养殖鱼类均有发生脂肪肝的报道, 脂肪肝不仅造成鱼体对摄入能量的浪费,而且严重威胁着鱼类健康[10,11]。因此, 预防养殖鱼类脂肪肝的发生, 对提高鱼类生产性能、改善鱼类健康状况具有重要意义。
水飞蓟素(Silymarin)是一种黄酮类植物提取物, 从紫花水飞蓟(Silybum marianumL.)的干燥果实中提取, 主要由4种黄酮类化合物组成, 包含水飞蓟宾A和B (Silibinin A and B)、异水飞蓟素宾A和B(Isosilibinin A and B)、水飞蓟亭(Silychristin)、水飞蓟宁(Silydianin)[12,13]。在哺乳动物上, 水飞蓟素具有保护肝脏、抗氧化、抗炎、抗癌等作用[14—16]。在鱼类上, 水飞蓟素能够修复CCl4诱导的鲤肝损伤[17], 降低虹鳟血浆胆固醇含量[18], 抑制斑马鱼的脂质蓄积[19]。本研究室前期研究发现, 水飞蓟素能够降低高脂日粮诱导的草鱼肝脏脂质含量的增加[20]。
草鱼(Ctenopharyngodon idellus)属于草食性鱼类, 是我国主要的淡水养殖品种之一, 2015年总产量为5.68×109kg, 占全国淡水鱼总产量的20.91%(中国渔业统计年鉴, 2016)。有学者指出, 草鱼对饲料脂肪的利用能力较低[4,21]。然而, 在实际生产中, 草鱼饲料脂质水平越来越高, 导致鱼体脂肪肝现象频繁发生。研究报道, 过量的游离脂肪酸摄入引起肝脏脂质过度蓄积, 导致肝细胞出现脂肪变性, 同时过量的游离脂肪酸也是产生脂毒性的重要介质, 引起细胞受损[22]。因此, 研究草鱼脂肪肝防控技术具有重要的理论和应用上的意义。目前, 关于水飞蓟素降脂作用的研究有一些报道[19,23—25], 但评价手段较为单一。在哺乳动物上, 有学者通过构建细胞离体培养体系, 采用游离脂肪酸诱导建立脂肪肝细胞模型, 对一些功能性成分进行筛选[26—30], 在鱼类上,杜金梁等[31]用油酸构建了建鲤原代脂肪肝细胞损伤模型, 并获得了泽泻提取物对油酸诱导的脂肪肝具有保护作用, 而有关就水飞蓟素作用离体评价的研究还未见报道。因此, 本研究采用油酸与水飞蓟素共同处理草鱼肝细胞的技术路线, 探讨水飞蓟素对草鱼肝细胞脂质蓄积的作用和分子机制, 为养殖鱼类脂肪肝的防治和功能性饲料添加剂的开发提供参考资料。
1 材料与方法
1.1 主要试剂
M199培养基、胎牛血清和无脂肪酸牛血清白蛋白购自Gibco公司, 水飞蓟素、油红O、MTT和油酸均购自Sigma公司, 二甲亚砜(Dimethyl sulfoxide, DMSO)、碳酸氢钠、无水乙醇等化学试剂均为国产分析纯。Trizol、反转录试剂盒及荧光定量试剂盒购自TaKaRa公司。
1.2 草鱼肝细胞的培养
草鱼肝细胞(L8824)购自中国典型培养物保藏中心(China Center for Type Culture Collection,CCTCC)。将肝细胞置于10%胎牛血清的M199培养液中, 并于28℃、5% CO2饱和湿度培养箱中培养。隔天换液, 待细胞生长至汇合后, 用于试验。
1.3 油酸溶液和水飞蓟素溶液的配制
油酸用无水乙醇配制成100 mmol/L贮存液, 保存于–20℃, 使用前用2%无脂肪酸牛血清白蛋白的M199培养基将油酸稀释成10 mmol/L储备液。之后用10%胎牛血清的M199培养液配置成400 μmol/L油酸溶液待用。
水飞蓟素用DMSO溶液配制成10 mg/mL贮存液, 保存于–20℃, 使用前用10%胎牛血清的M199培养液配制成不同质量浓度(5、25、50、75、100、125、150和200 μg/mL, 简写为SM5、25、50、75、100、125、150和200)的水飞蓟素工作液待用。
1.4 试验处理
根据本实验室前期研究成果, 选用400 μmol/L油酸处理草鱼肝细胞, 作为诱导肝细胞脂肪化的浓度[32]。
试验组别设为对照组、油酸组和水飞蓟素处理组。其中: 对照组为不经任何处理的, 用10%胎牛血清的M199培养液培养肝细胞24h, 为正常肝细胞组(Control); 油酸组(OA组)为用含400 μmol/L油酸的培养液培养肝细胞24h; 水飞蓟素处理组(SM组)为用含有400 μmol/L油酸并同时添加不同质量浓度的水飞蓟素的培养液培养肝细胞24h。
1.5 MTT法评估水飞蓟素对肝细胞活力的影响
采用MTT法, 分别评估了不同质量浓度水飞蓟素对未加油酸和同时添加油酸的草鱼肝细胞活力的影响。具体操作如下:
(1) 将草鱼肝细胞均匀接种于96孔板(150 μL/孔), 28℃, 5% CO2培养24h。之后, 更换为含有不同质量浓度(5、25、50、100和200 μg/mL)水飞蓟素的培养液培养肝细胞24h, 然后MTT法评估水飞蓟素对未加油酸的肝细胞活力的影响。
(2) 将草鱼肝细胞均匀接种于96孔板(150 μL/孔), 28℃, 5% CO2培养24h。之后, 更换为含有油酸和不同质量浓度(75、100、125 μg/mL)水飞蓟素的培养液培养肝细胞24h, 然后MTT法评估水飞蓟素对添加油酸的肝细胞活力的影响。
MTT法操作步骤为: 细胞经上述处理后, 向每孔加入20 μL的MTT溶液(5 mg/mL), 在28℃、5%CO2条件下继续培养4h, 吸弃培养液, 用PBS洗1次,吸弃, 每孔加入150 μL DMSO, 于28 ℃孵育10 min,溶解细胞中的甲臢。用Gen5 酶标仪于490 nm波长处测定吸光值, 每组6个重复。
1.6 油红O染色提取法及试剂盒法测定细胞甘油三酯含量
将草鱼肝细胞均匀接种于96孔板, 根据1.4方式处理肝细胞后, 吸弃培养基, 每孔用PBS洗2次, 加入10%的甲醛溶液固定30min, PBS洗2次, 加入新鲜配制的油红O染液浸染15min, 之后用PBS清洗2次,于倒置显微镜下观察细胞内脂滴的染色情况, 拍照记录。之后每孔加入150 μL的异丙醇萃取脂质, 用Gen5 酶标仪于490 nm波长处测定吸光值。每组6个重复。
此外, 用甘油三酯试剂盒定量测定细胞内甘油三酯含量(北京普利莱基因技术有限公司), 进一步确定水飞蓟素抑制脂质积累的质量浓度。
1.7 抗氧化指标的检测
将草鱼肝细胞均匀接种于24孔板, 按照1.4方式处理肝细胞后, 吸弃培养基, 胰蛋白酶消化细胞, 待细胞接近圆球形时, 立即加入含10%胎牛血清的M199培养液终止消化, 用移液器反复轻轻吹打, 收集细胞悬液, 1000 r/min离心5min, 弃上清液, 加PBS吹打均匀, 1000 r/min离心5min, 弃上清液, 收集细胞待用, 用于抗氧化指标测定。
抗氧化指标包括超氧化物歧化酶(Superoxide dismutase, SOD)和还原型谷胱甘肽(Reduced glutathione, GSH), 均采用试剂盒进行测定(南京建成生物工程研究所)。细胞蛋白含量用Bradford蛋白浓度测定试剂盒测定蛋白含量(碧云天生物技术有限公司)。
1.8 实时定量PCR检测脂质代谢相关基因mRNA的表达
将草鱼肝细胞均匀接种于24孔板, 按照1.4方式处理肝细胞后, 吸弃培养基, PBS清洗2次, 提取总RNA, 并反转录。采用CFX-96实时定量PCR仪(Bio-Rad, USA)测定相关基因的mRNA表达量。20 μL反应体系, 包括: 上下游引物(10 mmol/μL)各0.6 μL、cDNA 1 μL、2×SYBR Premix ExTaqTMII 10 μL、灭菌双蒸水加至20 μL。反应条件是: 95℃,10s; 95℃, 15s; 57℃, 15s; 40个循环。实时定量检测基因β-actin、FAS、ACC、SCD1、ATGL、HSL、CPT1的引物序列见表1。在反应结束后, 利用溶解曲线对产物的唯一性进行分析。β-actin作为内参,相对定量法比较Ct值(2–ΔΔCt), 计算基因表达量, 并作图分析, 每组3个重复。
1.9 统计分析
所有数据均以平均值±标准误(Mean±SE)表示。采用SPSS18.0软件中的单因素方差分析(Oneway ANOVA)以及Duncan氏多重比较,t-检验对数据进行统计学分析。显著水平为P<0.05, 极显著水平为P<0.01。

表1 实时定量PCR引物序列Tab. 1 Primers used in real-time quantitative PCR
2 结果
2.1 水飞蓟素对草鱼肝细胞活力的影响
首先评估了水飞蓟素对未加油酸的草鱼肝细胞活力影响(图1), 结果显示, 与对照组比较, 水飞蓟素质量浓度在25—100 μg/mL时显著增加了细胞活力(P<0.05), 而在5和200 μg/mL时均与对照组无显著差异(P>0.05)。
进一步评估了水飞蓟素和油酸共同处理草鱼肝细胞24h后, 对肝细胞活力的影响(图2), 结果显示, 与对照组比较, 油酸组(OA组)显著提高了肝细胞活力(P<0.05)。与油酸组(OA组)比较, SM75、SM100组均显著提高了细胞活力(P<0.05), 而SM125组无显著影响(P>0.05)。这表明水飞蓟素质量浓度在75—125 μg/mL并同时添加400 μmol/L油酸对草鱼肝细胞活力无抑制作用。
2.2 水飞蓟素对草鱼肝细胞脂质蓄积的抑制作用
采用不同质量浓度的水飞蓟素和油酸处理草鱼肝细胞24h后, 通过油红O染色对细胞形态进行了观察(图3A), 随着水飞蓟素质量浓度的增加, 草鱼肝细胞内红色脂滴含量呈现出减少的趋势, 且脂滴变小, 颜色变浅。同时, 用油红O染色提取比色法定量分析细胞内脂质含量(图3B), 结果显示, 与对照组比较, 油酸组(OA组)的脂质含量显著增加(P<0.05)。与油酸组(OA组)比较, SM5组的脂质含量显著增加(P<0.05), 之后随着水飞蓟素质量浓度的增加, 肝细胞内的脂质含量逐渐降低, 且水飞蓟素质量浓度在100—150 μg/mL时的脂质含量显著降低(P<0.05)。
进一步用甘油三酯试剂盒定量检测肝细胞甘油三酯含量(图4), 结果显示水飞蓟素100 μg/mL处理肝细胞24h后, 肝细胞内甘油三酯含量显著低于油酸组(OA组), 但高于对照组(P<0.05); 油酸组(OA组)肝细胞内甘油三酯含量则显著高于对照组(P<0.05)。
2.3 水飞蓟素对草鱼肝细胞脂质蓄积抑制作用的时间依赖关系
研究了水飞蓟素对草鱼肝细胞脂质蓄积抑制作用的时间依赖关系(图5)。选择质量浓度为100 μg/mL的水飞蓟素处理肝细胞, 油红O染色提取比色法定量分析细胞脂质含量(图5B)。结果显示, 与油酸组(OA组)相比, 随着水飞蓟素处理时间的延长, 在12h时肝细胞脂质含量出现显著降低(P<0.05), 在18h和24h时肝细胞内脂质含量均极显著降低(P<0.01)。油红O染色后光学显微镜观察细胞形态(图5A), 随着水飞蓟素处理时间的延长, 在同一时间点肝细胞内的红色脂滴少且颜色浅于油酸组。
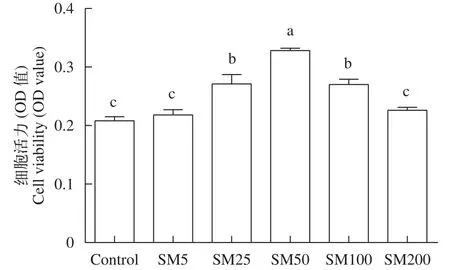
图1 水飞蓟素对草鱼肝细胞活力的影响(平均值±标准误, n=6)Fig. 1 Effect of silymarin on the viability of grass carp hepatocytes (mean±SE, n=6)
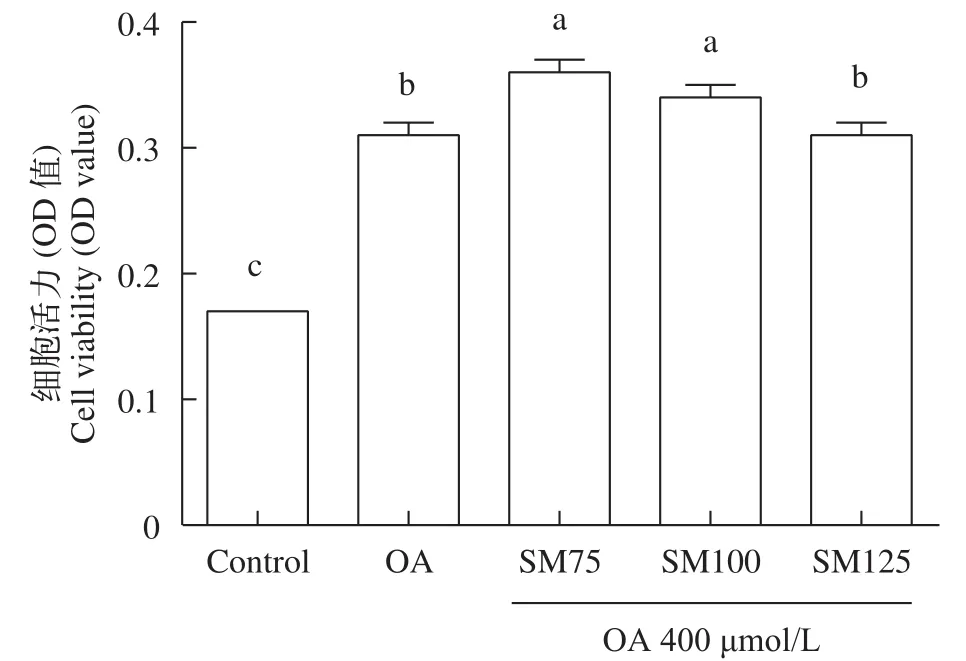
图2 水飞蓟素和油酸共同处理24h对草鱼肝细胞活力的影响(平均值±标准误, n=6)Fig. 2 Effect of silymarin and oleic acid on the viability of grass carp hepatocytes (means±SE, n=6)
2.4 水飞蓟素对草鱼肝细胞抗氧化能力的影响
结果表明(图6), SM100组的GSH含量显著高于油酸组(OA组)(P<0.05), 但与对照组无差异(P>0.05); 油酸组(OA组)的GSH含量低于对照组, 但无统计学差异(P>0.05)(图6B)。SOD活性在对照组、油酸组(OA组)和SM100组间均无显著差异(P>0.05)(图6A)。
2.5 水飞蓟素对草鱼肝细胞脂质代谢相关基因表达的影响
与对照组相比(图7), 油酸组(OA组)SCD1的mRNA表达量显著上调, 而ATGL、HSL和CPT1的mRNA表达量则显著下调(P<0.05); 油酸组(OA组)FAS的mRNA表达量呈增加趋势, 但与对照组间无统计学差异(P>0.05)。与油酸组(OA组)比较,SM100组的FAS和SCD1的mRNA表达量均显著下调(P<0.05)。SM100组的ACC、ATGL、HSL、CPT1的mRNA表达量与油酸组相比呈降低趋势, 但均无显著差异(P>0.05)。
3 讨论
3.1 水飞蓟素对肝细胞活力的影响
在哺乳动物上, 体外建立脂肪肝细胞模型, 进行外源性活性功能成分筛选, 是一种常用研究手段,而在鱼类上的相关研究报道较少。Okamoto等[26]用0.1和1 mmol/L油酸培养HepG2 24h, 成功造成肝细胞脂肪变性。Ricchi等[27]用0.66和1.32 mmol/L油酸成功诱导3种肝细胞系(HepG2, WRL-68和HuH-7细胞)脂肪变性。本研究室用油酸成功诱导了草鱼肝细胞脂质蓄积, 即油酸浓度在400 μmol/L培养24h时能够促进草鱼肝细胞脂质蓄积且有利于增强细胞活力[32]。因此, 本研究选用400 μmol/L油酸用于诱导草鱼肝细胞脂质蓄积。MTT和油红O染色法提取脂质结果显示油酸组的细胞活力和脂质含量均显著高于对照组, 表明400 μmol/L油酸能够增加草鱼肝细胞的活力并诱导脂质蓄积, 进一步证实了上述研究结果。有研究报道指出, 水飞蓟素(30 μmol/L)和水飞蓟宾(100 μmol/L)对原代培养的大鼠肝细胞产生损伤作用[33]。Venkataramanan等[34]报道0.25 mmol/L (48h)水飞蓟素对原代培养的人肝细胞活力无抑制作用, 而水飞蓟素在0.5 mmol/L (48h)时对细胞活力产生抑制作用。Zhang等[35]用水飞蓟素(100 μmol/L)和棕榈酸(200 μmol/L)共同处理HepG2和BRL-3A细胞, 发现添加水飞蓟素后能够降低棕榈酸对细胞的毒性作用。在本研究中, 水飞蓟素处理未加油酸的肝细胞结果表明, 水飞蓟素质量浓度在5—200 μg/mL时对细胞活力无抑制作用,且25—100 μg/mL时能够增强细胞活力。进一步分析水飞蓟素和油酸共同处理草鱼肝细胞结果, 发现水飞蓟素质量浓度在75—125 μg/mL并同时添加400 μmol/L油酸对肝细胞活力无抑制作用。
3.2 水飞蓟素对肝细胞脂质蓄积的抑制作用及其调控机制

图3 油红O染色法评估水飞蓟素对草鱼肝细胞脂质蓄积的影响(平均值±标准误, n=6)Fig. 3 Effects of silymarin on intracellular lipid accumulation in grass carp hepatocytes (mean±SE, n=6)
水飞蓟素是一种黄酮类植物提取物, 具有保护肝脏和缓解胰岛素耐受, 影响糖脂代谢的作用[36—38]。在大鼠上发现, 水飞蓟素降低了高脂血症或CCl4诱导增加的大鼠血液总脂质, 甘油三酯和胆固醇含量[25,39]。Zhang等[35]用水飞蓟素与棕榈酸共同处理BRL-3A和HepG2细胞, 发现水飞蓟素抑制了细胞脂质蓄积。在本实验中, 水飞蓟素显著降低了油酸诱导草鱼肝细胞中甘油三酯的蓄积, 这与我们先前在体研究中发现的水飞蓟素能够降低高脂日粮诱导增加的草鱼肝脂含量结果一致[20], 表明水飞蓟素对草鱼肝细胞脂质蓄积具有抑制作用, 有利于保护肝脏。此外, 时间依赖关系结果表明, 随着水飞蓟素处理肝细胞时间的延长, 抑制脂质蓄积的效果显著。
本研究进一步分析了水飞蓟素对肝细胞脂质蓄积抑制的调控机制。乙酰辅酶A羧化酶(Acetyl-CoA carboxylase, ACC)和脂肪酸合酶(Fatty acid synthase, FAS)是调节脂质合成的关键限速酶[40,41],硬脂酰辅酶A去饱和酶1(Stearoyl-CoA desaturases 1, SCD1)是软脂酸去饱和合成单不饱和脂肪酸的调控酶[42]。甘油三酯脂酶(Adipose triglyceride lipase, ATGL)和激素敏感酶(Hormone-sensitive lipase, HSL)是调控甘油三酯水解的关键酶[43]。肉毒碱棕榈酰转移酶(Carnitine palmitoyltransferase 1,CPT1)是影响线粒体脂肪酸β-氧化的限速酶[44]。在本研究中, 与对照组相比, 油酸组脂质分解相关基因(ATGL、HSL、CPT1)的mRNA表达量显著下调,而脂质合成基因SCD1的mRNA表达量显著上调,同时FAS的mRNA表达量呈增加趋势, 表明油酸能够抑制肝细胞中脂质分解, 促进脂质合成, 这可能是导致肝细胞脂质增加的主要原因[28]。黄酮可降低非酒精性脂肪肝大鼠的肝脏脂质蓄积, 其抑制作用与抑制脂质合成有关[45]。在体研究指出, 水飞蓟素可降低高果糖日粮饲喂大鼠的FAS基因表达量[37]。在本研究中, 与油酸组比较, 水飞蓟素处理组的FAS和SCD1基因表达量显著下调, 表明水飞蓟素可能通过下调肝细胞内脂质合成来抑制脂质蓄积, 这可能是导致肝细胞内甘油三酯含量降低, 改善油酸诱导肝细胞脂肪蓄积的主要原因。
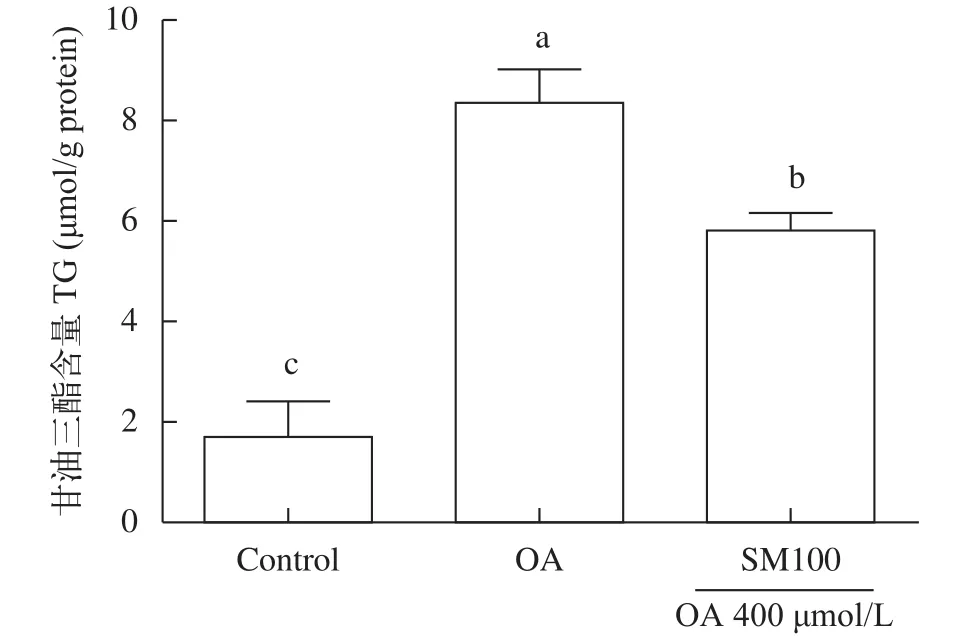
图4 水飞蓟素对草鱼肝细胞甘油三酯含量的影响(平均值±标准误, n=3)Fig. 4 Effect of silymarin on triacylglycerol (TG) contents in grass carp hepatocytes (mean±SE, n=3)
3.3 水飞蓟素对肝细胞抗氧化能力的影响

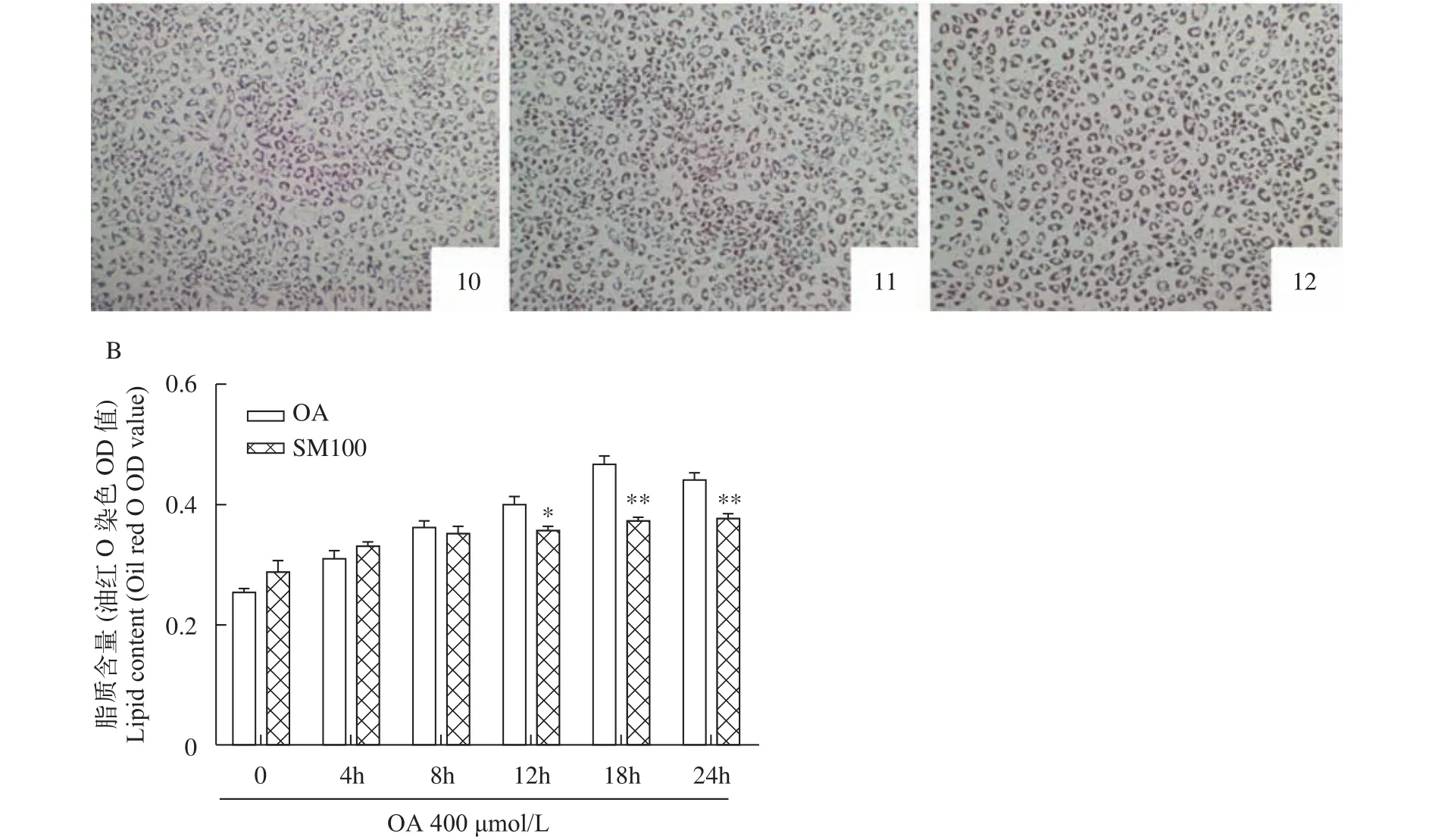
图5 水飞蓟素对草鱼肝细胞脂质蓄积的时间依赖关系(平均值±标准误, n=6)Fig. 5 Effect of silymarin on lipid accumulation in grass carp hepatocytes for 0, 4h, 8h, 12h, 18h or 24h (mean±SE, n=6)
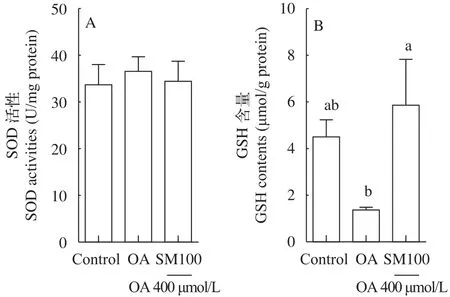
图6 水飞蓟素对草鱼肝细胞抗氧化能力的影响(平均值±标准误, n=3)Fig. 6 Effect of silymarin on antioxidant capabilities in grass carp hepatocytes (mean±SE, n=3)
肝细胞对甘油三酯的储存能力有限。当过量游离脂肪酸蓄积在肝细胞内, 导致产生过量的活性氧(Reactive oxygen species, ROS), 引起氧化应激发生, 造成脂毒性, 导致细胞损伤或死亡[46,47], 并使得营养性脂肪肝进一步向肝纤维化和肝坏死转变[9]。ROS是不稳定的活性分子, 依赖于细胞内抗氧化系统的清除作用。SOD属于抗氧化酶, 可清除游离的自由基进而保护细胞的抗脂质过氧化反应[48];GSH用于维持细胞内氧化还原状态的平衡, 作为谷胱甘肽过氧化物酶和谷胱甘肽转移酶的底物, 对清除自由基起了关键作用[49]。水飞蓟素具有抗氧化、抗炎、抗癌等作用[16,17]。已有研究发现, 水飞蓟素处理棕榈酸诱导的HepG2细胞后, 不仅提高了细胞中GSH含量, 而且改善了棕榈酸诱导的AKT酶活性的降低, 并缓解了细胞死亡[50]。在体研究中, 水飞蓟宾不仅能够调节脂质平衡, 而且可显著降低酒精性脂肪肝炎大鼠ROS含量, 抑制氧化应激介导的脂毒性作用, 最终阻止了肝脏损伤的发展[38]。在本研究中, 水飞蓟素处理肝细胞后, GSH含量增加, 表明水飞蓟素能够促进肝细胞的抗氧化能力的提高, 这将有助于抵抗细胞内ROS的产生, 保护肝细胞[17]。然而, 有关水飞蓟素对肝细胞氧化应激和脂质蓄积影响的内在作用机制有待进一步研究。
4 结论
本研究发现, 水飞蓟素能够抑制油酸诱导的草鱼肝细胞脂质蓄积, 改善肝细胞的脂肪变性状况,其作用机制可能与其抑制脂质合成基因的表达有关; 同时水飞蓟素能够提高肝细胞的抗氧化能力,表明水飞蓟素或可作为一种具有开发潜力的鱼用降脂及抗氧化因子。另外, 研究认为, 结合在体饲养试验, 通过建立细胞离体培养模型进行微量成分作用机制研究和功能性添加剂的筛选, 可作为开展水产动物营养学研究和饲料开发的有效方法。
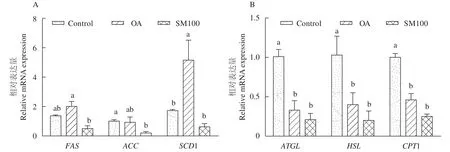
图7 RT-PCR测定水飞蓟素对草鱼肝细胞脂质代谢相关基因的影响(平均值±标准误, n=3)Fig. 7 Effects of silymarin on the relative expression of the lipid metabolism related genes in grass carp hepatocytes (mean±SE, n=3)
[1]Tocher D R. Metabolism and functions of lipids and fatty acids in teleost fish [J].Reviews in Fisheries Science,2003, 11(2): 107—184
[2]Tang J, Wang A L, Miao Y T,et al. Protein-sparing effects andLPLgene expressions of dietary lipids in the juvenile soft-shelled turtle,Pelodiscussinensis[J].Aquaculture Research, 2016, 47(2): 579—590
[3]Hung L T, Binh, V T T, Truc N T T,et al. Effects of dietary protein and lipid levels on growth, feed utilization and body composition in red-tailed catfish juveniles(Hemibagrus wyckioides, Chaux amp; Fang 1949) [J].Aquaculture Nutrition, 2017, 23(2): 367—374
[4]Du Z Y, Liu Y J, Tian L X,et al. Effect of dietary lipid level on growth, feed utilization and body composition by juvenile grass carp (Ctenopharyngodon idella) [J].Aquaculture Nutrition, 2005, 11(2): 139—146
[5]Guo X, Liang X, Fang L,et al. Effects of dietary non-protein energy source levels on growth performance, body composition and lipid metabolism in herbivorous grass carp (Ctenopharyngodon idella Val.) [J].Aquaculture Research, 2013, 46(5): 1197—1208
[6]Jin Y, Tian L, Zeng S,et al. Dietary lipid requirement on non-specific immune responses in juvenile grass carp(Ctenopharyngodon idella) [J].Fish amp; Shellfish Immuno-logy, 2013, 34(5): 1202—1208
[7]Lu K L, Xu W N, Li J Y,et al. Alterations of liver histology and blood biochemistry in blunt snout breamMegalobrama amblycephalafed high-fat diets [J].Fisheries Science, 2013a, 79(4): 661—671
[8]Zhao P F, Li F J, Chen X R,et al. Dietary lipid concentrations influence growth, liver oxidative stress, and serum metabolites of juvenile hybrid snakehead (Channa argus×Channa maculata) [J].Aquaculture International, 2016,24(5): 1—12
[9]Du Z Y. Causes of fatty liver in farmed fish: a review and new perspectives [J].Journal of Fisheries of China, 2014,38(9): 1628—1638 [杜震宇. 养殖鱼类脂肪肝成因及相关思考. 水产学报, 2014, 38(9): 1628—1638]
[10]Lu K L, Xu W N, Li X F,et al. Hepatic triacylglycerol secretion, lipid transport and tissue lipid uptake in blunt snout bream (Megalobrama amblycephala) fed high-fat diet [J].Aquaculture, 2013b, 408—409(9): 160—168
[11]Nanton D A, Lall S P, Ross N W,et al. Effect of dietary lipid level on fatty acid β-oxidation and lipid composition in various tissues of haddock,Melanogrammus aeglefinusL [J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2003,135(1): 95—108
[12]Colturato C P, Constantin R P, Maeda A S,et al. Metabolic effects of silibinin in the rat liver [J].Chemico-biological Interactions, 2012, 195(2): 119—132
[13]Lee D Y W, Liu Y. Molecular Structure and Stereochemistry of Silybin A, Silybin B, Isosilybin A, and Isosilybin B, Isolated fromSilybum marianum(Milk Thistle) [J].Journal of Natural Products, 2003, 66(9): 1171—1174
[14]Ludovico A, Gabriella A, Raffaele C,et al. Milk thistle for treatment of nonalcoholic fatty liver disease [J].Hepatitis Monthly, 2011, 11(3): 173—177
[15]Shaker E, Mahmoud H, Mnaa S. Silymarin, the antioxi-dant component andSilybum marianumextracts prevent liver damage [J].Food and Chemical Toxicology, 2010,48(3): 803—806
[16]Surai P F. Silymarin as a natural antioxidant: An overview of the current evidence and perspectives [J].Antioxidants, 2015, 4(1): 204—247
[17]Jia R, Cao L, Du J,et al. The protective effect of silymarin on the carbon tetrachloride (CCl4)-induced liver injury in common carp (Cyprinus carpio) [J].In Vitro Cellular amp; Developmental Biology-Animal, 2013, 49(3):155—161
[18]Banaee M, Sureda A, Mirvaghefi A R,et al. Effects of long-term silymarin oral supplementation on the blood biochemical profile of rainbow trout (Oncorhynchus mykiss) [J].Fish Physiology and Biochemistry, 2011,37(4): 885—896
[19]Suh H J, Cho S Y, Kim E Y,et al. Blockade of lipid accumulation by silibinin in adipocytes and zebrafish [J].Chemico-Biological Interactions, 2015, 227: 53—62
[20]Xiao P Z, Ji H, Ye Y T,et al. Dietary silymarin supplementation promotes growth performance and improves lipid metabolism and health status in grass carp (Ctenopharyngodon idellus) fed diets with elevated lipid levels[J].Fish Physiology and Biochemistry, 2017, 43(1):245—263
[21]Du Z Y, Clouet P, Zheng W H,et al. Biochemical hepatic alterations and body lipid composition in the herbivorous grass carp (Ctenopharyngodon idella) fed high-fat diets [J].British Journal of Nutrition, 2006, 95(5):905—915
[22]Savary S, Trompier D, Andréoletti P,et al. Fatty acids -induced lipotoxicity and inflammation [J].Current Drug Metabolism, 2012, 13(10): 1358—1370
[23]Chou C, Chen Y, Hsu M,et al. Effect of silymarin on lipid and alcohol metabolism in mice following long-term alcohol consumption [J].Journal of Food Biochemistry, 2012,36(3): 369—377
[24]El-Sheikh N M, El-Fattah H M A. Counteracting methionine choline-deficient diet-induced fatty liver by administration of turmeric and silymarin [J].Journal of Applied Sciences Research, 2011, 7(12): 1812—1820
[25]Metwally M A A, Elgellal A M, Elsawaisi S M. Effects of silymarin on lipid metabolism in rats [J].World Applied Sciences Journal, 2009, 6(12): 1634—1637
[26]Okamoto Y, Tanaka S, Haga Y. Enhanced GLUT2 gene expression in an oleic acid-induced in vitro fatty liver model [J].Hepatology Research, 2002, 23(2): 138—144
[27]Ricchi M, Odoardi M R, Carulli L,et al. Differential effect of oleic and palmitic acid on lipid accumulation and apoptosis in cultured hepatocytes [J].Journal of Gastroenterology and Hepatology, 2009, 24(5): 830—840
[28]Ou T T, Man-Jung Hsu, Chan K C,et al. Mulberry extract inhibits oleic acid-induced lipid accumulation via reduction of lipogenesis and promotion of hepatic lipid clearance [J].Journal of the Science of Food and Agriculture, 2011, 91(15): 2740—2748
[29]Wu C H, Lin M C, Wang H C,et al. Rutin inhibits oleic acid induced lipid accumulation via reducing lipogenesis and oxidative stress in hepatocarcinoma cells [J].Journal of Food Science, 2011, 76(2): T65—T72
[30]Kang O H, Kim S B, Seo Y S,et al. Curcumin decreases oleic acid-induced lipid accumulation via AMPK phosphorylation in hepatocarcinoma cells [J].European Review for Medical amp; Pharmacological Sciences, 2013,17(17): 2578—2586
[31]Du J L, Cao L P, WangT,et al. Protective effects of Rhizoma Alismatis extract on hepatocyte steatosis injury induced by Oleic acid in Jian Carp (Cyprinus carpio var.JIAN) [A]. Academic Annual Meeting of China Society of Fisheries [C]. 2015 [杜金梁, 曹丽萍, 王涛, 等. 泽泻提取物对油酸诱导建鲤脂肪肝细胞损伤的保护作用.中国水产学会学术年会论文摘要集. 2015]
[32]Li X, Sun J, Ji H,et al. Influence of fatty acids on lipid accumulation and apoptosis status of grass carpCtenopharyngodon idellushepatocytein vitro[J].Acta Hydrobiologica Sinica, 2017, 41(1): 56—64 [李雪贤, 孙健, 吉红, 等. 脂肪酸影响草鱼肝细胞脂质蓄积状态及诱导其凋亡的离体研究. 水生生物学报, 2017, 41(1): 56—64]
[33]Sainz-Pardo L A, Anundi I, Miguez M P,et al. The effects of silymarin on the attachment and viability of primary cultures of rat hepatocytes [J].Toxicology in Vitro, 1994, 8(4): 577—579
[34]Venkataramanan R, Ramachandran V, Komoroski B J,et al. Milk thistle, a herbal supplement, decreases the activity of CYP3A4 and uridine diphosphoglucuronosyl transferase in human hepatocyte cultures [J].Drug Metabolism and Disposition, 2000, 28(11): 1270—1273
[35]Zhang Y, Hai J, Cao M,et al. Silibinin ameliorates steatosis and insulin resistance during non-alcoholic fatty liver disease development partly through targeting IRS-1/PI3K/Akt pathway [J].International Immunopharmacology,2013, 17(3): 714—20
[36]Chen I S, Chen Y C, Chou C H,et al. Hepatoprotection of silymarin against thioacetamide-induced chronic liver fibrosis [J].Journal of the Science of Food and Agriculture, 2012, 92(7): 1441—1447
[37]Prakash P, Singh V, Jain M,et al. Silymarin ameliorates fructose induced insulin resistance syndrome by reducingde novohepatic lipogenesis in the rat [J].European Journal of Ppharmacology, 2014, 727: 15—28
[38]Salamone F, Galvano F, Cappello F,et al. Silibinin modulates lipid homeostasis and inhibits nuclear factor kappa B activation in experimental nonalcoholic steatohepatitis[J].Translational Research, 2012, 159(6): 477—486
[39]Hassan H A, El-Gendy A M. Evaluation of silymarin and/or ginger effect on induced hepatotoxicity by carbon tetrachloride in male albino rats [J].Egyptian Journal of Hospital Medicine, 2003, 12: 101—112
[40]Davis M S, Solbiati J, Cronan J E. Overproduction of acetyl-CoA carboxylase activity increases the rate of fatty acid biosynthesis inEscherichia coli[J].Journal of Biological Chemistry, 2000, 275(37): 28593—28598
[41]Jensen-Urstad A P L, Semenkovich C F. Fatty acid synthase and liver triglyceride metabolism: housekeeper or messenger [J]?Biochimica et Biophysica Acta(BBA)-Molecular and Cell Biology of Lipids, 2012, 1821(5):747—753
[42]Ntambi J M, Miyazaki M. Regulation of stearoyl-CoA desaturases and role in metabolism [J].Progress in Lipid Research, 2004, 43(2): 91—104
[43]Schweiger M, Schreiber R, Haemmerle G,et al. Adipose triglyceride lipase and hormone-sensitive lipase are the major enzymes in adipose tissue triacylglycerol catabolism [J].Journal of Biological Chemistry, 2006, 281(52):40236—40241
[44]Kerner J, Hoppel C. Fatty acid import into mitochondria[J].Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids, 2000, 1486(1): 1—17
[45]Zhang S, Zheng L, Dong D,et al. Effects of flavonoids from Rosa laevigata Michx fruit against high-fat diet-induced non-alcoholic fatty liver disease in rats [J].Food Chemistry, 2013, 141(3): 2108—2116
[46]Singal A K, Jampana S C, Weinman S A. Antioxidants as therapeutic agents for liver disease [J].Liver International, 2011, 31(10): 1432—1448
[47]Feldstein A E, Werneburg N W, Canbay A,et al. Free fatty acids promote hepatic lipotoxicity by stimulating TNF-α expression via a lysosomal pathway [J].Hepatology, 2004, 40(1): 185—194
[48]Fridovich I. Superoxide radical and superoxide dismutases [J].Annual Review of Biochemistry, 1995, 64(1):97—112
[49]Masella R, Di Benedetto R, Varì R,et al. Novel mechanisms of natural antioxidant compounds in biological systems: involvement of glutathione and glutathione-related enzymes [J].The Journal of Nutritional Biochemistry,2005, 16(10): 577—586
[50]Song Z, Song M, Lee D Y,et al. Silymarin prevents palmitate-induced lipotoxicity in HepG2 cells: involvement of maintenance of Akt kinase activation [J].Basic and Clinical Pharmacology and Toxicology, 2007,101(4): 262—268
INHIBITORY EFFECT OF SILYMARIN ON OLEIC ACID-INDUCED LIPID ACCUMULATION IN GRASS CARP (CTENOPHARYNGODON IDELLUS)HEPATOCYTES IN VITRO
XIAO Pei-Zhen1, JI Hong1, ZHANG Bao-Tong2, YE Yuan-Tu3, SUN Jian1, YANG Zhou1,LI Xue-Xian1and TIAN Jing-Jing1
(1. College of Animal Science and Technology, Northwest A amp; F University, Yangling 712100, China; 2. Open Lab for Aquatic Animal Nutrition, Beijing Research Institute for Nutritional Resources, Beijing 100069, China; 3. Key Laboratory of Aquatic Nutrition of Jiangsu Province, School of Biology and Basic Medical Sciences, Soochow University, Suzhou 215123, China)
The objective of this study was to explore the mechanism and effect of silymarin on hepatocytes lipid accumulation of grass carp (Ctenopharyngodon idellus) induced by oleic acid (OA). Hepatocytes were treated at 400 μmol/L OA with or without silymarin to observe the cell viability by 3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT) and the lipid accumulation by Oil Red O stain. We also tested the effects of silymarin on the antioxidant capacities and the expression of lipid metabolism related gene in hepatocytes in grass carp detected by RT-PCR.The results showed that the cell viability was not affected by the treatment of 400 μmol/L OA with 75—125 μg/mL silymarin in presence for 24h (P>0.05). The intracellular lipid content of hepatocytes decreased significantly after the treatment of 400 μmol/L OA with 100—150 μg/mL silymarin for 24h by Oil Red O stain (P<0.05). Compared with the OA group, SM100 group showed time-dependent trend on the decreasing lipid accumulation (P<0.05). Reduced glutathione (GSH) contents were higher in SM100 group than those in the OA group. The expressions of fatty acid synthase(FAS) and stearoyl-CoA desaturases 1 (SCD1) mRNA were significantly downregulated in SM100 group compared with those in the OA group (P<0.05). These results demonstrated silymarin exerted an inhibitory effect on lipid accumulation by decreasing lipogenesis, and enhanced antioxidative ability in grass carp hepatocytes. Silymarin may shed light on the prevention of fatty liver.
Silymarin; Lipid accumulation; Hepatocyte; Grass carp; Oleic acid
S963.7
A
1000-3207(2017)06-1301-10
2017-01-04;
2017-03-17
陕西省水产健康生态养殖技术集成与示范(2014-TS-36)资助 [Supported by the Technical Integration and Demonstration of Aquaculture Health Ecology in Shaanxi Province (2014-TS-36)]
萧培珍(1980—), 女, 山西忻州人; 博士研究生在读; 主要研究方向为水生生物研究方法与技术。E-mail: peizhenxiao2012@163.com
吉红(1967—), 男, 河南灵宝人; 博士, 教授, 博士生导师; 主要研究方向为水产动物营养与饲料。E-mail: jihong@nwsuaf.edu.cn
