四个罗非鱼选育品种抗链球菌病能力差异研究
2017-11-29祝璟琳邹芝英李大宇薛良义
祝璟琳 邹芝英 李大宇 肖 炜 徐 跑 杨 弘 薛良义
(1. 宁波大学海洋学院, 宁波 315211; 2. 中国水产科学研究院淡水渔业研究中心,农业部淡水渔业和种质资源利用重点实验室, 无锡 214081)
四个罗非鱼选育品种抗链球菌病能力差异研究
祝璟琳1,2邹芝英2李大宇2肖 炜2徐 跑2杨 弘2薛良义1
(1. 宁波大学海洋学院, 宁波 315211; 2. 中国水产科学研究院淡水渔业研究中心,农业部淡水渔业和种质资源利用重点实验室, 无锡 214081)
为筛选出抗病力优良的罗非鱼品种, 以奥利亚罗非鱼“夏奥1号”、尼罗罗非鱼“99”埃及品系、吉富罗非鱼“中威1号”和奥尼罗非鱼为研究对象, 33℃水温暂养7d后分别进行无乳链球菌人工感染实验, 连续7d统计累计死亡率, 并于人工感染后0、24h、48h和72h采集血液和组织样本, 研究这4个罗非鱼选育品种抗链球菌病能力的差异。结果显示: 感染7d后奥尼罗非鱼的累计死亡率最低; 奥尼罗非鱼的谷草转氨酶(AST)感染前后始终都低于其余3个品种罗非鱼(P<0.05); 埃及尼罗和奥尼在感染72h后球蛋白(GLO)分别显著升高1.13倍和1.41倍;奥尼罗非鱼白蛋白/球蛋白(A/G)在感染前后没有显著性变化(P>0.05), 而其余3个品种罗非鱼A/G比值在感染后都显著性降低(P<0.05); 埃及尼罗的碱性磷酸酶(AKP)在感染72h后显著降低(P<0.05), 奥利亚和吉富的AKP表现为先上升后下降, 奥尼的AKP感染前后没有显著性变化(P>0.05); 各品种罗非鱼血清中的乳酸脱氢酶(LDH)感染后都显著升高(P<0.05); 奥利亚、吉富和奥尼罗非鱼的超氧化歧化酶(SOD)感染48h时都显著升高(P<0.05); 奥尼罗非鱼在感染前后溶菌酶(LZM)活性都显著高于其余3个品种罗非鱼(P<0.05)。组织病理学结果显示:吉富和奥尼肝细胞水肿变性, 而奥利亚和埃及尼罗出现大面积肝细胞脂肪变性; 每个品种罗非鱼均呈现严重的脾炎, 奥利亚、埃及尼罗和吉富的脾脏中大量铁血黄素沉积; 每种罗非鱼呈现不同程度的肾小球萎缩, 肾小管上皮细胞变性、坏死。研究表明奥尼罗非鱼抗链球菌病能力最强, 感染后血清中AST水平与肝受损程度呈一定的正相关, LZM水平和罗非鱼抗链球菌病能力呈一定的正相关。
品种; 罗非鱼; 无乳链球菌; 生化指标; 溶菌酶; 抗病力; 组织病理
罗非鱼(Oreochromisspp.)自1956年开始引进我国, 现已成为我国第六大养殖鱼类, 吉富罗非鱼(Oreochromis niloticus♀×Oreochromis niloticus ♂)和奥尼罗非鱼(Oreochromis niloticus♀×Oreochromis aureus♂)是目前的主要养殖品种。“中威1号”新品种是吉富罗非鱼的代表性品种之一, 是以2006年从世界渔业中心新引进的60个家系吉富罗非鱼为原始亲本, 采用家系选育和BLUP育种值评价技术通过5代连续选育获得[1]。奥尼罗非鱼通常以尼罗罗非鱼♀×奥利亚罗非鱼♂通过杂交育种途径获得, 其亲本尼罗罗非鱼(Oreochromis niloticus)和奥利亚罗非鱼(Oreochromis aureus)以群体选育为主。
目前鱼类的选育指标以生长指标作为主要衡量指标, 而对抗逆性和健康状况指标相对考虑较少。很多学者认为血液学指标评价对评估野生和养殖鱼类的健康状态至关重要[2—4]。血液学指标因为能提供鱼体应激程度, 代谢异常, 生殖机能障碍和疾病的基本信息, 可作为鱼体生理和病理变化的较好指示指标[5]。而对病原菌感染后的鱼体进行组织病理学研究, 有利于疾病的诊断, 并为研究病原的感染机制提供依据[6]。Chen等[7]研究了罗非鱼感染创伤弧菌(Vibrio vulnificus)和海豚链球菌(Streptococcus iniae)后的血清生化指标和病理变化之间的关联, 发现肝脏、肠和肾的病理受损严重程度和谷丙转氨酶(ALT)、谷草转氨酶(AST)呈正相关, 而和Na+、Cl–、胆固醇和总蛋白呈负相关。徐晓津等[8]对大黄鱼(Larimichthys crocea)感染哈维氏弧菌(Vibrio harveyi)后血液生化指标的变化及组织病理学进行研究, 发现血清指标的测定可以作为大黄鱼哈维氏弧菌病细菌感染的指标, 病鱼的肝、肾等发生了严重病变, 肝、肾功能不全。目前罗非鱼高密度、高集约化养殖方式导致链球菌病频繁暴发[9],其病原菌2008年前以海豚链球菌为主, 2008年后以无乳链球菌(Streptococcus agalactiae)为主[10]。国内外研究表明, 罗非鱼的生长最适宜温度是29—31℃,水温高于32℃时, 罗非鱼更容易感染无乳链球菌[6,9]。本文以奥尼罗非鱼及其亲本奥利亚罗非鱼和埃及尼罗罗非鱼为对象, 并与吉富罗非鱼相比较, 研究这4个罗非鱼选育品种在水温33℃时抗链球菌能力的差异, 初步筛选出抗病力优良的罗非鱼品种, 探索罗非鱼抗病机理, 并了解选育途径对鱼类抗病力的影响。
1 材料与方法
1.1 无乳链球菌
病原菌保存于本实验室, 编号LB110808-2, 经16S rDNA分子鉴定为无乳链球菌(GenBank登录号:JQ990153)。
1.2 实验用鱼
奥利亚罗非鱼、埃及尼罗罗非鱼、吉富罗非鱼和奥尼罗非鱼均来自农业部罗非鱼遗传育种中心, 奥利亚罗非鱼为“夏奥1号”新品种(登记号: GS-01-002-2006), 鱼体质量为(60.71±5.63) g; 尼罗罗非鱼为1999年引自埃及农业部和农垦部水产研究中心实验室的埃及品系, 鱼体质量为(59.65±4.59) g;奥尼罗非鱼(登记号: GS-02-001-1996)为埃及尼罗♀ד夏奥1号”奥利亚罗非鱼♂的杂交子一代, 鱼体质量为(63.65±4.84) g; 吉富罗非鱼为“中威1号”新品种(登记号: GS-01-003-2014), 鱼体质量为(65.38±5.27) g。人工感染实验前在实验室分别于(33±1)℃水温下暂养7d, 养殖桶体积为360 L, 每天投喂2次。
1.3 人工感染实验
将经鉴定的无乳链球菌原种从冰箱中取出, 复壮后接种于脑心浸液液体培养基(BHI)中, 28℃200 r/min扩大培养24h后, 4000 r /min离心 5min, 用无菌的8.5 g/L NaCl溶液洗涤后配成1.5×109CFU/mL的菌悬液原液。开展人工感染实验Ⅰ研究4个罗非鱼选育品种对无乳链球菌的抗病力差异, 同时开展人工感染实验Ⅱ研究低浓度腹腔注射无乳链球菌后对4个罗非鱼选育品种的血清生化指标和组织病理的影响。
人工感染实验Ⅰ: 将菌悬液原液用8.5 g/L无菌NaCl溶液稀释成1.5×108CFU/mL的菌液, 每个品种设置3个养殖桶, 每桶10尾, 每尾鱼腹腔注射0.3 mL菌液。对照组注射等量的8.5 g/L NaCl溶液。攻毒后连续7d观察记录死亡尾数, 并及时捞出死鱼。
人工感染实验Ⅱ: 将菌悬液原液用8.5 g/L无菌NaCl溶液稀释成1.5×107CFU/mL的菌液, 每个品种设置3个养殖桶, 每桶20尾, 每尾鱼腹腔注射0.3 mL菌液, 同时设置相应的对照组注射等量的8.5 g/L NaCl溶液。
实验期间溶解氧保持在5 mg/L以上, 水温(33±1)℃, 实验期间不投喂。人工感染3d后每个罗非鱼选育品种随机取濒死的罗非鱼解剖, 无菌操作取脑和肾脏组织在血平板上分离、纯化病原菌, 并用梅里埃API 20 Strep试剂条进行快速鉴定。
1.4 采样与处理
在人工感染实验Ⅱ中, 鱼感染0、24h、48h和72h分别从每个养殖桶中取2尾鱼, 每个时间点每个罗非鱼选育品种共6尾鱼用MS-222(200 mg/L)快速麻醉, 进行尾静脉取血, 室温静置2h后4000 r/min离心10min分离血清, 保存于–20℃冰箱中。同时取感染72h后4个罗非鱼选育品种的肝脏、脾脏和肾脏用波恩氏液固定后进行组织病理学观察。
1.5 血清生化指标测定
每个品种的血清在日立7600全自动生化分析仪上检测下列指标: 谷丙转氨酶(ALT)、谷草转氨酶(AST)、白蛋白(ALB)、球蛋白(GLO)和乳酸脱氢酶(LDH)试剂盒购自日本和光纯药工业株式会社, 碱性磷酸酶(AKP, 试剂盒购自四川迈克生物科技股份有限公司, 超氧化歧化酶(SOD)试剂盒购自宁波美康生物科技有限公司。溶菌酶(LZM)试剂盒购自南京建成生物工程研究所, 具体操作按照使用说明进行。
1.6 组织病理学观察
[11]的方法, 将组织从固定液里取出,用70%酒精洗涤至无色; 组织依次进行梯度脱水;二甲苯透明; 石蜡包埋; KD2258型切片机连续切片,厚度为4—7 μm; 脱蜡和水化; 苏木精-伊红(HE)染色后将切片放入梯度酒精里脱水和透明; 中性树胶封片后用尼康80i显微镜观察并拍照保存。
1.7 数据分析
数据利用Excel 2007软件进行初步处理, 再用SPSS 18.0软件进行单因素方差(One-Way ANOVA)分析, Duncan’s法多重比较检验差异性, 用Origin 8.0软件作图,P<0.05表明差异显著。实验数据以平均值±标准差(Mean±SD)表示。
2 结果
2.1 四个罗非鱼选育品种抗链球菌病能力差异比较
在人工感染后, 4个品种的濒死罗非鱼都表现出全身发黑, 游姿失衡等链球菌病的典型症状, 在感染3d后一些濒死罗非鱼显示角膜混浊, 突眼等现象, 解剖鱼体后发现肝脏充血、脾脏充血肿大等,无菌操作分离的细菌经API 20 Strep鉴定为无乳链球菌。人工感染实验Ⅰ中, 对照组均没有发现罗非鱼死亡, 而试验组感染3d后奥尼罗非鱼的累计死亡率(40%)和奥利亚罗非鱼(50%)差异不显著(P>0.05), 但显著低于吉富罗非鱼(76.67%)和埃及尼罗罗非鱼(96.67%)(P<0.05)。感染4d后奥利亚罗非鱼累计死亡率为73.33%, 显著高于奥尼罗非鱼(46.67%)(P<0.05)。感染7d后奥尼罗非鱼的累计死亡率(53.33%)显著低于吉富罗非鱼(86.67%)、奥利亚罗非鱼(90%)和埃及尼罗罗非鱼(96.67%)(P<0.05), 而奥利亚罗非鱼、埃及尼罗罗非鱼和吉富罗非鱼之间的累计死亡率差异不显著(P>0.05)(图1)。
2.2 四个罗非鱼选育品种感染无乳链球菌后血清谷丙转氨酶和谷草转氨酶活力的变化
由表1可知, 埃及尼罗罗非鱼和奥尼罗非鱼的血清谷丙转氨酶(ALT)感染前后没有显著性变化(P>0.05), 而奥利亚罗非鱼表现为先上升后下降, 吉富罗非鱼却一直保持上升趋势, 但埃及尼罗罗非鱼的ALT在感染前就显著高于其余3个品种(P<0.05),感染72h后奥利亚罗非鱼和奥尼罗非鱼的ALT活力显著低于埃及尼罗和吉富罗非鱼(P<0.05)。奥利亚和吉富罗非鱼在感染24h时AST就显著升高(P<0.05), 而埃及尼罗和奥尼罗非鱼的AST在感染48h后才显著升高(P<0.05), 但埃及尼罗罗非鱼的AST在感染前就显著高于其余3个品种的罗非鱼(P<0.05), 而奥尼罗非鱼的AST活力在感染前后每个时间点都比其余3个品种罗非鱼要低(P<0.05)。
2.3 四个罗非鱼选育品种感染无乳链球菌后血清球蛋白和白蛋白/球蛋白的变化
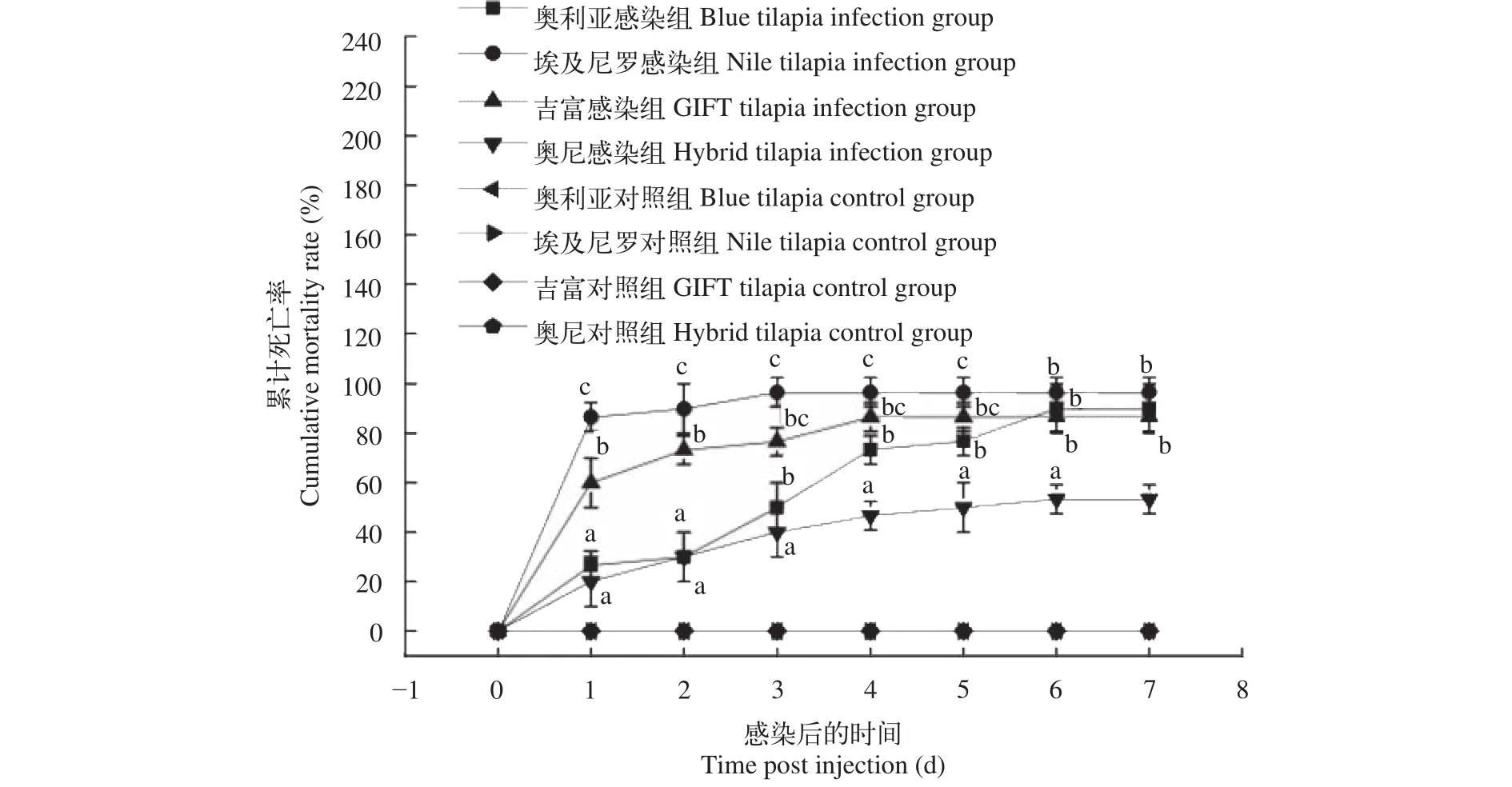
图1 四个罗非鱼选育品种感染无乳链球菌后的累计死亡率Fig. 1 The cumulative mortality of four Oreochromis spp. bleeding species infected by S. agalactiae

表1 四个罗非鱼选育品种感染无乳链球菌后血清的谷丙转氨酶和谷草转氨酶的变化Tab. 1 The comparison on serum glutamic-pyruvic transaminase and glutamic-oxaloacetic transamnase activities of four Oreochromis spp.bleeding species infected by S. agalactiae (n=6; x±SD)

表2 四个罗非鱼选育品种感染无乳链球菌后血清的球蛋白和白蛋白/球蛋白的变化Tab. 2 The comparison on serum globulin and albumin/globulin activities of four Oreochromis spp. bleeding species infected by S.agalactiae (n=6; x±SD)
由表2可知, 埃及尼罗罗非鱼和奥尼罗非鱼在感染72h后血清GLO水平分别显著升高1.13倍和1.41倍(P<0.05), 但感染前奥尼罗非鱼GLO水平显著低于埃及尼罗罗非鱼(P<0.05), 而奥利亚罗非鱼和吉富罗非鱼GLO水平在感染前后没有显著性差异(P>0.05), 感染72h后各品种之间GLO水平没有显著性差异(P>0.05); 奥尼罗非鱼A/G在感染前后没有显著性变化(P>0.05), 而奥利亚罗非鱼在感染48h后显著降低(P<0.05), 埃及尼罗罗非鱼和吉富罗非鱼A/G在感染72h后显著性降低(P<0.05)。
2.4 四个罗非鱼选育品种感染无乳链球菌后血清碱性磷酸酶和乳酸脱氢酶的变化
由表3可知, 埃及尼罗罗非鱼的AKP在感染72h后显著降低(P<0.05), 奥利亚和吉富罗非鱼的AKP表现为先上升后下降, 在感染24h时达到峰值,但在感染72h时和感染前没有显著性差异(P>0.05),奥尼罗非鱼的AKP感染前后没有显著性变化(P>0.05), 并且在感染前后各时间点都显著低于其余品种罗非鱼(P<0.05)。感染前和感染48h后吉富和奥尼罗非鱼的LDH显著低于埃及尼罗和奥利亚罗非鱼(P<0.05)。奥利亚罗非鱼的LDH感染后一直持续显著升高(P<0.05), 在感染后72h其值为感染前的3.22倍, 而埃及尼罗、吉富和奥尼罗非鱼的LDH却先升高后降低, 感染48h后达到峰值, 分别为感染前的2.31倍、6.53倍和7.28倍。
2.5 四个罗非鱼选育品种感染无乳链球菌后血清超氧化物歧化酶和溶菌酶的变化
由表4可知, 奥利亚和奥尼罗非鱼的SOD感染48h后显著升高(P<0.05), 吉富罗非鱼的SOD在感染48h时显著升高(P<0.05), 感染72h后恢复到感染前水平, 埃及尼罗罗非鱼的SOD感染前后没有显著性变化(P>0.05), 但其值都显著高于其余各品种(P<0.05)。奥利亚罗非鱼LZM在感染48h后显著降低(P<0.05), 感染72h后又显著升高到感染前水平,埃及尼罗和奥尼罗非鱼在感染48h后显著升高(P<0.05), 而吉富罗非鱼在感染72h后才显著升高(P<0.05), 奥尼罗非鱼在各时间点LZM活性都显著高于其余品种罗非鱼(P<0.05)。
2.6 四个罗非鱼选育品种感染无乳链球菌后的组织病理学变化
在人工感染无乳链球菌后, 4个罗非鱼选育品种的肝脏、脾脏和肾脏均表现出显著的病理学变化。奥利亚罗非鱼: 与对照组肝脏相比(图版Ⅰ-1),感染组肝脏脂肪变性, 见许多大小不等的脂肪空泡,肝索排列紊乱(图版Ⅰ-2); 与对照组脾脏相比(图版Ⅰ-3), 感染组脾脏含铁血黄素沉积, 脾实质细胞水肿, 淋巴细胞, 单核细胞浸润(图版Ⅰ-4); 与对照组肾脏相比(图版Ⅰ-5), 感染组肾小球轻微萎缩, 肾小管上皮细胞颗粒变性, 并见少量淋巴细胞浸润(图版Ⅰ-6)。埃及尼罗罗非鱼: 与对照组肝脏相比(图版Ⅰ-7), 感染组肝脏严重脂肪变性、坏死, 淋巴细胞浸润(图版Ⅰ-8); 与对照组脾脏相比(图版Ⅰ-9),感染组脾脏含铁血黄素沉积, 周围见淋巴细胞浸润,血浆蛋白渗出呈淀粉样变性(图版Ⅰ-10); 与对照组肾脏相比(图版Ⅰ-11), 感染组肾小球严重萎缩空泡化, 肾小管上皮细胞严重变性、坏死(图版Ⅰ-12)。吉富罗非鱼: 与对照组肝脏相比(图版Ⅰ-13), 感染组肝细胞水肿, 细胞内玻璃样变, 血管壁见淋巴细胞浸润(图版Ⅰ-14), 与对照组脾脏相比(图版Ⅰ-15),感染组脾充血呈淀粉样变性, 含铁血黄素沉积和巨噬细胞浸润(图版Ⅰ-16), 与对照组肾脏相比(图版Ⅰ-17), 感染组肾小球萎缩空泡化, 肾间质淋巴细胞浸润(图版Ⅰ-18); 奥尼罗非鱼: 与对照组肝脏相比(图版Ⅰ-19), 感染组肝索排列紊乱, 肝细胞水肿颗粒变性, 静脉周围见纤维样变性(图版Ⅰ-20), 与对照组脾脏相比(图版Ⅰ-21), 感染组脾充血呈淀粉样变性, 大量巨噬细胞浸润(图版Ⅰ-22), 与对照组肾脏相比(图版Ⅰ-23), 感染组肾小球萎缩, 肾小管上皮细胞颗粒变性(图版Ⅰ-24)。
3 讨论
3.1 四个罗非鱼选育品种感染无乳链球菌后抗病力差异分析
目前我国罗非鱼具有稳定遗传性状的品种有11个, 生产上常用的尼罗罗非鱼、奥利亚罗非鱼、“新吉富”罗非鱼(NEW GIFT tilapia,O. niloticus♀×O. niloticus♂)等养殖品种采用群体选育路线, 吉富罗非鱼采用家系选育路线。由于罗非鱼种间杂交后代在一些生产性状上表现出明显杂种优势, 生产中也被广泛采用, 如奥尼杂交罗非鱼。强俊等[12]研究表明, 感染海豚链球菌4d后吉富罗非鱼和“新吉富”罗非鱼累积死亡率显著高于红罗非鱼(Red tilapia,Oreochromisspp.)和埃及尼罗罗非鱼(O. niloticusEgypt strain), 而本文研究表明感染3d后吉富罗非鱼的累积死亡率显著低于埃及尼罗罗非鱼, 但感染4d后两者之间的累积死亡率没有显著性差异,这可能是因为不同的品种对不同链球菌的易感性不同, 或者不同链球菌毒力差异所致。Huang等[13]比较了新吉富罗非鱼, 奥尼罗非鱼和吉奥罗非鱼(NEW GIFTO. niloticus♀×O. aureus♂)对无乳链球菌的抗病力差异, 发现奥尼罗非鱼抗病力最强。柯剑等[14]用嗜水气单胞菌浸泡感染奥利亚、尼罗、奥尼、吉富、莫荷(O. mossambica♀×O. hornorum♂)5个品种罗非鱼, 表明奥利亚和奥尼罗非鱼抗病力相对较好, 本实验显示感染无乳链球菌7d后奥尼罗非鱼的累计死亡率最低。结果表明杂交育种获得的奥尼杂交鱼抗病力不仅超过亲代埃及尼罗罗非鱼和奥利亚罗非鱼, 而且超过了家系选育获得的吉富罗非鱼, 证明了杂交育种是行之有效的品种培育的手段之一, 能显著增强鱼体抗病力。
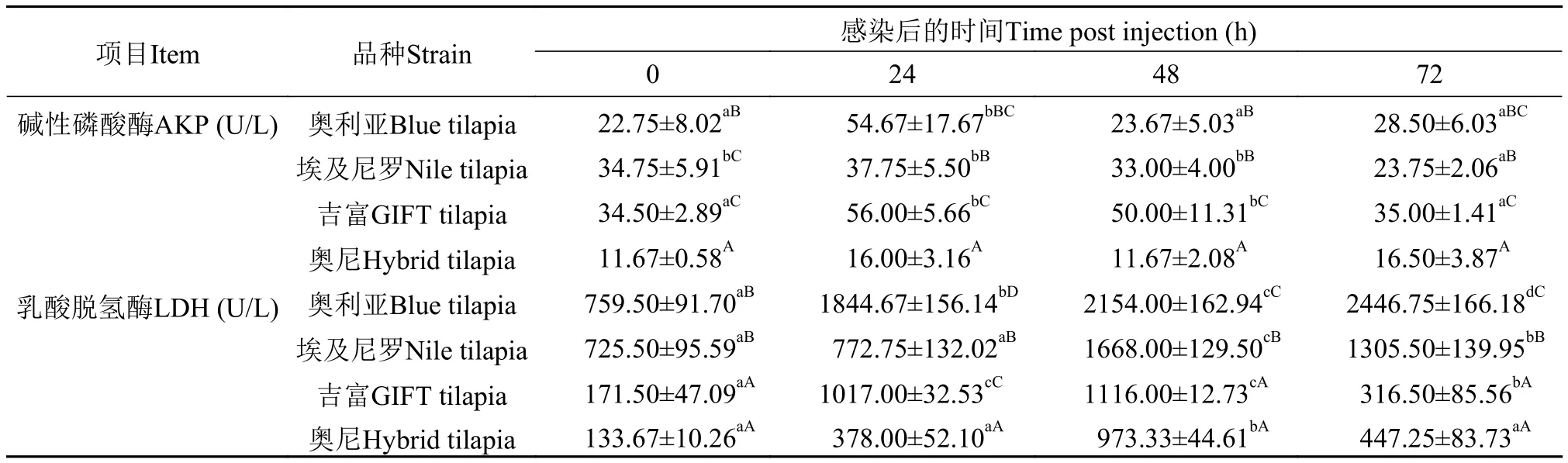
表3 四个罗非鱼选育品种感染无乳链球菌后血清的碱性磷酸酶和乳酸脱氢酶的变化Tab. 3 The comparison on serum alkaline phosphatasel activity and lactic dehydrogenase of four Oreochromis spp. bleeding species infected by S. agalactiae (n=6; x±SD)

表4 四个罗非鱼选育品种感染无乳链球菌后血清的超氧化物歧化酶和溶菌酶的变化Tab. 4 The comparison on serum superoxide dismutase and lysozyme activities of four Oreochromis spp. bleeding species infected by S.agalactiae (n=6; x±SD)
3.2 四个罗非鱼选育品种感染无乳链球菌后血清生化指标的变化
血液生化指标是反映鱼类的生理代谢状态变化和鱼体对病原菌生理响应的有力指标, 能评估鱼体的健康状态[5]。已有研究表明, 鱼体被病原菌感染后血清中ALT和AST含量都会显著增加, 如罗非鱼被创伤弧菌(Vibrio vulnificus)和海豚链球菌感染后[7], 大黄鱼(Pseudosciaena crocea)被哈维氏弧菌(Vibrio harveyi)感染后[8], 鲶(Silurus asotus)被爱德华氏菌(Edwardsiella tarda)感染后[15]。ALT、AST是肝脏受损伤重要的指示酶[16], 本试验中奥利亚罗非鱼和吉富罗非鱼的ALT和AST在感染12h后就显著上升, 埃及尼罗和奥尼罗非鱼的AST在感染48h后才显著升高, 而埃及尼罗和奥尼的ALT感染前后没有显著性变化, 奥尼罗非鱼的AST在感染前后始终都低于其余3个品种罗非鱼, 说明奥尼罗非鱼的抗病力较强, 肝脏受损较轻, 但埃及尼罗的ALT和AST在攻毒前就显著高于其余3个品种的罗非鱼, 可能是因为埃及尼罗罗非鱼相比较其余3种罗非鱼对高温的耐受性较差, 在暂养1周的时候受到高温应激肝脏就已经受损[17]。
球蛋白(GLO)主要在肝的淋巴组织生成, 参与机体免疫反应, 较高的血清球蛋白含量对应着较强的免疫力[18]。强俊等[12]研究表明, 不同品系罗非鱼感染海豚链球菌96h后, 埃及尼罗与红罗非鱼GLO显著上升(P<0.05), 而吉富罗非鱼与新吉富罗非鱼的GLO没有显著变化(P>0.05)。本试验中埃及尼罗罗非鱼和奥尼罗非鱼在感染72h后GLO分别显著升高1.13倍和1.41倍, 而奥利亚和吉富罗非鱼GLO在感染前后没有显著性差异, 说明奥尼罗非鱼对应着较强的免疫力。A/G比值可以衡量机体正常的蛋白质维持程度[12,17]。强俊等[12]研究表明埃及尼罗与红罗非鱼随感染时间的延长, A/G比值基本呈下降趋势。我们之前的研究表明埃及尼罗罗非鱼在高温应激下无乳链球菌感染后A/G的比值攻毒后呈下降趋势[17]。本试验中奥尼罗非鱼A/G在感染前后没有显著性变化, 而奥利亚罗非鱼, 埃及尼罗罗非鱼和吉富罗非鱼A/G比值在感染后都显著性降低, 说明感染无乳链球菌后奥尼罗非鱼体内的蛋白维持程度最好, 能较好地抵抗病原菌的侵染。
非特异性免疫防御机制作为鱼类抵抗病原的第一道屏障, 在维持鱼类机体健康和抗病原防御中具有重要的作用[19]。AKP和LDH是除SOD和LZM之外鱼体血清中的重要的非特异免疫酶。AKP是一种重要的代谢调控酶, 参与钙磷代谢和磷酸基团的转移, 并且能够通过改变病原体的表面结构提高机体对病原体的识别和吞噬能力, 有助于增强鱼体的抗病力[12,17]。不同品系罗非鱼感染海豚链球菌96h血清中AKP显著降低[12], Yu等[15]报道患迟缓爱德华菌病的鲇血清中AKP降低, 推测可能与贫血相关, 这通常是代谢活动减弱的结果。我们之前研究表明高温应激下罗非鱼感染无乳链球菌后AKP表现为先上升后下降[17]。本研究中埃及尼罗罗非鱼的AKP在感染72h后显著降低, 奥利亚和吉富罗非鱼的AKP表现为先上升后下降, 奥尼罗非鱼的AKP感染前后没有显著性变化, 说明无乳链球菌感染对埃及尼罗罗非鱼代谢活动影响最大, 对奥尼罗非鱼影响最小。LDH含量增高, 是病鱼肌肉组织受损的表征[20]。金珊等[21]报道加州鲈(Micropterus salmoides)患白云病后血液中LDH显著上升, 但大黄鱼感染哈维氏弧菌后LDH却没有显著性变化[8],这可能是因为哈维氏弧菌感染对大黄鱼的肌肉损伤影响较小。本试验中感染无乳链球菌后各品种罗非鱼血清中的LDH都显著升高, 感染前和感染48h后吉富和奥尼罗非鱼的LDH显著低于埃及尼罗和奥利亚罗非鱼, 说明无乳链球菌感染对各品种罗非鱼的肌肉都造成了损伤, 而埃及尼罗和奥利亚罗非鱼在试验前暂养阶段高水温就对鱼体肌肉有了一定的损伤。
SOD作为抗氧化酶, 能够清除有危害性的活性氧, 使机体防御过氧化损害, 并与免疫水平相关, 有助于增强机体的免疫功能和抗病能力[17]。高温应激下无乳链球菌感染96h内SOD表现为先升高后降低, 升高的原因可能是鱼体遭到无乳链球菌侵袭后,激活了该诱导酶, 下降则可能是因为病原菌感染而导致活性氧自由基的水平超过了鱼体自身的清除阂值, SOD活性受到了抑制[17]。本试验中奥利亚、吉富罗非鱼和奥尼罗非鱼的SOD感染48h时都显著升高, 说明无乳链球菌感染诱导了SOD的表达, 只有埃及尼罗罗非鱼的SOD感染前后没有显著性变化, 但其值都显著高于其余各品种的值, 我们之前的研究表明埃及尼罗罗非鱼在33℃SOD水平显著高于29℃, 说明高温应激造成埃及尼罗机体损伤,使鱼体SOD升高以抵御损伤[17]。LZM由白细胞释放, 作为是鱼类最常见的体液免疫指标之一, 在抗菌活动中起着重要作用[22]。Huang等[13]报道LZM水平和鱼体抵抗无乳链球菌侵染的能力有一定的相关性, 奥尼罗非鱼比新吉富罗非鱼和吉奥罗非鱼LZM水平更高, 对链球菌感染也有更高的抵抗力,LZM水平可作为抗链球菌品系的选育指标。与此类似的是, 具有更高LZM水平的虹鳟和鲤鱼家系对嗜水气单胞菌具有更强的抵抗力[23,24]。本试验中奥尼罗非鱼在各时间点溶菌酶活性都显著高于其余各品种罗非鱼, 说明奥尼罗非鱼对无乳链球菌的抗病力最强。
3.3 四个罗非鱼选育品种感染无乳链球菌后组织病理的变化
对鱼体进行组织病理学检查, 有利于疾病的诊断[6,17]。我们之前的研究表明罗非鱼感染无乳链球菌后会引起各内脏器官的广泛充血、水肿、变性和炎性细胞浸润, 严重的细胞坏死[11]。高温应激会对鱼体的肝脏、脾脏和肾脏造成轻微病变, 无乳链球菌感染12h后脾脏就发生了严重充血, 感染24h后脾脏呈淀粉样变性, 坏死, 感染48h后肾小球均发生萎缩, 肾小管上皮细胞脱落坏死[17]。在本试验中,人工感染无乳链球菌后, 4个品种罗非鱼的肝脏、脾脏和肾脏均出现不同程度的病理变化, 其中吉富罗非鱼和奥尼罗非鱼肝索排列紊乱, 肝细胞水肿变性,而奥利亚罗非鱼和埃及尼罗罗非鱼肝脏中大面积肝细胞脂肪变性, 最终使肝代谢受到阻碍, 引起肝功能障碍, 其病理学变化程度与血清中AST值有一定的相关性, 感染72h后奥利亚罗非鱼和埃及尼罗罗非鱼血清中的AST值显著高于吉富罗非鱼和奥尼罗非鱼, Chen等[7]也研究表明了罗非鱼感染创伤弧菌与海豚链球菌后肝和肾的病理学变化严重程度与血液中的ALT和AST呈正相关。每个品种的罗非鱼感染无乳链球菌后都引起了严重的脾炎, 大量巨噬细胞或者淋巴细胞等炎性细胞浸润, 这可能是因为脾脏作为免疫器官, 优先响应吞噬链球菌[25]。此外, 奥利亚、埃及尼罗和吉富罗非鱼的脾脏中大量铁血黄素沉积, 说明这3种罗非鱼明红细胞大量被破坏, 溶血严重, 造成脾脏造血功能较低, 导致贫血以及免疫功能降低, 致使机体抵抗力降低[11]。病原菌产生的毒素致使奥利亚罗非鱼和奥尼罗非鱼肾小球轻微萎缩, 肾小管上皮细胞颗粒变性, 埃及尼罗罗非鱼和吉富罗非鱼肾小球严重萎缩空泡化,肾小管上皮细胞严重变性、坏死, 说明链球菌感染造成罗非鱼肾功能障碍。海豚链球菌的感染也能引起罗非鱼肾小管上皮细胞的相似的病变, 造成肾小球的滤过及肾小管的重吸收作用减弱, 肾脏机能降低, 以致体内渗透压及水盐失衡。
综上所述, 奥尼罗非鱼在4个罗非鱼选育品种中抗链球菌病能力最强; 4个罗非鱼选育品种感染无乳链球菌后肝脏、脾脏和肾脏均出现不同程度的病理变化, 血清中AST水平与肝受损程度呈一定的正相关, LZM水平和罗非鱼抗链球菌病能力呈一定的正相关。
参考文献:
[1]Xu P, Dong Z J, Zhu W B. GIFT strain tilapia (Oreochromis niloticus♀×Oreochromis niloticusreochromis nilotic ♂) “Zhongwei No.1” [J].Fisheries of China, 2015,(9): 45—47 [徐跑, 董在杰, 朱文彬. 吉富罗非鱼“中威1号”. 中国水产, 2015, (9): 45—47]
[2]Terry C H, Jenifer L C, Stephen A S. Hematology and plasma chemistry reference intervals for cultured tilapia(OreochromisHybrid) [J].Veterinary Clinical Pathology,2008, 29(1): 7—12
[3]Okorie-Kanu C O, Unakalamba N J. Normal haematological and blood biochemistry values of cultured Heteroclarias hybrid in South East Nigeria [J].Comparative Clinical Pathology, 2014, 24(5): 1—6
[4]Mozanzadeh M T, Yaghoubi M, Yavari V,et al. Reference intervals for haematological and plasma biochemical parameters in sobaity sea bream juveniles (Sparidentex hasta, Valenciennes 1830) [J].Comparative Clinical Pathology, 2015, 24(6): 1501—1507
[5]Clauss T M, Dove A D M, Arnold J E. Hematologic disorders of fish [J].Veterinary Clinics of North America Exotic Animal Practice, 2008, 11(3): 445—462
[6]Wongsathein D. Factors affecting experimentalStreptococcus agalactiaeinfection in tilapia,Oreochromis niloticus[D]. Scotland: The University of Stirling. 2012
[7]Chen C, Wooster G A, Bowser P R. Comparative blood chemistry and histopathology of tilapia infected withVibrio vulnificusorStreptococcus iniaeor exposed to carbon tetrachloride, gentamicin, or copper sulfate [J].Aquaculture, 2004, 239(1—4): 421—443
[8]Xu X J, Xu B, Wang J,et al. Studies on blood chemistry indices and histopathology ofPseudosciaena croceaartificially challenged withVibrio harveyi[J].Journal of Fisheries of China, 2010, 34(4): 618—625 [徐晓津, 徐斌, 王军, 等. 大黄鱼感染哈维氏弧菌后血液生化指标的变化及组织病理学观察. 水产学报, 2010, 34(4):618—625]
[9]Zhu J L, Yang H, Zou Z Y,et al. Isolatiom, identification and drug sensitivity test of patholgenic streptococcus from tilapiasOreochromis niloticuscultured in Hainan[J].Oceanologia et Limnologia Sinica, 2010, 41(4):590—596 [祝璟琳, 杨弘, 邹芝英, 等. 海南养殖罗非鱼(Oreochromis niloticus) 致病链球菌的分离、鉴定及其药敏试验. 海洋与湖沼, 2010, 41(4): 590—596]
[10]Chen M, Li L P, Wang R,et al. PCR detection and PFGE genotype analyses of streptococcal clinical isolates from tilapia in China [J].Veterinary Microbiology, 2012,159(3-4): 526—530
[11]Zhu J L, Zou Z Y, Li D Y,et al. Pathological changes in tilapia (Oreochromis niloticus) naturally infected byStreptococcus agalactiae[J].Journal of Fisheries of China, 2014, 38(11): 1937—1944 [祝璟琳, 邹芝英, 李大宇, 等. 尼罗罗非鱼无乳链球菌病的病理学研究. 水产学报, 2014, 38(11): 1937—1944]
[12]Qiang J, Yang H, Wang H,et al. Studies on blood biochemical indices and expression of hepatic HSP70 mRNA of different tilapia strains artificially challenged withStreptococcus iniae[J].Journal of Fisheries of China,2012, 36(6): 958—968 [强俊, 杨弘, 王辉, 等. 海豚链球菌感染对不同品系罗非鱼血液生化指标和肝脏HSP70 mRNA表达的影响. 水产学报, 2012, 36(6): 958—968]
[13]Huang B F, Zou L L, Xie J G,et al. Immune responses of different species of tilapia infected withStreptococcus agalactiae[J].Journal of Fish Diseases, 2013, 36(8):747—752
[14]Ke J. Bacteria pathogeny isolation, identification and primary comparative study of disease resistance in Tilapia species [D]. Shanghai Ocean University. 2011 [柯剑. 罗非鱼病原菌分离鉴定及不同品系间抗病力初步比较.上海海洋大学. 2011]
[15]Yu J H, Han J J, Park S W. Haematological and biochemical alterations in Korean catfish,Silurus asotus, experimentally infected withEdwardsiella tarda[J].Aquaculture Research, 2010, 41(2): 295—302
[16]Řehulka J, Minařík B. Blood parameters in brook trout Salvelinus fontinalis (Mitchill, 1815), affected by columnaris disease [J].Aquaculture Research, 2007, 38(11):1182—1197
[17]Zhu J L, Li D Y, Zou Z Y,et al. The impact of high temperature stress on serum biochemical parameters and histopathology of tilapiaOreochromis niloticusinfected byStreptococcus agalactiae[J].Journal of Fisheries of China, 2016, 40(3): 445—456 [祝璟琳, 李大宇, 邹芝英,等. 高温应激下无乳链球菌感染对尼罗罗非鱼血清生化指标和组织病理的影响. 水产学报, 2016, 40(3):445—456]
[18]Moran C U H F. Innate and adaptive immunity in teleost fish: a review [J].Veterinarni Medicina, 2011, 56(10):486—503
[19]Magnadottir B. Innate immunity of fish (overview) [J].Fish amp; Shellfish Immunology, 2006, 20(2): 137—151
[20]Zhou Y, Guo W C, Yang Z G,et al. Studies on the blood biochemical indice of “Mad Swim Disease” eel,Anguilla anguillaL [J].Acta Hydrobiologica Sinica, 2002, 26(3):314—316 [周玉, 郭文场, 杨振国, 等. 欧洲鳗鲡“狂游病”血液生化指标研究. 水生生物学报, 2002, 26(3):314—316]
[21]Jin S, Wang G L, Zhao Q S,et al. Preliminary studies on pathogen and hemopathology of the white cloud disease inMicropterus salmoides[J].Acta Hydrobiologica Sinica, 2005, 29(2): 184—188 [金珊, 王国良, 赵青松, 等. 加州鲈白云病的病原及血液病理的初步研究. 水生生物学报, 2005, 29(2): 184—188]
[22]He Z G, Wang J L, Wu Y A. Effect of dietary lipid levels on serum biochemical indeces, immune responses and antioxidant capability of juvenile Furong crucian carp (Furong carp ♀×Red crucian carp♂) [J].Acta Hydrobiologica Sinica, 2016, 40(4): 655—662 [何志刚, 王金龙, 伍远安, 等. 饲料脂肪水平对芙蓉鲤鲫幼鱼血清生化指标、免疫反应及抗氧化能力的影响. 水生生物学报,2016, 40(4): 655—662]
[23]R Ed K H, Fevolden S E, Fjalestad K T. Disease resistance and immune characteristics in rainbow trout (Oncorhynchus mykiss) selected for lysozyme activity [J].Aquaculture, 2002, 209(1-4): 91—101
[24]Ardó L, Jeney Z, Adams A,et al. Immune responses of resistant and sensitive common carp families following experimental challenge withAeromonas hydrophila[J].Fish amp; Shellfish Immunology, 2010, 29(1): 111—116
[25]Chen D, Wang K, Geng Y,et al. Pathological changes in cultured channel catfishIctalurus punctatusspontaneously infected withStreptococcus iniae[J].Diseases of Aquatic Organisms, 2011, 95(3): 203—208
STUDY ON RESISTANT DIFFERENCE AMONG FOUR BLEEDING SPECIES OF TILAPIA OREOCHROMIS SPP. FOLLOWING STREPTOCOCCUS AGALACTIAE CHALLENGE
ZHU Jing-Lin1,2, ZOU Zhi-Ying2, LI Da-Yu2, XIAO Wei2, XU Pao2, YANG Hong2and XUE Liang-Yi1
(1. College of Marine Science, Ningbo University, Ningbo 315211, China; 2. Key Laboratory of Freshwater Fisheries and Germplasm Resources Utilization, Ministry of Agriculture Freshwater Fisheries Research Center,Chinese Academy of Fishery Sciences, Wuxi 214081, China)
The aim of this paper was to identify a tilapia strain that is the most resistant to the infection ofStreptococcus agalactiae. The serum biochemical parameters and histopathology of Blue tilapia (Oreochromis aureus) “Xia’ao No.1”, Nile tilapia (Oreochromis niloticus) “99 strain”, GIFT tilapia (Oreochromis niloticus♀×Oreochromis niloticus♂) “Zhongwei No.1”, Hybrid tilapia (Oreochromis niloticus♀×Oreochromis aureus♂) infected byS. agalac
tiaewere investigated. They were cultured on (33±1) ℃. All fish were acclimated to the laboratory conditions for one week then artificially inducedS. agalactiaeto the fish. The cumulative mortality was recorded at different time points.Blood and tissue samples were collected at 0, 12h, 24h, 48h and 72h after infection. The result showed that the cumulative mortality of Hybrid tilapia was significantly lower than that of other species; Glutamic-oxaloacetic transamnase(AST) activity of Hybrid tilapia was consistently lower than that of other three strains (P<0.05); compared with initial measurement, globulin of Nile tilapia and Hybrid tilapia increased by 1.13 times and 1.41 times respectively at 72h after infection. Albumin/globulin (A/G) index of Hybrid tilapia showed no significantly difference (P>0.05), while that of other three species was significantly lower after infection (P<0.05); Alkaline phosphatase (AKP) activity of Nile tilapia decreased significantly at 72h after infection (P<0.05) while AKP levels of Blue tilapia and GIFT tilapia increased first followed by decrease, and AKP of Hybrid tilapia showed no significantly difference (P>0.05). Lactic dehydrogenase (LDH) of all four strains increased significantly on the progress of disease after infection (P<0.05). Superoxide dismutase (SOD) activities of Blue tilapia, GIFT tilapia and Hybrid tilapia increased significantly at 48h after infection (P<0.05). Lysozyme (LZM) activities of Hybrid tilapia were consistently higher than that of other three strains(P<0.05). Hepatocytes of GIFT and Hybrid tilapia showed hydropic degeneration, while hepatocytes of Blue tilapia,Nile tilapia showed highly vacuolation and macrovesicular steatosis. The spleen of all challenged strains showed had serious splenitis while the spleen of Blue tilapia, Nile tilapia and GIFT tilapia contained a large number of hemosiderin deposition. Renal glomerular atrophy, degeneration and necrosis in renal tubule epithelial cell were apparent after infection. The results indicated that Hybrid tilapia was the most resistant toS. agalactiae; AST in serum was correlated positively with liver damage; LZM level was correlated positively with the anti-Streptococcusability.
Species;Oreochromisspp.;Streptococcus agalactiae; Biochemical parameters; Lysozyme (LZM);Resistance to disease; Histopathology
S941
A
1000-3207(2017)06-1232-10
2016-09-30;
2017-05-23
现代农业产业技术体系建设专项(CARS-49); 中央级公益性科研院所基本科研业务费专项(2015JBFM27、2017JBFZ03、2015JBFM08)资助 [Supported by the Earmarked Fund for China Agriculture Research System (CARS-49); the Special Scientific Research Funds for Central Non-profit Institutes, Chinese Academy of Fishery Sciences (2015JBFM27, 2017JBFZ03,2015JBFM08)]
祝璟琳(1983—), 男, 浙江省武义县人; 博士研究生; 研究方向为罗非鱼育种与病害防治。E-mail: zhujl@ffrc.cn
杨弘, 研究员;E-mail: yangh@ffrc.cn; 薛良义, 教授;E-mail: xueliangyi@nbu.edu.cn
10.7541/2017.153


图版Ⅰ 四个罗非鱼选育品种感染无乳链球菌后肝脏、脾脏和肾脏的组织病理变化PlateⅠ Histopathological changes in liver, spleen and kidney of four Oreochromis spp. bleeding species infected by Streptococcus agalactiae
