翘嘴鳜病原嗜水气单胞菌分子特征及LAMP检测方法的建立
2017-11-29高晓建叶金明杜雪地张晓君邴旭文
张 悦 高晓建 叶金明 陈 楠 杜雪地 张晓君 邴旭文
(1. 扬州大学动物科学与技术学院, 扬州 225009; 2. 扬州市水产生产技术指导站, 扬州 225101; 3. 中国水产科学研究院淡水渔业研究中心, 农业部淡水渔业和种质资源利用重点实验室, 无锡 214081)
翘嘴鳜病原嗜水气单胞菌分子特征及LAMP检测方法的建立
张 悦1高晓建1叶金明2陈 楠1杜雪地1张晓君1邴旭文3
(1. 扬州大学动物科学与技术学院, 扬州 225009; 2. 扬州市水产生产技术指导站, 扬州 225101; 3. 中国水产科学研究院淡水渔业研究中心, 农业部淡水渔业和种质资源利用重点实验室, 无锡 214081)
嗜水气单胞菌(Aeromonas hydrophila)是一种危害鳜鱼养殖生产的重要病原细菌, 为进一步明确该病原菌的分子特征及建立快速检测技术, 实验对引起翘嘴鳜(Siniperca chuatsi)暴发性死亡的病原嗜水气单胞菌进行了致病性、菌株毒力特征研究, 同时以嗜水气单胞菌气溶素基因aerA为分子靶标设计引物, 利用环介导等温扩增技术(Loop-mediated isothermal amplification, LAMP)建立了病原嗜水气单胞菌的快速检测方法。结果表明, 本次引起翘嘴鳜暴发性死亡的病原嗜水气单胞菌半致死浓度为1.6×106CFU/mL, 携带aerA等14种毒力基因, 此14种毒力基因可用于其致病性分析及分子检测。以气溶素基因aerA设计引物进行的环介导恒温扩增, 结果显示可扩增出阶梯状条带, 加入SYBR Green I染色后呈现绿色的阳性反应, 而对照组均未出现任何扩增条带且反应体系呈现橙色, 表明LAMP检测方法对于嗜水气单胞菌检测具有很好的特异性; 灵敏度检测的最低检测限为4.6×101CFU/mL; 10种经人工感染的淡水养殖鱼虾组织匀浆增菌液, 提取DNA后进行LAMP方法检测, 结果均可获得阳性扩增结果, 而对照未染菌组呈阴性, 表明该方法具有较好的应用性, 可应用于嗜水气单胞菌引起的水生动物疾病的检测。
翘嘴鳜; 嗜水气单胞菌;aerA基因; 环介导等温扩增(LAMP)
翘嘴鳜(Siniperca chuatsi)是淡水凶猛肉食性鱼类, 生长速度快, 因其肉质细嫩、营养含量高而深受欢迎, 目前鳜养殖已成为我国水产养殖业一大特色, 但日益严重发生的鳜病害问题, 已然成为制约其发展的不利因素之一。目前鳜发生的病害除传染性脾肾坏死病毒(Infectious spleen and kidney necrosis virus, ISKNV)病导致鳜大批死亡外, 细菌引起的败血症病害也较为严重, 败血症暴发的高峰时期为每年季节交替时段, 该病会造成大批鳜发病死亡, 给养殖户带来巨大的经济损失[1,2]。
近年来江苏扬州地区多家养殖场养殖的翘嘴鳜出现暴发性死亡, 病鱼通常表现为鳃盖出血, 鳃丝腐烂裂开, 部分病鱼鳃部黏液较多、附有大量污泥, 鳃丝末端腐烂; 解剖之后发现肝脏出血, 有腹水;病鱼肝脏、脾脏、肾脏肿大, 脾脏常呈紫黑色; 鳔壁充血, 胆囊肿大, 肠系膜、腹膜及肠壁充血, 肠内没有食物、有较多黏液, 有的肠腔内积水或有气体、肠管粗胀。经调查及对病鱼的检验排除了病毒和寄生虫感染, 经过对患病翘嘴鳜病原菌的分离、形态特征、理化特性、16S rRNA和gyrB基因序列的同源性分析及致病性检验, 确定该病原为致病性嗜水气单胞菌, 分离菌对翘嘴鳜的半致死浓度为1.6×106CFU/mL, 且携带aerA等14种毒力基因。实验以嗜水气单胞菌的气溶素基因aerA序列设计LAMP (Loop-mediated isothermal amplification)引物, 建立针对嗜水气单胞菌的LAMP检测方法, 并分析了其特异性, 灵敏性和实际应用性, 该实验为诊断由嗜水气单胞菌引起的病害提供了快速的可行性的方法。
1 材料与方法
1.1 分离菌致病性检测
将分离自患病翘嘴鳜的供试病原嗜水气单胞菌菌株(G3)接种于普通营养肉汤, 28℃过夜培养后作为供试菌液, 菌液稀释10倍浓度, 分别为2.8×108、2.8×107、2.8×106、2.8×105和2.8×104CFU/mL,经肌肉注射的方法感染培养一周的健康的翘嘴鳜,每个实验组各10尾, 每尾接种0.1 mL; 对照组接种同剂量无菌营养肉汤; 于试验水族箱中隔离养殖,观察记录试验鱼感染后每天的发病与死亡情况, 测定分离菌对翘嘴鳜的半致死浓度,LD50计算参考张庆萍等[3]方法进行。
1.2 分离菌毒力基因检测
细菌模板DNA的制备按煮沸法提取: 取1 mL菌液(供试菌株接种在营养肉汤培养基中过夜培养至对数期)离心1min (12000 r/min), 弃上清, 将菌体悬浮于100 μL的灭菌蒸馏水中, 100℃煮沸10min,冰浴中冷却后离心10min (12000 r/min), 取上清作为PCR模板。
根据已报道的嗜水气单胞菌的毒力基因, 选择气溶素基因(aerA)等14种毒力基因, 引物由上海生物工程技术公司合成(表1), 用以检测分离菌毒力基因的携带情况。PCR反应体系: 2×EasyTaqPCR SuperMix (北京全式金生物技术有限公司) 12.5 μL,上下游引物各0.5 μL, 模版1 μL, 最后加ddH2O至25 μL。PCR程序如下: 94℃ 5min、94℃ 30s、50—60℃ 30s、72℃ 2min, 循环30次后72℃ 延伸7min。用1%琼脂糖凝胶进行电泳分析, 采用凝胶成像系统观察并记录结果。
1.3 嗜水气单胞菌LAMP检测
供试菌株分离自发病翘嘴鳜的供试嗜水气单胞菌G3, 对照副溶血弧菌(Vibrio parahaemolyticus)、鳗弧菌(Vibrio anguillarum)、温和气单胞菌(Aeromonas sobria)、维氏气单胞菌(Aeromonas veronii)、非O1霍乱弧菌(non-O1Vibrio cholerae)、爱德华氏菌(Edwardsiella tarda)均分离自发病水生动物, 本实验室保存供用, 菌株编号及在GenBank登录号见表2。
LAMP引物设计与合成用引物设计软件primer premier5.0和primer explorer V4, 以气溶素基因(aerA)为靶基因(EU484343)设计嗜水气单胞菌LAMP特异性引物(表3), 引物由上海生物工程技术公司。
LAMP扩增条件的优化及特异性检测以一对外引物(Ah-aerA-F3与Ah-aerA-B3)和一对内引物(Ah-aerA-FIP与Ah-aerA-BIP) 对模板进行恒温扩增, 优化嗜水单胞菌LAMP最佳反应体系。以副溶血弧菌、鳗弧菌、温和气单胞菌、维氏气单胞菌、非O1霍乱弧菌及爱德华氏菌为对照菌株, 检验内外引物LAMP扩增的特异性, 通过凝胶电泳观察实验结果。将反应产物加入1 μL SYBR Green I荧光染料后, 轻轻振荡, 观察混合液有无颜色变化。

表1 PCR扩增产物引物Tab. 1 The PCR amplification primers
嗜水气单胞菌LAMP扩增的灵敏性检测菌液稀释法将菌液进行10倍比梯度稀释为: 4.6×1010、4.6×109、4.6×108、4.6×107、4.6×106、4.6×105、4.6×104、4.6×103、4.6×102、4.6×101和4.6×100CFU/mL。取1 mL菌液按上述煮沸法提取DNA作为LAMP扩增的模板, 阴性对照为灭菌去离子水。按照所建立的LAMP检测方法进行灵敏性检测。
嗜水气单胞菌LAMP检测的应用取南美白对虾、罗氏沼虾、罗非鱼、白鲢、鲫、草鱼、鲤、泥鳅、黄颡鱼、团头鲂等10种淡水养殖鱼虾,进行肌肉组织匀浆, 人工染菌后用营养肉汤培养4h,煮沸法提取DNA, 按优化的LAMP方法进行检测。通过琼脂糖凝胶电泳及添加荧光染料SYBR GreenⅠ以检测结果。
2 结果
2.1 供试菌致病性及LD50
供试菌株(G3)肌肉注射感染健康翘嘴鳜, 感染数小时后翘嘴鳜表现为反应迟钝, 鳃部出血, 肝脏、脾脏肿大出血, 且出现体表出血及腹水等病变,然后陆续死亡, 死亡情况见表4; G3对翘嘴鳜的LD50为1.6×106CFU/mL; 对感染死亡的翘嘴鳜进行细菌学检验, 分离检验到其含有大量原感染菌, 表明该分离菌为引起翘嘴鳜大量死亡的病原菌。
2.2 嗜水气单胞菌毒力基因检测结果
经PCR检测该菌株可以扩增出aerA(280 bp)等14个毒力基因。图1为选择的代表菌株G3菌株的14种毒力基因检测结果。

表2 供试菌株来源Tab. 2 Origin of strains used in the study

表3 引物序列Tab. 3 Sequence of primers
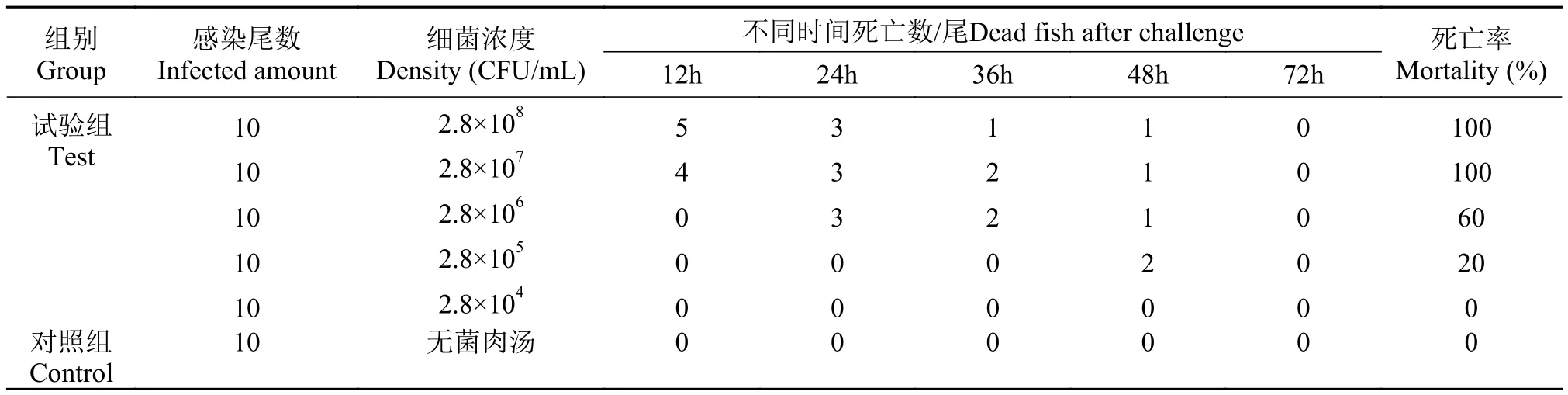
表4 分离菌(G3)的致病性Tab. 4 Pathogenicity of isolates (G3)
2.3 嗜水气单胞菌LAMP检测方法的建立
经过优化之后的 25 μL LAMP反应体系包括dNTP 2.5 μL (10 mmol/L)、10×Thermopol buffer 2.5 μL、甜菜碱4 μL (5 mol/L)、Mg2+2 μL (25 mmol/L), 引物FIP、BIP各2 μL (10 μmol/L), F3、B3各0.5 μL (10 μmol/L)、Bst DNA酶1 μL (8000U)、DNA模板2 μL, ddH2O补足至25 μL; LAMP的反应条件即在65℃条件下保持60min, 之后80℃终止反应10min。
2.4 嗜水气单胞菌LAMP检测的特异性扩增结果
应用上述反应程序, 以一对外引物(Ah-aerAF3与Ah-aerA-B3)和一对内引物(Ah-aerA-FIP与AhaerA-BIP)分别对嗜水气单胞菌和6株对照致病菌进行LAMP扩增, 结果显示嗜水气单胞菌可扩增出阶梯状条带且经SYBR Green I染色后呈现绿色的阳性反应, 而其他6株对照病原菌均未出现任何扩增条带且经SYBR Green I染色后呈现橙色的阴性反应(图2、图3), 该结果表明所建立的嗜水气单胞菌LAMP检测方法特异性较强。
2.5 嗜水气单胞菌LAMP检测的灵敏度
10倍系列稀释嗜水气单胞菌液提取DNA后, 按2.3建立的LAMP检测方法进行灵敏性检测, 结果表明嗜水气单胞菌菌体浓度自4.6×1010至4.6×101CFU/mL结果显示可扩增出阶梯状条带(图4), 加入SYBR Green I染色后呈现绿色的阳性反应, 而对照组均未出现任何扩增条带且反应体系呈现橙色(图5)。本实验建立的LAMP检测嗜水气单胞菌灵敏度为4.6×101CFU/mL。

图1 嗜水气单胞菌毒力基因PCR扩增结果Fig. 1 The result of virulence genes of A. hydrophila by PCR amplification
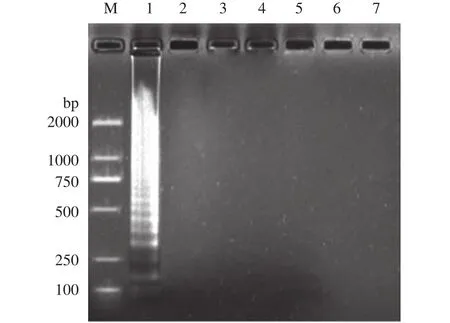
图2 嗜水气单胞菌LAMP检测方法的特异性(电泳)Fig. 2 Specificity of LAMP for detection of A. hydrophila(electrophoresis)

图3 嗜水气单胞菌LAMP检测方法的特异性(SYBR Green I)Fig. 3 Specificity of LAMP for detection of A. hydrophila (SYBR Green I)

图4 嗜水气单胞菌LAMP检测方法的灵敏性(电泳)Fig. 4 Sensitivity of LAMP methods for detection of A.hydrophila (electrophoresis)
2.6 嗜水气单胞菌LAMP检测应用
人工染菌的10种水产品组织匀浆增菌液, 提取其DNA后进行LAMP检测。LAMP检测电泳结果显示人工染菌组均呈现阶梯状条带, 结果为阳性。对照组未染菌组均无电泳条带(图6), 加入SYBR GreenⅠ染色后,人工染菌组呈现绿色的阳性反应,而对照组呈现橙色的阴性反应(图7), 结果表明所建立的LAMP检测方法准确测出感染的嗜水气单胞菌样品。
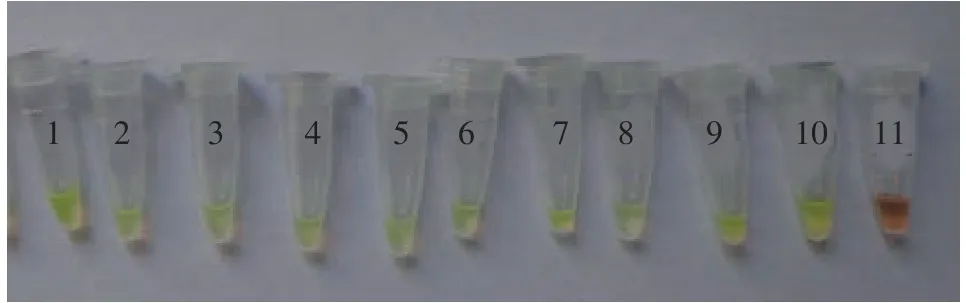
图5 嗜水气单胞菌LAMP检测方法的灵敏性(SYBR Green I)Fig. 5 Sensitivity of LAMP methods for detection of A.hydrophila (SYBR Green I)
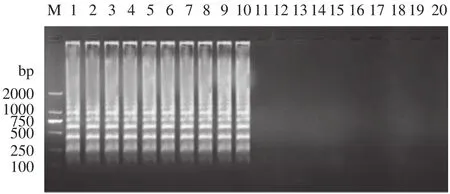
图6 嗜水气单胞菌的LAMP检测应用(电泳)Fig. 6 Application of LAMP for detection of A. hydrophila(electrophoresis)
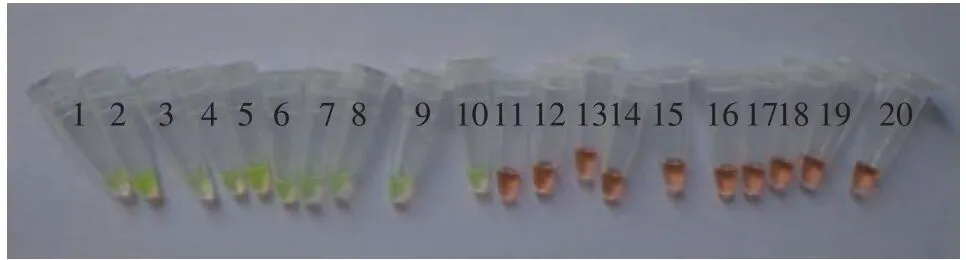
图7 嗜水气单胞菌的LAMP检测应用(SYBR Green I)Fig. 7 Application of LAMP for detection of A. hydrophila(SYBR Green I)
3 讨论
嗜水气单胞菌隶属于弧菌科、气单胞菌属, 是水产动物细菌性疾病的重要病原菌之一[13], 该菌近年来已发展成为能够引起多种水生动物感染的细菌性传染病原, 可引起鲢、鳙、团头鲂、鳊、鲮、鳗、银鲫、异育银鲫、草鱼及鳜等多种淡水养殖鱼类发生细菌性败血症[14], 该菌引起的疾病在我国养鱼史上被记载为危害鱼的年龄范围最大(从夏花鱼种至食用鱼)、危害鱼的种类最多、流行地区范围最广、造成的损失最大的一种鱼类细菌性病害[15], 造成了水产养殖业的巨大损失; 同时, 该菌为典型的人、畜、鱼共患病原菌[16]。
自然界中嗜水气单胞菌分布广泛, 且对水产养殖动物危害极大[17]。本文从病变的具有典型症状的鳜进行病原菌的分离, 从濒死的鳜的肝脏、肾脏组织中分离到大量优势菌, 经纯化培养, 证实为同一种菌。人工感染实验结果表明嗜水气单胞菌具有较强的致病性, 本文对细菌的16S rRNA和gyrB基因序列进行了系统发育学分析, 运用MEGA软件进行系统进化树构建, 结果显示分离菌株与嗜水气单胞菌具有很高的同源性, 经形态特征、理化特性、16S rRNA和gyrB基因序列的同源性分析及致病性检验, 均表明引起翘嘴鳜暴发性死亡的病原为嗜水气单胞菌。
嗜水气单胞菌有非致病性菌株和致病性菌株之分, 其中后者又可分为强毒株和弱毒株, 而嗜水气单胞菌的致病力大小与菌株所携带毒力基因有关[18]。嗜水气单胞菌众多的毒力基因是否在同一种毒力菌株中全部存在, 或者只有几种存在并发生作用, 均需要进一步研究明确。溶血素、细胞毒性肠毒素、气溶素、细胞兴奋性肠毒素和胞外蛋白酶等被认为是嗜水气单胞菌主要致病性毒力基因,这些毒素有较强的毒性, 是导致机体组织出现溃疡、出血、坏死问题发生的直接原因之一。朱大玲等[19]报道aer和ahp基因与嗜水气单胞菌的毒力存在相关性, 携带aer和ahp基因的菌株可能是强毒株。本研究PCR检测的毒力基因包括aer和ahp两种毒力基因, 同时也检测到lip、act、fla、alt、hly、gcaT、eprCAI、ast、lafA、acg、ela和ompAI等毒力基因, 表明分离株携带嗜水气单胞菌的主要毒力基因。致病性试验中2.8×107CFU/mL浓度的分离株菌液腹腔感染鳜, 48h内鳜全部死亡, 表明该分离株具有很强的致病性。通过毒力基因检测和致病性试验表明溶血素、细胞性肠毒素、气溶素、细胞兴奋性肠毒素等毒力因子为嗜水气单胞菌主要的毒力因子, 且携带这些毒力基因的菌株能够引起疾病的暴发性流行。
本文以为嗜水气单胞菌气溶素基因aerA为靶基因设计了LAMP检测的4对的特异性引物即2对内引物与2对外引物来识别靶基因的6个特定区域,通过特异性、灵敏性及实际应用情况, 建立了病原嗜水气单胞菌的LAMP检测方法。通过琼脂糖凝胶电泳, 观察到产生各种片断长度的茎环结构的扩增产物, 加入SYBR Green I染色后呈现绿色的阳性反应, 而对照组均未出现任何扩增条带且反应体系呈现橙色, 该方法可用于病原嗜水气单胞菌的检验。由于LAMP扩增的阳性反应呈现smear和一些低分子质量的带, 一旦产生非特异性扩增, 便不易鉴别, 因此检测过程应注意外源性DNA污染问题,避免出现假阳性结果, 关注反应的特异性。在分子流行病研究中, LAMP技术相较于PCR法, 它不需要昂贵的PCR热循环仪, 只需要普通的水浴锅或者稳定热源设备即可, 该方法操作简便、耗时短, 非常适用于水生动物疫病即时、现场、快速检测病原体的要求。
[1]Pan H J, Wu S Q, Dong C F,et al. Identification of pathogenicAeromonas hydrophilaGYK1 strain, virulence and hemolysis [J].Journal of Shanghai Fisheries University,2004, 13(1): 23—29 [潘厚军, 吴淑勤, 董传甫, 等. 鳜致病性嗜水气单胞菌GYK1株鉴定、毒力及溶血性. 上海水产大学学报, 2004, 13(1): 23—29]
[2]Zhao H J, Zhang X, Lin C J,et al. Isolation and identification ofAeromonas hydrophilafrom mandarin fish [J].Chinese Journal of Animal Quarantine, 2012, 29(6):54—56 [肇慧君, 张雪, 林长军, 等. 鳜鱼嗜水气单胞菌的分离与鉴定. 中国动物检疫, 2012, 29(6): 54—56]
[3]Zhang Q P, Huang X H, Xie H T. Calculation of LD_(50)and empirical estimation [J].Chinese Journal of Clinical Pharmacology and Therapeutics, 2000, 5(2): 162—163[张庆萍,黄晓辉, 谢海棠. 计算LD_(50)的查表法和经验估算法. 中国临床药理学与治疗学, 2000, 5(2): 162—163]
[4]Liang L G, Xie J. Identification, virulence factor test and drug sensitivity test ofAeromonas hydrophilaofHelicoverpa armigera[J].Chinese Journal of Ecology, 2013,32(12): 3236—3242 [梁利国, 谢骏. 青鱼病原嗜水气单胞菌分离鉴定、毒力因子检测及药敏试验. 生态学杂志, 2013, 32(12): 3236—3242]
[5]Fu G H, Xiao D, Hu K,et al. Multiplex PCR detection and ERIC-PCR molecular typing of virulence genes ofAeromonas hydrophilainCarassius auratus[J].Marine Fishery, 2014, 36(6): 549—556 [符贵红, 肖丹, 胡鲲, 等.鲫源嗜水气单胞菌毒力基因多重PCR检测及ERICPCR分子分型. 海洋渔业, 2014, 36(6): 549—556]
[6]Sen K, Rodgers M. Distribution of six virulence factors inAeromonasspecies isolated from US drinking water utilities: a PCR identification [J].Journal of Applied Microbiology, 2004, 97(5): 1077—1086
[7]Ren Y, Lu C P, Yao H C. Cloning, sequence analysis and detection of an extracellular temperature-labile protease encoding gene (eprJ) fromAeromonas hydrophila[J].Journal of Fishery Sciences of China, 2006, 13(6):924—928 [任燕, 陆承平, 姚火春. 嗜水气单胞菌温敏胞外蛋白酶基因eprJ的克隆与检测. 中国水产科学, 2006,13(6): 924—928]
[8]Wong C Y, Heuzenroeder M W, Flower R L. Inactivation of two haemolytic toxin genes inAeromonas hydrophilaattenuates virulence in a suckling mouse model [J].Microbiology, 1998, 144(2): 291—298
[9]Merino S, Gavín R, Vilches S,et al. A colonization factor(production of lateral flagella) of mesophilicAeromonasspp. is inactive inAeromonas salmonicidastrains [J].Applied amp; Environmental Microbiology, 2003, 69(1):663—667
[10]Han H J, Taki T, Kondo H,et al. Pathogenic potential of a collagenase gene fromAeromonas veronii[J].Canadian Journal of Microbiology, 2007, 54(1): 1—10
[11]Nawaz M, Khan S A, Khan A A,et al. Detection and characterization of virulence genes and integrons inAeromonas veronii, isolated from catfish [J].Food Microbiology, 2010, 27(3): 327—331
[12]Wang H. Comparative study between biological characteristics of the different animal speciesAeromonas veronniand four virulence [D]. Thesis for Master of Science,Jilin Agricultural University, Jilin. 2014 [王惠.不同动物源性维氏气单胞菌的生物特性及四种毒力基因比较研究. 硕士学位论文, 吉林农业大学, 吉林. 2014]
[13]Mou S X, Zhou X, Peng Y Z,et al. Effect of fibrous root ofCoptis chinensisfranch and berberine on the non-specific immunity and resistance againstAeromonas hydrophilainfection in grass carp (Ctenopharyngodon idella)[J].Acta Hydrobiologica Sinica, 2015, 39(2): 267—274[牟绍霞, 周霞, 彭耀宗, 等. 黄连须和小檗碱对草鱼非特异性免疫系统的影响及对嗜水气单胞菌感染的抵抗作用. 水生生物学报, 2015, 39(2): 267—274]
[14]Pang M D, Xie X, Dong Y H,et al. Identification of novel virulence-related genes inAeromonas hydrophilaby screening transposon mutants in a tetrahymena infection model [J].Veterinary Microbiology, 2017, 199: 36—46
[15]Rao J J, Li S S, Huang K H,et al. Establishment of multiple PCR detection method for pathogenicAeromonas hydrophila[J].Journal of Fishery Sciences of China,2007, 14(5): 749—755 [饶静静, 李寿崧, 黄克和, 等. 致病性嗜水气单胞菌多重PCR检测方法的建立. 中国水产科学, 2007, 14(5): 749—755]
[16]Fadl A A, Galindo C L, Sha J,et al. Global transcriptional responses of wild-typeAeromonas hydrophilaand its virulence-deficient mutant in a murine model of infection[J].Microbial Pathogenesis, 2007, 42(5—6): 193—203
[17]Li F J, Wang W Q, Zhu Z Q,et al. Distribution, virulence-associated genes and antimicrobial resistance ofAeromonasisolates from diarrheal patients and water,China [J].Journal of Infection, 2015, 70(6): 600—608
[18]Pridgeon J W, Klesius P H, Song L,et al. Identification,virulence, and mass spectrometry of toxic ECP fractions of West Alabama isolates ofAeromonas hydrophilaobtained from a 2010 disease outbreak [J].Veterinary Microbiology, 2013, 164(2-3): 336—343
[19]Zhu D L, Li A H, Qian D,et al. Advances in virulence genes ofAeromonas hydrophila[J].Journal of Hydrodynamics, 2004, 28(1): 80—84 [朱大玲, 李爱华, 钱冬,等. 嗜水气单胞菌毒力基因的研究进展. 水生生物学报,2004, 28(1): 80—84]
MOLECULAR CHARACTERIZATION AND ESTABLISHMENT OF LAMP DETECTION METHOD OF PATHOGENIC AEROMONAS HYDROPHILA ISOLATED FROM SINIPERCA CHUATSI
ZHANG Yue1, GAO Xiao-Jian1, YE Jin-Ming2, CHEN Nan1, DU Xue-Di1, ZHANG Xiao-Jun1and BING Xu-Wen3
(1. College of Animal Science and Technology, Yangzhou University, Yangzhou 225009, China; 2. Yangzhou Aquatic Product Technical Guidance Station, Yangzhou 225101, China; 3. Key Laboratory of Freshwater Fisheries and Germplasm Utilization,Ministry of Agriculture, Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences, Wuxi 214081, China)
Aeromonas hydrophilaexists in the water body, which can cause many kinds of diseases and huge loss of aquaculture animals to the aquaculture production. The pathogenicity and virulence characteristics of the isolated strain which caused mass mortalities of reared Mandarin fish were studied. The rapid detection methods ofA. hydrophilawere established by the loop-mediated isothermal amplification (LAMP) usingaerAgene as molecular marker. The results showed that theLD50ofA. hydrophilawas 1.6×106CFU/mL, and 14 virulence genes were detected from the isolated strain, which can be biology markers in detecting of pathogenicA. hydrophila. The assay of LAMP for detectingA. hydrophilawas established usingaerAgene as molecular marker. Positive reactions were detected by the stair-step amplified bands, and the green amplified products were observed directly by naked-eye in the reaction tube by addition of SYBR Green I. No any amplified bands and orange color were detected in control group. The results showed that LAMP detection method ofA. hydrophilahad good specificity. The results of sensitivity of LAMP showed that the primers could detectA. hydrophilaat the level of 4.6×101CFU/mL. The artificially infected 10 species of freshwater fishes and shrimps revealed positive amplified results using LAMP detection method, and no-infected 10 samples revealed negative amplified results. The results showed that the LAMP detection method has preferable application, and could be used in rapid diagnose of aquatic animal diseases caused byA. hydrophila.
Siniperca chuatsi;Aeromonas hydrophila;aerAgene; Loop-mediated isothermal amplification (LAMP)
S941.42
A
1000-3207(2017)06-1225-07
2017-01-03;
2017-04-26
江苏省水产三项工程项目(Y2016-33和D2015-15); 江苏省高校自然科学研究重大项目(14KJA240001); 江苏省重点研发计划项目(BE2017311)资助 [Supported by the Projects of Shui Chan San Xiang of Jiangsu Province (Y2016-33, D2015-15); the Major Natural Science Research Program of Jiangsu Higher Education Institutions (14KJA240001); the Key Research and Development Program of Jiangsu Province (BE2017311)]
张悦(1994—), 女, 江苏南京人; 硕士研究生; 主要从事水产动物病害及病原微生物学研究。E-mail: 18861339319@163.com
张晓君, E-mail: zxj9307@163.com; 邴旭文, E-mail: bingxw@ffrc.cn
