日本七鳃鳗胚胎发育及卵黄囊期仔鱼的异速生长
2017-11-29韩英伦马庆华董彦娇欣逄李庆伟
李 军 韩英伦 徐 磊 马庆华 宋 涛 董彦娇 刘 欣逄 越 李庆伟
(1. 辽宁师范大学生命科学学院, 大连 116081; 2. 辽宁师范大学七鳃鳗研究中心, 大连 116081; 3. 辽宁省淡水水产科学研究院,辽宁省水生动物病害防治重点实验室, 辽阳 111000)
日本七鳃鳗胚胎发育及卵黄囊期仔鱼的异速生长
李 军1,2,3韩英伦1,2徐 磊1,2马庆华1,2宋 涛1,2董彦娇1,2刘 欣1,2逄 越1,2李庆伟1,2
(1. 辽宁师范大学生命科学学院, 大连 116081; 2. 辽宁师范大学七鳃鳗研究中心, 大连 116081; 3. 辽宁省淡水水产科学研究院,辽宁省水生动物病害防治重点实验室, 辽阳 111000)
通过观察日本七鳃鳗Lampetra japonica(Martens, 1868)胚胎外部形态和内部组织结构变化, 描述受精卵从卵裂至器官形成以及仔鱼孵出的发育阶段, 采用实验生态学方法研究卵黄囊期仔鱼的异速生长模式。结果表明: 日本七鳃鳗卵子为乳白色, 呈卵圆形; 受精卵卵裂方式为全卵裂; 胚胎发育过程主要包括卵裂期、囊胚期、原肠胚期、神经胚期、头凸期、孵出前期和孵出期, 历时11—12d; 初孵仔鱼为乳白色, 全长约(3.41±0.24) mm,体质量约为0.0006 g。日本七鳃鳗胚胎发育研究可为了解七鳃鳗胚胎发育过程, 早期脊椎动物的起源和发育进化研究提供参考。卵黄囊期内仔鱼身体各部分中, 头长和尾长均表现出快速生长, 同在7 日龄出现生长拐点, 且生长拐点后的生长速率都大于生长拐点前的生长速率; 而仔鱼体长在卵黄囊期内表现出慢速生长。在头部器官中, 吻长、鳃前长和鳃长均表现出快速生长现象, 吻长和鳃长分别在9日龄和8日龄出现生长拐点; 口笠长在3日龄时出现生长拐点, 在生长拐点前为等速生长, 而在生长拐点后表现出快速生长; 眼径和眼鳃间距则分别表现出等速生长和慢速生长。泄殖孔在卵黄囊期内未出现生长拐点, 生长速率相对于全长生长速率表现出快速生长现象。七鳃鳗卵黄囊期仔鱼的异速生长是在长期进化过程中, 适应早期生活环境和独特的生活方式而形成特有的发育机制。
日本七鳃鳗; 胚胎发育; 卵黄囊期仔鱼; 异速生长
七鳃鳗隶属于脊椎动物亚门(Vertebrata)、圆口纲(Cyclostomata)、七鳃鳗目(Petromyzoniformes)、七鳃鳗科(Petromyzonidae), 在地球上已生活约3.5亿年, 是最低等的无颌类脊椎动物之一[1]。七鳃鳗在进化过程中具有特殊地位, 已成为研究脊椎动物起源和进化的关键物种, 是联系无脊椎动物与脊椎动物间的重要阶元。研究表明, 七鳃鳗是研究神经嵴、外胚层基板以及有颌等脊椎动物重要特性起源和进化[2—4]、适应性免疫应答机制起源和演化[5,6]以及脊椎动物脑系统发育[7]的模式动物, 对理解和揭示脊椎动物起源和进化具有重要意义。
胚胎学是研究个体发生过程和规律的科学, 包括形态变化、发生机理以及影响胚胎发育的因素。胚胎学不仅对生产实践有指导作用, 同时对从理论上认识个体发生规律具有重要意义。作为研究脊椎动物起源和发育进化的模式生物[2—4], 胚胎发育是七鳃鳗研究中一个重要领域[8—12]。七鳃鳗胚胎与爪蟾和斑马鱼胚胎具有相似的生物学特性,如双层的卵膜、卵膜透明和卵子个体较大[11], 除此以外, 七鳃鳗怀卵量大, 胚胎发育温度低, 发育时间长等特点, 更适于进行胚胎早期进化研究, 是理想的脊椎动物起源和发育进化研究模型。目前, 对七鳃鳗胚胎发育已有一些研究报道, 如Damas[12]观察Lampetra fluviatilis胚胎发育, Piavis[8]对Petromyzon marinus胚胎发育时期特征进行了描述, Yamazaki等[10]研究Entosphenus tridentatus胚胎发育过程, 但以上研究以七鳃鳗胚胎发育形态学描述为主, 并未对胚胎内部结构的变化开展系统组织学研究。日本七鳃鳗Lampetra japonica(Martens, 1868)是分布在我国3种七鳃鳗中唯一的洄游七鳃鳗[13]。在本研究中结合日本七鳃鳗胚胎发育过程中外部形态和内部组织构造变化, 系统地描绘了日本七鳃鳗胚胎早期发育过程, 为早期脊椎动物的起源和发育进化研究提供参考。
异速生长是指生物体某一特征的相对生长速率不等于第二种特征的相对生长速率, 该现象广泛存在于动植物的生长模式中[14,15]。生物体的特定器官在早期发育中具备比身体整体更快或更慢的生长速率, 以这种异速生长的特征确保重要的器官优先发育, 增加存活的机率, 是动植物长期适应外界环境, 进化保留下来的发育特征和策略[14]。研究日本七鳃鳗卵黄囊期仔鱼早期生长发育, 可以掌握不同器官在不同发育阶段特征、生长速率以及器官发育的基础数据, 了解各器官在发育中所起的重要作用, 解释其在生存环境中某些行为, 具有重要的生态学意义。
1 材料与方法
1.1 实验材料与饲养条件
2015年12月在乌苏里江抚远段捕获生殖洄游的日本七鳃鳗群体为亲本, 于12月至次年4月在循环水养殖水槽暂养, 暂养期间水温为6—10℃。在其繁殖季节, 观察第二性征来鉴别其性腺成熟度,进行人工繁殖。日本七鳃鳗胚胎发育时期参照Piavis[8]。将同一批人工授精获得受精卵为胚胎发育材料, 并辅以两批受精卵作为补充材料, 在解剖镜下, 观察胚胎发育形态特征和记录起始时间, 当其中50%以上胚胎出现某个时期发育特征则记为该发育阶段的起始时间。各发育时期分别随机选取50—100 枚胚胎, 用4%多聚甲醛固定, 4℃保存,待试验结束后, 剔除卵膜, 在解剖镜下观察摄像。试验用水为充分曝气的自来水, 孵化温度控制在(20±1)℃, 每天换等温水2 次, 换水量为孵化缸内水量的1/3, 及时清除死卵。
1.2 日本七鳃鳗的各胚胎发育时期组织切片
参照楼允东和王逸妹[16]的方法固定胚胎, 将50—100枚不同发育时期胚胎用4%多聚甲醛固定,再置于15—20倍体积的Smith氏液中固定16—24h,用流水充分冲洗后, 剔除卵膜。采用冰冻切片方法制作切片, 切片厚度为2.5 μm, 常规HE染色, 中性树胶封片, 拍照, 避光保存。
1.3 日本七鳃鳗卵黄囊期仔鱼的异速生长
选取同一天孵出仔鱼用于试验, 直至仔鱼的卵黄囊完全吸收即为实验结束, 实验周期为16d。仔鱼在养殖缸中(50 cm×50 cm×50 cm)静水养殖(水高为40 cm), 每天取15尾仔鱼, 在解剖镜下观察, 测量以及摄像。试验仔鱼用MS-222 (100 mg/L)麻醉, 在解剖镜下拍照并测量吻长、眼径、眼鳃间距、口笠长、鳃前长、鳃长、头长、体长、尾长、泄殖孔长和全长各形态学指标, 精确至1 μm, 所有量度指标以平行于鱼体水平轴为基准(图1)。养殖温度控制在(20±1)℃, 每天换等温水1 次, 换水量为养殖缸水量的1/3, pH在7.2±0.1, 保持水中溶氧在5.0 mg/L以上。
1.4 数据处理

图1 日本七鳃鳗卵黄囊期仔鱼测量图Fig. 1 Illustration of measurement of Lampetra japonica yolk-sac larvae
2 结果
2.1 日本七鳃鳗胚胎发育
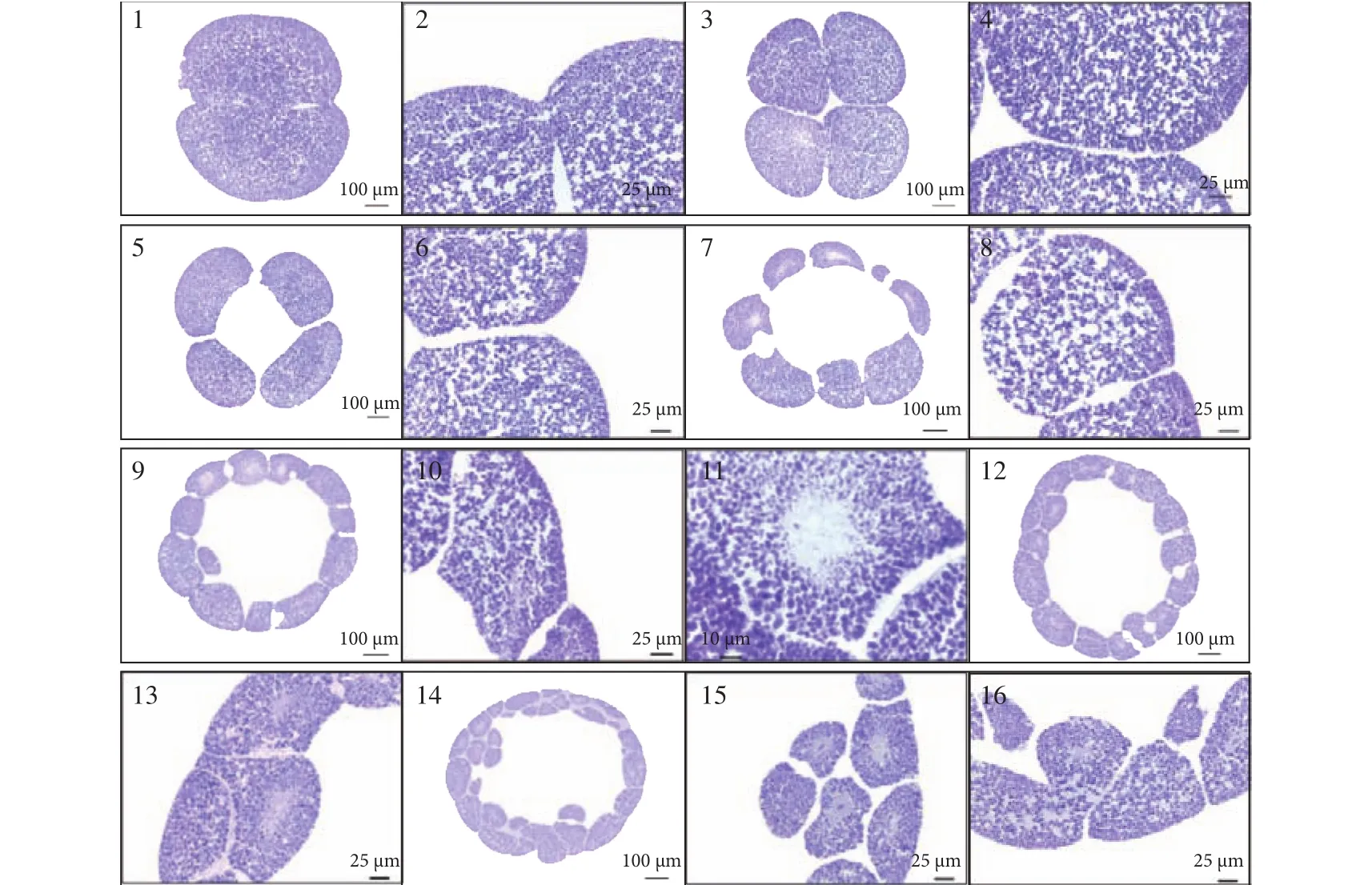
日本七鳃鳗成熟卵子为乳白色, 卵质均匀, 呈卵圆形, 其长径和短径分别为(0.846±0.039)和(0.759±0.026) mm。在卵子受精后, 迅速吸水膨胀,受精膜高高举起, 受精膜外具有胶质膜(图版Ⅰ-1)。
卵裂期受精后约6—8h, 开始第一次卵裂,分裂沟最终将分裂球分成两个大小相似、紧密相连的半球形细胞(图版Ⅰ-2)。第一次卵裂后, 约每2h进行一次卵裂, 分裂球分别进入4细胞期 (图版Ⅰ-3), 8细胞期 (图版Ⅰ-4、5), 16细胞期 (图版Ⅰ-6)和32细胞期(图版Ⅰ-7), 细胞个体逐渐减小, 卵裂沟清晰。卵裂期细胞内均匀分布大量椭圆形卵黄粒,呈蓝紫色(图版Ⅱ-1—11)。在4细胞早期, 分裂球中心出现空隙(图版Ⅱ-3); 随胚胎发育, 细胞个体减小, 空隙增大, 形成一空腔(图版Ⅱ-5), 在以后卵裂期, 分裂球内部空腔体积逐渐增大(图版Ⅱ-7和9)。8细胞期有两种卵裂方式, 一种是在分裂球表面同时出现2条卵裂沟, 与第一次出现的卵裂沟相垂直,分裂成8个细胞, 细胞排成两行, 每行4个(图版Ⅰ-4); 另一种为出现1条卵裂沟, 与第一次和第二次出现的卵裂沟垂直, 分裂球分为上下两层, 每层4个细胞(图版Ⅰ-5)。
囊胚期受精后约16—18h, 进入64细胞期(图版Ⅰ-8)。这一时期分裂球的体积明显增大, 细胞明显减小, 卵裂沟清晰。由于动物极细胞分裂比植物极细胞快, 导致动物极细胞个体明显小于植物极细胞。图版Ⅱ-12表明, 分裂球由单层细胞组成,形成囊胚腔, 细胞内卵黄粒分布均匀(图版Ⅱ-13)。
原肠期受精后约18—20h, 胚胎进入128细胞期, 细胞减小, 细胞界线明显(图版Ⅰ-9), 胚胎发育成由多层细胞组成的原肠胚(图版Ⅱ-14)。约2h后, 胚胎进入256细胞期, 细胞进一步减小, 卵裂沟比较清晰(图版Ⅰ-10)。在128和256细胞期(图版Ⅱ-14—19), 胚胎内部的空腔逐渐减小, 植物极细胞明显大于动物极细胞; 细胞内有大量卵黄粒; 在细胞近中央部位可见蓝紫色细胞核, 稍大于卵黄粒,形状为长条形或近椭圆形; 在细胞核周围, 卵黄粒数量少, 个体较小。受精后约22—70h, 随细胞分裂次数的增加, 细胞个体减小, 细胞数量增加, 细胞间界线模糊, 整个胚胎发育成表面光滑的圆球型(图版Ⅰ-11), 细胞层加厚(图版Ⅱ-20), 细胞间结合紧密(图版Ⅱ-21和22)。受精后约3—5d, 在胚胎植物极一端形成一拱形狭长的裂缝(图版Ⅰ-12), 随动物极细胞的增加、移动和包裹, 胚胎体积明显减小, 胚孔不断的内陷和扩大, 并逐渐向胚胎的腹面移动(图版Ⅰ-13、图版Ⅱ-23—25); 与此同时, 由于胚孔的背侧开始增厚, 胚胎背侧变得平直, 并向动物极一侧延伸(图版Ⅱ-25—28)。
神经胚受精后5—6d, 胚胎进入神经胚期。胚孔背侧增厚已延伸至胚胎最前端, 胚体增厚,从而使胚胎背侧较平直, 呈倒三角形(图版Ⅰ-14和图版Ⅱ-29—31、33、34), 胚胎背部的外胚层不断增厚, 形成神经基板; 神经板两侧外胚层隆起, 出现两条纵褶(神经褶), 在胚胎背中线形成神经沟(图版Ⅰ-14、15和图版Ⅱ-35、36), 此时胚体大约环抱2/3卵黄囊(图版Ⅰ-14和图版Ⅱ-29)。胚孔移至胚体的腹面(图版Ⅰ-14和图版Ⅱ-31—33)。左右神经褶被牵引至背中线合并, 形成神经管。
头凸期受精后6—8d, 胚胎进入头凸期, 头部明显隆起, 凸出于卵黄囊, 在头部的腹面前部可见凹痕, 胚体增厚, 环抱3/4卵黄囊, 神经管在胚胎背部明显凸起, 从头部延伸至胚孔, 胚孔移至卵黄囊末端, 球型的卵黄囊位于胚胎的后部, 约占整个胚胎的1/2(图版Ⅰ-16)。从胚胎的腹面观察, 可见头部咽部凸起, 胚孔位于其头部的下方(图版Ⅰ-17),从胚胎的背面可观测到, 胚胎背部神经管明显凸起(图版Ⅰ-18)。由图版Ⅱ-37、38可见, 头凸期头部的咽部已形成咽囊腔, 在胚体的背部可见肌节。
孵出前期受精后8—11d, 胚胎进入孵出前期, 胚体进一步拉伸, 头部和尾部伸长, 卵黄囊由球型收缩呈长条状, 胚胎在卵膜内卷曲, 不停颤动, 转动(图版Ⅰ-19)。切片显示, 其消化道已开始发育, 咽囊腔进一步扩大, 胚胎具有大大的卵黄囊(图版Ⅱ-39), 在卵黄囊末端可见肌节和神经管(图版Ⅱ-40)。
孵出期在受精后11—12d, 仔鱼破膜。初孵仔鱼为乳白色, 尾部未伸直, 呈“J”型, 侧卧缸底部, 偶尔摆动头部, 极少游动。在初孵仔鱼头部腹面可见两凹痕, 分别为鼻和口的雏形, 同时在头部可见鳃孔雏形。在头部后面, 卵黄囊的前面, 可见心和肝, 但未见心脏跳动。卵黄囊呈长条型。背部肌节明显, 从头部延伸至尾部(图版Ⅰ-20)。初孵仔鱼全长约(3.41±0.24) mm, 体质量约为0.0006 g。
随仔鱼发育, 卵黄囊逐渐减小, 身体发育平直。在第2至第3天, 可见其7对鳃孔, 自前向后, 逐渐减小。头部沉着色素, 在尾部可见肛门雏形。仔鱼孵出后第3至第5天, 可见其心脏跳动, 心脏内充满红色血液。孵出后第5至第7天, 仔鱼自由游动,眼点有色素沉着, 仔鱼钻入沙土中, 营穴居生活。卵黄囊在孵出后15—16d, 完全吸收。
2.2 日本七鳃鳗卵黄囊期仔鱼的异速生长
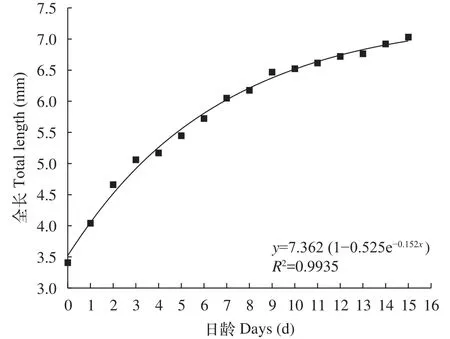
图2 日本七鳃鳗卵黄囊期仔鱼日龄与全长的关系Fig. 2 Correlation between total length and day age of Lampetra japonica yolk-sac larvae
全长和日龄的关系 如图2所示, 日本七鳃鳗卵黄囊期仔鱼的全长随日龄的增加而增长, 全长与日龄的关系符合Brody方程y=7.362(1–0.525e–0.152x),R2=0.9935, 拟合效果较好。初孵仔鱼全长为(3.41±0.24) mm, 在卵黄囊期发育过程中, 卵黄囊随日龄增加而逐渐减小, 经15d生长, 其卵黄囊被完全吸收, 此时仔鱼全长可达(7.03±0.18) mm。
卵囊期仔鱼身体各部分的异速生长: 日本七鳃鳗仔鱼在卵黄囊期发育过程中, 头长、体长和尾长均随日龄增加而增长, 其头长、体长和尾长均表现出异速生长(图3)。仔鱼头长和尾长均在7日龄出现生长拐点[头长(1.472±0.051) mm, 尾长(0.388±0.029) mm, 全长(6.049±0.198) mm], 在生长拐点前其异速生长指数分别为1.352 (P<0.05)和2.265 (P<0.05), 在生长拐点后其异速生长指数分别为2.458 (P<0.05)和3.468 (P<0.05), 头长和尾长生长速率相对于全长生长速率均表现出快速生长, 生长拐点后异速生长指数明显增大。而仔鱼体长在卵黄囊期内未出现生长拐点, 其异速生长指数b=0.602 (P<0.05), 表现出慢速生长。
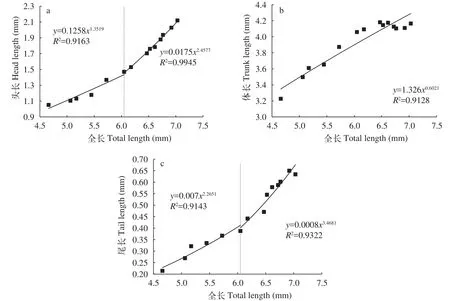
图3 日本七鳃鳗卵黄囊期仔鱼身体各部分异速生长曲线及表达函数Fig. 3 Allometric growth curve and function of body parts of Lampetra japonica yolk-sac larvae

图4 日本七鳃鳗卵黄囊期仔鱼头部各器官的异速生长曲线及表达函数Fig. 4 Allometric growth curve and function of head organs of Lampetra japonica yolk-sac larvae
头部器官的异速生长: 在卵黄囊期内, 日本七鳃鳗仔鱼的头部器官中, 吻长、眼径、眼鳃间距、口笠长、鳃前长和鳃长均随日龄的增加而增长, 但其生长速率相对于全长的生长速率并不相同(图4)。仔鱼吻长的生长拐点出现在9日龄[吻长: (0.481±0.051) mm, 全长: (6.469±0.178) mm], 生长拐点前后的异速生长指数分别为2.929 (P<0.05)和 2.760(P<0.05), 吻长生长速率快于全长生长速率, 表现出异速生长现象 (图4a)。仔鱼眼径的异速生长指数b为1.078 (P>0.05), 表现出等速生长, 数据分析表明日本七鳃鳗眼径在卵黄囊期内未出现生长拐点(图4b)。眼鳃间距在卵黄囊期发育中未出现生长拐点,其异速生长指数(0.577)与1之间具有显著性差异(P<0.05), 表现出慢速生长(图4c)。口笠长在3日龄时出现生长拐点[口笠长: (0.227±0.015) mm, 全长:(5.061±0.149) mm], 在生长拐点前其异速生长指数为1.057 (P>0.05), 表现出等速生长; 而在出现生长拐点后, 其异速生长指数为1.729 (P<0.05), 表现出快速生长(图4d)。鳃前长在卵黄囊期内未出现生长拐点, 其异速生长指数为1.835 (P<0.05), 为快速生长(图4e)。仔鱼的鳃长在8日龄出现生长拐点[鳃长: (0.884±0.050) mm, 全长: (6.176±0.226) mm], 生长拐点后的异速生长指数(2.652,P<0.05)要明显高于生长拐点前的异速生长指数(1.445,P<0.05), 表现为快速生长(图4f)。
其他器官的异速生长: 如图5所示, 日本七鳃鳗仔鱼泄殖孔在卵黄囊期内未出现生长拐点。泄殖孔的异速生长指数b为1.214 (P<0.05), 其生长速率相对于全长生长速率表现出快速生长现象。
3 讨论
3.1 日本七鳃鳗的胚胎发育

图5 日本七鳃鳗卵黄囊期仔鱼泄殖孔异速生长曲线及表达函数Fig. 5 Allometric growth curve and function of cloacal length of Lampetra japonica yolk-sac larvae
生物在其生活史进化中形成不同的生物学特征, 表明生活史多态性[17]。卵径是反映生物生活史进化过程的一个重要的生物学特征, 其大小与环境相关, 是长期适应环境的结果。如生活在淡水中的溪水型七鳃鳗, 其卵径要大于洄游型七鳃鳗卵径[18,19],这可能由于七鳃鳗的产卵场位于河流的上游, 其生存环境恶劣(饵料缺乏, 水温低, 水流速快), 较大卵子能增加生存的机率[20]。Yamazaki等[19]认为, 七鳃鳗表型特征向具有较小体型(繁殖期)、相对较大卵径以及低繁殖力的特征进化。在本研究中, 日本七鳃鳗卵子的形态特征与P. marinus[8]和Lethenteron japonicum[19]相似; 其卵径[长径: (0.846±0.039) mm,短径: (0.759±0.026) mm]与P. marinus卵径[8](1.0±0.2) mm和L. japonicum[19][长径: (1.04±0.10) mm,短径: (0.94±0.11) mm)]相近, 而小于溪水型Lethenteron reissneri[长径: (1.14±0.07) mm, 短径: (1.01±0.08) mm]。
作为研究脊椎动物起源和发育进化的模式生物[2—4], 七鳃鳗早期胚胎发育研究具有重要的意义。本研究结合日本七鳃鳗胚胎发育过程中各时期外部形态特征和胚胎内部结构特点, 划分日本七鳃鳗胚胎发育时期。研究表明, 日本七鳃鳗胚胎发育过程与L. fluviatilis[12]、P. marinus[8]和E. tridentatus[10]相似, 胚胎发育过程主要有卵裂期、囊胚期、原肠胚期、神经胚期和头凸期、孵出前期和孵出期。Piavis[8]认为, 在P. marinus卵裂过程中32细胞期形成由单层细胞围绕的空心分裂球, 囊胚期在64细胞期后, 以分裂球呈光滑的圆球型、胚胎体积增大和动物极透明程度等形态学指标确定囊胚期; 胚胎在囊胚期后进入原肠期, 原肠期标志性事件是胚孔的形成。Yamazaki等[10]仅依据胚胎发育的外部形态特征(分裂球表面光滑程度)确定胚胎囊胚期, 以胚孔形成确定胚胎进入原肠期。囊胚期和原肠期是胚胎发育的两个重要时期。划分这两个时期不仅依据其外部形态特征, 还应结合胚胎内部结构变化特点。囊胚期胚胎内部结构特征是形成由单层细胞包围囊胚腔, 而原肠期主要事件是细胞迁移内置囊胚腔以及后期胚孔发育事件[21]。日本七鳃鳗在64细胞期形成一由单层细胞包围的分裂球, 在随后128细胞期, 由于原肠化作用, 其内部结构发生明显变化, 发生细胞内置事件, 细胞迁移进囊胚腔内部, 原肠胚形成。由日本七鳃鳗64细胞期和128细胞期外部形态和内部结构特征可以确定,分裂球在64细胞期和128细胞期分别进入囊胚期和原肠期。本研究通过观察日本七鳃鳗不同胚胎发育时期外部形态变化, 结合其内部组织构造, 较为系统地描绘了日本七鳃鳗从受精卵卵裂至器官形成以及仔鱼孵出的各个阶段, 从形态和结构2个方面的变化, 了解日本七鳃鳗胚胎发育过程, 为研究早期脊椎动物的起源和发育进化研究提供参考。
日本七鳃鳗的卵裂方式为全卵裂, 这与P. marinus[8]和E. tridentatus[10]卵裂方式完全相同, 与头索动物亚门的文昌鱼的卵裂方式[21]相同, 而与鱼类的端黄卵的卵裂方式[21]不同。早期卵裂是在母型调控下进行的过程, 每个物种的卵裂方式由两个方面决定: (1)卵质中卵黄的含量及其分布情况; (2)卵质中影响纺缍体方位角度和形成时间的一些因素。七鳃鳗属全卵裂的卵裂方式。在其早期胚胎发育过程中, 细胞内含有大量的卵黄粒, 卵黄颗粒大而且数量多, 利用常规的组织固定和切片法, 致使胚胎脆硬, 卵黄粒容易从胚体脱出致使切片破碎, 难于观察胚胎内部的组织结构, 是阻滞七鳃鳗胚胎切片技术发展的关键问题[22], 同时也阻碍七鳃鳗早期胚胎发育和组织学的深入研究。本研究七鳃鳗胚胎采用的是Smith液固定方法。Smith固定液为凝固型固定剂, 可以均匀凝固卵黄粒, 从而避免含有卵黄粒组织和细胞脆硬, 有效地解决胚胎脆硬问题,这是得到胚胎完整组织切片的前提和基础。另外冷冻切片技术适用于科研和常规组织学研究, 减少胚胎处理过程和时间, 可在相对较短的时间内得高质量的切片。本文在日本七鳃鳗胚胎发育研究中采用Smith液固定方法结合利用冷冻切片技术得到了完整的不同发育时期胚胎切片, 不但完善七鳃鳗胚胎切片技术也为动物早期胚胎发育组织学研究提供可借鉴方法。
温度是早期胚胎发育中的一个重要的环境因子。在一定的温度范围内, 不同温度下七鳃鳗胚胎发育时间不同[8], 随温度的增高, 胚胎发育加快, 发育时间缩短, 不同发育时期重叠减小。如表1, 寄生类洄游型七鳃鳗(E. tridentatus、P. marinus和L. japonica)和非寄生类溪水型七鳃鳗(L. reissneri), 在不同温度下, 胚胎发育时间略有不同, 七鳃鳗胚胎进入不同的发育时期的时间有随温度的增高而减少的趋势。

表1 不同七鳃鳗胚胎发育时间Tab. 1 Post-fertilization times to reach successive developmental stages in Lampetra japonica and other lamprey species
3.2 日本七鳃鳗卵黄囊期仔鱼的异速生长
生物体早期发育过程是重要而又复杂的过程,包括形态发生、身体外形、新陈代谢和生活行为等变化[23], 异速生长普遍存在于动植物早期发育过程中[24], 生物个体为适应生活环境, 优先发育重要功能器官, 提高存活率, 在长期进化中形成了的个体发育机制和生存策略。
日本七鳃鳗仔鱼头长和尾长的生长拐点均在7日龄出现, 与其开始营穴居生活时间基本一致, 可能与生活环境和生活方式有关。在生长拐点前, 孵出仔鱼大部分时间侧卧孵化缸的底部, 极少游动。而在生长拐点后, 仔鱼游动能力增强, 游动时整个身体形成了波浪式摆动, 头部在运动中保持着相对稳定而左右摆动, 呈“S”型, 头部和尾部在仔鱼的游动过程中起到重要的作用, 这2个部分快速发育增强仔鱼的游动能力。与头部和尾部不同, 仔鱼躯干部生长则表现为慢速生长, 这种负异速生长模式能有效控制鱼体全长, 减少头部和尾部之间的距离,利于调节身体的平衡, 增强仔鱼的游泳能力, 减少运动代价[25,26]。其次头部是仔鱼早期大脑、视觉、呼吸和摄食器官发育的重要部分, 头部的快速发育保证了重要器官的发育。再次头部和尾部的正异速生长也为仔鱼钻沙土营穴居生活提供了必要的条件。在试验中观察到孵出后第6至第7天, 仔鱼钻入沙土过程中, 先是头部接触缸底部的沙土,随后头部和尾部摆动剧烈, 整个身体钻入沙土中,头部和尾部的快速生长, 大大提高其钻沙土能力,保证其营穴居生活, 是七鳃鳗在进化过程中形成的个体发育机制。在生长拐点后, 头部和尾部异速生长指数比拐点前明显增大, 表明生长速率进一步加快。这可能与营穴居生活有关, 在穴居生活中, 仔鱼在沙土中活动的阻力要远远大于其在水中游动的阻力, 头部和尾部的快速生长发育对仔鱼的活动能力更显重要, 特别是要比生长拐点前(在水中)的生长速率还大, 大大增强其在沙土中的活动能力,适应穴居生活, 提高其生存机率, 是对其生活环境的适应性选择。头部和尾部的这种异速生长现象在其他鱼类中也普遍存在[25—27], 是鱼类长期进化过程中自然选择的结果。日本七鳃鳗仔鱼身体各部分的异速生长为其穴居生活奠定了物质基础, 有助于仔鱼运动和躲避敌害, 适应生存环境。
在日本七鳃鳗仔鱼的头部器官中, 口笠是摄食的重要器官。在穴居生活期间, 卵黄囊耗尽后, 仔鱼开始外源营养期, 以滤食腐植碎片、有机碎屑、浮游动物和浮游植物为生, 经过约3—5年变态成成体[28,29]。仔鱼滤食能力的强弱与口笠直接相关, 口笠的快速生长, 促进口笠的发育, 增强仔鱼滤食能力以获得充足的营养。口笠大小与吻长和和鳃前长密切相关, 吻长和和鳃前长快速发育为口笠的发育供了必要的空间。与口笠生长相一致, 仔鱼泄殖孔在卵黄囊期内也表现出快速生长现象, 消化器官的协调生长, 促进消化系统的发育, 为其从内源性营养向外源性营养的转化提供物质条件。
鳃是日本七鳃鳗呼吸器官, 日本七鳃鳗仔鱼在卵黄囊期内, 鳃长表现出快速生长, 其在8日龄出现生长拐点, 鳃长的生长拐点出现时间与其开始穴居生活的时间基本在同一时期, 生长拐点后的快速生长速率要明显高于生长拐点前的生长速率, 这可能与其生活方式有关。在生长拐点前, 仔鱼在生活在溶解氧较低的水底, 鳃长的快速生长保证仔鱼能够获得足够的溶解氧。而在生长拐点后, 仔鱼开始营穴居生活, 其生活环境中的溶解氧更低, 鳃的快速生长, 促进鳃的发育和完善, 加大水流的交换量,保证仔鱼在低溶氧的环境中获得足够的氧气, 而眼鳃间距的慢速生长则为鳃的快速生长提供了必要的空间。
眼睛是动物重要的感觉器官, 鱼类眼睛能较早完成快速生长阶段, 不仅有利于其寻找食物, 而且有助于其感知和躲避敌害[25,27]。与鱼类不同, 日本七鳃鳗仔鱼眼径在卵黄囊期内表现出等速生长, 这与其生活暗环境有关。日本七鳃鳗仔鱼孵出后在水底短时间营自由生活, 随后开始漫长的穴居生活,主要生活在较暗的环境中, 同时其摄食也以滤食为主, 是一种被动摄食方式, 所以眼睛发育对于七鳃鳗仔鱼早期生存作用较小。
通过对日本七鳃鳗卵黄囊期仔鱼发育研究可知, 在早期发育过程中, 仔鱼的摄食、呼吸和游泳器官均存在异速生长现象, 各种器官共同生长, 协调发育, 获得与其早期生存方式密切相关的各种能力, 仔鱼可在最短时间内适应生活环境, 提高逃避敌害和摄食的能力。这是七鳃鳗在长期进化过程中, 适应环境形成特有的早期发育机制和独特的生活方式, 是其能在残酷的自然界存活的一个重要原因。
[1]Gess R W, Coates M I, Rubidge B S. A lamprey from the Devonian period of South Africa [J].Nature, 2006,443(7114): 981—984
[2]Green S A, Bronner M E. The lamprey: A jawless vertebrate model system for examining origin of the neural crest and other vertebrate traits [J].Differentiation, 2014,87(1—2): 44—51
[3]Nikitina N, Bronner-Fraser M, Sauka-Spengler T. The sea lampreyPetromyzon marinus: a model for evolutionary and developmental biology [J].Cold Spring Harbor Protocols, 2009(1): Pdb.emo113, doi: 10.1101/pdb.emo113
[4]Kuratani S, Kuraku S, Murakami Y. Lamprey as an evodevo model: Lessons from comparative embryology and molecular phylogenetics [J].Genesis, 2002, 34(3):175—183
[5]Amemiya C T, Saha N R, Zapata A. Evolution and development of immunological structures in the lamprey [J].Current Opinion in Immunology, 2007, 19(5): 535—541
[6]Herrin B R, Cooper M D. Alternative adaptive immunity in jawless vertebrates [J].Journal of Immunology, 2010,185(3): 1367—1374
[7]Li Q W, Liu X.Lampetra japonicaResearch in China[M]. Beijing: Science Press. 2011, 6—10 [李庆伟, 刘欣.中国七鳃鳗研究. 北京: 科学出版社. 2011, 6—10]
[8]Piavis G W. Embryological stages in the sea lamprey and effects of temperature on development [J].U.S. Fish and Wildlife Service Fish Bull, 1961, 61: 111—143
[9]Tahara Y. Normal stages of development in the lamprey,Lampetra reissneri(Dybowski) [J].Zoological Science,1988, 5(1): 109—118
[10]Yamazaki Y, Fukutomi N, Takeda K,et al. Embryonic Development of the Pacific Lamprey,Entosphenus tridentatus[J].Zoological Science, 2003, 20(9):1095—1098
[11]Nikitina N, Bronner-Fraser M, Sauka-Spengler T. Culturing lamprey embryos [J].Cold Spring Harbor Protocols,2009(1): pdb.prot5122, doi: 10.1101/pdb.prot5122
[12]Damas H. Recherches sur le developpment deLampetra fluviatilis[J].Archives de Biology, 1944, 55: 1—284
[13]Zhu Y D, Meng Q W. Fauna Sinica: Cyclostomata, Chondrichthyes [M]. Beijing: Science Press. 2001, 21—26 [朱元鼎, 孟庆闻. 中国动物志: 圆口纲 软骨鱼纲. 北京: 科学出版社. 2001, 21—26]
[14]Peters R H. The Ecological Implications of Body Size[M]. New York: Cambridge University Press. 1983,197—198
[15]Niklas K J. Plant allometry: the scaling of form and process [A]. In: Klinkhamer, Peter G L. Trends in Ecology amp;Evolution [C]. Chicago: University of Chicago Press.1994, 274—290
[16]Lou Y D, Wang Y M. Questions about section of fish embryo [J].Chinese Journal of Zoology, 1964, (4):180—181 [楼允东, 王逸妹. 关于鱼类胚胎的切片问题.动物学杂志, 1964, (4): 180—181]
[17]Yamamoto S, Nakano S, Tokuda Y. Variation and divergence of the life-history of Japanese charrSalvelinus leucomaenisin an artificial lake-inlet stream system [J].Japanese Journal of Ecology, 1992, 42: 149—157
[18]Gross M R. Evolution of diadromy in fishes [J].American Fisheries Society Symposium, 1987, 1: 14—25
[19]Yuji Yamazaki, Konno S, Goto A. Interspecific differences in egg size and fecundity among Japanese lampreys[J].Fisheries Science, 2001, 67(2): 375—377
[20]Goto A. A consideration on the adaptation and evolution of life history in the freshwater sculpins [J].Biological Science, 1981, 33: 129—136
[21]Qu S H, Li J Y, Huang Z,et al. Animal Embryology [M].Beijing: People’s Education Press. 1980, 179—271 [曲漱惠, 李嘉泳, 黄浙, 等. 动物胚胎学. 北京: 人民教育出版社. 1980, 179—271]
[22]Richardson M K, Wright G M. Developmental transformations in a normal series of embryos of the sea lampreyPetromyzon marinus(Linnaeus) [J].Journal of Morphology, 2003, 257(3): 348—363
[23]Nogueira L B, Godinho A L, Godinho H P. Early development and allometric growth in hatchery-reared characinBrycon orbignyanus[J].Aquaculture Research, 2014,45(6): 1004—1011
[24]Choo C K, Liew H C. Morphological development and allometric growth patterns in the juvenile seahorse,Hippocampus kudaBleeker [J].Journal of Fish Biology, 2006,69(2): 426—445
[25]Song H J, Liu W, Wang J L,et al. Allometric growth during yolk-sac larvae of Chum salmon (Oncorhynchus ketaWalbaum) and consequent ecological significance [J].Acta Hydrobiologica Sinica, 2013, 37(2): 329—335 [宋洪建, 刘伟, 王继隆, 等. 大麻哈鱼卵黄囊期仔鱼异速生长及其生态学意义. 水生生物学报, 2013, 37(2):329—335]
[26]Gisbert E. Early development and allometric growth patterns inSiberian sturgeonand their ecological significance [J].Journal of Fish Biology, 1999, 54(4): 852—862
[27]Gao X Q, Hong L, Liu Z F,et al. The study of allometric growth pattern of American shad larvae and juvenile(Alosa sapidissima) [J].Acta Hydrobiologica Sinica,2015, 39(3): 638—644 [高小强, 洪磊, 刘志峰, 等. 美洲鲥仔稚鱼异速生长模式研究. 水生生物学报, 2015,39(3): 638—644]
[28]Xie Y H, Li W K, Xie H. Freshwater fishes in northeast region of China [M]. Shenyang: Liaoning Science and Technology Press. 2007, 1—7 [解玉浩, 李文宽, 解涵. 东北地区淡水鱼类. 沈阳: 辽宁科学技术出版社. 2007,1—7]
[29]Yamazaki Y, Goto A. Present status and perspectives on the phylogenetic systematics and speciation of lampreys[J].Japanese Journal of Ichthyology, 2000, 47(1): 1—28
EMBRYOLOGICAL STAGES AND ALLOMETRIC GROWTH DURING YOLKSAC LARVAE OF LAMPETRA JAPONICA (MARTENS)
LI Jun1,2,3, HAN Ying-Lun1,2, XU Lei1,2, MA Qing-Hua1,2, SONG Tao1,2, DONG Yan-Jiao1,2, LIU Xin1,2,PANG Yue1,2and LI Qing-Wei1,2
(1. College of Life Science, Liaoning Normal University, Dalian 116081, China; 2. Lamprey Research Center, Liaoning Normal University, Dalian 116081, China; 3. Liaoning Institute of Freshwater Fisheries Sciences, Liaoning Key Laboratory of Aquatic Animal Infectious Diseases Control and Prevention, Liaoyang 111000, China)
Early embryology of theLampetra japonicahas been studied based largely on external morphology and histology. In current study, ecological experiment was conducted to investigate the allometric growth ofL. japonicayolksac larvae. The results indicated the ovulated egg was creamy-white with the oval shape. The cleavage of zygote was holoblastic cleavage. The early embryology ofL. japonicahad been characterized into cleavage, blastula, gastrula,neural plate and groove, head, prehatching and hatching. The embryo breaks through the fertilization membrane at 11—12 day-post-fertilization. Newly-hatched larvae were (3.41±0.24) mm in total length and about 0.0006 g in weight.Study of the early embryology ofL. japonicamay provide the basis for understanding the origin and evolution development of vertebrates. During yolk-sac stage, head and tail length exhibited positive allometric growth, and trunk exhibited negative allometric growth. The inflection point was at 7 day-post-fertilization for both head and tail length. The head and tail length exhibited positive allometric growth before and after the growth inflection point and the growth was higher post the inflection point. In terms of the dimensions of organs in head, snout length, prebranchial length and branchial length exhibited positive allometric growth. The inflection point appeared at 9 day-post-hatch for snout length and at 8 day-post-hatch for branchial length, respectively. The inflection point of disc length occurred at 3 day-posthatch, and the disc length exhibited isometric allometric growth to the inflection point, then became positive allometric growth. The eye length was characterized by isometric allometric growth and had no inflection point. The postocular length exhibited negative allometric growth. The cloacal slit length exhibited positive allometric increase and hads no inflection point. The allometric growth pattern ofL. japonicayolk-sac larvae enabled rapid development of the organisms which has important function to adapt to the early life stage and increases their survival rate.
Lampetra japonica; Yolk-sac larvae; Early embryology; Allometric growth
Q132.4
A
1000-3207(2017)06-1207-11
2016-11-07;
2017-05-11
国家重大基础研究发展规划(973)计划 (2013CB835304); 全国海洋公益项目(201305016); 国家自然科学基金(31170353、31202020、31601865); 辽宁省教育厅项目(L201683651); 辽宁省高等学校杰出青年学者成长计划(LJQ2014117); 大连市科技计划(2013E11SF056)资助 [Supported by the National Program on Key Basic Research Project (973 Program, 2013CB835304);National Marine Public Projects (201305016); the National Natural Science Foundation of China (31170353, 31202020, 31601865);Liaoning Provincial Department of Education Foundation (L201683651); Colleges and Universities in Liaoning Province Outstanding Young Scholar Growth Plans (LJQ2014117); Dalian Science and Technology Program (2013E11SF056)]
李军(1975—), 男, 辽宁辽阳人; 博士研究生, 高级工程师; 主要研究方向为水产种质资源。E-mail: lj_nwafu@163.com;韩英伦(1985—), 男, 吉林人; 博士, 讲师; 主要研究方向为七鳃鳗免疫防御研究。E-mail: hanyinglun@163.com
逄越(1975—), 女, 辽宁大连人; 副教授, 硕士生导师; 主要从事细胞生物学研究。E-mail: pangyue01@163.com;李庆伟(1955—), 男, 辽宁大连人; 教授, 博士生导师; 主要从事细胞生物学研究。E-mail: liqw@263.net
10.7541/2017.150

图版Ⅰ 日本七鳃鳗胚胎发育PlateⅠ Observation of embryonic development of Lampetra japonica
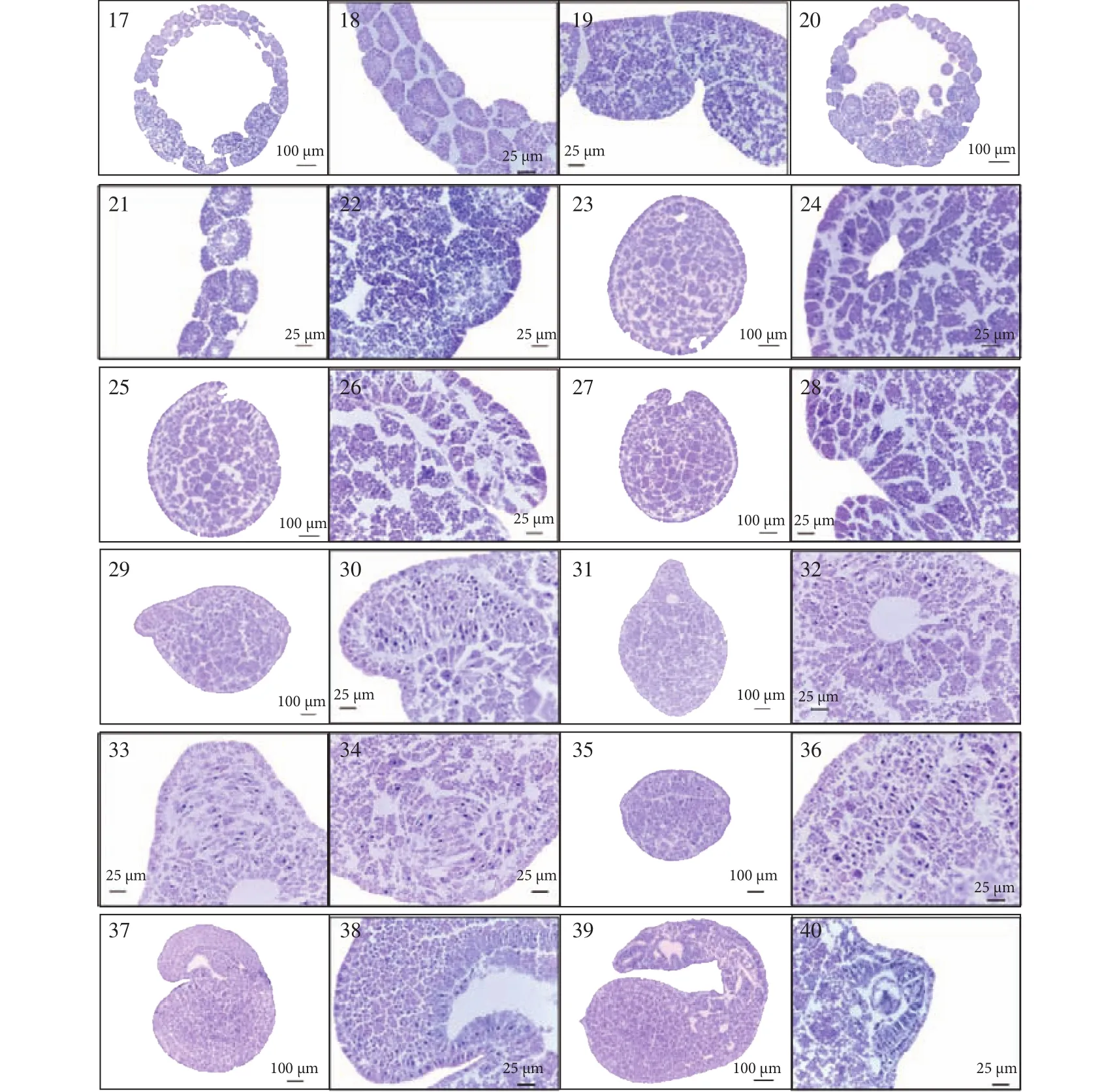
图版Ⅱ 日本七鳃鳗各胚胎时期组织切片PlateⅡ Sagittal section of embryonic development of Lampetra japonica
doi: 10.7541/2017.151
