藻类挥发性有机化合物研究进展
2017-11-29左照江
左照江
(浙江农林大学林业与生物技术学院, 临安 311300)
藻类挥发性有机化合物研究进展
左照江
(浙江农林大学林业与生物技术学院, 临安 311300)
在水域生态系统中, 藻类释放的挥发性有机化合物(VOCs)种类众多, 主要有萜烯类、醛类、醇类、酯类、酮类、脂肪族烃、芳香族、硫化物和卤化物。这些VOCs通过不同的次生代谢途径形成, 可为多种环境因素所诱导产生。在逆境胁迫下, VOCs具有提高藻细胞抗逆性的作用。当VOCs释放到水体中后, 可为同种藻细胞传递胁迫信息, 使感受细胞做好防御准备。对于异种藻细胞, VOCs通过化感作用抑制其生长, 从而保证VOCs释放者的竞争优势。此外, VOCs还可驱避捕食者, 保护藻细胞免受伤害。未被感受者利用的VOCs经挥发进入大气层后, 会参与水域上空二次有机气溶胶的形成。通过对藻类VOCs的种类、形成途径、诱导释放因素及其生态作用进行综述, 以期对藻类VOCs的研究有所帮助。
挥发性有机化合物; 形成途径; 诱导因素; 生态作用
挥发性有机化合物(Volatile organic compounds, VOCs)是指“在生理温度下植物体内可迅速从液态转化为气态并释放到大气中的低沸点有机物分子”[1]。在高等植物体内, VOCs主要通过次生代谢途径合成, 其种类约为30000多种[2]。在陆地生态系统中, 这些VOCs是植物与植物以及植物与昆虫间的信号物质, 具有重要的信息传递功能[3, 4]。
除高等植物外, 藻类植物也会产生大量的VOCs, 其种类丰富并含有独特的化合物成分, 例如,土味素、2-甲基异莰醇、硫化物和卤化物等[5, 6]。藻类VOCs可为多种环境因素所诱导产生[7—10], 其不仅可提高产生者的抗逆性, 还可作为信号物质在水域生态系统中进行信息传递, 从而有利于释放者及其种群在激烈的竞争环境中生存与繁衍[8, 9]。这些VOCs从水体释放到大气中后, 还会参与二次有机气溶胶形成进而影响大气环境[11]。因此, 本文就藻类VOCs种类、形成途径、诱导产生因素及其在生态系统中的功能作用进行综述, 以期对藻类VOCs的深入研究有所裨益。
1 藻类VOCs的种类
在水域生态系统中, 藻类VOCs组成丰富, 根据其化合物类型可分为萜烯类、醛类、醇类、酯类、酮类、脂肪族烃、芳香族、硫化物和卤化物。在不同藻种中, VOCs组成存在较大差异。莱茵衣藻(Chlamydomonas reinhardtii)主要释放醛类、醇类、酯类、酮类、萜烯类、烷烃类和烯烃类化合物[8, 9]; 铜绿微囊藻(Microcystis aeruginosa)除释放C15-C20 脂肪族烃、臭樟脑、萜烯类、β-环柠檬醛和β-紫罗兰酮等化合物外[12], 还释放大量的芳香族和硫化物[10]; 红藻会释放大量的卤化物[5]。藻类VOCs释放到水体中后会改变水体品质, 使其呈现特殊气味, 例如鱼腥藻(Anabeana)、微囊藻和颤藻(Oscillatoria)3 种蓝藻释放的土味素和2-甲基异莰醇会使水体呈现泥土气味[13]。对于食用藻类而言, 所释放的VOCs构成了其独特的风味, 例如海带(Laminaria japonica)的腥味主要来自己醛、辛醛、壬醛、反-2-辛烯醛和1-辛烯-3-醇[14]; 龙须菜(Gracilaria lemaneiformis)的独特风味主要来自醛、酮等羰基类化合物和烃类化合物[15]; 坛紫菜(Pyropia haitanensis)的风味则主要由硫化物和胺类化合物构成[16]。
2 藻类VOCs的形成途径
2.1 萜烯类VOCs
萜烯类VOCs是藻类和高等植物释放最为广泛的一类化合物, 主要有异戊二烯(半萜, C5)和以其为基本单位构成的单萜(C10)和倍半萜(C15)[17]。根据文献报道, 来自于海洋的异戊二烯释放量约为1.9—11.6 Tg C/年[18—20], 单萜约为0.013—29.5 Tg C/年[20]。萜烯类VOCs不仅释放量大, 而且组成丰富,例如, 铜绿微囊藻和水华微囊藻(M. flos-aquae)释放的单萜主要是α-蒎烯、桉树脑、柠檬烯和β-环柠檬醛, 倍半萜主要是雪松烯、长叶烯和柏木烯[10]。
在真核细胞中, 单萜主要通过质体中的甲基赤藓醇-4-磷酸途径(Methylerythritol-4-phosphat pathway, MEP)[21]合成; 倍半萜主要通过细胞质中的甲羟戊酸途径(Mevalonate pathway, MVA)[22]合成, 其中MEP途径以三磷酸甘油醛和丙酮酸为底物,MVA途径以乙酰-CoA为底物。这些底物经一系列酶促反应后均会形成二甲基烯丙基焦磷酸(DMAPP), 此化合物是所有萜烯类化合物合成的前体物质, 其在异戊二烯合成酶(ISPS)直接催化下可形成异戊二烯; 而经不同酶催化后再在萜烯合酶(单萜合酶和倍半萜合酶)催化下则可形成单萜和倍半萜(图1)[23, 24]。Hemmerlin等[25]研究表明, 采用膦胺霉素抑制MEP途径后, 饲喂的甲羟戊酸可用于合成质体醌(MEP途径合成), 这表明此两条途径间存在着物质交流。异戊烯基焦磷酸(IPP)和DMAPP是MEP和MVA途径中2种相同的中间产物, 也是萜烯类VOCs合成的C5前体物质。在这2种物质中,IPP可能会通过质体膜上的IPP转运体进行跨膜转运从而使两条途径间进行交流[26], 然而关于IPP跨膜转运尚需大量的研究予以证实。原核藻类没有质体等细胞器分化, 其MEP合成途径也在细胞质中完成, 因此IPP和DMAPP可为2条途径所共用[27]。
此外, 藻细胞中β-胡萝卜素经β-胡萝卜素7,8(7′,8′)-氧化酶氧化降解也会产生单萜类化合物——β-环柠檬醛(C10)[28], 然而在高氧浓度下, β-胡萝卜素则被降解为β-紫罗兰酮(C13)[29]。
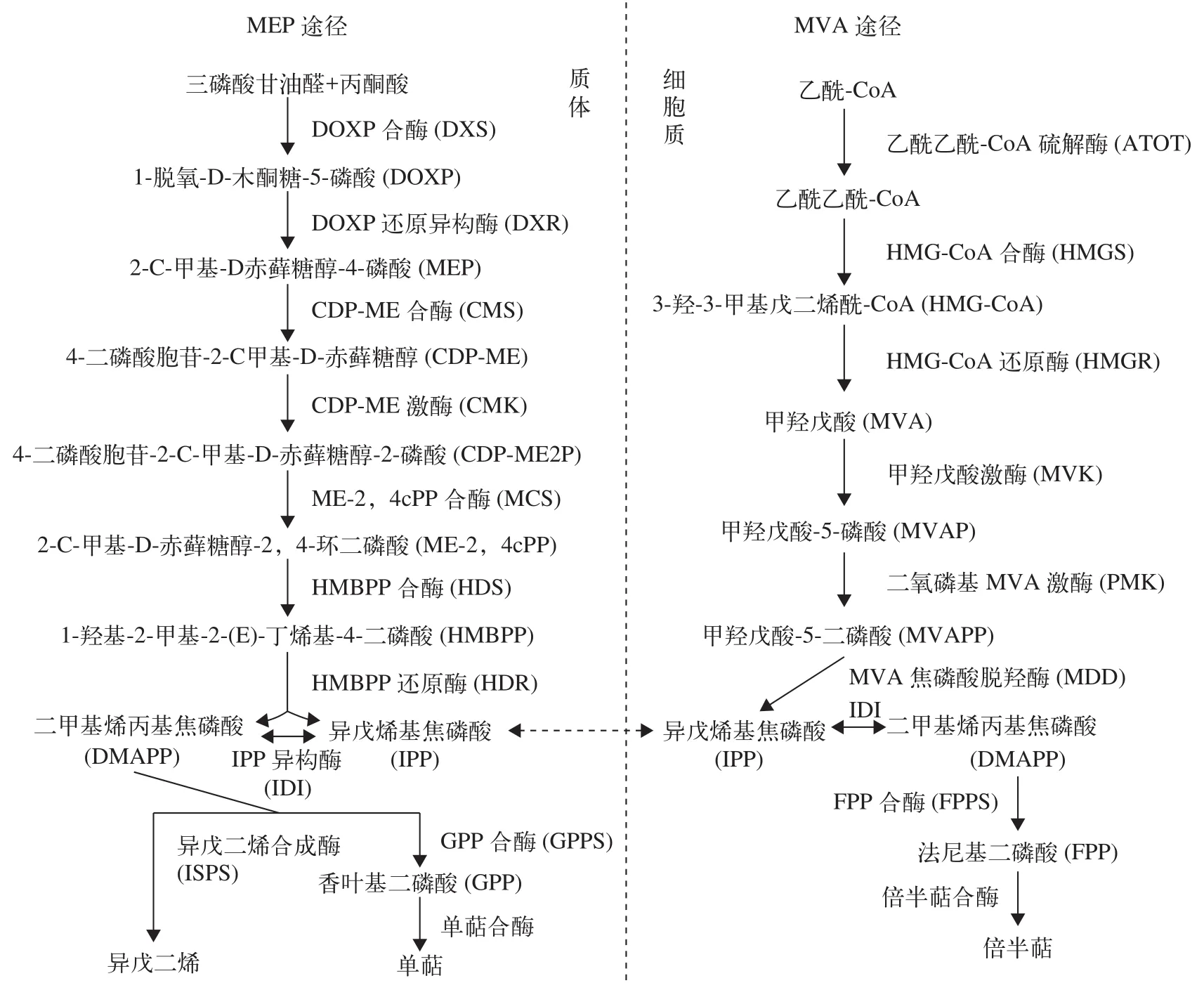
图1 萜烯类VOCs的合成途径[23, 24]Fig. 1 The synthetic pathway of terpenoids
2.2 C6绿叶挥发物
C6绿叶挥发物(C6 green leaf volatiles, GLVs)是指脂肪酸经脂氧合酶途径(图2)氧化降解形成的饱和与不饱和C6醇、醛和酯类VOCs[2]。对于α-亚麻酸而言, 其脂氧合酶途径的代谢初产物为(Z)-3-己烯醛, 经转化后形成(Z)-3-己烯醇、(E)-2-己烯醛和(E)-2-己烯醇等化合物; 而亚油酸的初产物则为己醛, 经醇脱氢酶转化后为己醇(图2)[30]。目前,GLVs的报道主要是高等植物受到机械损伤或昆虫取食时释放[31]。然而, 我们在对莱茵衣藻进行研磨损伤后发现, 其VOCs中出现己醛, 并且脂氧合酶活性较高; 机械损伤的两种原核微囊藻(铜绿微囊藻和水华微囊藻)VOCs中则未发现GLVs, 并且水华微囊藻中的脂氧合酶活性较低(未发表)。此外, 乙酸和NaCl胁迫也会诱导莱茵衣藻释放己醛, 并且其释放量随乙酸胁迫时间延长而增加[8, 9]。由此推断,GLVs产生机制可能是原核藻类进化到真核藻类后才形成的。
2.3 脂肪族烃
脂肪族烃是指长链烃类化合物, 在藻类VOCs中大量存在[8, 9, 32], 其来源主要是脂肪酸脱羧反应[33]。藻细胞膜脂过氧化反应或在脂酰水解酶作用下可产生游离脂肪酸, 其在脂酰-脂酰载体蛋白还原酶(Acyl-ACP还原酶)催化下形成脂肪醛, 再经醛脱羰酶作用形成脂肪族烃[34—36]。例如, 十七烷是蓝藻VOCs的标志性化合物之一[12, 32], 由醛脱羰酶催化十八醛脱羰基形成[33]。
2.4 芳香族VOCs
芳香族VOCs是含有苯环的化合物, 其形成过程主要来自苯丙氨酸代谢。例如, 苯乙醛是苯丙氨酸脱羧后再氧化脱氨形成[37]。对烯丙基苯酚是苯丙氨酸先经苯丙烷途径形成香豆醇, 再被还原成二氢香豆醇后脱氢形成[38]。对伞花烃是铜绿微囊藻和水华微囊藻释放的芳香族化合物[10], 然而其形成途径并非来自苯丙氨酸代谢, 而是萜品烯经O2氧化产生[39]。
2.5 硫化物
硫化物在高等植物中并不多见, 可作为某些植物的特有成分。例如, 芥子油甙为十字花科植物所特有, 其合成来源于氨基酸碳链的亚甲基化延长,可被昆虫取食所诱导释放[40]。在水域生态系统中,二甲硫醚(DMS)是大量产生的硫化物, 释放量约为3×1014g/年[41], 其来源主要是海藻中的渗透调节物质——硫代甜菜碱(Dimethylsulphoniopropionate,DMSP)降解。当藻类死亡后, DMSP被微生物DMSP裂解酶分解或经光氧化降解为DMS[42—44]。DMSP裂解酶不仅存在于细菌中, 也存在于一些藻类中, 例如Symbiodinium microadriaticum[45]、赫氏颗石藻(Emiliania huxleyi(Lohm.) Hay and Mohler)和大洋桥石藻(Gephyrocapsa oceanicaKamptner)[46]。de Souza等[47]从大型绿藻石莼(Ulva curvata)体内纯化出DMSP裂解酶, 其大小为78 kD, 催化反应最适pH为8.0。由此可见, 藻类也可自身分解DMSP产生DMS。Lu等[48]对太湖水样中的藻类饲喂甲硫氨酸(Met)后, 其硫化物甲硫醇、DMS、二甲基二硫醚、二甲基三硫化物和二甲基四硫化物释放量明显升高, 其中二甲基二硫醚的释放量最高, 而当饲喂葡萄糖后则抑制硫化物产生; 同时饲喂Met和葡萄糖后, 二甲基四硫化物释放量最高, 由此可见,Met可能是含硫VOCs形成的前体物质, 细胞内糖水平增加可能会改变Met代谢, 使其形成高含硫量VOCs。
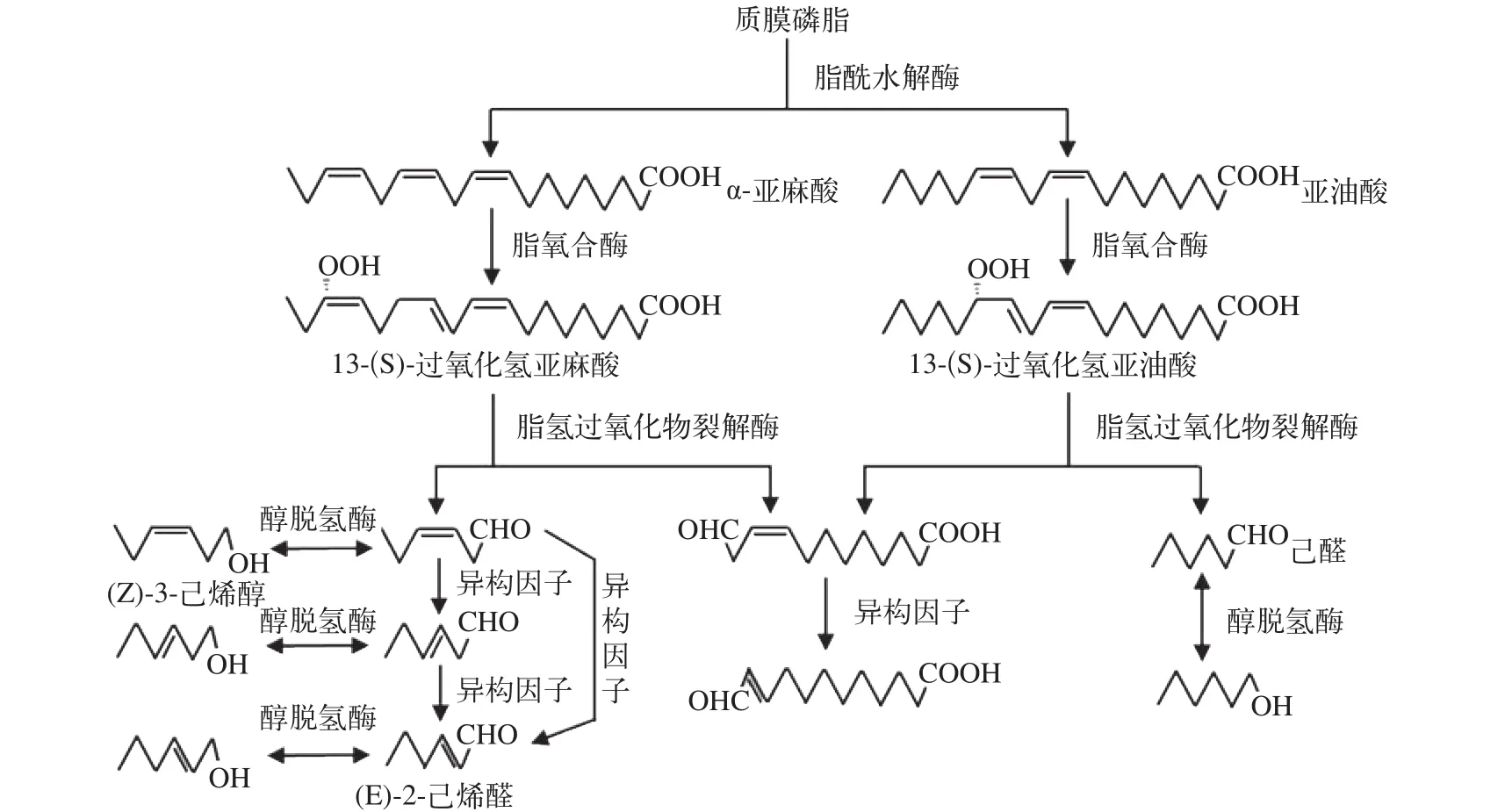
图2 GLVs的形成途径[30]Fig. 2 The forming pathway of GLVs
2.6 卤化物
含有卤素(Cl、Br和I)的VOCs在高等植物中亦不多见, 而在水体藻类中则大量产生, 尤其是在海藻之中, 例如, 柏桉藻科、海头红科、根叶藻科等红藻均会大量释放含有卤素的烃、烯、萜烯、醇、醛、酮、酯等化合物[5]。在藻细胞中, 依赖于钒或血红素的卤化物过氧化物酶利用H2O2中的2个电子氧化卤素离子形成次卤酸(HOI、HOBr)[49, 50],次卤酸再与有机物反应形成卤化物[51]。在卤化物过氧化物酶中, 氯化物过氧化物酶可催化氯、溴和碘离子氧化, 溴化物过氧化物酶可催化溴和碘离子氧化[50]。
3 诱导藻类VOCs产生的环境因素
藻类VOCs可自发产生, 也可为多种环境因素所诱导产生。光照、温度、营养条件、水体pH、盐度等环境因子始终作用于藻类生命周期中, 这些环境因子变化会导致藻类次生代谢途径改变, 并诱导新VOCs产生与释放。
3.1 光照
藻类释放萜烯类VOCs与光照密切相关, 例如,原绿球藻(Prochlorococcus)的异戊二烯释放速率随光照强度增加而增加[52]。Bonsang等[53]研究发现,蓝藻、硅藻和绿藻均能释放异戊二烯, 并且均依赖于光。微氏海链藻(Thalassiosira weissflogii)、伪矮海链藻(T. pseudonana)、颗石藻(Pleurochrysis carterae)和红胞藻(Rhodomonas salina)在不同光强下培养4h时, 异戊二烯释放量最大, 同时高光强[420和900 μmol/(m2·s)]时释放速率较高; 除异戊二烯外, 这几种微藻还会释放单萜, 并且高光强可促进其释放[54]。光促进异戊二烯释放, 可能与光激活异戊二烯合成酶有关, 此激活过程可能是光激活叶绿体基质中的Mg2+, 使其浓度增加或改变基质pH所致[55]。
海藻会释放大量的卤化物, 其中热带海藻的释放速率明显高于温带海藻[56], 并且1d之内中午的释放速率最高[57]。巨型红藻(Solieria chordalis)可释放CH3I、CH3CH2I、CH2ClI、CH2Br2、CHBrCl2、
3.2 温度
将中心目珪藻(Pleurosira laevis)和浒苔(Enteromorpha flexuosa)分别培养在17℃和23℃条件下,其中在较高温度时中心目珪藻CHCl3和浒苔CHBr3释放量均明显增加[7]。在不同温度(4—23.2℃)条件下, 赫氏颗石藻的生长速率随温度升高而增加,然而其DMSP含量则逐渐降低, 这表明其DMS释放量随温度升高而降低[62]。
Meskhidze等[54]通过研究9种微藻异戊二烯和单萜释放速率表明, 温度对藻类萜烯类VOCs释放无明显影响。这与高等植物萜烯类VOCs释放速率随温度升高而显著增加不同。在高等植物中, 高温通过提高与萜烯合成相关的酶活性以及储藏结构内部蒸汽压而促进其合成与释放, 并且这些萜烯类VOCs具有保护高等植物抵抗高温胁迫的作用[63—65]。藻类不具备萜烯类VOCs储存结构, 并且生活的水体温度相对较低, 因此可能未进化出高温诱导萜烯释放的响应机制[52]。
肺衣(Lobaria pulmonaria)是真菌、蓝藻和绿藻的三者共生体, 其中蓝藻主要是念珠藻(Nostoc),绿藻主要是Dyctiochloropsis。在热击胁迫下, 其释放的β-环柠檬醛、3-羟基环柠檬醛、紫罗烯、二氢猕猴桃内酯、香叶基丙酮和羟基罗兰酮等β-胡萝卜素降解产物明显增加, 其原因可能是高温诱导ROS大量产生并氧化β-胡萝卜素形成[66]。
3.3 营养条件
随着经济社会发展, 大量营养物质排放到水体当中, 从而致使水域生态系统内含有多样且复杂的氮磷营养。对于氮素而言, 可分为无机氮(、和)和有机氮(脲、多肽和氨基酸)[67, 68]。当采用NaNO3、NaNO2、NH4Cl、脲、丝氨酸、赖氨酸和精氨酸作为唯一氮源培养水华微囊藻24h时, 其释放的呋喃类、硫化物、萜烯类、芳香族、脂肪族烃、醛类和酯类VOCs存在明显差异, 其中NaNO3和脲作为氮源时VOCs种类最多[32]。与VOCs释放相似, 不同氨基酸作为氮源培养铜绿微囊藻后, 其藻毒素释放量不同, 其中丙氨酸、亮氨酸和精氨酸作为氮源时释放量较多[69]。除不同氮源外, 不同氮浓度也会影响藻类VOCs释放。当培养基中氮素营养耗尽时, 铜绿微囊藻的醇类和β-环柠檬醛释放量明显增加[70]。以NaNO3作为氮源培养水华微囊藻, 其VOCs释放量随氮浓度降低而明显增加, 并且在无氮时释放量最大[32]。不同氮浓度培养铜绿微囊藻的结果与水华微囊藻相似, 通过转录组分析表明, 无氮条件促进了与MEP和MVA途径前体物质形成以及膜脂水解相关酶基因的表达,从而促进了萜烯类和脂肪族烃类VOCs的产生与释放(未发表)。
在水域生态系统中, 磷易形成不溶性盐沉淀,是藻类生长的限制性营养元素。除无机磷外, 多聚磷酸盐亦是水体中可溶性磷的主要存在形式[71]。分别采用K2HPO4和2种多聚磷酸盐(焦磷酸钠与六偏磷酸钠)作为磷源培养水华微囊藻, 其VOCs释放量以六偏磷酸钠作为磷源时最大; 并且随着磷(K2HPO4)浓度降低VOCs释放量逐渐增加(未发表)。此外, 限制P营养还会促进蓝藻Trichormus doliolum藻毒素产生, 与对照相比提高了2.9倍[72]。
随着水体富营养化加剧, 水体中多样且复杂的氮磷营养会改变藻类VOCs释放, 并诱导新VOCs产生; 同时随着优势藻类的大量繁殖生长, 水体中的营养物质会进一步消耗甚至出现匮乏, 从而诱导VOCs的大量产生与释放。
3.4 酸、碱、盐胁迫
莱茵衣藻释放的VOCs种类丰富, 当采用乙酸、Na2CO3和NaCl对藻细胞进行酸、碱、盐胁迫时,其VOCs释放量均明显增加, 并且乙酸和NaCl胁迫还会诱导GLVs (己醛)释放, 而Na2CO3胁迫则诱导3, 4-二甲基-己烷和5-甲基-2-庚烯两种特异性成分释放[8, 9]。由此可见, 乙酸和NaCl胁迫均能诱导脂氧合酶发挥作用, 从而产生GLVs, 而Na2CO3胁迫则不能诱导脂氧合酶发挥作用, 其原因可能是Na2CO3胁迫所造成的碱性环境会导致脂氧合酶失活。与NaCl处理莱茵衣藻相似, NaNO3胁迫水华微囊藻和铜绿微囊藻24h后, 2种微囊藻中的萜烯类、硫化物、脂肪族烃、芳香族、醛类和酯类VOCs释放量均明显增加, 但是并无GLVs释放[10], 这可能与微囊藻体内脂氧合酶活性较低有关(未发表)。此外, 盐胁迫还会诱导巨型红藻和Gymnongongrus antarcticus释放卤化物[58, 73], 这可能与盐胁迫诱导藻细胞H2O2产生以促进卤素离子氧化有关[74]。
4 藻类VOCs的生态作用
4.1 提高藻细胞抗逆性
在卤化物形成过程中, 卤素离子的氧化需要H2O2提供提电子, 在高光强、盐和H2O2胁迫条件下, 卤化物释放量均明显增加[58, 59, 61]。这表明卤化物形成有利于降低藻细胞内ROS水平, 从而提高藻细胞对逆境引起的次生氧化胁迫的抵抗能力。在热击胁迫下, 肺衣的β-胡萝卜素降解产物(β-环柠檬醛等)释放量明显增加, 这些降解产物可能是β-胡萝卜素淬灭ROS时的氧化产物, 因此其产生过程是β-胡萝卜素抵抗ROS的结果[66]。在高等植物体内, 萜烯类VOCs释放可提高植物抵抗高温和ROS胁迫的能力, 其原因可能为萜烯类VOCs具有淬灭ROS、稳定细胞膜和光合系统的作用[64, 65, 75, 76]。在藻类中, 萜烯类VOCs是其释放的一类主要化合物, 可被高光强、酸、碱、盐等逆境胁迫所诱导产生[8, 9, 54],由此推断, 此类VOCs可能也具有提高藻细胞抵抗逆境胁迫的能力。pH 5.0乙酸可诱导莱茵衣藻发生细胞程序性死亡(Programmed cell death, PCD),在此过程中, VOCs可能会淬灭细胞内的ROS, 从而使含氧VOCs释放量明显增加[77]。由此可见, 在逆境胁迫下, 藻类VOCs的产生与释放可提高藻细胞的抗逆性, 从而有利于藻细胞在逆境胁迫中生存与繁衍。
4.2 诱导防御
莱茵衣藻在pH 5.0乙酸诱导发生PCD过程中以及NaCl和Na2CO3胁迫下所释放的VOCs均可诱导其他正常莱茵衣藻细胞内ROS含量升高、保护酶活性增强, 同时生长减缓, 这表明逆境胁迫诱导的VOCs在藻细胞间进行了信息传递。VOCs通过诱导莱茵衣藻细胞ROS产生而诱导其保护酶活性增强, 进而使其降低生长并作好防御准备[8, 9]。Yordanova等[78]研究发现, 黄峰毒素在诱导莱茵衣藻发生PCD过程中会释放乙烯和NO, 采用已发生PCD的培养基培养正常细胞后再采用黄峰毒素处理,则无PCD发生, 推测乙烯和NO可能为正常细胞传递了胁迫信息。由此可见, 藻细胞在胁迫条件下可释放VOCs为其他同种细胞传递胁迫信息, 从而有利于种群生存与繁衍。这种胁迫信息的传递与高等植物中VOCs诱导临近植株防御昆虫取食相类似[3, 31]。高等植物是由藻类不断演化而来, 莱茵衣藻是最原始的真核生物, 因此, 植物间的VOCs信号传递机制可能是进化过程中的一种保留机制, 从而有利于植物应对复杂的自然环境并促进种群生存与繁衍。
4.3 对其他藻类的化感作用
在富营养化水体中, 蓝藻大量繁殖后, 其他藻类明显减少, 生物多样性降低。在此过程中, 除了藻毒素具有抑制其他藻类和水生生物生长的作用外[79, 80], VOCs也具有化感抑制作用[32, 81]。例如, 采用缺氮条件模拟蓝藻大量繁殖后水体营养元素缺乏, 水华微囊藻在此条件下释放的VOCs可明显抑制小球藻(Chlorella vulgaris)生长[32]。
蓝藻释放的VOCs种类众多, 在这些化合物中,β-环柠檬醛、α-紫罗兰酮、β-紫罗兰酮和香叶基丙酮等β-胡萝卜素降解产物具有抑制蛋白核小球藻(C. pyrenoidosa)生长的作用, 其抑制浓度为2—5 mg/mL[81]。采用β-环柠檬醛处理谷皮菱形藻(Nitzschia palea), 在0.1—0.5 mg/L时便可引起15%—20%的藻细胞发生破裂[82]。此外, β-环柠檬醛处理还会改变藻细胞颜色, 使微囊藻细胞呈现蓝绿色, 席藻(Phormidium)呈现粉色, 其原因为β-环柠檬醛通过引起叶绿素a和β-胡萝卜素迅速降解而改变藻细胞颜色[83]。由此可见, β-环柠檬醛可通过引起光合色素降解和细胞裂解来发挥化感作用。
在陆地生态系统中, 萜烯类VOCs是发挥化感作用的主要化合物。采用水华微囊藻释放的两种主要单萜——桉树脑和柠檬烯处理小球藻和莱茵衣藻后, 两种藻细胞的光合色素均会发生降解, 其中柠檬烯处理后叶黄素和单乙烯基叶绿素b降解最为严重; 同时桉树脑和柠檬烯还会抑制光系统II(PSII)电子产生与传递, 从而使光合效率降低[32, 84, 85]。Zeraatpisheh和Vatanparast[86]研究表明, 桉树脑具有抑制蜗牛中枢神经元K+通道的作用。这表明桉树脑除可引起藻细胞光合色素降解和降低光合效率外, 还可能通过抑制K+离子通道扰乱细胞内离子平衡以发挥化感作用, 然而, 有关此方面的作用机制还有待于进一步深入研究。
此外, 在藻类VOCs中, 脂肪酸降解产生的十七烷和十四烷可抑制细菌和念珠菌(Candida albicans)生长[87]; 二甲基二硫醚可抑制尖孢镰刀菌(Fusarium oxysporum)细胞生长和莴苣(Lactuca sativa)种子萌发[88], 这表明脂肪族烃和硫化物对藻细胞也可能具有化感抑制作用。
4.4 驱避捕食者
在自然界中, 藻类不但受到环境变化影响, 还时刻受到捕食者威胁。在应对捕食者威胁时, 藻细胞除了形成聚集体和释放藻毒素外[89], 还可通过VOCs进行驱避。采用褐藻Dictyopteris membranacea饲喂一种藻沟虾Ampithoe longimana, 与产生C11硫化物的藻株相比, 藻沟虾更倾向于取食无硫化物产生的藻株[90]。圆海链藻(T. rotula)在受到损伤时会通过活化磷脂酶A2水解膜脂以释放游离脂肪酸, 其再经脂氧合酶水解产生2,4-癸二烯醛和2,4,7-癸三烯醛用于防御[91]。当采用β-环柠檬醛和2,4,7-癸三烯醛处理水蚤(Daphnia magna)时, 其泳速迅速增加, 这表明藻类释放的此两种化合物可用于驱避捕食者[92, 93]。然而, 对卵萝卜螺(Radix ovata)而言, 其可利用丝藻(Ulothrix fimbriata)释放的VOCs信息进行捕食[94]。
4.5 影响大气化学
植物释放的VOCs进入大气层后, 其不饱和键极易发生光氧化反应, 进而形成低挥发性氧化物,这些氧化物再经气态/粒子态转化凝结后形成二次有机气溶胶[95]。虽然水域环境中的VOCs释放量明显低于陆地生态系统, 但是这些VOCs却可明显影响广阔海洋上空的大气环境。萜烯类VOCs含有1到多个不饱和双键, 与大气中的O3、·OH、NOx极易发生氧化反应并形成多种氧化产物[96, 97]。例如,当大气中O3浓度为0.625 μmol/L时, 植物释放的α-萜品烯可在5min内进行反应[98]。月桂烯、萜品油烯、3-蒈烯、α-蒎烯、β-蒎烯与·OH反应均可生成酮、醛和甲酸[99]。在与O3反应时, α-蒎烯可生成蒎酮酸、蒎醛酸、降蒎酮酸、降蒎醛酸和蒎酸等5种氧化产物[100]。萜烯类VOCs是藻类释放的一类主要化合物, 其在海洋大气二次有机气溶胶形成中具有重要作用[19]。DMS主要由海藻中DMSP分解形成, 其释放量约为0.5—1.0×1012摩尔/年[41]。DMS在大气中被氧化为酸性气溶胶颗粒, 可明显影响海洋上空的云层形成与太阳辐射, 这表明藻类释放的VOCs在海洋上空形成气溶胶后可能会影响气候形成, 进而影响人类在海洋上的生产活动[11, 101]。
5 结语
在水域生态系统中, 藻类时刻处于多种环境因子的影响之中, 这些环境因子变化均会诱导藻细胞释放大量的VOCs。在这些VOCs中, 哪些化合物是藻细胞应对环境变化的功能成分, 同时其通过何种机制提高藻细胞的抵抗能力, 尚需大量的VOCs单体和突变体藻株予以证实。藻类VOCs作为水域生态系统中的信号物质, 其产生、传递以及感受者(藻类或水生动物)感知与应答是一个复杂过程, 是水生生物在漫长进化过程中所形成的生存策略。VOCs在空气中易于传播, 而水体中藻类VOCs如何进行传播及其传播的有效距离尚不清楚。藻类释放的VOCs种类众多, 这些VOCs中哪些是传递信息的化合物亦不明确。VOCs信号为感受者所感知后,
其信号作用得以发挥——诱导防御、抑制藻细胞生长以及驱避捕食者。在此过程中, VOCs信号所传递的具体信息、感受VOCs信号的受体是何物质以及胞内信号如何进行传递并调控基因表达, 这些都是阐明藻类VOCs信号机制所需研究的问题。藻类VOCs中, 不为感受者所利用的成分经水体表面挥发后进入大气层中, 从而参与二次有机气溶胶的形成。海藻VOCs进入海洋上空形成二次有机气溶胶后对海洋气候具有哪些影响, 海洋气候变化后是否会反作用于海藻生长及其VOCs释放, 从而使两者间形成相互调节机制, 对此问题进行阐释将有助于气候预测以及海洋的开发与利用。
[1]Lerdau M, Slobodkin K. Trace gas emissions and species dependent ecosystem services [J].Trends in Ecology amp; Evolution, 2002, 17(7): 309—312
[2]Peñuelas J, Llusià J. Plant VOC emissions: making use of the unavoidable [J].Trends in Ecology and Evolution, 2004, 19(8): 402—404
[3]Baldwin I T, Halitschke R, Paschold A,et al. Volatile signaling in plant-plant interactions: “talking trees” in the genomics era [J].Science, 2006, 311(5762):812—815
[4]Zhang R M, Zuo Z J, Gao P J,et al. Allelopathic effects of VOCs ofArtemisia frigidaWilld. on the regeneration of pasture grasses in Inner Mongolia [J].Journal of Arid Environments, 2012, 87: 212—218
[5]Kladi M, Vagias C, Roussis V. Volatile halogenated metabolites from marine red algae [J].Phytochemistry Reviews, 2004, 3(3): 337—366
[6]Fujise D, Tsuji K, Fukushima N,et al. Analytical aspects of cyanobacterial volatile organic compounds for investigation of their production behavior [J].Journal of Chromatography A, 2010, 1217(39): 6122—6125
[7]Abrahamsson K, Choo K S, Pedersén M,et al. Effects of temperature on the production of hydrogen peroxide and volatile halocarbons by brackish-water algae [J].Phytochemistry, 2003, 64(3): 725—734
[8]Zuo Z J, Zhu Y R, Bai Y L,et al. Volatile communication betweenChlamydomonas reinhardtiicells under salt stress [J].Biochemical Systematics and Ecology,2012, 40(1): 19—24
[9]Zuo Z J, Zhu Y R, Bai Y L,et al. Acetic acid-induced programmed cell death and release of volatile organic compounds inChlamydomonas reinhardtii[J].Plant Physiology and Biochemistry, 2012, 51(2): 175—184
[10]Gan L P, Xu Q H, Yang W T,et al. The effects of NaNO3stress on the release of VOCs from twoMicrocystis[J].Acta Hydrobiologica Sinica, 2015, 39(4):782—788 [甘丽平, 徐庆欢, 杨王庭, 等. NaNO3胁迫对两种微囊藻VOCs释放的影响. 水生生物学报,2015, 39(4): 782—788]
[11]Vallina S M, Simó R. Strong relationship between DMS and the solar radiation dose over the global surface ocean [J].Science, 2007, 315(5811): 506—508
[12]Walsh K, Jones G J, Dunstan R H. Effect of high irradiance and iron on volatile odour compounds in the cyanobacteriumMicrocystis aeruginosa[J].Phytochemistry, 1998, 49(5): 1227—1239
[13]Huang W J, Lai C H, Cheng Y L. Evaluation of extracellular products and mutagenicity in cyanobacteria cultures separated from a eutrophic reservoir [J].Science of the Total Environment, 2007, 377(2/3):214—223
[14]Cui C Q, Han J J, Dong L S,et al. Effects of processing temperature on volatile compounds inLaminaria japonica[J].Science and Technology of Food Industry,2016, 37(24): 157—162 [崔晨茜, 韩姣姣, 董丽莎, 等.温度与海带挥发性成分量效关系的解析. 食品工业科技, 2016, 37(24): 157—162]
[15]Yang S L, Yu G, Qi B,et al. Analysis of volatile compounds of driedGracilaria lemaneiformisby HSSPME method [J].South China Fisheries Science,2016, 12(6): 115—122 [杨少玲, 于刚, 戚勃, 等. 顶空固相微萃取法分析龙须菜干品中的挥发性成分. 南方水产科学, 2016, 12(6): 115—122]
[16]Hu C M, Wang D Q, Wang X C,et al. Odors analysis ofPyropia yezoensisandPyropia haitanensisby electronic nose [J].Guangxi Science, 2016, 23(2): 138—143[胡传明, 王丹青, 王锡昌, 等. 条斑紫菜与坛紫菜挥发性风味的电子鼻分析. 广西科学, 2016, 23(2):138—143]
[17]Holopainen J K, Blande J D. Where do herbivore-induced plant volatiles go [J]?Frontiers in Plant Science,2013, 4(1): 185
[18]Palmer P I, Shaw S L. Quantifying global marine isoprene fluxes using MODIS chlorophyll observations[J].Geophysical Research Letters, 2005, 32(9):L09805
[19]Gantt B, Meskhidze N, Kamykowski D. A new physically-based quantification of marine isoprene and primary organic aerosol emissions [J].Atmospheric Chemistry and Physics, 2009, 9(14): 4915—4927
[20]Luo G, Yu F. A numerical evaluation of global oceanic emissions of α-pinene and isoprene [J].Atmospheric Chemistry and Physics, 2010, 10(4): 2007—2015
[21]Rohmer M, Knani M, Simonin P,et al. Isoprenoid biosynthesis in bacteria: a novel pathway for the early steps leading to isopentenyl diphosphate [J].Biochemical Journal, 1993, 295(1): 517—524
[22]Chappell J, Wolf F, Proulx J,et al. Is the reaction catalysed by 3-hydroxy-3-methylglutaryl coenzyme A re-ductase a rate-limiting step for isoprenoid biosynthesis in plants [J]?Plant Physiology, 1995, 109(4):1337—1343
[23]Hsieh M H, Goodman H M. The Arabidopsis IspH homolog is involved in the plastid nonmevalonate pathway of isoprenoid biosynthesis [J].Plant Physiology,2005, 138(2): 641—653
[24]Withers S T, Keasling J D. Biosynthesis and engineering of isoprenoid small molecules [J].Applied Microbiology and Biotechnology, 2007, 73(5): 980—990
[25]Hemmerlin A, Hoeffler J-F, Meyer O,et al. Cross-talk between the cytosolic mevalonate and the plastidial methylerythritol phosphate pathways in tobacco bright yellow-2 cells [J].The Journal of Biological Chemistry, 2003, 278: 26666—26676
[26]Soler E, Clastre M, Bantignies B,et al. Uptake of isopentenyl diphosphate by plastids isolated fromVitis viniferaL. cell suspensions [J].Planta, 1993, 191(3):324—329
[27]Seto H, Watanabe H, Furihata K. Simultaneous operation of the mevalonate and non-mevalonate pathways in the biosynthesis of isopentenyl diphosphate inStreptomyces aeriouvifer[J].Tetrahedron Letters, 1996,37(44): 7979—7982
[28]Jüttner F. Quantitative trace analysis of volatile organic compounds [J].Methods in Enzymology, 1988, 167:609—616
[29]Jüttner F. The algal excretion product, geranylacetone:A potent inhibitor of carotene biosynthesis inSynechococcus[J].Zeitschrift Fur Naturforschung, 1979,34(11): 957—960
[30]Hatanaka A. The biogeneration of green odour by green leaves [J].Phytochemistry, 1993, 34(5):1201—1218
[31]Fall R, Karl T, Hansel A,et al. Volatile organic compounds emitted after leaf wounding: on-line analysis by proton-transfer-reaction mass spectrometry [J].Journal of Geophysical Research, 1999, 104(D13):15963—15974
[32]Xu Q, Yang L, Yang W,et al. Volatile organic compounds released fromMicrocystis flos-aquaeunder nitrogen sources and their toxic effects onChlorella vulgaris[J].Ecotoxicology and Environmental Safety,2017, 135: 191—200
[33]Cheesbrough T M, Kolattukudy P E. Alkane biosynthesis by decarbonylation of aldehydes catalyzed by a particulate preparation fromPisum sativum[J].Proceedings of the National Academy of Sciences of the United States of America, 1984, 81(21): 6613—6617
[34]Schirmer A, Rude M A, Li X,et al. Microbial biosynthesis of alkanes [J].Science, 2010, 329(5991):559—562
[35]Zhang J, Lu X, Li J J. Conversion of fatty aldehydes into alk(a/e)nes by in vitro reconstituted cyanobacterial aldehyde-deformylating oxygenase with the cognate electron transfer system [J].Biotechnology for Biofuels,2013, 6: 86
[36]Klähn S, Baumgartner D, Pfreundt U,et al. Alkane biosynthesis genes in cyanobacteria and their transcriptional organization [J].Frontiers in Bioengineering and Biotechnology, 2014, 2: 1—12
[37]Pichersky E, Noel J P, Dudareva N. Biosynthesis of plant volatiles: nature’s diversity and ingenuity [J].Science, 2006, 311(5762): 808—811
[38]Vassao D G, Gang D R, Koeduka T,et al. Chavicol formation in sweet basil(Ocimum basilicum): cleavage of an esterified C9 hydroxyl group with NAD(P)H-dependent reduction [J].Organic amp; Biomolecular Chemistry, 2006, 4(14): 2733—2744
[39]Rudbäck J, Bergström M A, Börje A,et al. α-Terpinene, an antioxidant in tea tree oil, autoxidizes rapidly to skin allergens on air exposure [J].Chemical Research in Toxicology, 2012, 25(3): 713—721
[40]Halkier B A, Gershenzon J. Biology and biochemistry of glucosinolates [J].Annual Review of Plant Biology,2006, 57: 303—333
[41]Kettle A J, Andreae M O. Flux of dimethylsulfide from the oceans: a comparison of updated data sets and flux models [J].Journal of Geophysical Research-Atmospheres, 2000, 105(D22): 26793—26808
[42]Kiene R P, Bates T S. Biological removal of dimethyl sulphide from sea water [J].Nature, 1990, 345(6277):702—705
[43]Curson A R J, Todd J D, Sullivan M J,et al. Catabolism of dimethylsulphoniopropionate: microorganisms,enzymes and genes [J].Nature Reviews Microbiology,2011, 9(12): 849—859
[44]Moran M A, Reisch C R, Kiene R P,et al. Genomic insights into bacterial DMSP transformations [J].Annual Review of Marine Science, 2012, 4: 523—542
[45]Yost D M, Mitchelmore C L. Dimethylsulfoniopropionate (DMSP) lyase activity in different strains of the symbiotic algaSymbiodinium microadriaticum[J].Marine Ecology Progress Series, 2009, 386: 61—70
[46]Franklin D J, Steinke M, Young J,et al. Dimethylsulphoniopropionate (DMSP), DMSP-lyase activity(DLA) and dimethylsulphide (DMS) in 10 species of coccolithophore [J].Marine Ecology Progress Series,2010, 410: 13—23
[47]de Souza M P, Chen Y P, Yoch D C. Dimethylsulfoniopropionate lyase from the marine macroalgaUlva curvata: purification and characterization of the enzyme [J].Planta, 1996, 199(3): 433—438
[48]Lu X, Fan C, He W,et al. Sulfur-containing amino acid methionine as the precursor of volatile organic sulfur compounds in algae-induced black bloom [J].Journalof Environmental Sciences, 2013, 25(1): 33—43
[49]Ohsawa N, Ogata Y, Okada N,et al. Physiological function of bromoperoxidase in the red marine alga,Corallina piluliferaproduction of bromoform as an allelochemical and the simultaneous elimination of hydrogen peroxide [J].Phytochemistry, 2001, 58(5):683—692
[50]Winter J M, Moore B S. Exploring the chemistry and biology of vanadium-dependent haloperoxidases [J].The Journal of Biological Chemistry, 2009, 284:18577—18581
[51]Moore R M, Webb M, Tokarczyk R,et al. Bromoperoxidase and iodoperoxidase enzymes and production of halogenated methanes in marine diatom cultures [J].Journal of Geophysical Research, 1996, 101(C9):20899—20908
[52]Shaw S L, Chisholm S W, Prinn R. Isoprene production byProchlorococcus, a marine cyanobacterium,and other phytoplankton [J].Marine Chemistry, 2003,80(4): 227—245
[53]Bonsang B, Gros V, Peeken I,et al. Isoprene emission from phytoplankton monocultures: the relationship with chlorophyll-a, cell volume and carbon content [J].Environmental Chemistry, 2010, 7(6): 554—563
[54]Meskhidze N, Sabolis A, Reed R,et al. Quantifying environmental stress-induced emissions of algal isoprene and monoterpenes using laboratory measurements [J].Biogeosciences, 2015, 12(3): 637—651
[55]Fall R, Wildermuth M C. Isoprene synthase: from biochemical mechanism to emission algorithm [J].Journal of Geophysical Research, 1998, 103(D19):25599—25609
[56]Abrahamsson K, Ekdahl A, Collén J,et al. Marine algae—a source of trichloroethylene and perchloroethylene [J].Limnology and Oceanography, 1995, 40(7):1321—1326
[57]Ekdahl A, Pedersén M, Abrahamsson K. A study of the diurnal variation of biogenic volatile halocarbons [J].Marine Chemistry, 1998, 63(1—2): 1—8
[58]Bondu S, Cocquempot B, Deslandes E,et al. Effects of salt and light stress on the release of volatile halogenated organic compounds bySolieria chordalis: a laboratory incubation study [J].Botanica Marina, 2008,51(6): 485—492
[59]Hughes C, Sun S. Light and brominating activity in two species of marine diatom [J].Marine Chemistry,2016, 181: 1—9
[60]Milne A, Davey M S, Worsford P S,et al. Real-time detection of reactive oxygen species generation by marine phytoplankton using flow injection-chemiluminescence [J].Limnology and Oceanography: Methods, 2009, 7(10): 706—715
[61]Wever R, van der Horst M A. The role of vanadium haloperoxidases in the formation of volatile brominated compounds and their impact on the environment[J].Dalton Transactions, 2013, 42(33): 11778—11786
[62]van Rijssel M, Gieskes W W C. Temperature, light,and the dimethylsulfoniopropionate (DMSP) content ofEmiliania huxleyi(Prymnesiophyceae) [J].Journal of Sea Research, 2002, 48(1): 17—27
[63]Pasqua G, Monacelli B, Manfredini C,et al. The role of isoprenoid accumulation and oxidation in sealing wounded needles of Mediterranean pines [J].Plant Science, 2002, 163(2): 355—359
[64]Loreto F, Pinelli P, Manes F,et al. Impact of ozone on monoterpene emissions and evidence for an isoprenelike antioxidant action of monoterpenes emitted byQuercus ilexleaves [J].Tree Physiology, 2004, 24(4):361—367
[65]Loreto F, Schnitzler J P. Abiotic stresses and induced BVOCs [J].Trends in Plant Science, 2009, 15(3):154—166
[66]García-Plazaola J I, Portillo-Estrada M, Fernández-Marín B,et al. Emissions of carotenoid cleavage products upon heat shock and mechanical wounding from a foliose lichen [J].Environmental and Experimental Botany, 2017, 133: 87—97
[67]Rabalais N N. Nitrogen in aquatic ecosystems [J].A Journal of the Human Environment, 2002, 31(2):102—112
[68]Glibert P M, Heil C A, Hollander D,et al. Evidence for dissolved organic nitrogen and phosphorus uptake during a cyanobacterial bloom in Florida Bay [J].Marine Ecology Progress Series, 2004, 280: 73—83
[69]Dai R, Liu H, Qu J,et al. Effects of amino acids on microcystin production of theMicrocystis aeruginosa[J].Journal of Hazardous Materials, 2009, 161(2-3):730—736
[70]Hasegawa M, Nishizawa A, Tsuji K,et al. Volatile organic compounds derived from 2-keto-acid decarboxylase inMicrocystis aeruginosa[J].Microbes and Environments, 2012, 27(4): 525—528
[71]Nishikawa K, Machida H, Yamakoshi Y,et al. Polyphosphate metabolism in an acidophilic algaChlamydomonas acidophilaKT-1 (Chlorophyta) under phosphate stress [J].Plant Science, 2006, 170(2):307—313
[72]von Elert E, Jüttner F. Phosphorus limitation and not light controls the extracellular release of allelopathic compounds byTrichormus doliolum(Cyanobacteria)[J].Limnology and Oceanography, 1997, 42(8):1796—1802
[73]Laturnus F, Giese B, Wiencke C,et al. Low molecularweight organoiodine and organobromine compounds released by polar macroalgae-the influence of abiotic factors [J].Fresenius Journal of Analytical Chemistry,2000, 368: 297—302
[74]Collen J, Ekdahl A, Abrahamsson K,et al. The involvement of hydrogen peroxide in the production of volatile halogenated compounds byMeristiella gelidium[J].Phytochemistry, 1994, 36(5): 1197—1202
[75]Vickers C E, Possell M, Cojocariu C I,et al. Isoprene synthesis protects transgenic tobacco plants from oxidative stress [J].Plant Cell and Environment, 2009,32(5): 520—531
[76]Velikova V, Várkonyi Z, Szabó M,et al. Increased thermos stability of thylakoid membranes in isopreneemitting leaves probed with three biophysical techniques [J].Plant Physiology, 2011, 157(2): 905—916
[77]Zuo Z, Chen Z, Shi M,et al. Reactive oxygen species contribute to the release of volatile organic compounds fromChlamydomonas reinhardtiiduring programmed cell death [J].Phycological Research, 2015, 63(1):37—42
[78]Yordanova Z P, Iakimova E T, Cristescu S M,et al. Involvement of ethylene and nitric oxide in cell death in mastoparan-treated unicellular algaChlamydomonas reinhardtii[J].Cell Biology International, 2010, 34(3):301—308
[79]Abrantes N, Antunes S C, Pereira M J,et al. Seasonal succession of cladocerans and phytoplankton and their interactions in a shallow eutrophic lake (Lake Vela,Portugal) [J].Acta Oecologica, 2006, 29(1): 54—64
[80]Li Y, Li D. Competition between toxicMicrocystis aeruginosaand nontoxicMicrocystis wesenbergiiwithAnabaenaPCC7120 [J].Journal of Applied Phycology,2012, 24(1): 69—78
[81]Ikawa M, Sasner J J, Haney J F. Activity of cyanobacterial and algal odor compounds found in lake waters on green algaChlorella pyrenoidosagrowth [J].Hydrobiologia, 2001, 443(1): 19—22
[82]Chang D W, Hsieh M L, Chen Y M,et al. Kinetics of cell lysis forMicrocystis aeruginosaandNitzschia paleain the exposure to β-cyclocitral [J].Journal of Hazardous Materials, 2011, 185(2-3): 1214—1220
[83]Harada K I, Ozaki K, Tsuzuki S,et al. Blue color formation of cyanobacteria with β-cyclocitral [J].Journal of Chemical Ecology, 2009, 35(11): 1295—1301
[84]Zhao J, Yang L, Zhou L,et al. Inhibitory effects of eucalyptol and limonene on the photosynthetic abilities inChlorella vulgaris(Chlorophyceae) [J].Phycologia,2016, 55(6): 696—702
[85]Zhou L, Zhao J X, Xu Q H,et al. Effects of eucalyptol and limonene on the photosynthetic abilities inChlamydomonas reinhardtii[J].Acta Hydrobiologica Sinica, 2016, 40(6): 294—300 [周律, 赵静娴, 徐庆欢,等. 桉树脑和柠檬烯对莱茵衣藻光合特性的影响. 水生生物学报, 2016, 40(6): 294—300]
[86]Zeraatpisheh Z, Vatanparast J. Eucalyptol induces hyperexcitability and epileptiform activity in snail neurons by inhibiting potassium channels [J].European Journal of Pharmacology, 2015, 764: 70—78
[87]Ozdemir G, Karabay N U, Dalay M C,et al. Antibacterial activity of volatile component and various extracts ofSpirulina platensis[J].Phytotherapy Research, 2004, 18(9): 754—757
[88]Gómez-Tenorio M A, Zanón M J, de Cara M,et al. Efficacy of dimethyl disulfide (DMDS) againstMeloidogynesp. and three formae speciales ofFusarium oxysporumunder controlled conditions [J].Crop Protection, 2015, 78: 263—269
[89]Ghadouani A, Pinel-Alloul B, Plath K,et al. Effects ofMicrocystis aeruginosaand purified microcystin-LR on the feeding behavior ofDaphnia pulicaria[J].Limnology and Oceanography, 2004, 49(3): 666—679
[90]Schnitzler I, Pohnert G, Hay M E,et al. Chemical defense of brown algae (Dictyopterisspp.) against the herbivorous amphipodAmpithoe longimana[J].Oecologia, 2001, 126(4): 515—521
[91]Pohnert G. Phospholipase A2 activity triggers the wound activated chemical defense in the diatomThalassiosira rotula[J].Plant Physiology, 2002,129(1): 103—111
[92]Watson S B, Jüttner F, Köster O.Daphniabehavioural responses to taste and odour compounds: ecological significance and application as an inline treatment plant monitoring tool [J].Water Science and Technology,2007, 55(5): 23—31
[93]Jüttner F, Watson S B, von Elert E,et al. β-Cyclocitral,a grazer defence signal unique to the cyanobacteriumMicrocystis[J].Journal of Chemical Ecology, 2010,36(12): 1387—1397
[94]Fink P, von Elert E, Jüttner F. Volatile foraging kairomones in the tittoral zone: attraction of an herbivorous freshwater gastropod to algal odors [J].Journal of Chemical Ecology, 2006, 32(9): 1867—1881
[95]Atkinson R. Atmospheric chemistry of VOCs and NOx[J].Atmospheric Environment, 2000, 34(12—14):2063—2101
[96]Calogirou A, Larsen B R, Kotzias D. Gas-phase terpene oxidation products: a review [J].Atmospheric Environment, 1999, 33(9): 1423—1439
[97]Xu L, Guo H, Boyd C M,et al. Effects of anthropogenic emissions on aerosol formation from isoprene and monoterpenes in the southeastern United States [J].Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(1): 37—42
[98]Yuan J S, Himanen S J, Holopainen J K,et al.Smelling global climate change: mitigation of function for plant volatile organic compounds [J].Trends in Ecology amp; Evolution, 2009, 24(6): 323—331
[99]Orlando J J, Nozière B, Tyndall G S,et al. Product studies of the OH-and ozone-initiated oxidation of some monoterpenes [J].Journal of Geophysical Research, 2000, 105(D9): 11561—11572
[100]Li S Z, Ma Y, Zheng J,et al. Physicochemical properties and cloud nucleating abilities of secondary organic aerosol from α-pinene ozonolysis [J].EnvironmentalChemistry, 2015, 34(9): 1633—1641 [李时政, 马嫣,郑军, 等. α-蒎烯臭氧氧化反应中二次有机气溶胶理化特性与云凝结核活性. 环境化学, 2015, 34(9):1633—1641]
[101]Sievert S, Kiene R, Schulz-Vogt H. The sulfur cycle[J].Oceanography, 2007, 20(2): 117—123
The REVIEW OF RESEARCH ADVANCES IN ALGAL VOLATILE ORGANIC COMPOUNDS
ZUO Zhao-Jiang
(School of Forestry and Biotechnology, Zhejiang A amp;F University, Lin’an 311300, China)
In aquatic ecosystem, abundance of various volatile organic compounds (VOCs) are released from algae, including terpenoids, aldehydes, alcohols, esters, aliphatic hydrocarbons, aromatic series, sulfides and halogenides. These VOCs are synthesized from different secondary metabolism pathways, which can be induced by lots of environmental factors. Under environmental stresses, VOCs play an important role in improving algal resistance. When VOCs are released to water bodies, they transfer stress information to the congener algal cells, and the acceptors can prepare to defense the coming stress. For heterogeneous algal cells, VOCs can inhibit their growth via allelopathic effects and keep emitter's competitive advantages. Meanwhile, VOCs can also repel predators to protect algal cells. The VOCs which can not be captured by acceptors volatilize into the atmosphere and take part in the formation of secondary organic aerosols over the waters. To aid in helping the study of algal VOCs, this research review summarizes the types, forming pathways, inducing factors and ecological functions of algal VOCs.
Volatile organic compounds; Forming pathway; Inducing factor; Ecological function
Q946
A
1000-3207(2017)06-1369-11
2016-11-18;
2017-04-11
国家自然科学青年基金(31300364); 浙江省自然科学基金(LY17C160004); 浙江农林大学科研发展基金人才启动项目(2013FR069)资助 [Supported by the National Natural Science Foundation of China (No. 31300364); the Natural Science Foundation of Zhejiang Province (No. LY17C160004); the School Development Fund for Scientific Research Personnel Startup Project (No.2013FR069)]
左照江(1982—), 男, 河北肃宁人; 博士; 副教授; 主要从事化学生态研究。E-mail: zuozhaojiang@126.com
10.7541/2017.169
