搅拌转速和通风量对里氏木霉发酵β-甘露聚糖酶的影响
2017-11-28谢益晖黄曹兴李鑫赖晨欢余世袁勇强
谢益晖,黄曹兴,李鑫,赖晨欢,余世袁,勇强
(江苏省林业资源高效加工利用协同创新中心,南京林业大学化学工程学院,南京 210037)
搅拌转速和通风量对里氏木霉发酵β-甘露聚糖酶的影响
谢益晖,黄曹兴,李鑫,赖晨欢,余世袁,勇强*
(江苏省林业资源高效加工利用协同创新中心,南京林业大学化学工程学院,南京 210037)
发酵液中溶解氧浓度是好氧发酵过程中反映氧传质效率的综合指标,维持发酵液适宜的溶解氧浓度是实现好氧发酵成功的关键所在,搅拌转速和通风量是影响发酵液溶解氧浓度的重要参数。笔者研究了在3 L发酵罐中搅拌转速和通风量对里氏木霉发酵合成β-甘露聚糖酶的影响。试验结果表明,里氏木霉发酵β-甘露聚糖酶时搅拌转速对氧传质效率的影响大于通风量。以质量浓度为1 g/L的葡萄糖和21.95 g/L的微晶纤维素为碳源发酵合成β-甘露聚糖酶,当搅拌转速450 r/min、通风量0.3 m3/(m3·min)时,发酵过程中溶解氧浓度保持在20%以上,发酵120 h,β-甘露聚糖酶活力、β-甘露糖苷酶活力和菌体质量浓度达到最大值3.92 U/mL,0.033 U/mL和6.56 g/L。因此,发酵过程中溶解氧浓度维持在20%以上可获得较高的β-甘露聚糖酶活力。
β-甘露聚糖酶;里氏木霉;氧传质;溶解氧浓度
β-甘露聚糖酶是一类能够催化甘露聚糖、葡萄甘露聚糖、半乳甘露聚糖和半乳葡萄甘露聚糖主链的β-1,4-甘露糖苷键水解生成低聚糖和单糖的复合酶系[1]。β-甘露聚糖酶主要由β-甘露聚糖酶和β-甘露糖苷酶组成,还包括β-葡萄糖苷酶、α-半乳糖苷酶和脱乙酰酶等支链降解酶[2],在饲料加工、造纸、咖啡提取、木质纤维素糖化等领域广泛应用[3-5]。里氏木霉(Trichodermareesei)除分泌纤维素酶[6],还可分泌大量与植物纤维降解相关的多种聚糖降解酶系,其中包括β-甘露聚糖酶[7-8]。里氏木霉β-甘露聚糖酶酶系分泌组的主要特点为β-甘露糖苷酶活力低,因此里氏木霉β-甘露聚糖酶较适合应用于选择性降解甘露聚糖制备甘露低聚糖。有关里氏木霉β-甘露聚糖酶的制备研究主要集中在培养基组成和培养条件对酶合成的影响方面[9],里氏木霉属好氧微生物,有关氧传质对里氏木霉合成β-甘露聚糖酶的影响研究鲜见报道。在好氧发酵中,氧传质是影响酶活力的重要因素,而在机械通气式发酵罐中,氧传质效率主要由搅拌转速和通风量决定[10]。因此,笔者在3 L发酵罐水平上研究搅拌转速和通风量对里氏木霉发酵产β-甘露聚糖酶的影响,研究结果可为β-甘露聚糖酶发酵技术的工业放大提供依据。
1 材料与方法
1.1 主要材料
菌种:里氏木霉(Trichodermareesei)NL03,β-甘露聚糖酶生产菌株,于4℃条件下保存在PDA斜面培养基上,由南京林业大学生物化工研究所负责保存。
微晶纤维素(Avicel PH101):购于Sigma公司,纤维素质量分数为92%,纤维素结晶度为72%。洋槐豆胶:购于Sigma公司,半乳甘露聚糖质量分数为56%。
1.2 培养基
活化培养基:Mandels培养基[11]。产酶培养基(g/L):葡萄糖1.0;微晶纤维素21.95;硫酸铵4.12;尿素2.07;磷酸二氢钾2.0;硫酸镁0.08;氯化钙0.4;七水硫酸亚铁0.005;一水硫酸锰0.001 6;七水硫酸锌0.001 4。活化培养基和产酶培养基分别用浓度为0.05 mol/L的柠檬酸缓冲液调节初始pH为4.8,培养基于121℃条件下灭菌30 min。
1.3 β-甘露聚糖酶发酵
β-甘露聚糖酶发酵在3 L发酵罐中进行(发酵罐型号BioFlo 110,搅拌器为六叶平直圆盘涡轮搅拌器,美国New Brunswick公司生产)。将里氏木霉试管斜面菌种接入活化培养基中,于恒温振荡器中170 r/min、30℃条件下活化36 h,活化后的种子按接种量10%接入装有1 500 mL发酵培养基的3 L发酵罐中,于搅拌转速为100~500 r/min和通风量为0.2~1.0 m3/(m3·min)条件下培养,通过发酵罐自动控制系统控制发酵液pH为4.8±0.2。产酶第1天温度控制为(30±1)℃,第2天后控制为(28±1)℃。
1.4 分析方法
1.4.1 β-甘露聚糖酶活力测定
于25 mL刻度试管中加入0.9 mL质量浓度为5.0 g/L的洋槐豆胶底物溶液(用pH 5.0柠檬酸-磷酸氢二钠缓冲液配制),50℃条件下预热5 min,加入0.1 mL经适当稀释的酶液,于50℃条件下反应30 min后,立即加入3.0 mL DNS试剂,煮沸7 min,冷却后定容至25 mL,摇匀,采用DNS法测定水解产生的还原糖[12]。以每分钟水解底物产生1 μmol还原糖(以甘露糖计)的酶量定义为1个β-甘露聚糖酶活单位[13]。
1.4.2 β-甘露糖苷酶活力测定
在试管中加入0.1 mL适当稀释的酶液和0.9 mL的1 mmol/L对硝基苯基-β-D-吡喃甘露糖苷(pNPM)溶液(50℃条件下预热5 min),于50℃下保温10 min后,立即加入2.0 mL 1 mol/L的Na2CO3溶液终止反应,加入10 mL蒸馏水,摇匀。于400 nm下测定释放的对硝基苯酚吸光度。以每分钟水解pNPM释放1 μmol对硝基苯酚所需要的酶量定义为1个β-甘露糖苷酶活单位[13]。
1.4.3 菌丝体质量浓度测定
由于发酵液中微晶纤维素和菌丝体难以分离,不能用常规方法测定菌丝体浓度,采用测定菌丝体中蛋白质质量浓度的方法间接测定菌丝体质量浓度[14]。取20 mL发酵液于3 000 r/min条件下离心10 min,弃上清液,使用60 mL蒸馏水分3次洗涤、离心,沉淀物中加入10 mL 0.2 mol/L的NaOH溶液,在100℃条件下煮沸20 min,于3 000 r/min条件下离心10 min,取上清液采用Bradford方法测定蛋白质质量浓度。根据里氏木霉胞内蛋白质质量浓度与菌丝体质量浓度之间的关系,计算菌丝体的质量浓度。
1.4.4 溶解氧浓度测定
溶解氧浓度以溶解氧的相对浓度(dissolved oxygen tension,DOT)表示,即以一定条件下溶解氧量相对于饱和溶解氧量的百分比表示。未加菌种前,发酵罐在最适搅拌下的溶解氧浓度设为100%[10]。DOT采用Hamilton(瑞士)溶解氧电极测定,测定前须进行电极校正。
2 结果与分析
2.1 搅拌转速对里氏木霉合成β-甘露聚糖酶的影响
在好氧发酵中,维持发酵液中一定的溶解氧水平是保证微生物发酵成功的关键。在发酵生产中,影响发酵液溶解氧浓度的主要因素为发酵罐结构、搅拌转速和通风量,其中搅拌转速对溶解氧浓度的影响较大。在3 L发酵罐中,里氏木霉在通风量0.3 m3/(m3·min)条件下发酵产酶,搅拌转速对β-甘露聚糖酶合成的影响如表1所示。由表1可知,里氏木霉在固定通风量0.3 m3/(m3·min)条件下发酵产酶时,搅拌转速越大,越有利于菌丝体获得更多的溶解氧用于菌体的增殖和酶的合成。在搅拌转速低于450 r/min时,β-甘露聚糖酶活力、β-甘露糖苷酶活力和菌丝体质量浓度随搅拌转速增加而升高,当搅拌转速从100 r/min增大到450 r/min时,β-甘露聚糖酶活力、β-甘露糖苷酶活力和菌丝体质量浓度分别从0.28 U/mL,0.005 U/mL和0.52 g/L升高至3.92 U/mL,0.033 U/mL和6.56 g/L。 当搅拌转速高于450 r/min时,酶活力和菌丝体质量浓度反而下降,其原因可能为搅拌转速增加,搅拌桨对丝状真菌的剪切力增大,导致菌丝体断裂而影响菌体的增殖和酶的合成。Feng等[15]在6.6 L发酵罐中研究地衣芽孢杆菌(Bacilluslicheniformis)以魔芋粉为碳源合成β-甘露聚糖酶时发现,当搅拌转速从600 r/min增加至750 r/min后,尽管能保证发酵液中足够的溶解氧浓度,但酶活力反而下降。该结果与本研究的结果一致,即发酵罐搅拌转速达到一定值时,继续提高转速不利于微生物发酵合成β-甘露聚糖酶。
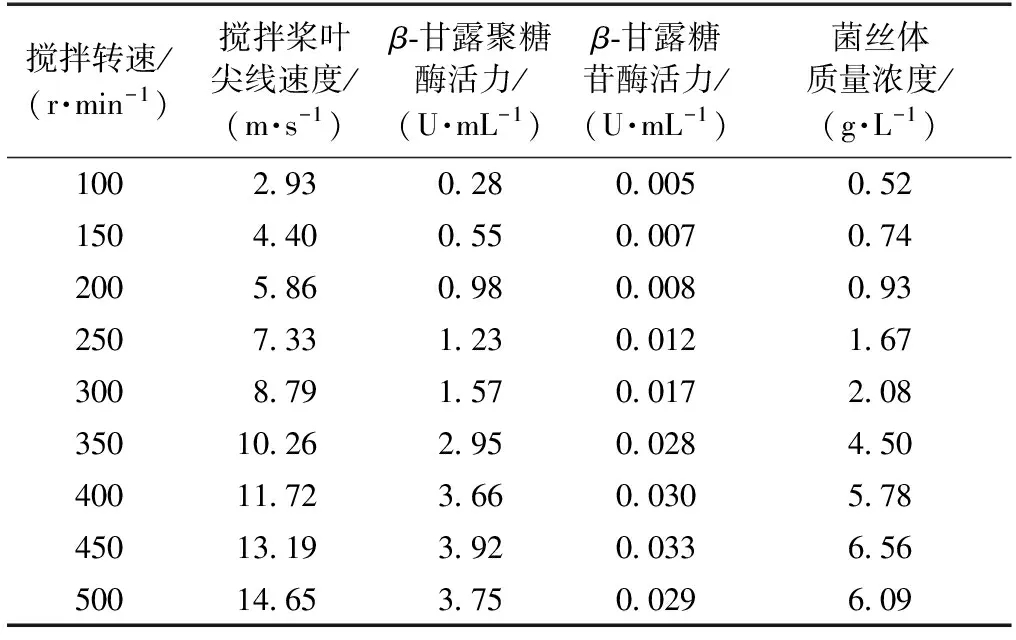
表1 搅拌速度对里氏木霉发酵合成β-甘露聚糖酶的影响Table 1 Effects of agitation speed on β-mannanasepreparation by Trichoderma reesei
2.2 搅拌转速对发酵液中溶解氧浓度的影响
在好氧发酵过程中,发酵液中溶解氧浓度一般要求在临界溶解氧浓度(维持微生物正常生长和代谢需要的最低溶解氧浓度)以上,丝状真菌的临界溶解氧质量分数一般为20%[16]。里氏木霉在通风量0.3 m3/(m3·min)条件下发酵,发酵过程中不同搅拌转速下溶解氧浓度的变化如图1所示。由图1可知,里氏木霉在3 L通气搅拌发酵罐中发酵产β-甘露聚糖酶,在通风量0.3 m3/(m3·min)条件下,搅拌转速对发酵液中溶解氧浓度影响较大。搅拌转速分别为100,200和300 r/min时,当发酵过程进入菌体利用微晶纤维素进行增殖和酶合成时(12 h后),溶解氧浓度快速下降并保持在较低水平,远低于丝状真菌的临界溶解氧浓度(DOT=20%),从而不能保证里氏木霉正常生长和酶合成对氧的需求,导致酶活力较低。当搅拌转速增加至450 r/min时,在整个发酵过程中发酵液溶解氧浓度基本保持在临界溶解氧浓度以上,满足了里氏木霉菌体增殖和产酶对氧的需求。当搅拌转速继续增加至500 r/min时,在发酵过程中发酵液溶解氧浓度均高于搅拌转速为450 r/min时的溶解氧浓度,但过高的搅拌转速存在高剪切力、泡沫量大和动力消耗大等不利影响。
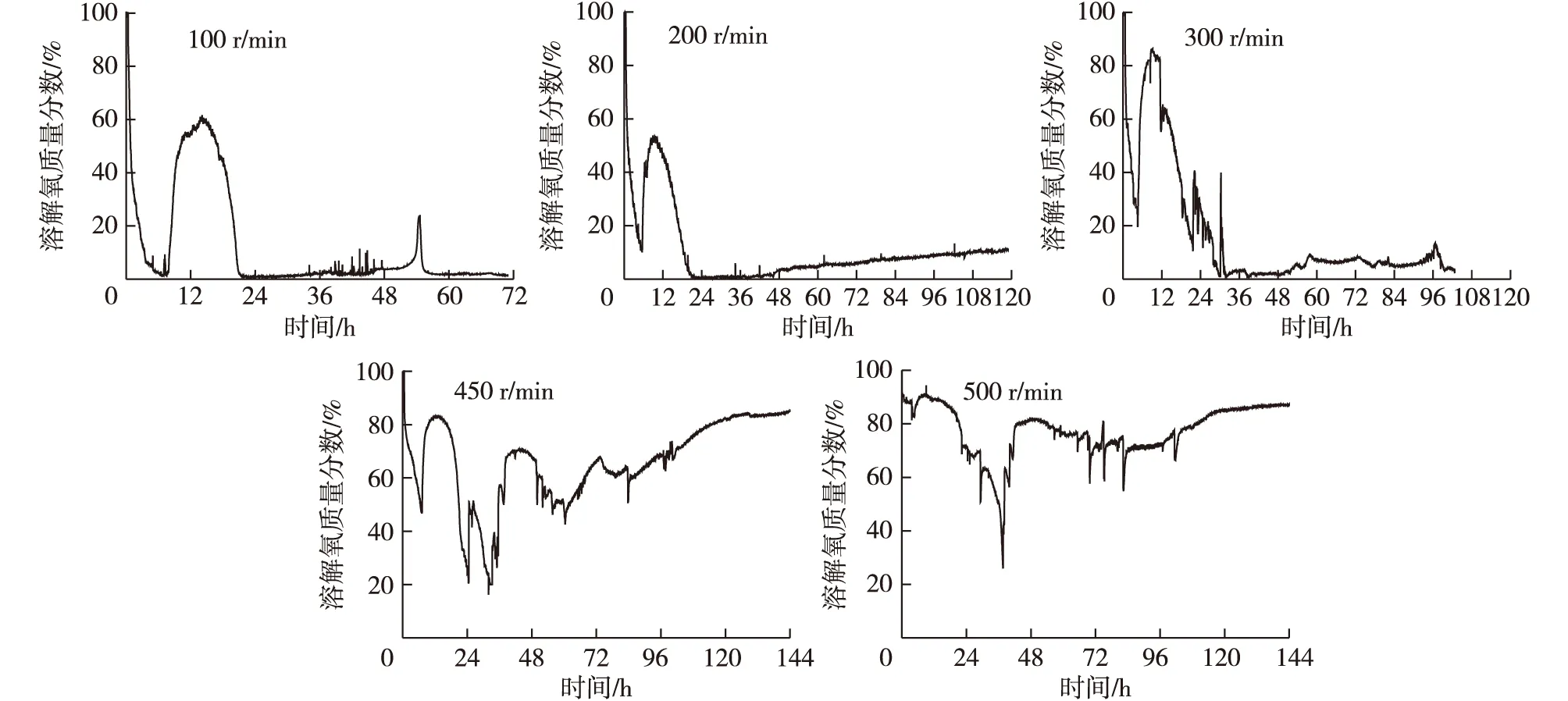
图1 不同搅拌转速下发酵液溶解氧浓度变化Fig. 1 Changes of dissolved oxygen tension at different agitation speeds
2.3 通风量对里氏木霉合成β-甘露聚糖酶的影响
通风量是影响好氧微生物发酵过程中氧传质的另一个因素,通风量越高,体积溶氧系数越大,但当通风量增加到一定值时,通风量对体积溶氧系数没有影响。里氏木霉在3 L发酵罐中,于搅拌转速450 r/min条件下发酵产酶,通风量对β-甘露聚糖酶合成的影响如表2所示。由表2可知,当搅拌转速为450 r/min、通风量为0.3 m3/(m3·min)时,里氏木霉发酵产β-甘露聚糖酶活力最高。当通风量为0.2 m3/(m3·min)时,β-甘露聚糖酶活力、β-甘露糖苷酶活力和菌丝体质量浓度均低于通风量为0.3 m3/(m3·min)时的酶活力和菌丝体质量浓度,其原因可能是当通风量为0.2 m3/(m3·min)时,在发酵28~36 h时段内发酵液中溶解氧浓度低于临界溶解氧浓度(DOT=20%),从而不利于里氏木霉的生长和酶的合成(图2)。当通风量高于0.3 m3/(m3·min)时,尽管发酵液中溶解氧浓度均高于临界溶解氧浓度,但酶活力和菌体质量浓度反而降低,原因可能是过高的通风量使得发酵过程中产生大量泡沫,多数菌体存在于发酵罐上层泡沫中而得不到营养。

表2 通风量对里氏木霉发酵合成β-甘露聚糖酶的影响Table 2 Effects of aeration rate on β-mannanasepreparation by T. reesei
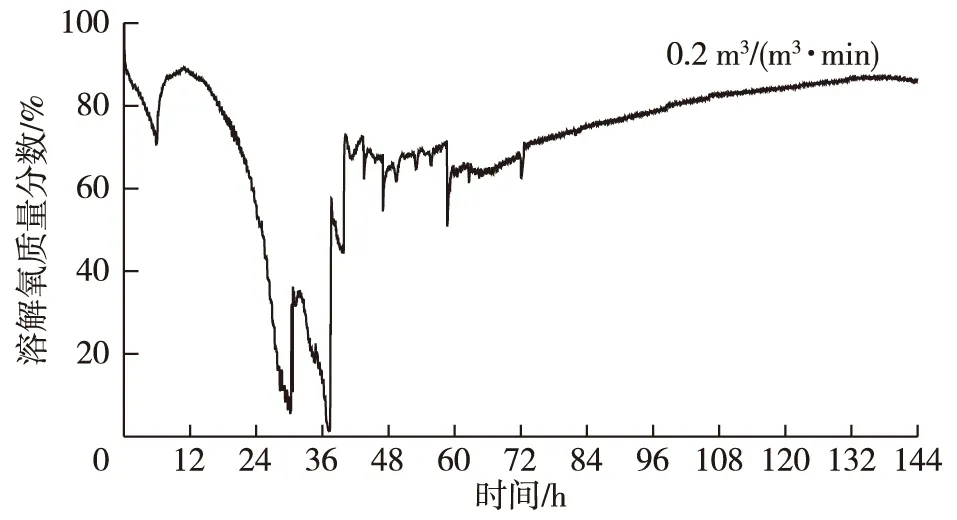
图2 在通风量0.2 m3/(m3·min)下里氏木霉发酵的溶解氧变化Fig. 2 Change of dissolved oxygen tension in fermentationof T. reesei with aeration rate of 0.2 m3/(m3·min)
2.4 典型发酵过程分析
在好氧发酵过程中溶解氧浓度是表征微生物代谢的重要指标。里氏木霉以1 g/L葡萄糖和21.95 g/L微晶纤维素为碳源,在450 r/min、0.3 m3/(m3·min)条件下发酵合成β-甘露聚糖酶,发酵过程中溶解氧和主要参数变化如图3和4所示。由图3和4可知,里氏木霉在3 L通气搅拌发酵罐中,于搅拌转速450 r/min、通风量0.3 m3/(m3·min)条件下发酵产β-甘露聚糖酶,发酵0~6 h期间,菌体快速利用培养基中的葡萄糖用于生长,发酵液中氧的溶解速率低于菌体耗氧速率,溶解氧浓度迅速下降至45%;发酵6~12 h期间,培养基中葡萄糖基本消耗,菌体开始以微晶纤维素为碳源进行生长,由于菌体质量浓度较低,其分解产生的葡萄糖量较少,因此菌体耗氧较少,发酵液中氧的溶解速率高于菌体摄取氧的速率,溶解氧浓度上升;发酵12~36 h期间,随微晶纤维素分解的葡萄糖增加,菌体大量消耗葡萄糖进行增殖,菌体生长进入对数生长期,发酵液中氧的溶解速率低于菌体的摄氧速率,溶解氧浓度快速下降并维持在较低水平,且溶解氧浓度维持在临界溶解氧浓度20%水平左右;在发酵36 h后,随菌体生长进入稳定期,表现为菌体生物量增长缓慢,菌体开始大量合成β-甘露聚糖酶,菌体耗氧量减少,发酵液中氧的溶解速率高于菌体摄氧速率,溶解氧浓度增加;发酵末期,随菌体进入凋亡期,菌体开始死亡溶解,酶合成基本停止,发酵液中溶解氧浓度继续增加。
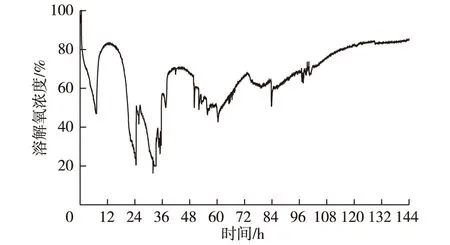
图3 典型发酵过程中的溶解氧变化Fig. 3 Change of dissolved oxygen tension duringtypical fermentation process

图4 里氏木霉发酵合成β-甘露聚糖酶的发酵历程Fig. 4 Course of β-mannanase fermentation by T. reesei
综上可知,里氏木霉在3 L发酵罐中发酵合成β-甘露聚糖酶,当搅拌转速和通风量分别为450 r/min和0.3 m3/(m3·min)时,可保证发酵过程中溶解氧浓度维持在临界溶解氧浓度以上,从而满足里氏木霉发酵对氧的需求。鉴于本研究所采用的3 L发酵罐规模较小,通风量结果可能存在一定误差,今后将在本研究基础上在更大规模发酵罐上开展研究,为β-甘露聚糖酶发酵的工业化放大提供更准确数据。
3 结 论
在3 L发酵罐水平上研究不同搅拌转速和通风量对里氏木霉发酵合成β-甘露聚糖酶的影响。结果表明,里氏木霉以1 g/L葡萄糖和21.95 g/L微晶纤维素为碳源发酵合成β-甘露聚糖酶时,当搅拌转速为450 r/min、通风量为0.3 m3/(m3·min)时,发酵120 h,β-甘露聚糖酶活力、β-甘露糖苷酶活力和菌体质量浓度达到最大值分别为3.92 U/mL,0.033 U/mL和6.56 g/L。发酵液溶解氧浓度是反映微生物发酵时氧传质效率的综合指标,里氏木霉发酵合成β-甘露聚糖酶,发酵过程中溶解氧浓度维持在20%以上可取得良好的发酵效果。
[1]YATMAZ E, KARAHALIL E, GERMEC M, et al. Controlling filamentous fungi morphology with microparticles to enhancedβ-mannanase production[J]. Bioprocess and Biosystems Engineering, 2016, 39(9):1391-1399.
[2]王静, 李鑫, 朱均均, 等. 培养基组成对里氏木霉合成β-甘露聚糖酶的影响[J]. 南京林业大学学报(自然科学版), 2013, 37(1):101-104.
WANG J, LI X, ZHU J J, et al. Effects of medium components onβ-mannanase production byTrichodermareesei[J]. Journal of Nanjing Forestry University (Natural Sciences Edition), 2013, 37(1):101-104.
[3]章飘海, 王琤韡.β-甘露聚糖酶在畜禽中的应用[J]. 饲料与畜牧:新饲料, 2015(2):52-53.
[4]SINGH G, CAPALASH N, KAUR K, et al. Chapter 7—Enzymes:applications in pulp and paper industry[M]. Agro-Industrial Wastes as Feedstock for Enzyme Production, 2016:157-172.
[5]FREITAS M N D, CONSOLACCEDIL A D, CLEMENTE A D C, et al. Relevance of endo-β-mannanase enzyme in coffee seed deterioration process[J]. African Journal of Agricultural Research, 2017, 12(15):1253-1258.
[6]覃玲灵, 何钢, 陈介南. 里氏木霉及其纤维素酶高产菌株的研究进展[J]. 生物技术通报,2011(5):43-49.
QIN L L, HE G, CHEN J N. Research development ofTrichodermareeseiand its cellulase hyperproduction strains[J]. Biotechnology Bulletin, 2011(5):43-49.
[7]CHAI S Y, BAKAR F D A, MAHADI N M. A thermotolerant Endo-1,4-beta-mannanase fromTrichodermavirensUKM1:cloning, recombinant expression and characterization[J]. Journal of Molecular Catalysis B—Enzymatic, 2016,125:49-57.
[8]MIKKELSON A, MAAHEIMO H, HAKALA T K. Hydrolysis of konjac glucomannan byTrichodermareeseimannanase and endoglucanases Cel7B and Cel5A for the production of glucomannooligosaccharides[J]. Carbohydrate Research, 2013,372(1):60-68.
[9]王静.β-甘露聚糖酶的制备与分离纯化的研究[D]. 南京:南京林业大学, 2012.
WANG J. Production, purification and characteristic ofβ-Mannanase[D]. Nanjing:Nanjing Forestry University, 2012.
[10]杭志喜. 溶解氧对里氏木霉产纤维素酶的作用和控制[D]. 南京:南京林业大学, 2008.
HANG Z X. Effect and control of dissolved oxygen on the cellulase production byTrechodermareesei[D]. Nanjing:Nanjing Forestry University, 2008.
[11]MANDELS M, MEDEIROS J E, ANDREOTTI R E, et al. Enzymatic hydrolysis of cellulose:evaluation of cellulase culture filtrates under use conditions[J]. Biotechnology and Bioengineering,1981, 23(9):2009-2026.
[12]GHOSE T K. Measurement of cellulase activities[J]. Pure and Applied Chemistry, 2009,59(2):257-268.
[13]MUDAU M M. The production, purification and characterization of endo-1,4-β-mannanase from newly isolated strains ofScopulariopsiscandida[D]. Bloemfontein in South Africa:Faculty of Natural and Agricultural Sciences, 2006.
[14]ZHANG Q, LO C M, JU L K. Factors affecting foaming behavior in cellulase fermentation byTrichodermareeseiRut C-30[J]. Bioresource Technology, 2007, 98(4):753-760.
[15]FENG Y Y, HE Z M, ONG S L, et al. Optimization of agitation, aeration, and temperature conditions for maximumβ-mannanase production[J]. Enzyme and Microbial Technology, 2003, 32(2):282-289.
[16]WEBER J, AGBLEVOR F A. Microbubble fermentation ofTrichodermareeseifor cellulase production[J]. Process Biochemistry, 2005, 40(2):669-676.
Effectofagitationspeedandaerationrateonfermentationsynthesisofβ-mannanasewithTrichodermareesei
XIE Yihui, HUANG Caoxing, LI Xin, LAI Chenhuan, YU Shiyuan, YONG Qiang*
(Jiangsu Co-Innovation Center for Efficient Processing and Utilization of Forest Products, College of ChemicalEngineering, Nanjing Forestry University, Nanjing 210037, China)
Trichodermareeseiis a kind of microorganism that can secrete enzymes (cellulase, hemicellulase,β-mannanase etc.) by aerobic fermentation with carbon sources, nitrogen source, and nutritive salt. For aerobic fermentation, the concentration of dissolved oxygen of fermentation broth is a comprehensive index to reflect the oxygen transfer efficiency. Meanwhile, maintaining a suitable concentration of dissolved oxygen in the fermentation broth is important to aerobic fermentation. During the fermentation process, the agitation speed and the aeration rate are both important parameters for oxygen transferring. In this study, the effects of the agitation speed (100-500 r/min) and the aeration rate (0.2-1.0 m3/(m3·min)) on the production ofβ-mannanase byT.reeseiwere investigated in a 3 L fermentor. Specifically, theβ-mannanase activity,β-manosidase activity and biomass were investigated when different agitation speed and aeration rate were carried out. The results showed that both the increased agitation speed and aeration rate could lead to higher oxygen transfer efficiency. However, the effect of agitation speed on oxygen transfer efficiency was greater than that of aeration rate. With the fermentation conditions for 1 g/L of glucose and 21.95 g/L of microcrystalline cellulose as carbon sources at 450 r/min of agitation rate and 0.3 m3/(m3·min) of aeration rate for 120 h, the dissolved oxygen tension can be remained above 20% during fermentation process. Accordingly,T.reeseicould produce theβ-mannanase with maximalβ-mannanase activity,β-manosidase activity and biomass of 3.92 U/mL, 0.033 U/mL and 6.56 g/L, respectively. Therefore, it can be concluded that higherβ-mannanase activity can be obtained when the dissolved oxygen tension is maintained at more than 20% in the fermentation process.
β-mannanase;Trichodermareesei; oxygen transfer; dissolved oxygen concentration
2017-01-15
2017-03-03
国家林业公益性行业科研专项(201404615);江苏省前瞻性联合研究项目(BY2015006-05);江苏省重点研发计划(BF2015007);江苏高校自然科学研究项目(15KJB530009)。
谢益晖,男,研究方向为生物化工。
勇强,男,教授。E-mail:swhx@njfu.com.cn
TQ351
A
2096-1359(2017)06-0092-05
