化香果单宁/聚N, N-二甲基丙烯酰胺水凝胶的制备及细胞黏附性能
2017-11-28胡新宇汪咏梅张亮亮徐曼
胡新宇,汪咏梅,张亮亮,徐曼
(中国林业科学研究院林产化学工业研究所,江苏省生物质能源与材料重点实验室,南京 210042)
化香果单宁/聚N,N-二甲基丙烯酰胺水凝胶的制备及细胞黏附性能
胡新宇,汪咏梅,张亮亮,徐曼
(中国林业科学研究院林产化学工业研究所,江苏省生物质能源与材料重点实验室,南京 210042)
聚N, N-二甲基丙烯酰胺(PDMAA)水凝胶的孔结构过于致密且不可降解,限制了其在组织工程领域的应用。为解决这些问题,笔者利用半互穿聚合物网络(semi-IPN)技术,在PDMAA网络中加入化香果单宁(TA),设计并合成了一系列新型的TA/PDMAA semi-IPN水凝胶,将“细胞黏附及可降解特性”引入水凝胶体系中。结果表明:加入1 mL TA溶液(质量分数为3%)明显改善了凝胶的孔结构,TA/PDMAA semi-IPN水凝胶表现出连续均匀的多孔结构,孔径分布为37.7~87.1 μm。在磷酸盐缓冲液(PBS)中,TA/PDMAA semi-IPN水凝胶可以降解,交联剂的含量可以调控降解速率。胞外毒性分析结果证明了TA/PDMAA semi-IPN水凝胶对COS-7细胞及CHO细胞完全无毒,细胞成活率均高于90%。引入TA显著改善了细胞黏附情况,COS-7细胞及CHO细胞可在TA/PDMAA semi-IPN水凝胶表面较好生长。TA/PDMAA semi-IPN水凝胶表现出较好的生物相容性,具有在组织工程领域应用的潜力。
半互穿聚合物网络水凝胶;细胞黏附特性;多孔结构;可降解;细胞成活率
水凝胶为具有大量亲水性基团的三维网络,在水中能够溶胀吸收自身几十倍甚至上千倍的水分,且具有较好的保持水分能力,即使在外界压力下水分也不会流失,可较好地模拟人体内环境,因此,水凝胶在组织工程领域的应用具有较大优势[1]。作为组织工程材料,水凝胶必须具备良好的生物相容性、力学性能、细胞或蛋白吸附性等。合成类高分子水凝胶(如聚丙烯酸、聚丙烯酰胺、聚丙烯酸酯等)具备较理想的机械性能、可控制的化学组成、制备过程以及分子量[2-3],但其生物相容性较差,孔结构过于致密,对于外部环境的响应缓慢且缺乏生物活性[4-5],导致体系不具备细胞识别信号,不适于活性物质和细胞的负载。
植物单宁广泛地存在于植物的叶、果实、根以及树皮等部位中,是重要的天然多酚类活性物质,也是天然产物中被研究较早、较多的一类化合物。植物单宁具有较强的抗氧化、抗病毒等多种生物活性,且能与蛋白质、多糖、生物碱相结合,与金属离子络合,被广泛用作抑菌剂、抗肿瘤药物、抗氧化剂、防腐剂等[6-7]。利用半互穿聚合物网络(semi-IPN)技术,将植物单宁与高分子聚合物相融合,制备的凝胶材料可以有效地解决合成类高分子水凝胶存在的问题。这类半互穿聚合物网络水凝胶具有连续、均匀的多孔结构,且对水分子和其他小分子物质具有较好的渗透性,有效地降低了对所黏附细胞的刺激[8-9]。另外,植物单宁亲水性强,进一步增大了凝胶网络中的含水量,系统因此获得一定的流体性质,有助于营养物质的扩散和细胞代谢产物的排泄,更好地模拟生物体内的组织器官,为细胞的渗入、生长扩散提供场所,为组织生长所需营养物质与组织代谢物提供通道[10-11]。
笔者采用半互穿聚合物网络技术,将化香果单宁(TA)引入到聚N, N-二甲基丙烯酰胺(PDMAA)体系中,设计、合成了一种全新的TA/PDMAA semi-IPN水凝胶,分析了加入植物单宁对凝胶的孔结构、热稳定性、溶胀性能、机械性能、降解性能及胞外毒性的影响,研究了引入植物单宁对凝胶细胞黏附性能的影响。通过这些表征探索TA/PDMAA semi-IPN水凝胶,以期在组织工程领域的应用潜力,进一步扩展植物单宁的使用范围。
1 材料与方法
1.1 原料和仪器
化香果单宁(TA,经纯化处理,质量分数为78%,中国林科院林产化学工业研究所);N, N-二甲基丙烯酰胺(DMAA)(分析纯)、N, N’-亚甲基双丙烯酰胺(BAAm)(分析纯)、过硫酸铵(APS)(分析纯)、N, N, N′, N′-四甲基乙二胺(TEMED)(分析纯)(上海阿拉丁试剂公司);Dulbecco改良Eagle培养基(DMEM)、MTT试剂盒(碧云天生物技术研究所);COS-7细胞和CHO细胞(ATCC细胞库)。
MS304S电子天平(梅特勒-托利多集团),恒温磁力搅拌器、HH-6恒温水浴锅、鼓风干燥箱、HY-4调速振荡器(常州国华仪器有限公司),BenchTop Pro台式冻干机(美国VirTis公司),Nicolet IS-10红外光谱仪(美国Thermo Fisher Scientific公司),Philips PW 1720 X射线衍射仪(荷兰Philips公司),TA Model Q600热重分析仪(美国TA公司),JEOLJSM-6380LV扫描电子显微镜(日本电子株式会社),MCR101流变分析仪(奥地利Anton Paar公司),PowerWave XS酶标仪(美国BioTek公司),CKX31荧光显微镜(日本奥林巴斯株式会社)。
1.2 TA/PDMAA semi-IPN水凝胶的制备
TA/PDMAA semi-IPN水凝胶主要采用自由基交联共聚法在水相、30℃条件下进行制备,制备方法如图1。具体方法为:在50 mL四口烧瓶中将1 mL质量分数为3%的TA溶液、2 mL质量分数为35% 的DMAA单体溶液及不同量的BAAm进行混合(表1)。然后将机械搅拌桨、温度计以及氩气(argon gas)管插入至瓶口位置,再将此四口瓶移入0℃的冰浴中,加入1 mL体积分数为2.5%的TEMED溶液,体系在氩气环境中搅拌30 min,每隔10 min添加一次冰,确保体系的温度维持在0℃左右。随之利用注射器将1 mL质量分数为8%的APS溶液逐滴缓慢加入反应瓶中,快速搅拌3 min。将7 mL此混合液移入至玻璃模具中,密封后置于30℃恒温水浴锅内。反应24 h后,将凝胶样品从模具中移出,置于去离子水中浸泡7 d,期间每天换4次水,确保未反应单体、引发剂等小分子物质充分除去,然后将样品冻干并置于保干器中储存。纯PDMAA水凝胶制备方法相同,反应物用量见表1。
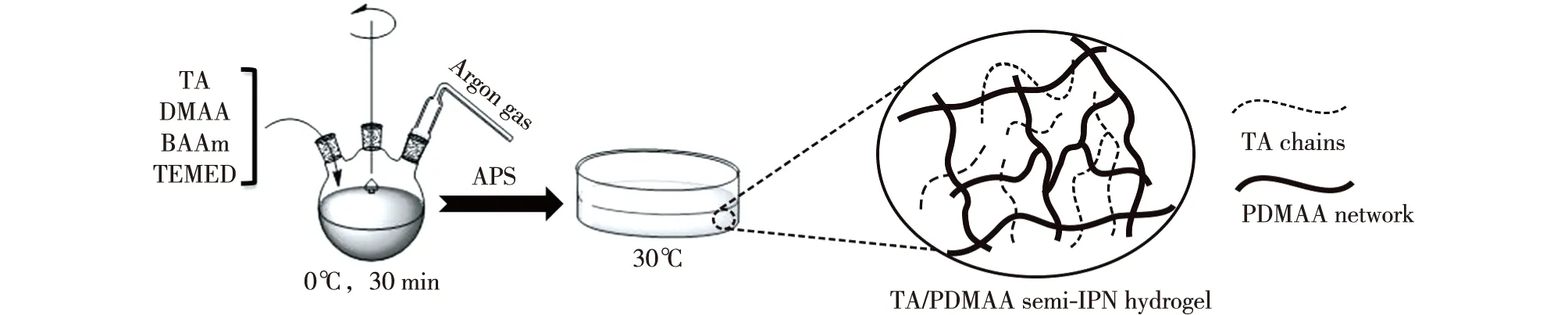
图1 TA/PDMAA semi-IPN水凝胶的制备方法Fig. 1 Scheme showing preparation of TA/PDMAA semi-IPN hydrogel
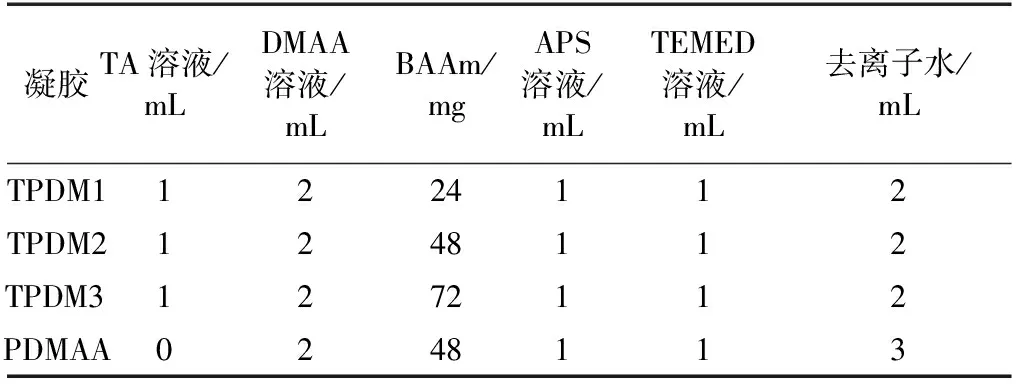
表1 制备原料用量及样品编号Table 1 Composition of initial reaction mixtures usedfor preparation of hydrogels
注:TA溶液的质量分数为3%;DMAA溶液的质量分数为35%;APS溶液的质量分数为8%;TEMED溶液的体积分数为2.5%。
1.3 TA/PDMAA semi-IPN水凝胶的结构表征和性能测试
1.3.1 红外光谱(FT-IR)表征
TA粉末和冻干的凝胶样品在4 000~400 cm-1范围内利用Nicolet IS-10红外光谱仪进行全反射红外光谱分析。
1.3.2 X射线衍射(XRD)表征
将TA和冻干的凝胶样品磨成粉末状,使用Philips PW 1720 X射线衍射仪进行X射线衍射分析。测试时使用Cu Kα射线,波长0.154 nm,电压为30 kV,电流为20 mA,扫描范围为2θ=10°~60°,扫描速率为10°/min。
1.3.3 热重分析(TGA)表征
将TA和冻干的凝胶样品磨成粉末状,使用TA Model Q600热分析仪测定其热性能的变化。测定参数:氮气氛围,升温速率10℃/min,温度范围35~600℃。
1.3.4 溶胀行为测试
将0.5 g干凝胶样品分别置于去离子水或质量分数为0.9%的NaCl溶液中,在25℃条件下测定吸水溶胀情况[10]。在指定的时间点将凝胶捞出,用湿滤纸将凝胶表面的水分擦除,使用电子天平测定吸水率(SR)。所有测试均重复3次。
SR= (Wt-Wd)/Wd
式中:Wt为在特定时间点t时凝胶的质量,g;Wd为干凝胶的质量,g。
1.3.5 形貌表征
凝胶内部孔结构使用扫描电子显微镜(SEM)进行观察。测试前将冻干的凝胶样品切为小块,然后镀金以提高导电率。利用Nano Measurer 1.2.5软件(复旦大学研制)计算孔径,至少选择20个孔进行平均孔径及标准差计算。
1.3.6 动态力学性能测试
用于测试的凝胶样品厚度为2 mm,采用50 mm平行板夹具,试验温度固定在25℃。为保证样品动态测试在线性范围内,首先对凝胶样品使用MCR101流变分析仪进行动态应变扫描,固定频率为1 Hz,扫描范围为0.05%~300%;样品的动态频率扫描,在线性范围内固定应变为0.5%,扫描范围为0.1~10.0 Hz。
1.3.7 体外降解实验
将溶胀平衡的凝胶样品置于pH 7.4的PBS溶液中(含有质量分数为0.02%的叠氮化钠),在37℃条件下进行测试[5]。在指定的时间内将样品取出,用湿滤纸擦掉表面的溶液,然后称质量。所有测试均重复3次。剩余质量百分率(weight remaining)采用如下公式计算:
剩余质量百分率=Wt/W0× 100%
式中:Wt为在特定时间点t时凝胶的质量,g;W0为凝胶的初始质量,g。
1.3.8 胞外毒性评估
1)COS-7细胞和CHO细胞培养。从冷冻温度为-70℃的冰箱中取出冻存的COS-7细胞和CHO细胞,在37℃水浴中迅速解冻,加入质量分数为10%的胎牛血清的DMEM培养基(含100 U/mL青霉素和100 μg/mL链霉素)复苏细胞。在37℃、5%(质量分数)的CO2培养箱中培养,用质量分数为0.25%的胰蛋白酶消化细胞并传代培养。
2)毒性评估。胞外毒性采用间接法,根据国际标准ISO 10993—5进行测试[8]。干凝胶样品首先用质量分数为70%的乙醇溶液灭菌,然后使用灭菌PBS溶液淋洗数次,再将样品置于包含血清的DMEM培养基中浸泡7 d,所有操作均在超净台中完成。
细胞毒性通过MTT法进行测定[9]。COS-7细胞和CHO细胞接种到96孔板,接种密度为每立方厘米5×103细胞,37℃条件下培养24 h。将培养基从96孔板移出,加入凝胶提取液,继续培养24 h。然后每孔加入50 μL的MTT溶液,继续培养4 h。随后将孔内液体移出,每孔加入150 μL二甲基亚砜,振荡15 min,以溶解细胞增殖所产生的甲臜结晶。再将培养板置于酶标仪中,在570 nm处读取吸光度。不加凝胶提取液的细胞作为阴性对照。
3)细胞接种。首先将凝胶样品(直径为10 mm,厚度为2 mm)置于体积分数为70%的乙醇溶液中灭菌30 min,然后用灭菌的PBS溶液及DMEM浸泡过夜,以除去凝胶表面及内部的乙醇溶液。以上操作均在超净台中完成。再将灭菌的凝胶样品平铺到6孔板中,以每立方厘米1×104细胞的密度将COS-7细胞和CHO细胞接种到凝胶表面,在37℃、5%(质量分数)的CO2条件下分别培养1和4 d,培养基隔天换一次。
4)细胞观察。经过1和4 d培养后,使用37℃的PBS溶液将未黏附的细胞从凝胶表面淋洗下来,并用质量分数为3%的戊二醛将细胞固定。30 min后,用37℃的PBS溶液淋洗凝胶样品3次,然后在荧光显微镜下观察细胞。
2 结果与分析
2.1 FT-IR分析

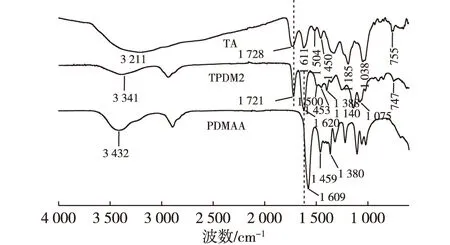
图2 TA、TPDM2和PDMAA水凝胶的红外谱图Fig. 2 The FT-IR spectra of TA, TPDM2 andPDMAA hydrogel
2.2 水凝胶形成机理分析
TA/PDMAA semi-IPN水凝胶的制备过程是DMAA单体在TA存在的情况下进行自由基共聚反应,聚合反应的同时,TA与DMAA形成的共聚物网络进行互穿。体系采用的交联剂为常用的BAAm,引发剂APS与加速剂TEMED配对使用。反应初始阶段首先是TEMED加速APS产生硫酸根自由基,进而引发单体与交联剂进行共聚反应,最终形成PDMAA三维网络,TA分子链插入此网络,并与网络进行物理缠绕,利用TA羟基之间以及羟基与PDMAA氨基、羰基之间的氢键作用(2.1 FT-IR分析部分已证实),维持整个网络结构的稳定性[18]。
2.3 XRD分析
TPDM2与TA、PDMAA凝胶进行对比的XRD谱图如图3所示。由图3可见,TA在2θ=24.5°附近有衍射峰,表示TA中的结晶区域。与TA相比,TPDM2在2θ=24.8°附近出现了一个更宽更弱的弥散峰,说明PDMAA网络加入后,TA的结晶程度进一步减少,分子间氢键遭到破坏[19]。
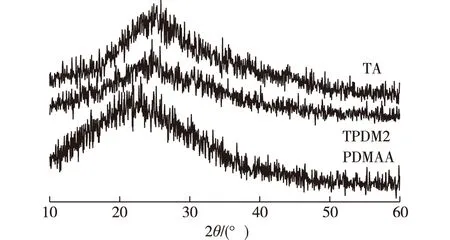
图3 TA、TPDM2和PDMAA水凝胶的XRD谱图Fig. 3 The XRD spectra of TA, TPDM2 andPDMAA hydrogel
2.4 热稳定性分析
TA、PDMAA和TPDM2水凝胶的热重曲线如图4所示。由图4可见,TA在100℃之前的热质量损失主要为样品中的水汽,质量损失率为3.3%;242~376℃质量损失率约为35.8%,主要为TA中酯键和侧链的分解;376~597℃质量损失率为75.5%,主要为TA芳环骨架的分解。PDMAA的热质量损失主要分为3个阶段:第1阶段在100℃之前,主要为材料中水汽的蒸发,质量损失率为12.5%;第2阶段为245~341℃,质量损失率为37.1%,主要是由于氨基以氨气的形式分解,以环化的方式形成了酰亚胺;第3阶段为341~600℃,质量损失率为86.9%,主要为环化产物的分解。TPDM2的热质量损失也分为3个阶段:第1阶段为34.9~100℃,质量损失率为11.2%,主要为样品中水汽的排出;第2阶段为242~333℃,质量损失率为30.0%;第3阶段为360~600℃,质量损失率为72.4%。后两个阶段的热质量损失包含一系列复杂的分解过程,包括TA骨架的分解、PDMAA分子链的裂解以及整个凝胶网络分解为小分子。需要注意的是,TPDM2各阶段的质量损失率均低于PDMAA各阶段的质量损失率,说明TA引入后,通过与PDMAA网络缠绕形成半互穿聚合物网络后,凝胶体系的热稳定性得以提高。
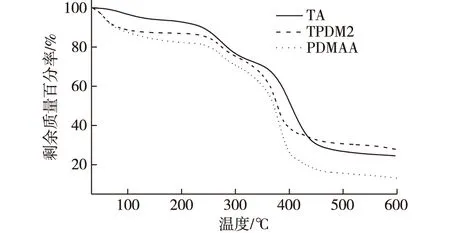
图4 TA、TPDM2和PDMAA水凝胶的热重曲线Fig. 4 The TGA curves of TA, TPDM2 andPDMAA hydrogel
2.5 溶胀行为分析
凝胶的溶胀动力学曲线如图5所示。从图5可以看出,当BAAm使用量从72 mg降至24 mg时(表1),吸水率随之增加。TPDM1表现出最大的吸水率27.6 g/g,TPDM2为22.1 g/g,TPDM3为17.4 g/g。总的来说,吸水率受到凝胶网络交联度的影响[20]。对于TA/PDMAA semi-IPN水凝胶而言,当BAAm使用量从72 mg降至24 mg时,凝胶网络的交联度也随之降低,TA和PDMAA网络的缠绕变得松弛,聚合物分子链之间的摩擦减弱,极大地扩大了水分子的空间,吸水能力增强。因此,TPDM1表现出了最高的吸水率[21]。而当BAAm使用量进一步降低时,即低于24 mg时,这一趋势将得以延续,吸水能力进一步增强。
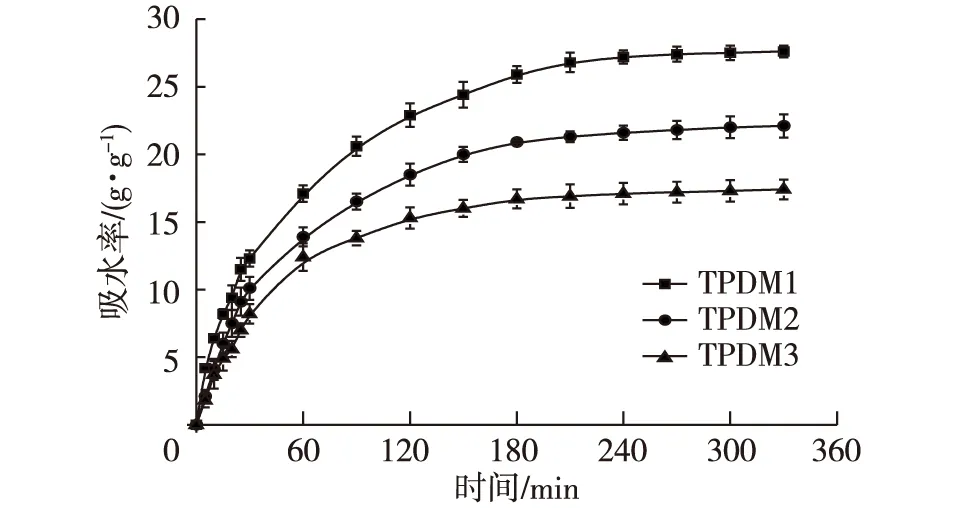
图5 TA/PDMAA semi-IPN水凝胶的溶胀动力学曲线Fig. 5 Swelling kinetic curves of TA/PDMAAsemi-IPN hydrogels
凝胶在去离子水中和质量分数为0.9%的NaCl溶液中的溶胀平衡吸水率如图6所示。从图6可以看出,凝胶在NaCl溶液中的溶胀平衡吸水率低于在去离子水中的溶胀平衡吸水率。这是因为溶液中盐浓度的增加导致凝胶网络与外部溶液的渗透压差降低,阻止了水分子进入凝胶网络中,导致吸水率降低[22-23]。
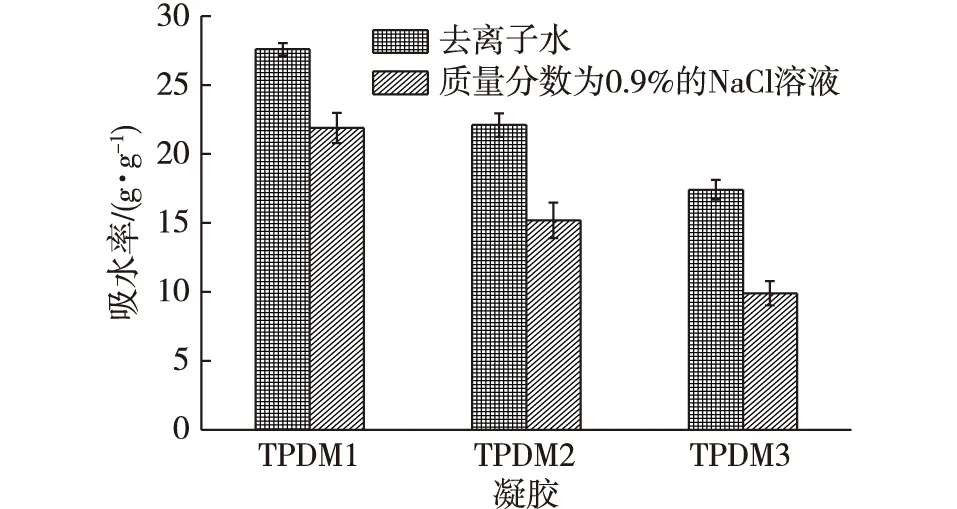
图6 TA/PDMAA semi-IPN水凝胶在去离子水及质量分数为0.9%的NaCl溶液中的吸水率Fig. 6 Swelling ratio in deionized water and 0.9 wt%NaCl solution of TA/PDMAA semi-IPN hydrogel
2.6 SEM形貌观察
冻干凝胶内部形貌的SEM图片如图7所示。由图7可见,纯PDMAA凝胶表现出致密光滑几乎无孔的内部形貌,而TA/PDMAA semi-IPN水凝胶则表现了高度连续、分布均匀的多孔结构,说明TA的引入使得凝胶的孔结构发生了较大变化。从TPDM1到TPDM3,凝胶的孔径逐渐变小。其中,TPDM1具有最大孔径,为(87.1 ± 5.5) μm;TPDM2为(62.8 ± 5.2) μm;TPDM3为(37.7 ± 6.2) μm。这一趋势与上述讨论的凝胶溶胀吸水率有关。随BAAm用量的增加,体系的交联度增加,导致凝胶含水量降低并限制了水分子的自由移动。在冷冻干燥的过程中,这些水分被冻成了更小的冰晶,这些冰晶最终形成了小孔[24]。SEM结果表明,TA/PDMAA semi-IPN水凝胶的孔径大小可根据BAAm用量进行调控。

a)PDMAA水凝胶;b)TPDM1;c)TPDM2;d)TPDM3图7 纯PDMAA和TA/PDMAA semi-IPN水凝胶电镜图Fig. 7 The SEM images of PDMAA and TA/PDMAAsemi-IPN hydrogel
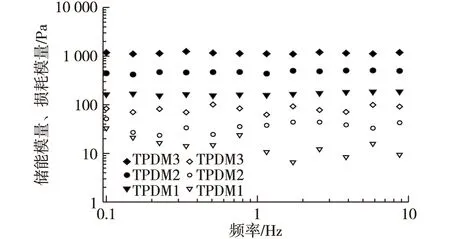
实心图例:储能模量;空心图例:损耗模量图8 纯PDMAA及TA/PDMAA semi-IPN水凝胶的储能模量和损耗模量的频率扫描图Fig. 8 Frequency dependence of dynamic storagemodulus and dynamic loss modulus of PDMAAand TA/PDMAA semi-IPN hydrogel
2.7 动态力学性能分析
凝胶的储能模量(G′)、损耗模量(G″)与频率的关系如图8所示。由图8可见,所有样品均表现出典型的凝胶流变行为:在扫描的频率范围内,凝胶的储能模量远高于其损耗模量,这说明凝胶的弹性行为优于其黏性行为,在凝胶网络中占主导地位,所制备的凝胶表现出较为“坚硬”的特性[25]。从TPDM1到TPDM3,随BAAm使用量的增加,凝胶的储能模量和损耗模量均呈现增大趋势。总体来说,凝胶网络的交联度和聚合物链的灵活度在较大程度上影响着凝胶的流变行为。当BAAm使用量增加时,凝胶网络变得更加稠密,聚合物之间的缠绕与接触变得更为紧密,这极大地降低了聚合物链的灵活度,导致凝胶模量增加[26]。由此也可看出,BAAm使用量的增加对提高凝胶的储能模量起到重要作用。
2.8 体外降解及机理分析
不同凝胶的体外降解过程如图9所示。由图9可见,经70 d后,纯PDMAA的凝胶剩余量近90%,说明其在PBS溶液中较稳定,几乎未发生降解。TA的加入赋予了凝胶可降解的特性:TPDM1为降解速率最快的样品,剩余质量百分率仅为12.7%。TPDM2和TPDM3剩余质量百分率分别为21.1%和40.2%。TA/PDMAA semi-IPN水凝胶的质量损失主要是因为TA脱离了物理缠绕的凝胶网络,溶解到溶液中。相似的降解情况也在Mandal等[27]制备的丝蛋白/聚丙烯酰胺semi-IPN水凝胶体系中观察到。这一结果也说明交联度在凝胶的降解过程中起到较重要作用。TPDM1凝胶的交联度最低,因此经表面侵蚀后,降解速率最快;而TPDM3凝胶网络的交联度最高,TA与PDMAA网络的物理缠绕最为紧密,因此降解速率最慢。
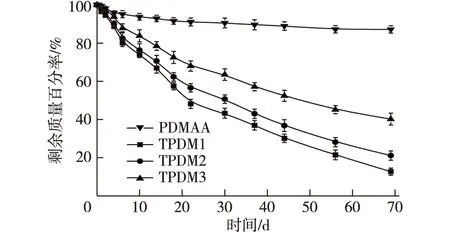
图9 纯PDMAA及TA/PDMAA semi-IPN水凝胶在PBS溶液中的降解情况Fig. 9 Degradation of PDMAA and TA/PDMAAsemi-IPN hydrogel in PBS solution
2.9 体外细胞试验
2.9.1 胞外毒性评估
试验采用7 d的凝胶提取液培养CHO细胞和COS-7细胞,培养24 h,细胞成活率如图10所示。由图10可见,经TA/PDMAA semi-IPN水凝胶提取液培养的CHO细胞和COS-7细胞,其成活率均高于90%,与阴性对照接近,说明材料无毒害,具备良好且持久的生物相容性。

图10 纯PDMAA和TA/PDMAA semi-IPN水凝胶的胞外毒性测试结果Fig. 10 Cytotoxicity test of PDMAA and TA/PDMAAsemi-IPN hydrogel
2.9.2 细胞黏附试验
将CHO细胞和COS-7细胞接种在TPDM2凝胶表面进行培养,分别于1和4 d后使用荧光显微镜进行观察,细胞形态如图11所示。由图11可见,在纯PDMAA凝胶表面接种的细胞,经1 d培养后,细胞呈球形并出现团簇现象,4 d后,虽然细胞数量增多,但细胞形态仍呈现团簇状,说明CHO细胞和COS-7细胞均不能在纯PDMAA凝胶中进行黏附和生长,这可能是由纯PDMAA致密的网络结构及较低的吸水率所导致。Jaiswal等[28]也证实了这一结果。相比较而言,在TPDM2表面培养的细胞4 d后呈现出极好的形态:大部分细胞舒展地平铺在凝胶表面,细胞体积增大,胞体伸出突起且出现分枝和伪足。这主要归因于两方面:1)引入TA使得TA/PDMAA semi-IPN水凝胶具有连续、分布均匀的多孔结构,有效地增大了凝胶内部的比表面积,有利于细胞生长所需养分的运送以及代谢废物排出,为细胞提供了良好的生长环境[10];2)加入TA使材料获得适中的亲水性,这种环境可更好地模拟体内,为细胞生长提供了充足的液体环境且有助于细胞黏附蛋白的绑定与运送[11]。

图11 COS-7细胞和CHO细胞在纯PDMAA水凝胶和TA/PDMAA semi-IPN水凝胶表面的生长情况Fig. 11 Phase-contrast micrographs (100×) of COS-7 cell and CHO cell cultured on surface of PDMAAhydrogel and TA/PDMAA semi-IPN hydrogel
3 结 论
采用半互穿聚合物网络技术,使化香果单宁与PDMAA网络进行互穿,设计并合成了一种全新的TA/PDMAA semi-IPN水凝胶,TA与PDMAA网络之间依靠氢键作用进行物理缠绕,以维持整个三维网络的稳定性。
1)加入TA使得凝胶的内部形态发生较大改变,相比于纯PDMAA凝胶,TA/PDMAA semi-IPN水凝胶展示了连续、分布均匀的多孔形态,孔径分布在37.7~87.1 μm范围内。Semi-IPN水凝胶的溶胀行为和保水能力与体系的交联度有关。随着BAAm使用量从24 mg提高到72 mg,凝胶的吸水率从27.6 g/g降到17.4 g/g。流变性能测试结果表明,凝胶的储能模量和损耗模量随着BAAm用量的增加而增大。
2)降解试验结果证实了TA/PDMAA semi-IPN水凝胶可在体外的PBS溶液中降解,当BAAm使用量从24 mg升至72 mg时,降解后的剩余质量百分率从12.7%提高至40.2%。胞外毒性测试结果证明了TA/PDMAA semi-IPN水凝胶对COS-7细胞和CHO细胞完全无毒,细胞成活率高于90%。
3)通过在凝胶表面培养COS-7细胞和CHO细胞,证明引入TA胶使TA/PDMAA semi-IPN水凝胶具备了细胞黏附性能,COS-7细胞和CHO细胞能够较好地在凝胶表面黏附生长,这一结果与TA/PDMAA semi-IPN水凝胶分布连续、孔径可控的多孔结构及适度的亲水性密不可分。
这些表征结果可为TA/PDMAA semi-IPN水凝胶在组织工程领域的应用提供理论依据,也为植物单宁更加广泛、有效的利用探索一条新途径。
[1]杨琳, 管晓燕, 陈黎明, 等. 智能水凝胶在骨类硬组织再生和修复中的应用[J]. 中国组织工程研究, 2016,20(3):430-434.
YANG L, GUAN X Y, CHEN L M, et al. Application of intelligent hydrogels in bone regeneration and repair[J]. Journal of Clinical Rehabilitative Tissue Engineering Research, 2016, 20(3):430-434.
[2]刘水莲, 宿烽, 李速明. 合成水凝胶材料在组织工程中的应用[J]. 中国材料进展, 2016, 35(3):227-232.
LIU S L, SU F, LI S M. Applications of synthetic hydrogels in tissue engineering[J]. Materials China, 2016, 35(3):227-232.
[3]孙静, 卫丹, 杨棵, 等. 微尺度水凝胶与组织工程[J]. 高分子通报, 2016(5):103-109.
SUN J, WEI D, YANG K, et al. Microengineered hydrogels for tissue engineering[J]. Chinese Polymer Bulletin, 2016(5):103-109.
[4]张丁文, 刘燕飞, 亓鹏, 等. 智能水凝胶在组织工程中的应用[J]. 中国组织工程研究, 2014, 18(12):1944-1950.
ZHANG D W, LIU Y F, QI P, et al. Application of intelligent hydrogel in the tissue engineering[J]. Journal of Clinical Rehabilitative Tissue Engineering Research, 2014, 18(12):1944-1950.
[5]TAN H, MARRA K G. Injectable, biodegradable hydrogels for tissue engineering applications[J]. Materials, 2010, 3(3):1746-1767.
[6]傅长明, 黄科林, 王则奋, 等. 植物单宁的性质及应用[J]. 企业科技与发展, 2010(22):57-60.
FU C M, HUANG K L, WANG Z F, et al. The properties and applications of vegetable tannin[J]. Enterprise Science and Technology amp; Development, 2010(22):57-60.
[7]SHIN M, RYU J H, PARK J P, et al. DNA/tannic acid hybrid gel exhibiting biodegradability, extensibility, tissue adhesiveness, and hemostatic ability[J]. Advanced Functional Materials, 2015, 25(8):1270-1278.
[8]HOO S P, LOH Q L, YUE Z, et al. Preparation of a soft and interconnected macroporous hydroxypropyl cellulose methacrylate scaffold for adipose tissue engineering[J].Journal of Materials Chemistry B, 2013, 1(24):3107-3117.
[9]RADHAKUMARY C, NANDKUMAR A M, NAIR P D. Hyaluronic acid-g-poly(HEMA) copolymer with potential implications for lung tissue engineering[J]. Carbohydrate Polymers, 2011, 85(2):439-445.
[10]HU X Y, FENG L D, XIE A M, et al. Synthesis and characterization of a novel hydrogel:salecan/polyacrylamide semi-IPN hydrogel with adesirable pore structure[J]. Journal of Materials Chemistry B, 2014, 2(23):3646-3658.
[11]LIU X, WU C, JIAO Y, et al. Chitosan-halloysite nanotubes nanocomposite scaffolds for tissue engineering[J]. Journal of Materials Chemistry B, 2013, 1(15):2078-2089.
[12]REN P F, YANG H C, LIANG H Q, et al. Highly stable, protein-resistant surfaces via the layer-by-layer assembly of poly(sulfobetaine methacrylate) and tannic acid[J]. Langmuir:the ACS Journal of Surfaces and Colloids, 2015, 31(21):5851-5858.
[13]MADY M M, MOHAMMED W A, EL-GUENDY N M, et al. Interaction of DNA and polyethylenimine:fourier-transform infrared (FTIR) and differential scanning calorimetry (DSC) studies[J]. International Journal of Physical Sciences, 2011, 6(32):7328-7334.
[14]HU X, FENG L, WEI W, et al. Synthesis and characterization of a novel semi-IPN hydrogel based on salecan and poly(N, N-dimethylacrylamide-co-2-hydroxyethyl methacrylate)[J]. Carbohydrate Polymers, 2014, 105:135-144.
[15]LUO J, LAI J P, ZHANG N, et al. Tannic acid induced self-assembly of three-dimensional grapheme with good adsorption and antibacterial properties[J]. ACS Sustainable Chemistry amp; Engineering, 2016, 4(3):1404-1413.
[16]SAHINER N, SAGBAS S, AKTAS N. Single step natural poly(tannic acid) particle preparation as multitalented biomaterial[J]. Materials Science amp; Engineering C, Materials for Biological Applications, 2015, 49:824-834.
[18]LYU S, LIU M, NI B, et al. A novel pH-and thermo-sensitive PVP/CMC semi-IPN hydrogel:swelling, phase behaviour, and drug release study[J]. Journal of Polymer Science Part B Polymer Physics, 2010, 48(15):1749-1756.
[19]LEE J W, KIM S Y, KIM S S, et al. Synthesis and characteristics of interpenetrating polymer network hydrogel composed of chitosan and poly(acrylic acid)[J]. Journal of Applied Polymer Science, 1999, 73(1):113-120.
[20]LOPES C M A, FELISBERTI M I. Mechanical behaviour and biocompatibility of poly(1-vinyl-2-pyrrolidinone)-gelatin IPN hydrogels[J]. Biomaterials, 2003, 24(7):1279-1284.
[21]DRAGAN E S, APOPEI D F. Synthesis and swelling behavior of pH-sensitive semi-interpenetrating polymer network composite hydrogels based on native and modified potatoes starch as potential sorbent for cationic dyes[J]. Chemical Engineering Journal, 2011, 178(1):252-263.
[22]HU X, WANG Y, ZHANG L, et al. Redox/pH dual stimuli-responsive degradable Salecan-g-SS-poly(IA-co-HEMA) hydrogel for release of doxorubicin[J]. Carbohydrate Polymers, 2017, 155:242-251.
[23]DRAGAN E S, PERJU M M, DINU M V. Preparation and characterization of IPN composite hydrogels based on polyacrylamide and chitosan and their interaction with ionic dyes[J]. Carbohydrate Polymers, 2012, 88(1):270-281.
[24]LI M, WU Z, ZHANG C, et al. Study on porous silk fibroin materials. Ⅱ. Preparation and characteristics of spongy porous silk fibroin materials[J]. Journal of Applied Polymer Science, 2001, 79(12):2192-2199.
[25]CHEN Y Q, CHEN L B, BAI H, et al. Graphene oxide-chitosan composite hydrogels as broad-spectrum adsorbents for water purification[J]. Journal of Materials Chemistry A, 2013, 1(6):1992-2001.
[26]NIE W, YUAN X, ZHAO J, et al. Rapidlyinsituforming chitosan/ε-polylysine hydrogels for adhesive sealants and hemostatic materials[J]. Carbohydrate Polymers, 2013, 96(1):342-348.
[27]MANDAL B B, KAPOOR S, KUNDU S C. Silk fibroin/polyacrylamide semi-interpenetrating network hydrogels for controlled drug release[J]. Biomaterials, 2009, 30(14):2826-2836.
[28]JAISWAL M, KOUL V, DINDA A K, et al. Cell adhesion and proliferation studies on semi-interpenetrating polymeric networks (semi-IPNs) of polyacrylamide and gelatin[J]. Journal of Biomedical Materials Research Part B Applied Biomaterials, 2011, 98(2):342-350.
PreparationandcelladhesionpropertyofTA/PDMAAsemi-IPNhydrogels
HU Xinyu, WANG Yongmei, ZHANG Liangliang, XU Man
(Jiangsu Province Biomass Energy and Materials Laboratory, Institute of Chemical Industry of Forestry Products,CAF, Nanjing 210042, China)
Due to the dense pore structure, the pure poly(N, N-Dimethylacrylamide) (PDMAA) hydrogel was non-degradable which restricts its application in tissue engineering. To solve this problem, a series of novel semi-interpenetrating polymer network (semi-IPN) hydrogels containing TA and PDMAA were designed and synthesized by radical polymerization and semi-IPN technology. The introduction of TA into the PDMAA network endowed the system with enhanced cell adhesion and degradation properties. The results of SEM showed that the addition of 1 mL of TA solution into the PDMAA hydrogel achieved substantial change in the final morphology. The TA/PDMAA semi-IPN hydrogel had a well-interconnected porous structure with tunable pore size ranging from 37.7 μm to 87.1 μm. The TA/PDMAA semi-IPN hydrogels was degradable in phosphate buffered saline (PBS) solution. The degradation rate could be tuned by modulating the content of cross-linker. The results of cytotoxicity tests demonstrated that the TA/PDMAA semi-IPN hydrogels were non-toxic to COS-7 cells and CHO cells, and the cell viability all exceeded 90%. The introduction of TA into the PDMAA network improved the cell adhesion properties, and COS-7 cells and CHO cells could grow well on the surface of TA/PDMAA semi-IPN hydrogels. The TA/PDMAA semi-IPN hydrogels exhibited good biocompatibility and had potential for tissue engineering application.
semi-IPN hydrogels; cell adhesion; porous structure; degradation property; cell viability
2017-03-23
2017-05-27
国家重点研发计划(2016YFD0600806);江苏省生物质能源与材料重点实验室基本科研业务费(JSBEM-S-201609)。
胡新宇,男,助理研究员,博士,研究方向为功能高分子凝胶材料。E-mail:huxinyulhs@163.com
TQ351.3
A
2096-1359(2017)06-0037-08
