姜黄素对大鼠蛛网膜下腔出血后脑血管痉挛的作用机制研究※
2017-11-28郭二坤梁朝辉米中波彭立威
郭二坤 梁朝辉 米中波 彭立威 徐 彬
(河北医科大学第二医院神经外科,河北 石家庄 050000)
实验研究
姜黄素对大鼠蛛网膜下腔出血后脑血管痉挛的作用机制研究※
郭二坤 梁朝辉△米中波1彭立威2徐 彬3
(河北医科大学第二医院神经外科,河北 石家庄 050000)
目的探讨姜黄素对大鼠蛛网膜下腔出血(SAH)后脑血管痉挛(CVS)的作用机制。方法将40只成年雄性SD大鼠随机分为4组,空白组、模型组、尼莫地平组及姜黄素组,每组10只。通过枕大池注血法建立SAH模型,造模成功30 min后,空白组、模型组均予二甲基亚砜2 mL腹腔注射;尼莫地平组予注射用尼莫地平0.05 mg/kg(2 mL二甲基亚砜溶解)腹腔注射;姜黄素组予姜黄素300 mg/kg(2 mL二甲基亚砜溶解)腹腔注射。给药4 h后,测定各组大鼠血清白细胞介素1β(IL-1β)、IL-6、肿瘤坏死因子α(TNF-α),在光学显微镜下观察基底动脉的形态变化和管壁厚度,记录各组大鼠基底动脉直径。结果模型组大鼠IL-1β、IL-6、TNF-α均较空白组升高(Plt;0.05),基底动脉直径降低(Plt;0.05),说明造模成功。尼莫地平组、姜黄素组大鼠IL-1β、IL-6、TNF-α均低于模型组(Plt;0.05),基底动脉直径高于模型组(Plt;0.05),说明治疗有效。姜黄素组大鼠IL-1β、IL-6、TNF-α均低于尼莫地平组(Plt;0.05),基底动脉直径高于尼莫地平组(Plt;0.05),说明姜黄素组治疗优于尼莫地平组。结论姜黄素具有扩张颅内血管的作用,能降低炎性因子而发挥抗炎作用,可作为新的治疗CVS的药物进行临床推广。
血管痉挛,颅内;蛛网膜下腔出血,并发症;尼莫地平;疾病模型,动物
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)常突然发生,是脑底部或脑表面的病变血管破裂,动脉血注入蛛网膜下腔或在脑和蛛网膜之间而引起的临床综合征,75%~80%的SAH由动脉瘤破裂引起,发病年龄多在40~60岁,每年发病率大约是10/100 000[1]。虽然SAH的诊断技术和外科治疗措施有了很大的提高和改进,但SAH患者的临床预后仍不理想。研究发现,脑血管痉挛(cerebral vasospasm,CVS)在SAH后6 d达到高峰,并持续2~3周,CVS是SAH后最常见的高危并发症,常可继发严重的脑组织缺血,进而出现迟发性脑缺血,导致患者遗留严重的神经功能障碍,是SAH患者残疾甚至死亡的重要原因之一[2-4]。CVS发病机制不确定,尽管采取了多种治疗方法,但致残率及死亡率仍很高。因此,明确CVS机制,采取积极的药物干预,改善SAH预后,是临床需要迫切解决的难题。
近年来研究发现,在脑动脉瘤破裂发生SAH后,血液进入蛛网膜下腔并裂解释放出血红蛋白、胆红素等物质从而激活免疫炎症系统,SAH后脑动脉壁中有中性粒细胞、巨噬细胞和其他免疫细胞浸润,免疫球蛋白及补体沉积,以及血管内皮发生肿胀与变性凋亡、血管中膜及外膜增厚等炎症表现。上述变化与CVS发生的时相及缺血性神经功能损害相一致,而且在SAH大鼠脑组织中,许多与免疫炎症相关的基因及其产物发生了明显变化,具有许多潜在的副作用。因此,免疫炎症反应是SAH后CVS有前景的治疗靶点,抑制过度免疫反应和炎性细胞激活、浸润及炎性细胞因子等的产生有望成为防止SAH后CVS的新的有效途径。
研究发现姜黄素具有抗炎、降血糖、抗病毒和抗真菌作用,并且在脑外伤、脑出血、脑缺血中具有神经保护作用[5],同时发现姜黄素在SAH中,能够降低死亡率和氧化应激反应,减轻SAH后CVS,但具体机制不详。本实验中我们应用姜黄素治疗SAH大鼠,测定SAH后基底动脉直径,以及血液中炎性因子,确定姜黄素通过扩张脑血管和抗炎作用来发挥对中枢神经系统的保护作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 成年雄性SD大鼠40只,体质量200~250 g,购于河北医科大学实验动物中心,动物合格证号:SCXK(冀)2013-1-003。饲养在空调恒温室内,室温19~25 ℃,相对湿度40%~70%,光照及黑暗时间分别为12 h,自由饮食取水。
1.1.2 实验药物及试剂 姜黄素(上海江莱生物科技有限公司);注射用尼莫地平(瑞阳制药有限公司,国药准字H20070195);水合氯醛(天津市光复精细化工研究所);二甲基亚砜(上海鼓臣生物技术有限公司)。
1.2 方法
1.2.1 动物分组 将40只成年雄性SD大鼠随机分为4组,空白组、模型组、尼莫地平组及姜黄素组,每组10只。
1.2.2 模型制备 将大鼠称质量,空白组按0.3 mL/100 g体质量,10%水合氯醛溶液进行腹腔麻醉,切开头部皮肤切口,然后再缝合切口。其余3组按0.3 mL/100 g体质量,10%水合氯醛溶液进行腹腔麻醉,麻醉后将大鼠仰卧位固定于鼠板上,消毒右腹股沟区,逐层切开皮肤及皮下组织,显露股动脉,备用。改俯卧位,将大鼠固定于鼠板上,使头前屈,枕部备皮,沿中线切开枕顶部皮肤及皮下组织、寰枕筋膜,显露硬膜,经枕部寰枕间硬膜处,穿刺枕大池,注射器缓慢回抽,可见清亮脑脊液而无血液,提示手术成功,抽出脑脊液0.1 mL后,自股动脉抽出0.1 mL血,将动脉血在2 min内缓慢注入枕大池,穿刺针眼用骨蜡封闭,缝合皮肤。若大鼠表现为精神萎靡、嗜睡、进食少,表示造模成功。
1.2.3 给药方法 造模成功30 min后,空白组、模型组均予二甲基亚砜2 mL腹腔注射;尼莫地平组予注射用尼莫地平0.05 mg/kg(2 mL二甲基亚砜溶解)腹腔注射;姜黄素组予姜黄素300 mg/kg(2 mL二甲基亚砜溶解)腹腔注射。
1.3 观察指标及方法 ①给药4 h后,抽取自体股动脉血2 mL,室温下静置4 h,12 000 r/min离心20 min,取血清,-20 °C冷却保存,应用酶联免疫吸附测定法(ELISA)测定各组白细胞介素(interleukin,IL)-1β、IL-6、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α),具体方法按照试剂盒说明书(武汉博士德生物工程有限公司)操作。②给药4 h后,将大鼠按0.3 mL/100 g体质量,10%水合氯醛溶液进行腹腔麻醉后,经左心室灌注0.9%氯化钠注射液100 mL后,再灌注4%多聚甲醛磷酸盐缓冲液(pH7.4)100 mL,灌洗完毕,双侧前顶枕开颅,在枕骨大孔上方,将含基底动脉的脑、小脑、脑干解剖完整取出,4%甲醛固定液固定24 h,取基底动脉分叉处的动脉,石蜡包埋,切片苏木精-伊红(HE)染色,在光学显微镜下观察基底动脉的形态变化和管壁厚度,并采用图像采集与分析系统(德国徕卡仪器有限公司)收集数据,记录每只大鼠的基底动脉直径。
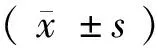
2 结 果
2.1 各组大鼠IL-1β、IL-6、TNF-α及基底动脉直径比较 见表1。
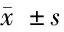

组 别nIL-1β(pg/mL)IL-6(pg/mL)TNF-α(pg/mL)基底动脉直径(μm)空白组10190.42±29.15134.54±31.26150.29±10.53297±52模型组10906.32±81.12∗632.87±73.02∗530.56±10.27∗168±22∗尼莫地平组10238.23±39.64△173.61±44.94△430.45±10.77△200±32△姜黄素组10208.31±36.45△#167.67±41.37△#260.27±10.64△#215±30△#
与空白组比较,*Plt;0.05;与模型组比较,△Plt;0.05;与尼莫地平组比较,#Plt;0.05
由表1可见,模型组大鼠IL-1β、IL-6、TNF-α均较空白组升高(Plt;0.05),基底动脉直径降低(Plt;0.05),说明造模成功。尼莫地平组、姜黄素组大鼠IL-1β、IL-6、TNF-α均低于模型组(Plt;0.05),基底动脉直径高于模型组(Plt;0.05),说明治疗有效。姜黄素组大鼠IL-1β、IL-6、TNF-α均低于尼莫地平组(Plt;0.05),基底动脉直径高于尼莫地平组(Plt;0.05),说明姜黄素组疗效优于尼莫地平组。
2.2 各组大鼠大脑病理解剖标本比较 肉眼观察:空白组大鼠大脑病理解剖标本下未见蛛网膜下腔出血,模型组、尼莫地平组、姜黄素组大鼠大脑病理解剖标本与空白组比较,可见不同程度的粘连及血凝块残留,基底动脉及其分支被血凝块包裹,脑组织肿胀,大体结构无明显变化。显微镜下观察:空白组大鼠基底动脉管径平滑,组织结构基本正常,管壁无增厚(见图1);模型组大鼠基底动脉血管狭窄,管壁增厚,内膜迂曲或断裂,厚薄不一,可见粒细胞、单核细胞浸润(见图2);尼莫地平组大鼠基底动脉血管直径较模型组增宽,管壁较模型组变薄,血管痉挛不明显,内膜部分区域出现迂曲、皱褶或断裂(见图3);姜黄素组大鼠基底动脉血管直径无明显改变,血管内膜光滑,无皱褶及断裂(见图4)。
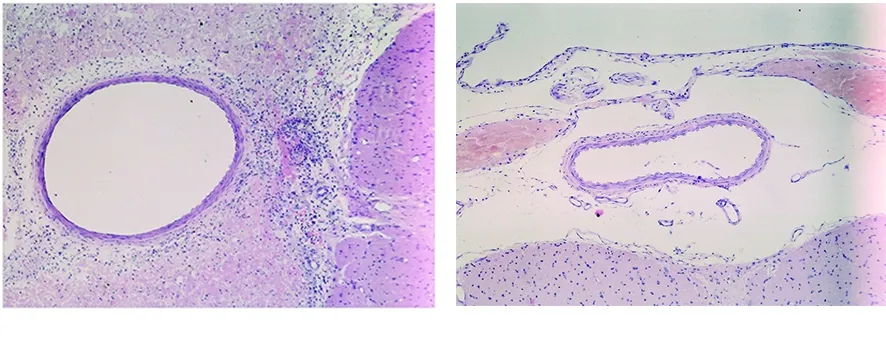
图1 空白组大鼠基底动脉组织结构(HE,×100) 图2 模型组大鼠基底动脉组织结构(HE,×100)
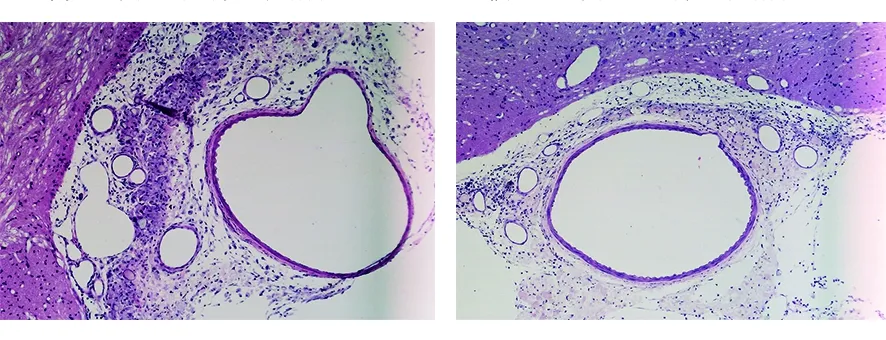
图3 尼莫地平组大鼠基底动脉组织结构(HE,×100) 图4 姜黄素组大鼠基底动脉组织结构(HE,×100)
3 讨 论
SAH是临床上常见疾病,具有极高的致残率和死亡率,而SAH后CVS一旦发生,就很难逆转,多数会进一步引起缺血性脑损害。影响SAH后发生CVS的因素很多,如血液中一氧化氮(NO)含量、血管内皮细胞的功能障碍、血液中各种免疫因子的含量变化等,因此理论上姜黄素可通过抑制SAH后病理生理过程中的炎性反应而达到保护血管内皮细胞的目的,减少各种免疫炎症因子的分泌,进而缓解SAH后CVS的程度。研究发现,SAH与脑缺血一样,炎症反应在病理生理过程中起到关键性作用。我们应用姜黄素行SAH大鼠腹腔内注射,从血液中炎性因子的变化及基底动脉的形态学变化来寻找SAH后CVS的新的治疗方法。
本实验通过向蛛网膜下腔注入自体血液,启动炎性反应,细胞炎性因子增加和血管直径缩窄,血流量降低,导致血管痉挛。近年来,许多学者提出关于SAH后CVS的机制,并且制作许多种动物模型(鼠、兔子、狗),以验证不同药物对CVS的治疗作用,其中不抗凝血注入枕大池制造的SAH模型可靠实用,与临床SAH相似,因此大鼠SAH模型广泛应用于药物治疗SAH后CVS的神经药理研究中。
尼莫地平是目前临床上常用的预防和治疗SAH后CVS的药物。在SAH发生早期,血管内皮细胞、平滑肌细胞及脑实质内钙稳态发生损害,钙浓度异常升高,引起脑血管持续收缩,导致SAH后CVS,造成脑组织缺血坏死[7]。尼莫地平治疗症状性SAH后CVS安全有效[8-9],尼莫地平是二氢吡啶类钙离子通道阻滞剂,有脂溶性并通过血脑屏障,选择性作用于脑组织和脑血管平滑肌细胞膜上的受体依赖性钙通道,增加细胞内线粒体、内质网等钙离子的摄取和储存作用,防止钙超载,保护神经线粒体的完整性,提高脑细胞的缺氧的耐受性,增加脑血流量,改善微循环,减轻脑水肿、脑缺血、颅内高压等继发性损伤,从而保护脑组织,降低致残率[10]。局部应用小剂量的尼莫地平有较强的扩张血管作用,大剂量尼莫地平实验中未显示与剂量相应的扩张血管作用。在应用尼莫地平扩张脑血管的治疗中,应避免大剂量应用尼莫地平以防止低血压导致脑灌注压降低[11],常规剂量预防性应用尼莫地平可防止迟发性脑梗死导致的继发性脑损伤作用[12]。因此,我们选用临床上解除CVS的经典药物尼莫地平作为对照,来检验姜黄素对SAH后CVS的效果。
当动脉瘤突然破裂时,血液急剧释放入蛛网膜下腔,造成颅内压迅速增高,全脑血流灌注下降及短暂性脑缺血等病理生理事件,在颅内短暂性脑缺血及红细胞裂解物的刺激下,星形胶质细胞及小细胞活化,导致炎症反应通路被激活,合成并释放大量炎症因子,如细胞因子、趋化因子等,最终导致血脑屏障的破坏及脑水肿、细胞凋亡和氧化应激等。炎症通路下游的炎症因子包括IL-1β、IL-6、IL-1,IL-8及TNF-α[13]。炎症因子与白细胞结合,使巨噬细胞、粒细胞等在血管外膜聚集,导致血管管壁增厚、管腔狭窄,加重脑缺血[14]。另外,一些炎症因子可参与血脑屏障破坏,进入全身循环,诱发炎症级联反应,导致全身炎症反应综合征和多器官功能衰竭的发生[15]。在众多的炎症因子中,TNF-α是炎症反应中具备多种功能的细胞因子,不仅正反馈激活放大炎症反应,促使其他细胞因子的合成和降解,还可诱导细胞凋亡。动物实验表明,TNF-α是SAH后最早表达的细胞因子,表达时相为SAH后24 h内开始升高并缓慢持续96 h[16],TNF-α对神经细胞有直接损伤作用,尤其是细胞凋亡,TNF-α抑制剂也被发现可有效减弱海马神经元凋亡及脑血管痉挛的发生。许多证据证明[17],SAH后早期炎症通路的激活可促进释放炎症因子及血管活性物质等系列级联反应,细胞因子、细胞黏附分子及白细胞均参与其中[18]。早期促炎症因子的增加,包括TNF-α、IL-6、IL-1等,它们可出现在SAH患者的血清和脑脊液中,并且与脑缺血造成的损伤呈正相关[19]。
有研究发现,SAH后CVS的严重程度与TNF-α、IL-1β、IL-6相关[20],降低炎症通路下游的TNF-α、IL-1β、IL-6的水平,能够抑制炎症的扩展,发挥扩血管作用。尼莫地平通过抑制钙离子(Ca2+)通道而发挥扩张血管作用,本实验发现尼莫地平有降低TNF-α、IL-1β、IL-6作用,说明其有抗炎作用,尼莫地平组大鼠较模型组大鼠的基底动脉出现一定程度扩张,说明其发挥扩张血管的作用是多方面的。
腹腔内应用30~300 mg/kg的姜黄素有预防脑缺血的作用[21],有研究显示姜黄素能降低IL-6的释放,减轻脑水肿导致的继发性脑损伤[22-23],因此在急救治疗阶段,应尽早明确SAH诊断。本实验应用300 mg/kg姜黄素治疗,在扩张血管作用上优于模型组和尼莫地平组,说明姜黄素通过降低IL-1β、IL-6及TNF-α,预防炎性反应,发挥去血块作用。
白细胞介素和TNF-α是急性期释放的对炎性反应的反应物,在反应过程中,由于血液注入蛛网膜下腔[24]引发炎性反应,TNF-α、IL-1β和IL-6在12 h对炎性反应达到高峰[25-26]。另一研究发现,SAH时释放IL-6水平增加,但TNF-α、IL-1β无变化[27]。以前关于细胞炎性因子水平发现,SAH后炎性因子水平与血管痉挛程度不一致,特别是脑脊液和血液中炎性因子的测定,二者并不成平行关系,但研究中发现神经功能损伤程度、细胞炎性因子增加程度同血液进入蛛网膜下腔有关[28]。本研究中姜黄素通过降低细胞炎症因子,特别降低TNF-α、L-1β而发挥其扩张血管作用,同文献一致。
姜黄素是一种抗氧化物质,具有扩张痉挛的脑血管的作用,治疗SAH后CVS能够代替尼莫地平,但姜黄素与尼莫地平作用机制不同,可能是通过其抗炎症因子的作用,降低炎性反应,扩张血管,而发挥其解除脑血管痉挛的作用。虽然本实验探明SAH后CVS的发生可能与SAH后的炎症反应有关,但SAH后CVS的病理生理过程和分子机制需要进一步研究,明确引发和调控的各种病理生理学变化的根本通路,以及各种标志物的浓度变化趋势,为进一步寻找CVS的治疗靶点提供依据,从而改善SAH后患者的转归。
[1] 马廉亭.动脉瘤性蛛网膜下腔出血的诊治规范[J].中国现代神经疾病杂志,2004,4(1):6-9.
[2] Pearl JD,Macdonald RL.Vasospasm after aneurysmal subarachnoid hemorrhage:need for further study[J].Acta Neurochir Suppl,2008,105:207-210.
[3] Keyrouz SG,Diringer MN.Clinical review:Prevention and therapy of vasospasm in subarachnoid hemorrhage[J].Crit Care,2007,11(4):220.
[4] Mocco J,Zacharia BE,Komotar RJ,et al.A review of current and future medical therapies for cerebral vasospasm following aneurysmal subarachnoid hemorrhage[J].Neurosurg Focus,2006,21(3):E9.
[5] 宋永周,童九辉,李明,等.姜黄素对骨关节炎软骨细胞氧化应激和基质金属蛋白酶13、白细胞介素-6分泌的影响[J].河北中医,2016,38(9):1344-1347,1352.
[6] 刘秀娟,韩雨薇,李晓明.齐墩果酸通过抑制NF-κB/ICAM-1信号通路减轻大鼠蛛网膜下腔出血后早期脑损伤的研究[J].中国现代应用药学,2017,34(9):1225-1228.
[7] Ayer R,Zhang J.Connecting the early brain injury of aneurysmal subarachnoid hemorrhage to clinical practice[J].Turk Neurosurg,2010,20(2):159-166.
[8] Hussain S,Barbarite E,Chaudhry NS,et al.Search for Biomarkers of Intracranial Aneurysms:A Systematic Review[J].World Neurosurg,2015,84(5):1473-1483.
[9] Foreman B.The Pathophysiology of Delayed Cerebral Ischemia[J].J Clin Neurophysiol,2016,33(3):174-182.
[10] 王毅,张建宁.尼莫地平治疗创伤性蛛网膜下腔出血的临床研究[J].天津医药,2011,39(4):315-317.
[11] Seker F,Hesser J,Neumaier-Probst E,et al.Dose-response relationship of locally applied nimodipine in an ex vivo model of cerebral vasospasm[J].Neuroradiology,2013,55(1):71-76.
[12] Castanares-Zapatero D,Hantson P.Pharmacological treatment of delayed cerebral ischemia and vasospasm in subarachnoid hemorrhage[J].Ann Intensive Care,2011,1(1):12.
[13] Lee JY,Keep RF,He Y,et al.Hemoglobin and iron handling in brain after subarachnoid hemorrhage and the effect of deferoxamine on early brain injury[J].J Cereb Blood Flow Metab,2010,30(11):1793-1803.
[14] Greenhalgh AD,Brough D,Robinson EM,et al.Interleukin-1 receptor antagonist is beneficial after subarachnoid haemorrhage in rat by blocking haem-driven inflammatory pathology[J].Dis Model Mech,2012,5(6):823-833.
[15] Sercombe R,Dinh YR,Gomis P.Cerebrovascular inflammation following subarachnoid hemorrhage[J].Jpn J Pharmacol,2002,88(3):227-249.
[16] Maddahi A,Povlsen GK,Edvinsson L,et al.Regulation of enhanced cerebrovascular expression of proinflammatory mediators in experimental subarachnoid hemorrhage via the mitogen-activated protein kinase kinase/extracellular signal-regulated kinase pathway[J].J Neuroinflammation,2012,9:274.
[17] Sehba FA,Hou J,Pluta RM,et al.The importance of early brain injury after subarachnoid hemorrhage[J].Prog Neurobiol,2012,97(1):14-37.
[18] Kerz T,Boor S,Beyer C,et al.Effect of intraarterial papaverine or nimodipine on vessel diameter in patients with cerebral vasospasm after subarachnoid hemorrhage[J].Br J Neurosurg,2012,26(4):517-524.
[19] Ryu CW,Koh JS,Yu SY,et al.Vasogenic edema of the Basal Ganglia after intra-arterial administration of nimodipine for treatment of vasospasm[J].J Korean Neurosurg Soc,2011,49(2):112-115.
[20] Carr KR,Zuckerman SL,Mocco J.Inflammation,cere bral vasospasm,and evolving theories of delayed cerebral ischemia[J].Neurol Res Int,2013:506584.
[21] Zhang L,Gu ZL,Qin ZH,et al.Effect of curcumin on the adhesion of platelets to brain microvascular endothelial cells in vitro[J].Acta Pharmacol Sin,2008,29(7):800-807.
[22] King MD,McCracken DJ,Wade FM,et al.Attenuation of hematoma size and neurological injury with curcumin following intracerebral hemorrhage in mice[J].J Neurosurg,2011,115(1):116-123.
[23] Tapia E,Soto V,Ortiz-Vega KM,et al.Curcumin induces Nrf2 nuclear translocation and prevents glomerular hypertension, hyperfiltration,oxidant stress,and the decrease in antioxidant enzymes in 5/6 nephrectomized rats[J].Oxid Med Cell Longev,2012:269039.
[24] Dumont AS,Dumont RJ,Chow MM,et al.Cerebral vasospasm after subarachnoid hemorrhage:putative role of inflammation[J].Neurosurgery,2003,53(1):123-133.
[25] Athar MK,Levine JM.Treatment options for cerebral vasospasm in aneurysmal subarachnoid hemorrhage[J].Neurotherapeutics,2012,9(1):37-43.
[26] Fassbender K,Hodapp B,Rossol S,et al.Inflammatory cytokines in subarachnoid haemorrhage:association with abnormal blood flow velocities in basal cerebral arteries[J].J Neurol Neurosurg Psychiatry,2001,70(4):534-537.
[27] Siasios I,Kapsalaki EZ,Fountas KN.Cerebral vasospasm pharmacological treatment:an update[J].Neurol Res Int,2013:571328.
[28] Erdi MF,Guney O,Kiyici A,et al.The effects of alpha lipoic acid on cerebral vasospasm following experimental subarachnoid hemorrhage in the rabbit[J].Turk Neurosurg,2011,21(4):527-533.
2017-09-28)
(本文编辑:习 沙)
Studythemechanismofcurcuminoncerebralvasospasmaftersubarachnoidhemorrhageinrats
GUOErkun*,LIANGChaohui,MIZhongbo,etal.
*DepartmentofNeurosurgery,theSecondHospitalAffiliatedtoHebeiMedicalUniversity,Hebei,Shijiazhuang050000
ObjectiveTo explore the mechanism the curcumin on cerebral vasospasm (CVS) after subarachnoid hemorrhage (SAH) in rats.Methods40 adult male SD rats were randomly divided into the blank group, the model group, the nimodipine group and curcumin group, 10 rats in each group. The SAH model was induced by injection of blood into cisterna magna. After 30 minutes of successfully established the model, the blank group and the model group were given 2 mL dimethyl sulfoxide by intraperitoneal injection, the nimodipine group were given nimodipine by 0.05 mg / kg (2 mL dimethyl sulfoxide dissolved) for intraperitoneal injection, the curcumin group were given curcumin by 300 mg/kg (2 mL dimethyl sulfoxide dissolved) for intraperitoneal injection. The serum interleukin1β (IL-1β), interleukin-6(IL-6), tumor necrosis factor-α(TNF-α) were detected after 4 h administration. The morphological changes and wall thickness of basilar artery were observed under the optical microscope, and the basilar artery diameter was recorded in each group.ResultsThe IL-1β, IL-6 and TNF-α in the model group were higher than those in the blank group (Plt;0.05), while the basilar artery diameter in the model group was decreased (Plt;0.05), which indicated that the model was established successfully. The IL-1β, IL-6 and TNF-α in the nimodipine group and curcumin group were lower than those in the model group (Plt;0.05), while the basilar artery diameter in the nimodipine group and curcumin group was higher (Plt;0.05), which indicated that the treatment was effective. The IL-1β, IL-6 and TNF-α in the curcumin group were lower than those in the nimodipine group (Plt;0.05), while the basilar artery diameter in the curcumin group was higher (Plt;0.05), which indicated that the effects in the curcumin group was superior to that in the nimodipine.ConclusionCurcumin has the function of expanding intracranial blood vessels, can reduce inflammatory factors and exert anti-inflammatory effects, and can be used as a new drug for the treatment of CVS for clinical promotion.
Vasospasm; Intracranial; Subarachnoid hemorrhage; Complication; Nimodipine; Animal
10.3969/j.issn.1002-2619.2017.10.027
※ 项目来源:河北省卫生厅2013年医学科学研究课题(编号:20130180)
△ 通讯作者:河北医科大学第二医院神经外科,河北 石家庄 050000
1 河北省赵县人民医院神经外科,河北 赵县 051530
2 河北医科大学第二医院神经内科,河北 石家庄 050000
3 新疆维吾尔自治区巴音郭楞蒙古自治州人民医院神经外科,新疆 库尔勒 841000
郭二坤(1966—),男,副主任医师,硕士。从事神经外科临床工作。研究方向:脑血管病和颅内肿瘤。
R743.350.6;R743.902.5;R972.4;R-331
A
1002-2619(2017)10-1545-06
