室管膜肿瘤组织分化谱系及分子分型进展
2017-11-21王行富
王行富
·神经病理学专家论坛·
室管膜肿瘤组织分化谱系及分子分型进展
王行富
室管膜肿瘤是临床较少见的神经上皮组织肿瘤,组织分化谱系多样,除目前世界卫生组织(WHO)承认的亚型和变异亚型外,尚有许多特殊变异亚型或组织分化模式,如巨细胞型、黑色素型、印戒细胞型、脂肪/空泡化生型、软骨化生(伴或不伴骨形成)型、嗜酸细胞型、上皮样等。病理科医师应注意上述特殊变异亚型的识别和鉴别诊断。基因组学和DNA甲基化谱系研究将室管膜肿瘤分为9种分子亚型,RELA融合基因阳性室管膜瘤被2016年WHO中枢神经系统肿瘤分类作为室管膜瘤的独特分子亚型。尽管分子亚型对预后的评价优于传统组织学分级,然而如何将分子遗传学特征与组织分化谱系整合尚待进一步深入研究。
室管膜瘤; 病理学; 免疫组织化学; 综述
室管膜肿瘤约占所有神经上皮组织肿瘤的10%,儿童多见,约占3岁以下儿童中枢神经系统肿瘤的 30%[1⁃2]。好发部位因发病年龄不同而各异,幕上和脊髓多见于儿童和成人,幕下则多见于婴儿和儿童。1926 年,Bailey 和 Cushing[3]认为,室管膜肿瘤的发生与发展与正常室管膜细胞有关。近年来,肿瘤干细胞(TSCs)理论认为,室管膜肿瘤源于室管膜下区多能神经干细胞即放射状胶质细胞[4]。放射状胶质细胞可以分化为不同形态的室管膜细胞,包括伸长细胞、胚胎性室管膜细胞、成熟室管膜上皮、特殊分化的室周器上皮和脉络膜上皮等。室管膜肿瘤的组织分化谱系相当于衍生出此种干细胞的不同分化阶段。近1个世纪来,室管膜肿瘤的分类分级完全基于组织学形态,但越来越多的研究显示,组织学标准对生物学行为的评价不够准确,其应用价值受到质疑。近年来,室管膜肿瘤相关分子遗传学特征得以部分阐述,对其治疗和预后具有重要意义,对室管膜肿瘤的更精确分类分型具有一定的补充价值。本文重点浅析室管膜肿瘤的组织分化谱系以及分子遗传学进展在肿瘤分类分型中的应用。
一、室管膜肿瘤的组织分化谱系
室管膜肿瘤具有广泛的组织分化谱系,包括一系列世界卫生组织(WHO)分类分型和尚未被WHO承认的亚型或组织分化模式。2016年WHO中枢神经系统肿瘤分类将室管膜肿瘤分为3级[5]:室管膜下室管膜瘤(SE)和黏液乳头型室管膜瘤(MPE)具有独特的组织学特征易于识别,属WHOⅠ级;还包括变异型如乳头型、伸长细胞型和透明细胞型室管膜瘤,属WHOⅡ和Ⅲ级。
1.室管膜下室管膜瘤 系一种发生于脑室壁下方的结节状肿瘤,于广泛致密的纤维样基质中散在或小簇状分布圆形或卵圆形形态温和的肿瘤细胞,这种独特的组织学特征形似星形细胞瘤背景中出现室管膜核型特征细胞的肿瘤(图1a)。肿瘤细胞具有成簇倾向,微囊常见。肿瘤表面常可见正常室管膜上皮被覆,增殖指数较低,无血管内皮细胞增生,坏死罕见,即使出现坏死也不影响预后。值得注意的是,有5%~20%的室管膜下室管膜瘤含经典甚至间变性室管膜瘤成分[6]。混合成分中室管膜瘤成分所占比例很小可能并无临床意义,若超过10%则诊断为混合性室管膜瘤/室管膜下室管膜瘤,并按照室管膜瘤级别分级。此外,伴黑色素分化的室管膜下室管膜瘤仅见个案报道[7]。
2.黏液乳头型室管膜瘤 典型特征是以血管黏液样间质为轴心,周围由立方体状和梭形胶质细胞放射状排列的乳头状结构(图1b)。血管壁玻璃样变常见,部分可见胶原蛋白小球,网状纤维染色和高碘酸⁃雪夫(PAS)染色呈阳性。部分肿瘤乳头状结构不明显,但所有肿瘤均可见血管壁玻璃样变和黏液样变性,有助于诊断。核分裂象罕见,无明显坏死和血管内皮细胞增生。发生间变者罕见。此外,伴巨细胞变异的黏液乳头型室管膜瘤仅见个案报道[8]。

图1 WHOⅠ级室管膜肿瘤光学显微镜观察所见 HE染色 低倍放大 1a 室管膜下室管膜瘤可见广泛致密的纤维样基质中小簇状分布的圆形或卵圆形肿瘤细胞 1b 黏液乳头型室管膜瘤可见特征性以血管黏液样间质为轴心,周围由立方体状和梭形胶质细胞放射状排列的乳头状结构Figure 1 Optical microscopy findings of WHO gradeⅠependymal tumors HE staining low power magnified Subependymoma was composed of bland cells with round to oval nuclei set within wide expanses of a delicate fibrillar matrix,which had a tendency to cluster(Panel1a). Myxopapillary ependymoma characteristically showed a papillary architecture with centralblood vessels,surrounded by cuboidal to spindled glial cells radially arranged around an intermediate layer of myxoid stroma(Panel 1b).
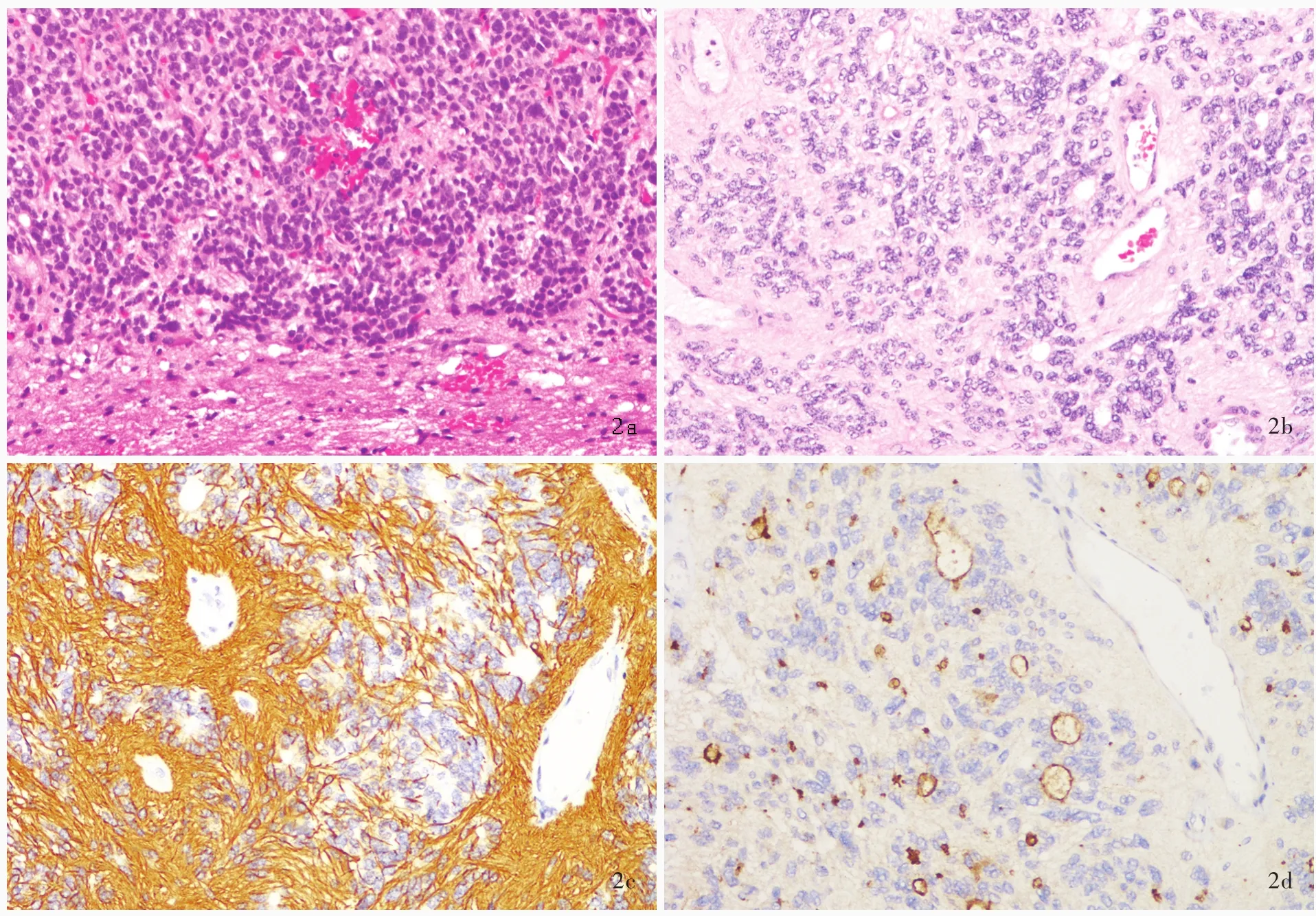
图2 经典室管膜瘤光学显微镜观察所见 2a 肿瘤组织与周围脑实质界限相对清晰 HE染色 低倍放大 2b 可见具有诊断价值的血管周围假“菊形团”样结构和室管膜“菊形团”样结构 HE染色 中倍放大 2c 血管周围无核区GFAP呈阳性 免疫组织化学染色(EnVison二步法) 高倍放大 2d 胞核旁EMA呈点状或小环状阳性 免疫组织化学染色(EnVison二步法) 高倍放大Figure 2 Optical microscopy findings of classical ependymoma Tumor showed a sharp demarcation from the surrounding brain tissue(Panel 2a). HE staining low power magnified Diagnostic architectural features included perivascular pseudorosettes and true ependymal rosettes(Panel 2b). HE staining medium power magnified GFAP in perivascular nuclear⁃free zone showed positivity(Panel 2c). Immunohistochemical staining(EnVison) high power magnified EMA showed dot⁃like or ring⁃like cytoplasmic positivity(Panel 2d). Immunohistochemical staining(EnVison) high power magnified
3.室管膜瘤 经典室管膜瘤与周围脑实质界限相对清晰,肿瘤细胞呈中等密度,形态变异较大,从具有细长纤维突起的胶质细胞样特征到具有室管膜细胞形态的上皮样特征。最具诊断意义的是结节状生长模式(即非浸润性,图2a)、血管周围假“菊形团”样结构(由放射状分布于血管周围的肿瘤细胞组成,终止于血管壁细胞突起形成的无核区)和室管膜“菊形团”样结构或裂隙[图2b,由立方体状或柱状肿瘤细胞围绕中央圆形(即“菊形团”样结构)或狭长空腔(即裂隙)组成,具有特异性诊断价值,但仅见于不足10%的病例]。核分裂象罕见,WHOⅡ级室管膜瘤无假“栅栏”样坏死和血管内皮细胞增生。“地图”样梗死性坏死相对常见,但并不影响肿瘤分类分型和预后。偶见异形性胞核,但不能作为高级别肿瘤的证据。退行性变常见,包括出血、钙化、黏液样变性和血管壁透明样变等。免疫组织化学染色,胶质纤维酸性蛋白(GFAP)阳性,其血管周围无核区阳性模式有别于胶质瘤(图2c);胞核旁上皮膜抗原(EMA)呈点状或小环状阳性具有特异性诊断价值(图2d)。2007年WHO中枢神经系统肿瘤分类第4版除经典室管膜瘤外,还根据不同细胞分化特点收录4种变异型,即细胞型、乳头型、透明细胞型和伸长细胞型室管膜瘤[2]。进一步研究显示,细胞型室管膜瘤与经典室管膜瘤存在广泛的组织学特征重叠,因此,2016年WHO中枢神经系统肿瘤分类第4版修订版将此亚型剔除[5]。此外还包括已有文献报道但尚未被WHO确定为独立亚型的特殊组织分化模式,如巨细胞型[9]、黑色素型[10]、印戒细胞型[11]、脂肪/空泡化生型[12]、软骨化生(伴或不伴骨形成)型[13]、嗜酸细胞型[14]、上皮样[15]等,以及最近文献报道的发生于两个部位的特殊组织学形态亚型,即血管型幕上室管膜瘤和双向颅后窝室管膜瘤[16⁃17]。(1)乳头型室管膜瘤(PE):临床罕见。主要特征是形成以胶质纤维血管为轴心的乳头状结构,周围是单层或多层立方体状或柱状肿瘤细胞(图3a),然而,真正的胶质纤维血管轴心并非其特征,且上皮样细胞表面较光滑。多数情况下该结构其实是假乳头状结构,系远离血管的肿瘤细胞之间黏附性缺失所致。(2)伸长细胞型室管膜瘤(TE):好发于脊髓。典型肿瘤细胞呈长梭形双极细胞伴细长的嗜酸性纤维突起(图3b),类似原始放射状胶质细胞。主要生长模式呈束状排列,局灶性不典型血管周围假“菊形团”样结构,缺乏室管膜“菊形团”样结构。胞核异型性较明显,但不影响肿瘤生物学行为 ,属 退 行 性 变[18]。(3)透 明 细 胞 型 室 管 膜 瘤(CCE):好发于儿童幕上。典型肿瘤组织由呈片状排列的透明细胞或弱嗜酸性细胞组成,胞核呈圆形,胞质丰富、透明,类似少突胶质细胞瘤(图3c)。二者明显不同之处在于,透明细胞型室管膜瘤与周围脑组织界限清晰。二者均可见血管周围假“菊形团”样结构,但不明显,缺乏室管膜“菊形团”样结构。属WHOⅡ级,但有文献报道,该亚型显示出较经典室管膜瘤或其他亚型更具侵袭性的生物学行为[19]。(4)巨细胞型室管膜瘤(GCE):临床罕见。主要特征是肿瘤组织由较多巨细胞甚至巨怪细胞组成,亦可见于其他类型室管膜瘤区域(图3d)。肿瘤细胞呈中等密度,异型性明显,巨细胞之间黏附性较差,胞质丰富,呈嗜酸性,可见假包涵体,部分胞核呈不规则深染,但无其他间变性特征如高核分裂象、坏死和微血管增生,血管壁玻璃样变常见。巨细胞增殖指数很低,一般认为是退行性变[9]。(5)黑色素型室管膜瘤(ME):生长模式罕见,仅见数例报道。主要特征是肿瘤细胞胞质和胞外黑色素沉积,临床和生物学行为尚不清楚。组织学形态主要表现为经典室管膜瘤,伴黑色素分化的肿瘤成分,且此部分细胞核仁明显。免疫组织化学染色,胞质GFAP和黑色素瘤相关抗原HMB45呈阳性[10]。亦有文献报道,此类肿瘤的色素可能是脂褐素与黑色素的混合[20]。(6)印戒细胞型室管膜瘤(SRE):生长模式罕见,生物学行为尚不明确[11]。主要组织学形态特征是印戒细胞样肿瘤细胞,其他区域可见不同比例的经典室管膜瘤或其他类型室管膜瘤成分(图3e)。应注意与转移性印戒细胞癌相鉴别,EMA以及胶质细胞和上皮组织源性标志物免疫组织化学染色可资鉴别。(7)脂肪/空泡化生型室管膜瘤:室管膜瘤的小灶性脂肪/空泡化生现象并不罕见,常见于发生在颅后窝的室管膜瘤,但以脂肪样或空泡状细胞为主的肿瘤十分少见[12]。主要组织学形态特征是部分肿瘤细胞呈脂肪样或空泡状细胞形态,胞核位于空泡边缘(图3f)。免疫组织化学染色,GFAP和EMA呈阳性,证实为室管膜瘤成分,其中EMA呈小环状阳性,提示空泡状结构可能是细胞内室管膜微管样分化。脂肪和(或)空泡化生具体机制不清,部分形态与印戒细胞型室管膜瘤难以区分。(8)软骨化生(伴或不伴骨形成)型室管膜瘤:临床十分罕见,目前仅见10余例报道。多发生于幕上,主要组织学形态特征是在经典室管膜瘤基础上出现分化成熟的软骨组织,部分伴骨形成(图3g)。易复发,具有明显进展能力,相当于WHOⅢ级肿瘤的生物学行为[13]。(9)嗜酸细胞型室管膜瘤(OE):嗜酸细胞变异可见于多种肿瘤,室管膜瘤伴嗜酸细胞变异仅见个案报道[14],为1例幕上室管膜瘤患者,组织学形态呈双向分化,部分为间变性室管膜瘤形态,部分以嗜酸细胞变异为主,此部分肿瘤细胞胞质可见丰富嗜酸性颗粒。免疫组织化学染色抗线粒体抗体阳性,GFAP和EMA免疫组织化学染色以及超微结构观察均支持颗粒细胞为室管膜瘤成分。(10)上皮样室管膜瘤(EE):2003年,Kleinman等[15]报告3例上皮样室管膜瘤,主要组织学形态特征为黏液背景中可见肿瘤细胞呈小簇状紧密排列,缺乏血管周围假“菊形团”样结构和室管膜“菊形团”样结构。HE染色难以明确诊断,依靠免疫组织化学染色和超微结构观察。GFAP和波形蛋白(Vim)免疫组织化学染色未见肿瘤细胞血管周围突起。免疫组织化学染色,胞核旁EMA呈点状阳性。超微结构观察呈室管膜细胞特征。(11)其他特殊组织分化模式的室管膜瘤:最近文献报道的发生于两个部位的特殊组织学形态亚型,即血管型幕上室管膜瘤和双向颅后窝室管膜瘤,血管型幕上室管膜瘤主要组织学形态特征是具有丰富的纤细毛细血管网和局灶性透明样变(图3h),位于幕上[16];双向颅后窝室管膜瘤由高密度肿瘤细胞结节和肿瘤细胞稀疏区组成,多见于颅后窝[17]。这两种变异模式对于预后并无影响。此外,伴神经毡样岛的室管膜瘤也见于个案报道[21]。
4.间变型室管膜瘤 由胶质纤维背景中形态一致的胞核呈圆形的小细胞组成,核质比高、核分裂象多见;血管周围假“菊形团”样结构常见,约1/4病例可见室管膜“菊形团”样结构;常伴显著微血管增生和坏死(图4)。免疫组织化学染色和超微结构观察类似经典室管膜瘤。部分肿瘤在透明细胞型、乳头型和伸长细胞型室管膜瘤等特殊亚型基础上发生间变。2016年WHO中枢神经系统肿瘤分类对室管膜瘤仍沿用组织学分级系统,但具体分级标准模糊不定,仍存有争议。首先,关于核分裂象,WHO中枢神经系统肿瘤分类无明确临界值。有研究将核分裂象<5个/10高倍视野(HPF)定义为WHOⅡ级,7 ~ 10 个/10高倍视野定义为 WHOⅢ级[22⁃23]。其次,肿瘤细胞密度增加更具主观性,不同病理科医师的分级结果一致性较差。相对而言,微血管增生易识别,主观性较低。假“栅栏”样坏死也为较易评价的特征,但应注意与单纯坏死相鉴别。因此,病理科医师对间变特征的评价一致性较差,文献报道的WHOⅡ级/WHOⅢ级比例为 17∶1~ 1∶7[24]。值得注意的是,肿瘤分类分级仍是预测无事件生存率(EFS)的重要指标,但对总体生存率(OS)的预测价值有限。然而,Zamecnik等[23]认为,肿瘤分类分级与无事件生存率和总体生存率显著相关,但仍有1/3患者无法较好地预测生物学行为,因此,他们提出综合肿瘤部位、生长模式、组织学形态和患者年龄等特征的分级标准。Raghunathan等[17]探讨解剖部位、组织学形态与无事件生存率之间的关系,结果显示,组织学形态特征(包括肿瘤细胞密度增加、坏死、微血管增生和核分裂象增加)与发生于颅后窝的室管膜瘤的无事件生存率具有相关性,而与室管膜“菊形团”样结构或裂隙形成无相关性。对于幕上室管膜瘤而言,微血管增生、核分裂象增加以及广泛的室管膜“菊形团”样结构或裂隙形成均与无事件生存率相关,而肿瘤细胞密度增加和坏死则与无事件生存率无关联性,提示特殊组织学形态与解剖部位有关,因此,肿瘤分类分级应考虑具体病变部位。

图3 特殊形态亚型室管膜瘤光学显微镜观察所见 HE染色 3a 乳头型室管膜瘤可见肿瘤细胞围绕胶质纤维血管为轴心形成乳头状结构 中倍放大 3b 伸长细胞型室管膜瘤可见肿瘤细胞呈长梭形双极细胞 中倍放大 3c 透明细胞型室管膜瘤可见呈片状排列的透明细胞或弱嗜酸性细胞,类似少突胶质细胞瘤形态 高倍放大 3d 巨细胞型室管膜瘤可见肿瘤组织由较多的巨细胞甚至巨怪细胞组成 中倍放大 3e 印戒细胞型室管膜瘤可见印戒细胞样肿瘤细胞 高倍放大 3f 脂肪/空泡化生型室管膜瘤可见部分肿瘤细胞呈脂肪样或空泡状细胞形态 中倍放大 3g 软骨化生型室管膜瘤可见在经典室管膜瘤基础上出现分化成熟的软骨组织 低倍放大 3h 血管型幕上室管膜瘤可见丰富的纤细毛细血管网和局灶性透明样变 中倍放大Figure 3 Optical microscopy findings of special morphologic variants of ependymoma HE staining Papillary ependymoma is characterized by papillae with gial fibrovascular cores(Panel 3a). medium power magnified Tanycytic ependymoma composed of elongated spindly bipolar cells possessing thin eosinophilic fibrillary processes(Panel 3b). medium power magnified Sheets of cells with round nuclei and abundant surrounding clear cytoplasm were contained in clear cell ependymonia,mimicking oligodendroglioma(Panel 3c). high power magnified Giant cell ependymoma was composed of giant cells and bizarre cells(Panel 3d). medium power magnified Signetring cellependymoma presentsignetring appearance ofcytoplasm (Panel3e). high powermagnified Ependymoma with extensive tumor cell vacuolation was presented a state of cytoplasmic vacuolization or fat⁃like elements(Panel 3f).medium power magnified Ependymoma with cartilage metaplasia was characterized by the presence of cartilage with or without bone formation(Panel 3g). low power magnified "Vascular"supratentorial ependymoma was characterized by a rich network of branching capillary and area of clear tumor cells(Panel 3h). medium power magnified
5.室管膜瘤伴肉瘤样变(室管膜肉瘤)
Rodriguez等[25]于2008年报告11例室管膜瘤伴肉瘤样变患者,并提出“室管膜瘤肉瘤(ependymosarcoma)”的概念。室管膜肉瘤临床罕见,组织学形态表现为双向分化特征:室管膜瘤区域多为间变性室管膜瘤,亦有个别特殊类型如伸长细胞型室管膜瘤;肉瘤样变区域主要为纤维肉瘤、多形性梭形细胞肉瘤或伴异源性分化的肉瘤等。大多数室管膜肉瘤初次诊断即表现出肉瘤样变,亦有部分病例于肿瘤复发时方出现肉瘤样变。值得注意的是,室管膜肉瘤的两种分化成分并非均呈恶性,室管膜瘤区域可为WHOⅡ级,甚至个别肿瘤可转化为室管膜下室管膜肉瘤[26],亦有1例混合性室管膜下室管膜瘤⁃横纹肌肉瘤的报道[27],还可见源于伸长细胞型室管膜瘤的室管膜肉瘤[28]。此类肿瘤预后极差。
二、室管膜肿瘤的分子分型进展
近年来,室管膜肿瘤分子遗传学研究取得较大进展,结合解剖部位和肿瘤DNA甲基化谱系特征,可以将室管膜肿瘤分为9种分子亚型[29](表1)。除外WHOⅠ级肿瘤,结合肿瘤发生部位将幕上室管膜瘤分为YAP1和RELA融合基因两种分子亚组;颅后窝室管膜瘤分为A和B两组;脊髓室管膜瘤为NF2基因突变型,其中颅后窝A组和RELA融合基因阳性幕上室管膜瘤预后最差。与现有的WHO中枢神经系统肿瘤分类标准相比,分子分型对室管膜瘤生物学行为的评价更为精准,临床价值更高。基因组学、转录组学及其他表观遗传学研究还发现其他室管膜肿瘤相关重要分子遗传学特征,如19号染色体三倍体型室管膜瘤(trisomy 19 ependymoma),但其临床价值有限[30⁃31]。2016 年 WHO 中枢神经系统肿瘤分类唯一将RELA融合基因阳性室管膜瘤(ependymoma,RELAfusion⁃positive)作为独特的室管膜瘤分子亚型进行独立分型,其余文献报道的分子亚型尚不足以成为独立亚型[5],尚待进一步研究以确定具体临床病理学意义。
1.RELA融合基因阳性室管膜瘤 该亚型是2016年WHO中枢神经系统肿瘤分类新增加的由基因型定义的室管膜瘤亚型[5],好发于儿童和青年人,均位于幕上,包括绝大多数儿童幕上室管膜瘤(>70%),属WHOⅡ或Ⅲ级。组织学形态无特征性,但常可见明显分枝状血管网或透明细胞(图5a)。主要分子特征是染色体11q13.1碎裂重排形成C11orf95⁃RELA融合基因,检测方法多样,荧光原位杂交(FISH)是最佳方法之一。该肿瘤除高表达C11orf95⁃RELA融合蛋白外,还高表达L1细胞黏附分子(L1CAM),故推荐L1CAM免疫组织化学染色作为RELA融合基因的替代标志物(图5b),但尚待大样本临床研究的验证。该亚型预后较其他幕上室管膜瘤差,10年无进展生存率<20%,10年总体生存率 < 50%[32]。
2.19号染色体三倍体型室管膜瘤 该亚型是近年提出的有特殊遗传学特征的室管膜瘤,即19号染色体为三倍体,伴有13q21.31~q31.2缺失[31]。约占所有室管膜瘤的9%,好发于儿童和青年,平均发病年龄为14岁。组织学形态主要表现为血管型幕上室管膜瘤,含有丰富的分枝状血管网,肿瘤细胞伴核周空晕,胞质丰富,呈淡染或嗜酸性,部分为透明细胞,常伴微钙化灶。该亚型的生物学行为尚不明确。
综上所述,室管膜肿瘤是界限相对清晰的中枢神经系统肿瘤,组织学分化谱系呈明显多样性,大部分与临床预后无特殊关联性,部分罕见亚型或组织分化模式意义尚不明确。肿瘤分级仍然沿用组织学分级系统,但间变性室管膜瘤的分级标准一直存有争议。近年来,分子遗传学研究的发展对室管膜肿瘤的更精准分类分型具有一定帮助,但目前仅为起步阶段,组织分化谱系与分子遗传学之间的关系尚不明确,尚待进一步深入研究和进行反复临床病理学研究验证。

图4 间变性室管膜瘤光学显微镜观察所见 HE染色 4a 肿瘤组织由细胞密度较高的小细胞组成,核质比高,常伴坏死和微血管增生 中倍放大 4b 核分裂象多见 高倍放大Figure 4 Optical microscopy findings of anaplastic ependymoma HE staining Histologic features of anaplastic ependymoma include hypercellular small cells with increased nucleus/cytoplasm ratio,abundant endothelial proliferation,pseudopalisading necrosis(Panel 4a,medium power magnified),and numerous mitotic figures(Panel 4b,high power magnified).

表1 室管膜肿瘤分子亚型Table 1. Molecular subgroups of ependymal tumors

图5 RELA融合基因阳性室管膜瘤光学显微镜观察所见 5a 特征性表现为丰富的分枝状血管网,部分肿瘤细胞呈透明细胞形态 HE染色 中倍放大 5b 肿瘤细胞胞质L1CAM呈阳性 免疫组织化学染色(EnVison二步法) 高倍放大Figure 5 Optical microscopy findings of RELA fusion⁃positive ependymoma A distinctive vascular pattern of branching capillaries or clear cell change was seen(Panel 5a). HE staining medium power magnified Cytoplasmic L1CAM was positive(Panel 5b).Immunohistochemical staining(EnVision) high power magnified
[1]McGuire CS,Sainani KL,Fisher PG.Incidence patterns for ependymoma:a surveillance,epidemiology,and end results study.J Neurosurg,2009,110:725⁃729.
[2]LouisDN,OhgakiH,WiestlerOD,CaveneeWK.WHO classification of tumours of the central nervous system.Lyon:International Agency for Research on Cancer(IARC),2007:69⁃80.
[3]Bailey P,Cushing H.A classification of tumors of the glioma group on a histogenetic basis with a correlated study of prognosis.London:J.B.Lippincott Company,1926:1⁃175.
[4]Taylor MD,Poppleton H,Fuller C,Su X,Liu Y,Jensen P,Magdaleno S,Dalton J,Calabrese C,Board J,Macdonald T,Rutka J,Guha A,Gajjar A,Curran T,Gilbertson RJ.Radial glia cells are candidate stem cells of ependymoma.Cancer Cell,2005,8:323⁃335.
[5]Louis DN,Ohgaki H,Wiestler OD,Cavenee WK.World Health Organization classification of tumours of the central nervous system.Lyon:IARC Press,2016:101⁃114.
[6]Rushing EJ,Cooper PB,Quezado M,Begnami M,Crespo A,Smirniotopoulos JG, Ecklund J, Olsen C, Santi M.Subependymoma revisited:clinicopathological evaluation of 83 cases.J Neurooncol,2007,85:297⁃305.
[7]Rosenblum MK,Erlandson RA,Aleksic SN,Budzilovich GN.Melanotic ependymoma and subependymoma.Am J Surg Pathol,1990,14:729⁃736.
[8]Zec N,De Girolami U,Schofield DE,Scott RM,Anthony DC.Giant cell ependymoma of the filum terminale:a report of two cases.Am J Surg Pathol,1996,20:1091⁃1101.
[9]Li JY,Lopez JI,Powell SZ,Coons SW,Fuller GN.Giant cell ependymoma:report of three cases and review of the literature.Int J Clin Exp Pathol,2012,5:458⁃462.
[10]Yang C,Li G,Fang J,Wu L,Deng X,Xu Y.Clinical analysis ofprimary melanotic ependymoma in the centralnervous system:case series and literature review.Acta Neurochir(Wien),2013,155:1839⁃1847.
[11]Mizuno J,Nakagawa H,Inoue T,Kondo S,Hara K,Hashizume Y.Signet⁃ring cell ependymoma with intratumoral hemorrhage in the medulla oblongata.J Clin Neurosci,2005,12:711⁃714.
[12]Sharma MC,Arora R,Lakhtakia R,Mahapatra AK,Sarkar C.Ependymoma with extensive lipidization mimicking adipose tissue:a report of five cases.Pathol Oncol Res,2000,6:136⁃140.
[13]Wang X,Zhang S,Ye Y,Chen Y,Liu X.Ependymoma with cartilaginous metaplasia might have more aggressive behavior:a case report and literature review.Brain Tumor Pathol,2012,29:172⁃176.
[14]Vajtai I,von Gunten M,Fung C,Brekenfeld C,Kappeler A,ReinertMM.Oncocyticependymoma:anew morphological variantofhigh⁃grade ependymalneoplasm composed of mitochondrion⁃rich epithelioid cells.Pathol Res Pract,2011,207:49⁃54.
[15]Kleinman GM,Zagzag D,Miller DC.Epithelioid ependymoma,a new variant of ependymoma: report of three cases.Neurosurgery,2003,53:743⁃747.
[16]Gupta K,Chandrasekaran M,Garg R,Salunke P.Supratentorial"vascular"variant of ependymoma:a lesser known morphologic variant and a diagnostic pitfall.Childs Nerv Syst,2016,32:1569⁃1571.
[17]Raghunathan A,Wani K,Armstrong TS,Vera⁃Bolanos E,Fouladi M,Gilbertson R,Gajjar A,Goldman S,Lehman NL,Metellus P,Mikkelsen T,Necesito⁃Reyes MJ,Omuro A,Packer RJ,Partap S,Pollack IF,Prados MD,Robins HI,Soffietti R,Wu J,MillerCR,GilbertMR,AldapeKD;Collaborative Ependymoma Research Network.Histologicalpredictors of outcome in ependymoma are dependent on anatomic site within the central nervous system.Brain Pathol,2013,23:584⁃594.
[18]Zhang S,Wang X,Zhang Z,Chen Y.Tanycytic ependymoma arising from the right lateral ventricle:a case report and review of the literature.Neuropathology,2008,28:427⁃432.
[19]Fouladi M,Helton K,Dalton J,Gilger E,Gajjar A,Merchant T,Kun L,Newsham I,Burger P,Fuller C.Clear cell ependymoma:a clinicopathologic and radiographic analysis of 10 patients.Cancer,2003,98:2232⁃2244.
[20]Chan AC,Ho LC,Yip WW,Cheung FC.Pigmented ependymoma with lipofuscin and neuromelanin production.Arch Pathol Lab Med,2003,127:872⁃875.
[21]Ahn S,Kang SY,Suh YL.Supratentorial ependymoma with glial component of two different histologies and neuropil⁃like islands:a case report.Clin Neuropathol,2014,33:128⁃134.
[22]Tihan T,Zhou T,Holmes E,Burger PC,Ozuysal S,Rushing EJ.The prognostic value of histological grading of posterior fossa ependymomas in children:a Children's Oncology Group study and a review of prognostic factors.Mod Pathol,2008,21:165⁃177.
[23]Zamecnik J,Snuderl M,Eckschlager T,Chanova M,Hladikova M,Tichy M,Kodet R.Pediatric intracranial ependymomas:prognostic relevance of histological,immunohistochemical,and flow cytometric factors.Mod Pathol,2003,16:980⁃991.
[24]Ellison DW,Kocak M,Figarella⁃Branger D,Felice G,Catherine G,Pietsch T,Frappaz D,Massimino M,Grill J,Boyett JM,Grundy RG. Histopathological grading of pediatric ependymoma: reproducibility and clinical relevance in European trial cohorts.J Negat Results Biomed,2011,10:7.
[25]Rodriguez FJ,Scheithauer BW,Perry A,Oliveira AM,Jenkins RB,Oviedo A,Mork SJ,Palmer CA,Burger PC.Ependymal tumors with sarcomatous change ("ependymosarcoma"): a clinicopathologic and molecular cytogenetic study.Am J Surg Pathol,2008,32:699⁃709.
[26]LouisDN,Hedley⁃Whyte ET,Martuza RL.Sarcomatous proliferation ofthe vasculature in a subependymoma.Acta Neuropathol,1989,78:332⁃335.
[27]Tomlinson FH, Scheithauer BW, Kelly PJ, Forbes GS.Subependymoma with rhabdomyosarcomatous differentiation:report of a case and literature review.Neurosurgery,1991,28:761⁃768.
[28]Vajtai I,Kuhlen D,Kappeler A,Mariani L,Zimmermann A,Paulus W. Rapid spontaneous malignant progression of supratentorial tanycytic ependymoma with sarcomatous features:"ependymosarcoma".Pathol Res Pract,2010,206:493⁃498.
[29]Pajtler KW,Witt H,Sill M,Jones DT,Hovestadt V,Kratochwil F,Wani K,Tatevossian R,Punchihewa C,Johann P,Reimand J,Warnatz HJ,Ryzhova M,Mack S,Ramaswamy V,Capper D,Schweizer L,Sieber L,Wittmann A,Huang Z,van Sluis P,Volckmann R,Koster J,Versteeg R,Fults D,Toledano H,Avigad S,Hoffman LM,Donson AM,Foreman N,Hewer E,Zitterbart K,Gilbert M,Armstrong TS,Gupta N,Allen JC,Karajannis MA,Zagzag D,Hasselblatt M,Kulozik AE,Witt O,Collins VP,von Hoff K,Rutkowski S,Pietsch T,Bader G,Yaspo ML,von Deimling A,Lichter P,Taylor MD,Gilbertson R,Ellison DW,Aldape K,Korshunov A,Kool M,Pfister SM.Molecular classification of ependymal tumors across all CNS compartments,histopathological grades,and age groups.Cancer Cell,2015,27:728⁃743.
[30]Gupta K,Salunke P.Understanding ependymoma oncogenesis:an update on recent molecular advances and current perspectives.Mol Neurobiol,2017,54:15⁃21.
[31]Rousseau E,Palm T,Scaravilli F,Ruchoux MM,Figarella⁃Branger D,Salmon I,Ellison D,Lacroix C,Chapon F,Mikol J,Vikkula M,Godfraind C.Trisomy 19 ependymoma,a newly recognized genetico⁃histological association,including clear cell ependymoma.Mol Cancer,2007,6:47.
[32]ParkerM,MohankumarKM,PunchihewaC,Weinlich R,Dalton JD,LiY,Lee R,Tatevossian RG,Phoenix TN,Thiruvenkatam R,White E,Tang B,Orisme W,Gupta K,Rusch M,Chen X,LiY,Nagahawhatte P,Hedlund E,Finkelstein D,Wu G,Shurtleff S,Easton J,Boggs K,Yergeau D,Vadodaria B,Mulder HL,Becksfort J,Gupta P,Huether R,Ma J,Song G,Gajjar A,Merchant T,Boop F,Smith AA,Ding L,Lu C,Ochoa K,Zhao D,Fulton RS,Fulton LL,Mardis ER,Wilson RK,Downing JR,Green DR,Zhang J,Ellison DW,Gilbertson RJ.C11orf95⁃RELA fusions drive oncogenic NF⁃κB signalling in ependymoma.Nature,2014,506:451⁃455.
Histologic spectrum and molecular subgroups of ependymal tumors
WANG Xing⁃fu
Department of Pathology,the First Affiliated Hospital of Fujian Medical University,Fuzhou 350005,Fujian,China(Email:wangxfu@fjmu.edu.cn)
Ependymal tumors are relatively infrequent neuroepithelial neoplasms,but they have a wide and complex histologic spectrum including subtypes and variants recognized by the current Word Health Organization(WHO),and some special morphologic variants or growth patterns such as giant cell morphology,melanin differentiation,signet⁃ring,fat or vacude metaplasia,cartilage metaplasia with or without bone formation,oncocytic,epithelioid,and so on.Pathologists need to pay attention to identification and differential diagnosis of these special morphologic variants.Genomic and DNA methylation profiling studies have defined nine distinct molecular subgroups of ependymal tumors.RELAfusion⁃positive ependymoma has now been designated as one of the distinctive molecular variants of ependymoma by 2016 WHO classification of central nervous system tumors. Risk stratification by molecular subgrouping is superior to histological grading.However,how to integrated molecular genetic features into the histological spectrum need to be further researched.
Ependymoma; Pathology; Immunohistochemistry; Review
10.3969/j.issn.1672⁃6731.2017.10.002
福建省自然科学基金资助项目(项目编号:2014J01413)
350005福州,福建医科大学附属第一医院病理科,Email:wangxfu@fjmu.edu.cn
This study was supported by Natural Science Foundation of Fujian Province,China(No.2014J01413).
2017⁃08⁃07)
